Ceteno
En química orgánica, una cetona es un compuesto orgánico de la forma RR'C=C=O, donde R y R& #39; son dos grupos químicos monovalentes arbitrarios (o dos sitios de sustitución separados en la misma molécula). El nombre también puede referirse al compuesto específico etenona H2C=C=O, la cetena más simple.
Aunque son muy útiles, la mayoría de las cetenas son inestables. Cuando se utilizan como reactivos en un procedimiento químico, normalmente se generan cuando se necesitan y se consumen tan pronto como (o mientras) se producen.
Historia
Las cetenas fueron estudiadas por primera vez como clase por Hermann Staudinger antes de 1905.
Ketenes fueron investigados sistemáticamente por Hermann Staudinger en 1905 en forma de diphenylketene (conversión de α α {displaystyle alpha }- Cloruro de clorodifenilo acetil con zinc). Staudinger se inspiró en los primeros ejemplos de intermediarios orgánicos reactivos y radicales estables descubiertos por Moses Gomberg en 1900 (compuestos con el grupo triphenylmethyl).
Propiedades
Los cetenos son altamente electrofílicos en el átomo de carbono unido al heteroátomo, debido a su carácter sp. El ceteno se puede formar con diferentes heteroátomos unidos al átomo de carbono sp, como O, S o Se, denominados respectivamente ceteno, tioceteno y selenoceteno.
Etenona, la cetena más simple, tiene diferentes longitudes experimentales para cada uno de los dobles enlaces; el enlace C=O es 1160Å y el enlace C=C es 1314Å. El ángulo entre los dos átomos de H es de 121,5°, similar al ángulo teóricamente ideal que se forma en los alquenos entre el átomo de carbono sp2 y los sustituyentes de H.
Los cetenos son inestables y no se pueden almacenar. En ausencia de nucleófilos con los que reaccionar, la etenona se dimeriza para dar β-lactona, un éster cíclico. Si la cetena está disustituida, el producto de dimerización es una ciclobutadiona sustituida. Para cetenos monosustituidos, la dimerización podría proporcionar el producto éster o dicetona.
Síntesis
La etenona se puede generar por pirólisis (craqueo térmico) de acetona:
- CH3−CO−CH3 → CH2=C=O + CH4
Esta reacción se denomina síntesis de cetena de Schmidlin.
Otras cetenas se pueden preparar a partir de cloruros de acilo mediante una reacción de eliminación en la que se pierde HCl:
En esta reacción, una base, generalmente trietilamina, elimina el protón ácido alfa al grupo carbonilo, lo que induce la formación del doble enlace carbono-carbono y la pérdida de un ion cloruro:
Los cetenos también se pueden formar a partir de α-diazocetonas por reordenamiento de Wolff.
Otra forma de generar cetenas es a través de la termólisis instantánea al vacío (FVT) con 2-piridilaminas. Plüg y Wentrup desarrollaron un método en 1997 que mejoró las reacciones de FVT para producir cetenas con una FVT estable que es insensible a la humedad, usando condiciones suaves (480 °C). Las N-piridilaminas se preparan por condensación con R-malonatos con N-amino(pirideno) y DCC como disolvente.
Un método más sólido para preparar cetenos es la carbonilación de carbenos metálicos y la reacción in situ de los cetenos altamente reactivos así producidos con reactivos adecuados como iminas, aminas o alcoholes. Este método es un protocolo en tándem eficiente de un solo recipiente para la carbonilación de compuestos de α-diazocarbonilo y una variedad de N-tosilhidrazonas catalizadas por metalorradicales de Co(II)-porfirina que conducen a la formación de cetenas, que posteriormente reaccionan con una variedad de nucleófilos e iminas para formar ésteres, amidas y β-lactámicos. Este sistema tiene una amplia gama de sustratos y se puede aplicar a varias combinaciones de precursores de carbeno, nucleófilos e iminas.
Reacciones y aplicaciones
Debido a sus dobles enlaces acumulados, los cetenos son muy reactivos.
Formación de ésteres de ácidos carboxílicos
Por reacción con alcoholes, se forman ésteres de ácidos carboxílicos:
Formación de anhídridos carboxílicos
Los cetenos reaccionan con ácidos carboxílicos para formar anhídridos de ácidos carboxílicos:
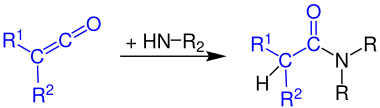
Formación de amidas de ácidos carboxílicos
Los cetenos reaccionan con el amoníaco a amidas primarias:
La reacción de cetenos con aminas primarias produce amidas secundarias:
Los cetenos reaccionan con las aminas secundarias para dar amidas terciarias:
Hidrólisis
Al reaccionar con el agua, se forman ácidos carboxílicos a partir de cetenos
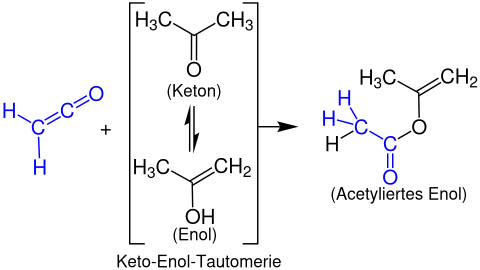
Formación de ésteres enólicos
Los ésteres de enol se forman a partir de cetenos con compuestos de carbonilo enolizables. El siguiente ejemplo muestra la reacción de etenona con acetona para formar un acetato de propen-2-ilo:
Dimerización
A temperatura ambiente, la cetena se dimeriza rápidamente a dicetena, pero la cetena se puede recuperar calentándola:
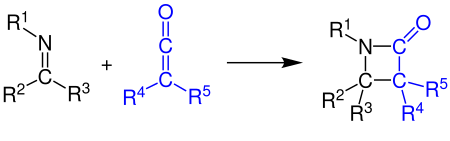
[2+2]-cicloadición
Los cetenos pueden reaccionar con alquenos, compuestos de carbonilo, carbodiimidas e iminas en una cicloadición [2+2]. El ejemplo muestra la síntesis de un β-lactámico por reacción de una cetena con una imina (ver síntesis de Staudinger):
Aplicaciones
Los cetenos son generalmente muy reactivos y participan en varias cicloadiciones. Un proceso importante es la dimerización para dar propiolactonas. Un ejemplo específico es la dimerización de la cetena del ácido esteárico para producir dímeros de alquilceteno, que se utilizan ampliamente en la industria papelera. Los AKD reaccionan con los grupos hidroxilo de la celulosa a través de una reacción de esterificación.
También sufrirán reacciones de cicloadición [2+2] con alquinos ricos en electrones para formar ciclobutenonas o grupos carbonilo para formar beta-lactonas. Con las iminas se forman betalactámicos. Esta es la síntesis de Staudinger, una vía fácil para esta importante clase de compuestos. Con acetona, la cetena reacciona para dar acetato de isopropenilo.
Una variedad de compuestos hidroxílicos se pueden agregar como nucleófilos, formando productos enol o éster. Como ejemplos, una molécula de agua se agrega fácilmente a la cetena para dar 1,1-dihidroxieteno y el anhídrido acético se produce por la reacción del ácido acético con la cetena. Reacciones entre dioles (HO−R−OH) y bis-cetenos (O=C=CH−R'−CH= C=O) producen poliésteres con una unidad repetida de (−O−R−O−CO−R'−CO).
El acetoacetato de etilo, un material de partida importante en la síntesis orgánica, se puede preparar usando una dicetena en reacción con etanol. Forman directamente acetoacetato de etilo y el rendimiento es alto cuando se lleva a cabo bajo circunstancias controladas; por lo tanto, este método se utiliza industrialmente.
Contenido relacionado
Baquelita
Gilbert n lewis
Tetraetilo de plomo