Células dendríticas foliculares
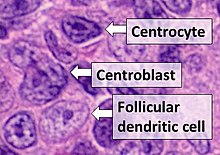
- Centrocytes son de tamaño pequeño a mediano con núcleos angulados, alargados, afilados o retorcidos.
- Centroblasts son células más grandes que contienen núcleos vesiculares con uno a tres núcleos basófilos que aplican la membrana nuclear.
- Células dendritas foliculares tienen núcleos redondos, núcleos centralizados, cromatina y dispersos, y aplanamiento de membrana nuclear adyacente.
Las células dendríticas foliculares (CDF) son células del sistema inmunitario que se encuentran en los folículos linfáticos primarios y secundarios (nódulos linfáticos) de las áreas de células B del tejido linfoide. A diferencia de las células dendríticas (CD), las CDF no se derivan de la célula madre hematopoyética de la médula ósea, sino que son de origen mesenquimal. Las posibles funciones de las CDF incluyen: organizar las células y la microarquitectura del tejido linfoide, capturar antígenos para apoyar a las células B, promover la eliminación de desechos de los centros germinales y proteger contra la autoinmunidad. Los procesos patológicos a los que pueden contribuir las CDF incluyen el tumor primario de CDF, las enfermedades inflamatorias crónicas, el desarrollo de la infección por VIH-1 y la tembladera neuroinvasiva.
Localización y marcadores moleculares
Las células dendríticas foliculares son una población no migratoria que se encuentra en los folículos primarios y secundarios de las áreas de células B de los ganglios linfáticos, el bazo y el tejido linfoide asociado a las mucosas (MALT). Forman una red estable debido a las conexiones intercelulares entre los procesos de las células dendríticas foliculares y la interacción íntima con las células B foliculares. La red de células dendríticas foliculares normalmente forma el centro del folículo y no se extiende desde el folículo hasta las regiones interfoliculares o la zona de células T. Supuestamente, esta separación de los sitios de procesamiento y captura de antígenos más tempranos proporciona un entorno protegido en el que los antígenos opsonizados pueden mostrarse durante mucho tiempo sin ser proteolizados o eliminados por las células fagocíticas. Las células dendríticas foliculares tienen una alta expresión de los receptores del complemento CR1 y CR2 (CD 35 y CD 21 respectivamente) y del receptor Fc FcγRIIb (CD32). Otros marcadores moleculares específicos de las células dendríticas foliculares son FDC-M1, FDC-M2 y C4. A diferencia de otras células dendríticas y macrófagos, las células dendríticas primarias carecen de moléculas antigénicas de clase II del MHC y expresan pocos receptores de reconocimiento de patrones, por lo que tienen poca capacidad para capturar antígenos no opsonizados.
Desarrollo
Las células dendríticas foliculares se desarrollan a partir de supuestos precursores mesenquimales. Los modelos de ratones con inmunodeficiencia combinada grave (SCID) demuestran que estos precursores pueden transmitirse a los receptores con alotrasplantes de médula ósea, en cuyo caso las redes de células dendríticas foliculares tanto de los donantes como de los receptores pueden encontrarse más tarde en los compartimentos linfoides de los receptores. La interacción entre los precursores de las células dendríticas foliculares y las células linfoides mediada por el TNF-a y la linfotoxina (LT) es crucial para el desarrollo y mantenimiento normal de las células dendríticas foliculares. El TNF-a se une al receptor TNFRI, mientras que la LT interactúa con el receptor LTβ expresado en los precursores de las células dendríticas foliculares. En los ratones que carecen de células B, o con la producción bloqueada de TNF-a y linfotoxina (LT), faltan células con fenotipo de células dendríticas foliculares.
Funciones
Organización de microarquitectura linfoide
En el tejido linfoide normal, las células B en reposo que recirculan migran a través de las redes de FDC, mientras que las células B activadas por antígenos son interceptadas y experimentan una expansión clonal dentro de las redes de FDC, generando centros germinales (CG). Los FDC se encuentran entre los principales productores de la quimiocina CXCL13, que atrae y organiza las células linfoides.
Captura de antígeno, memoria de apoyo de células B
Los receptores CR1, CR2 y FcγRIIb de las células dendríticas foliculares atrapan el antígeno opsonizado por el complemento o los anticuerpos. Estos antígenos son luego absorbidos en un compartimento endosómico cíclico no degradante para su posterior presentación a las células B. Para ser seleccionadas como futuras células de memoria, las células B GC deben unirse al antígeno presentado en las células dendríticas foliculares, de lo contrario entran en apoptosis.
Eliminación de desechos
Al secretar el factor de unión MFGE8, que une las células apoptóticas y los fagocitos, las células FDC promueven la eliminación selectiva de desechos del GC.
Prevención de la autoinmunidad
Se sabe que el factor Mfge producido en los tejidos linfoides principalmente por las FDC mejora la absorción de células apoptóticas. El déficit de este factor en ratones conduce a un estado similar al lupus eritematoso sistémico (LES). Además, los ratones que carecen de LT o de receptores LT, que carecen de FDC, desarrollan infiltrados linfocíticos generalizados, que son indicativos de autoinmunidad. Estos hallazgos sugieren que las FDC posiblemente protegen al organismo contra la autoinmunidad mediante la eliminación de restos potencialmente autorreactivos de los centros germinales.
Interacción con células B
Las células B no cognadas (no específicas de antígeno) desempeñan un papel importante en el transporte de antígenos a las células dendríticas primarias. Capturan complejos inmunes de manera dependiente de CR1/2, ya sea directamente desde la linfa o desde los macrófagos, y se desplazan al tejido linfoide, donde transfieren el antígeno opsonizado del complemento a las células dendríticas primarias.
A su vez, las células FDC atraen a las células B con el quimioatrayente CXCL13. Las células B que carecen de CXCR5, el receptor para CXCL13, igualmente ingresan a la pulpa blanca, pero están mal ubicadas y desorganizadas. Para generar estructuras foliculares, las FDC necesitan ser estimuladas por la linfotoxina (LT), un mediador producido por las células B. La estimulación de CXCR5 en las células B regula positivamente la producción de LT, lo que conduce a la activación de las FDC y estimula una mayor secreción de CXCL13, generando así un ciclo de retroalimentación positiva. Esto da como resultado la formación de centros germinales (GC), donde las células B activadas por antígeno quedan atrapadas para sufrir mutación somática, selección positiva y negativa, cambio de isotipo y diferenciación en células plasmáticas de alta afinidad y células B de memoria. La adhesión entre las FDC y las células B está mediada por las moléculas ICAM-1 (CD54)–LFA-1 (CD11a) y VCAM–VLA-4. Las células B activadas con baja afinidad al antígeno capturado en la superficie de las FDC, así como las células B autorreactivas, sufren apoptosis, mientras que las células B unidas a las FDC a través del complejo antigénico sobreviven debido al bloqueo de la apoptosis causado por la interacción con las FDC.
Enfermedades
Se han descrito tumores FDC primarios poco frecuentes. Estos sarcomas suelen afectar a los tejidos linfoides, pero en varios casos se han encontrado en el hígado, el conducto biliar, el páncreas, la tiroides, la nasofaringe, el paladar, la submucosa del estómago o el duodeno. En varias enfermedades inflamatorias crónicas, se han observado células que producen la quimiocina CXCL13 y que portan marcadores FDC como VCAM-1 y CD21 en sitios bastante inesperados, incluido el tejido sinovial de pacientes con artritis reumatoide (AR), las glándulas salivales de pacientes con síndrome de Sjögren y la piel de pacientes con linfoma de células pseudo B. Las células dendríticas foliculares participan en el desarrollo de la infección por VIH-1, tanto proporcionando un refugio para el VIH-1 como estimulando la replicación del VIH-1 en células monocíticas infectadas adyacentes a través de un mecanismo de señalización yuxtacrina. También hay cierta evidencia de que las FDC pueden promover la replicación de priones y la neuroinvasión en la tembladera neuroinvasiva.
Véase también
- Follicular+Dendritic+Cells en la Biblioteca Nacional de Medicina de EE.UU.
Referencias
- ^ Liu Y, Grouard G, de Bouteiller O, Banchereau J (1996). Células dendritas foliculares y centros germinales. International Review of Cytology. Vol. 166. pp. 139–79. doi:10.1016/S0074-7696(08)62508-5. ISBN 978-0-12-364570-8. PMID 8881775.
{{cite book}}:|journal=ignorado (ayuda) - ^ Heesters, Balthasar A.; Myers, Riley C.; Carroll, Michael C. (2014-06-20). "Células dendritas alimentarias: bibliotecas dinámicas de antígeno". Nature Reviews Immunology. 14 (7): 495–504. doi:10.1038/nri3689. ISSN 1474-1733. PMID 24948364. S2CID 7082877.
- ^ Aguzzi, Adriano; Kranich, Jan; Krautler, Nike Julia (marzo de 2014). "Células dendritas alimentarias: origen, fenotipo y función en salud y enfermedad". Tendencias en la inmunología. 35 (3): 105–113. doi:10.1016/j.it.2013.11.001. ISSN 1471-4906. PMID 24315719.
- ^ Banchereau J, Steinman RM (1998). "Células dendritas y el control de la inmunidad". Naturaleza. 392 (6673): 245–52. código:1998Natur.392..245B. doi:10.1038/32588. PMID 9521319. S2CID 4388748.van Nierop K, de Groot C (2002). "Células dendritas foliculares humanas: función, origen y desarrollo". Semin Immunol. 14 (4): 251–7. doi:10.1016/S1044-5323(02)00057-X. PMID 12163300.
- ^ a b Hombre D, Brostoff J, Roth D, Roitt I (2007). Inmunología (7a edición). Elsevier Health Sciences. ISBN 978-0-323-03399-2.
- ^ Banchereau J, Steinman RM (1998). "Células dendritas y el control de la inmunidad". Naturaleza. 392 (6673): 245–52. código:1998Natur.392..245B. doi:10.1038/32588. PMID 9521319. S2CID 4388748.
- ^ a b c d van Nierop K, de Groot C (2002). "Células dendritas foliculares humanas: función, origen y desarrollo". Semin Immunol. 14 (4): 251–7. doi:10.1016/S1044-5323(02)00057-X. PMID 12163300.
- ^ Kapasi ZF, Qin D, Kerr WG, Kosco-Vilbois MH, Shultz LD, Tew JG, Szakal AK (1998). "Precursores de células dendritas alimentarias (FDC) en tejidos linfoides primarios". The Journal of Immunology. 160 (3): 1078–84. doi:10.4049/jimmunol.160.3.1078. PMID 9570519. S2CID 1838950.
- ^ Wang Y, Wang J, Sun Y, Wu Q, Fu YX (2001). "Efectos completos de TNF y linfoxina en la formación del centro germinal y células dendritas foliculares". Journal of Immunology. 166 (1): 330–7. doi:10.4049/jimmunol.166.1.330. PMID 11123309.
- ^ Ettinger R, Mebius R, Browning JL, Michie SA, van Tuijl S, Kraal G, van Ewijk W, McDevitt HO (1998). "Efectos del factor de necrosis tumoral y la linfoxina en el desarrollo del tejido linfoides periférico". Int Immunol. 10 (6): 727–41. doi:10.1093/intimm/10.6.727. PMID 9678753.
- ^ Cister JG (2010). "B folículos celulares y encuentros de antígeno del tercer tipo". Nat Immunol. 11 11): 989-96. doi:10.1038/ni.1946. PMID 20959804. S2CID 26439962.
- ^ Balthasar, Heesters; Priyadarshini, Chatterjee; Young-A, Kim; Santiago, González; Michael, Kuligowski; Tomas, Kirchhausen; Michael, Carroll (2013). "La endocitosis y el reciclaje de complejos inmunitarios por células dendritas foliculares aumenta la unión y activación de células B". Fronteras en inmunología. 4. doi:10.3389/conf.fimmu.2013.02.00438. ISSN 1664-3224.
- ^ a b Aguzzi A, Krautler NJ (2010). "Caracterizando células dendritas foliculares: un informe de progreso". European Journal of Immunology. 40 (8): 2134-8. doi:10.1002/eji.201040765. PMID 20853499.
- ^ Kranich J, Krautler NJ, Heinen E, Polymenidou M, Bridel C, Schildknecht A, Huber C, Kosco-Vilbois MH, Zinkernagel R, Miele G, Aguzzi A (2008). "Las células dendritas alimentarias controlan el engulfmento de los cuerpos apoptóticos mediante el secreto de Mfge8". J Exp Med. 205 (6): 1293–302. doi:10.1084/jem.20071019. PMC 2413028. PMID 18490487.
- ^ Phan, Tri Giang; Grigorova, Irina; Okada, Takaharu; Cyster, Jason G (2007-07-29). "El encuentro subcapsular y el transporte dependiente de complementos de complejos inmunes por células B del ganglio linfático". Nature Immunology. 8 (9): 992–1000. doi:10.1038/ni1494. ISSN 1529-2908. PMID 17660822. S2CID 35256900.
- ^ Carrasco, Yolanda R.; Batista, Facundo D. (Julio 2007). "B Cells Acquireicula Partícula Antigen in a Macrophage-Rich Area at the Boundary between the Follicle and the Subcapsular Sinus of the Lymph Node". Inmunity. 27 (1): 160-171. doi:10.1016/j.immuni.2007.06.007. ISSN 1074-7613. PMID 17658276.
- ^ Aguzzi A, Kranich J, Krautler NJ (2014). "Células dendritas alimentarias: origen, fenotipo y función en salud y enfermedad". Tendencias en la inmunología. 35 (3): 105–113. doi:10.1016/j.it.2013.11.001. PMID 24315719.
- ^ Cavert W, Notermans DW, Staskus K, Wietgrefe SW, Zupancic M, Gebhard K, Henry K, Zhang ZQ, Mills R, McDade H, Schuwirth CM, Goudsmit J, Danner SA, Haase AT (1997). "Kinetics of response in linfoides tissues to antiretroviral therapy of HIV-1 infection". Ciencia. 276 (5314): 960-4. doi:10.1126/science.276.5314.960. PMID 9139661. S2CID 6800040.
- ^ Pantaleo G, Graziosi C, Demarest JF, Butini L, Montroni M, Fox CH, Orenstein JM, Kotler DP, Fauci AS (1993). "La infección por el VIH es activa y progresiva en el tejido linfoides durante la etapa clínicamente latente de la enfermedad". Naturaleza. 362 (6418): 355-8. Código: 1993Natur.362..355P. doi:10.1038/362355a0. PMID 8455722. S2CID 4326634.
- ^ Heesters, Balthasar A.; Lindqvist, Madelene; Vagefi, Parsia A.; Scully, Eileen P.; Schildberg, Frank A.; Altfeld, Marcus; Walker, Bruce D.; Kaufmann, Daniel E.; Carroll, Michael C. (2015-12-01). "Células dendritas alimentarias retienen el VIH infeccioso en los endosomas de ciclismo". PLOS Patógenos. 11 (12): e1005285. doi:10.1371/journal.ppat.1005285. ISSN 1553-7374. PMC 4666623. PMID 26623655.
- ^ Ohba K, Ryo A, Dewan MZ, Nishi M, Naito T, Qi X, Inagaki Y, Nagashima Y, Tanaka Y, Okamoto T, Terashima K, Yamamoto N (2009). "Las células dendriáticas alimentarias activan la replicación del VIH-1 en monocitos/macrofages a través de un mecanismo de yuxtacrina mediado por P-selectin glycoprotein ligand 1". Journal of Immunology. 183 (1): 524–32. doi:10.4049/jimmunol.0900371. PMID 19542463. S2CID 21434580.
- ^ Montrasio F, Frigg R, Glatzel M, Klein MA, Mackay F, Aguzzi A, Weissmann C (2000). "Replicación amparada de priones en pliegues de ratones carentes de células dendritas foliculares funcionales". Ciencia. 288 (5469): 1257-9. Código:2000Sci...288.1257M. doi:10.1126/ciencia.288.5469.1257. PMID 10818004.