Célula de Paneth
Las células de Paneth son células del epitelio del intestino delgado, junto con las células caliciformes, los enterocitos y las células enteroendocrinas. Algunas también se pueden encontrar en el ciego y el apéndice. Se encuentran debajo de las células madre intestinales en las glándulas intestinales (también llamadas criptas de Lieberkühn) y los grandes gránulos refráctiles eosinófilos que ocupan la mayor parte de su citoplasma.
Cuando se exponen a bacterias o antígenos bacterianos, las células de Paneth secretan varios compuestos antimicrobianos (en particular, defensinas y lisozima) que se sabe que son importantes para la inmunidad y la defensa del huésped en el lumen de la glándula intestinal, contribuyendo así al mantenimiento de la barrera gastrointestinal al controlar las bacterias entéricas. Por lo tanto, las células de Paneth desempeñan un papel en el sistema inmunológico innato.
Las células de Paneth reciben su nombre del patólogo del siglo XIX Joseph Paneth.
Estructura
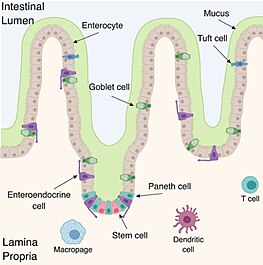
Las células de Paneth se encuentran en todo el intestino delgado y en el apéndice, en la base de las glándulas intestinales. Se observa un aumento en la cantidad de células de Paneth hacia el final del intestino delgado. Al igual que los demás linajes de células epiteliales del intestino delgado, las células de Paneth se originan en la región de células madre cerca de la parte inferior de la glándula. En promedio, hay entre 5 y 12 células de Paneth en cada cripta del intestino delgado.
A diferencia de los otros tipos de células epiteliales, las células de Paneth migran hacia abajo desde la región de células madre y se asientan justo al lado de ella. Esta estrecha relación con la región de células madre sugiere que las células de Paneth son importantes para defender a las células madre de la glándula del daño microbiano, aunque su función no se conoce por completo. Además, entre los cuatro linajes de células intestinales mencionados anteriormente, las células de Paneth son las que viven más tiempo (aproximadamente 57 días).
Función
Las células de Paneth secretan péptidos y proteínas antimicrobianos, que son "mediadores clave de las interacciones entre el huésped y el microbio, incluido el equilibrio homeostático con la microbiota colonizadora y la protección inmunitaria innata contra los patógenos entéricos".
Las criptas del intestino delgado albergan células madre que sirven para reponer constantemente las células epiteliales que mueren y se pierden de las vellosidades. Las células de Paneth sostienen la barrera física del epitelio al proporcionar señales esenciales de nicho a sus células madre intestinales vecinas. La protección y estimulación de estas células madre es esencial para el mantenimiento a largo plazo del epitelio intestinal, en el que las células de Paneth desempeñan un papel fundamental.
Las células de Paneth presentan secreción merocrina, es decir, secreción por exocitosis.
Sensing microbiota
Las células de Paneth son estimuladas para secretar defensinas cuando se exponen a bacterias (tanto de tipo Gram positivo como Gram negativo) o a productos bacterianos como lipopolisacáridos, ácido lipoteicoico, dipéptido de muramilo y lípido A. También son estimuladas por la señalización colinérgica que normalmente precede a la llegada de alimentos que potencialmente pueden contener una nueva carga bacteriana.
Las células de Paneth detectan las bacterias a través de la activación del receptor tipo Toll (TLR) dependiente de MyD88, que luego desencadena la acción antimicrobiana. Por ejemplo, la investigación mostró que en los gránulos secretores, las células de Paneth murinas y humanas expresan altos niveles de TLR9. El TLR9 reacciona a los CpG-ODN y oligonucleótidos no metilados, patrones moleculares asociados a patógenos (PAMP) típicos del ADN bacteriano. La internalización de estos PAMP y la activación de TLR9 conducen a la desgranulación y la liberación de péptidos antimicrobianos y otras secreciones. Sorprendentemente, las células de Paneth murinas no expresan transcripciones de ARNm para TLR4.
Secreciones antimicrobianas
Las principales moléculas de defensa secretadas por las células de Paneth son las alfa-defensinas, conocidas como criptinas en los ratones. Estos péptidos tienen dominios hidrofóbicos y cargados positivamente que pueden interactuar con los fosfolípidos de las membranas celulares. Esta estructura permite que las defensinas se inserten en las membranas, donde interactúan entre sí para formar poros que alteran la función de la membrana, lo que conduce a la lisis celular. Debido a la mayor concentración de fosfolípidos cargados negativamente en las membranas celulares bacterianas que en las de los vertebrados, las defensinas se unen preferentemente a las células bacterianas y las alteran, sin afectar a las células que están protegiendo.
Las células de Paneth humanas producen dos α-defensinas conocidas como α-defensinas humanas HD-5 (DEFA5) y HD-6 (DEFA6). La HD-5 tiene un amplio espectro de actividad letal contra bacterias Gram positivas y Gram negativas, así como hongos (Listeria monocytogenes, Escherichia coli, Salmonella typhimurium y C. albicans). La actividad antimicrobiana de la HD-6 consiste en autoensamblarse en redes extracelulares que atrapan las bacterias en el intestino y, de ese modo, evitan su translocación a través de la barrera epitelial.
Las células de Paneth humanas también producen otros AMP, como la lisozima, la fosfolipasa A2 secretora y la proteína IIIA derivada de los islotes que se regenera. La lisozima es una enzima antimicrobiana que disuelve las paredes celulares de muchas bacterias, y la fosfolipasa A2 es una enzima especializada en la lisis de los fosfolípidos bacterianos. Esta batería de moléculas secretoras proporciona a las células de Paneth un potente arsenal contra un amplio espectro de agentes, entre los que se incluyen bacterias, hongos e incluso algunos virus envueltos.
Autofagia secreta
Durante la secreción convencional de proteínas, las proteínas se transportan a través del complejo RE-Golgi empaquetadas en gránulos secretores y se liberan al espacio extracelular. Si los patógenos invasivos alteran el aparato de Golgi, causando un deterioro en la secreción de proteínas antimicrobianas por parte de las células de Paneth, existe una vía de secreción alternativa: se ha demostrado que la lisozima puede ser desviada a través de la autofagia secretora. En la autofagia secretora, la carga se transporta en una vesícula LC3+ y se descarga en la membrana plasmática, evitando así el complejo RE-Golgi. No todas las bacterias inducen la autofagia secretora: las bacterias comensales, por ejemplo, no causan la degradación del aparato de Golgi y, por lo tanto, no desencadenan la autofagia secretora de la lisozima. Se cree que una disfunción en la autofagia secretora es un posible factor contribuyente a la enfermedad de Crohn.
Función fagocítica
Las células de Paneth mantienen la salud del intestino actuando como macrófagos; se ha demostrado que las células de Paneth eliminan las células moribundas mediante la captación de células apoptóticas. La función fagocítica de las células de Paneth se descubrió mediante una serie de experimentos, uno de los cuales utilizó ratones a los que se les había irradiado una dosis baja de cesio-137 (137Cs), imitando la quimioterapia a la que se someten los pacientes con cáncer. Estos hallazgos pueden ser importantes para abordar los efectos secundarios que sufren los pacientes con cáncer cuya salud intestinal se ve perjudicada por la quimioterapia: aproximadamente el 40% de todos los pacientes que reciben terapia contra el cáncer experimentan mucositis gastrointestinal (GI) durante su tratamiento, y la cifra aumenta hasta el 80% en los pacientes que reciben irradiación abdominal o pélvica.
Mantenimiento de epitelio
Las células de Paneth participan en la vía de señalización Wnt y la vía de señalización Notch, que regulan la proliferación de células madre intestinales y enterocitos necesarios para la renovación de las células epiteliales. Expresan los ligandos Wnt canónicos: Wnt3a, Wnt9b y Wnt11, que se unen a los receptores Frizzled en las células madre intestinales para impulsar la señalización de β-catenina/Tcf. Las células de Paneth también son una fuente importante de los ligandos Notch DLL1 y DLL4, que se unen a los receptores Notch Notch1 y Notch2 en las células madre intestinales y los progenitores de los enterocitos.
Sin embargo, recientemente se ha descubierto que el potencial regenerativo de las células epiteliales intestinales disminuye con el tiempo como resultado de que las células de Paneth envejecidas secretan la proteína Notum, que es un inhibidor extracelular de la señalización de Wnt. Si se inhibe la secreción de Notum, el potencial regenerativo del epitelio intestinal podría aumentar.
Zinc
Se ha establecido que el zinc es esencial para el funcionamiento de las células de Paneth. Un defecto en el transportador de Zn (ZnT)2 altera el funcionamiento de las células de Paneth al provocar una secreción descoordinada de los gránulos. Los ratones que carecen del transportador (ZnT)2 no solo presentan una secreción de gránulos alterada, sino que también sufren una mayor respuesta inflamatoria al lipopolisacárido y son menos capaces de ejercer una actividad bactericida. Normalmente, el zinc se almacena en los gránulos secretores y, tras la desgranulación, se libera en el lumen. Se ha especulado que el almacenamiento de metales pesados contribuye a la toxicidad antimicrobiana directa, ya que el Zn se libera tras la estimulación de las PC colinérgicas.
La deficiencia de zinc también está implicada en la disfunción de la α-defensina de las células de Paneth inducida por el alcohol, que contribuye a la esteatohepatitis relacionada con el alcohol. El zinc puede estabilizar la α-defensina 5 humana (HD5), que es responsable de la homeostasis del microbioma. En consonancia con esto, la administración de HD5 puede alterar eficazmente el microbioma (especialmente al aumentar la Akkermansia muciniphila), y revertir el daño infligido al microbioma por el consumo excesivo de alcohol. La deficiencia de zinc en la dieta, por otro lado, exacerba el efecto nocivo del alcohol sobre la actividad bactericida de las células de Paneth.
Significado clínico
Las células de Paneth anormales con expresión o secreción reducida de las defensinas HD-5 y HD-6 (en humanos) y de los péptidos antimicrobianos están asociadas con la enfermedad inflamatoria intestinal. Además de eso, varios de los alelos de riesgo de enfermedad de Crohn están asociados con la disfunción de las células de Paneth y están involucrados en procesos como la autofagia, la respuesta de las proteínas desplegadas y la regulación de la función mitocondrial.
Se cree que la disfunción de las células de Paneth compromete los péptidos antimicrobianos, lo que lleva a un cambio en la composición de la microbiota e incluso a una disbiosis. Los pacientes con enfermedad de Crohn con un mayor porcentaje de células de Paneth anormales mostraron una diversidad bacteriana significativamente reducida en comparación con los pacientes con un menor porcentaje de células de Paneth anormales, lo que refleja una abundancia reducida de microbios antiinflamatorios. En conjunto, estos hallazgos respaldan la teoría de que la disfunción de las células de Paneth puede conducir a una microbiota disbiótica que, a su vez, podría predisponer a un individuo al desarrollo de la enfermedad de Crohn. Sin embargo, aún está por establecer si la disfunción de las células de Paneth es la causa de la disbiosis o su efecto concomitante.
Enterocolitis necrotizante
Las células de Paneth se desarrollan gradualmente durante la gestación y, por lo tanto, los bebés prematuros pueden no tenerlas en cantidades suficientes. Esto los deja vulnerables a la enterocolitis necrotizante. Aproximadamente a la mitad del desarrollo del intestino delgado, la secreción de catelicidina es reemplazada por la secreción de α-defensina. El intestino delgado del bebé prematuro se encuentra en esta etapa de transición cuando nace el bebé, lo que hace que los bebés prematuros sean susceptibles a lesiones intestinales y, posteriormente, a la enterocolitis necrotizante. Además, debe tenerse en cuenta que las células de Paneth tempranas no poseen gránulos maduros y completamente funcionales.
El mecanismo que vincula las células de Paneth con la enterocolitis necrotizante sigue sin estar claro, pero se ha teorizado que una proliferación de Proteobacteria y, más específicamente, de especies de Enterobacteriaceae precede al desarrollo de la enfermedad. Cuando posteriormente se produce una inflamación, los nitratos pueden ser fermentados por las especies de Enterobacteriaceae, pero no por los anaerobios obligados, que no pueden utilizar los nitratos como sustrato de crecimiento. Por lo tanto, las Proteobacteria pueden utilizar esta presión selectiva para superar a los anaerobios obligados Firmicutes y Bacteroidetes, lo que da lugar a su sobrecrecimiento y la consiguiente disbiosis.
Se cree que el proceso comienza cuando el bebé prematuro se expone a antígenos extraños a través de la alimentación con fórmula. Posteriormente, se liberan citocinas inflamatorias, lo que crea un estado más aeróbico que genera una ventaja competitiva para las Proteobacterias. A medida que el microbioma se vuelve más disbiótico, los mecanismos antiinflamatorios se debilitan, lo que contribuye a un ciclo de aumento de la inflamación intestinal. La inflamación conduce a una mayor pérdida de la densidad y la función de las células de Paneth, lo que da como resultado el deterioro de la secreción de AMP y la destrucción del nicho de las células madre.
Enfermedad hepática grasa no alcohólica
Aunque se ha prestado mucha atención al papel de las células de Paneth en el síndrome del intestino irritable y la enfermedad de Crohn, se sabe relativamente poco sobre el efecto que tiene el deterioro de las células de Paneth en la patogénesis de la esteatohepatitis no alcohólica o la enfermedad del hígado graso no alcohólico.
Los modelos murinos indican que la obesidad puede disminuir la secreción de α-defensina de las células de Paneth, lo que conduce a una disbiosis. Y al menos un modelo murino sugiere que cuando los niveles de α-defensina en el lumen intestinal se restauran mediante la administración intravenosa de R-Spondin1 para inducir la regeneración de las células de Paneth, la fibrosis hepática mejora como resultado de la resolución de la disbiosis. Se plantea la hipótesis de que las actividades microbicidas selectivas, así como el aumento de Muribaculaceae y la disminución de Harryflintia, contribuyen a la mejora de la fibrogénesis.
Un estudio describió la inyección de ditizona, que puede alterar los granulados celulares, en ratones alimentados con una dieta rica en grasas para identificar alteraciones microbianas orientadas a las células de Paneth. La aplicación de ditizona mejoró la intolerancia a la glucosa y la resistencia a la insulina de la dieta rica en grasas y se asoció con un alivio de la gravedad de la esteatosis hepática en ratones con dieta alta en grasas, posiblemente a través de la modulación del microbioma intestinal que implica el aumento de Bacteroides. Por lo tanto, se ha sugerido que las terapias dirigidas al microbioma pueden tener un papel en el tratamiento de la enfermedad del hígado graso no alcohólico.
Se necesitan más investigaciones para dilucidar la conexión entre las células de Paneth y el eje intestino-hígado.
Véase también
- Lista de tipos de células humanas derivados de las capas germinales
- Lista de tipos de células distintas en el cuerpo humano adulto
Referencias
- ^ Ibelgaufts H. "Ve a Cells-Talk.com". Copewithcytokines.org. Retrieved 2016-09-17.
- ^ a b "La célula de Paneth vivieron la anatomía". Britannica.com. Retrieved 2016-09-17.
- ^ Wallaeys C, García-Gonzalez N, Libert C (diciembre 2022). "Paneth cells as the cornerstones of intestinal and organismal health: a primer". EMBO Medicina molecular. 15 (2): e16427. doi:10.15252/emmm.202216427. PMC 9906427PMID 36573340. S2CID 255220922.
- ^ a b c Duggan C, Watkins JB, Walker WA (2008). Nutrición en Pediatría: Ciencia Básica, Aplicaciones Clínicas. B.C. Decker. p. 244. ISBN 9781550093612. Retrieved 2016-09-17.
- ^ a b c Elphick DA, Mahida YR (diciembre de 2005). "Las células de los padres: su papel en la inmunidad innata y la enfermedad inflamatoria". Gut. 54 (12): 1802-1809. doi:10.1136/gut.2005.068601. PMC 1774800. PMID 16284290.
- ^ Ireland H, Houghton C, Howard L, Winton DJ (agosto de 2005). "La herencia celular de un gen de reportero activado por Cre para determinar la longevidad de la célula Paneth en el intestino murino pequeño". Dinámica del desarrollo. 233 (4): 1332–1336. doi:10.1002/dvdy.20446. PMID 15937933. S2CID 33953837.
- ^ a b Clevers HC, Bevins CL (2013). "Células de los padres: maestros de las pequeñas criptas intestinales". Annual Review of Physiology. 75: 289–311. doi:10.1146/annurev-physiol-030212-183744. PMID 23398152.
- ^ a b Cray P, Sheahan BJ, Dekaney CM (2021). "Secretory Sorcery: Paneth Cell Control of Intestinal Repair and Homeostasis". Gastroenterología celular y molecular y hepatología. 12 (4): 1239–1250. doi:10.1016/j.jcmgh.2021.06.006. PMC 8446800. PMID 34153524.
- ^ Matsubara F (1977). "Estudio morfológico de la célula Paneth. Células de paneth en la metaplasia intestinal del estómago y el duodeno del hombre". Acta Pathol Jpn. 27 (5): 677–95. doi:10.1111/j.1440-1827.1977.tb00185.x. PMID 930588.
- ^ a b c Ganz T (agosto de 2000). "Células de los padres, guardianes de la hatchery de la célula intestinal". Nature Immunology. 1 (2): 99–100. doi:10.1038/77884. PMID 11248797. S2CID 36784170.
- ^ Vaishnava S, Behrendt CL, Ismail AS, Eckmann L, Hooper LV (diciembre de 2008). "Las células de los padres sienten directamente las comas intestinales y mantienen la homeostasis en la interfaz anfitriona-microbiana intestinal". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 105 (52): 20858–20863. Código:2008PNAS..10520858V. doi:10.1073/pnas.0808723105. PMC 2603261. PMID 19075245.
- ^ Rumio C, Besusso D, Palazzo M, Selleri S, Sfondrini L, Dubini F, et al. (agosto de 2004). "Degranulación de células de paneth a través del receptor 9 de peaje". El American Journal of Pathology. 165 (2): 373–381. doi:10.1016/S0002-9440(10)63304-4. PMC 1618569. PMID 15277213.
- ^ Wilson CL, Ouellette AJ, Satchell DP, Ayabe T, López-Boado YS, Stratman JL, et al. (octubre de 1999). "Regulación de la activación intestinal de alfa-defensin por la matrilysin metalloproteinasa en defensa host innata". Ciencia. 286 (5437): 113–117. doi:10.1126/science.286.5437.113. PMID 10506557.
- ^ Ayabe T, Satchell DP, Wilson CL, Parks WC, Selsted ME, Ouellette AJ (agosto de 2000). "Secreción de alfa-defensinas microbicidas por células Paneth intestinales en respuesta a bacterias". Nature Immunology. 1 (2): 113–118. doi:10.1038/77783. PMID 11248802. S2CID 23204633.
- ^ Ehmann D, Wendler J, Koeninger L, Larsen IS, Klag T, Berger J, et al. (Febrero 2019). "Poneth cell α-defensins HD-5 y HD-6 muestran degradación diferencial en fragmentos antimicrobianos activos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 116 (9): 3746–3751. Código:2019PNAS..116.3746E. doi:10.1073/pnas.1817376116. PMC 6397583. PMID 30808760.
- ^ Schroeder BO, Ehmann D, Precht JC, Castillo PA, Küchler R, Berger J, et al. (Mayo 2015). "Célula de color α-defensin 6 (HD-6) es un péptido antimicrobiano". Mucosal Immunology. 8 (3): 661–671. doi:10.1038/mi.2014.100. PMC 4424388. PMID 25354318.
- ^ a b c d e Lee VH, Gulati AS (Noviembre 2022). "Implicaciones de la disfunción celular de Paneth en la salud y enfermedad gastrointestinales". Opinión actual en Gastroenterología. 38 (6): 535-540. doi:10.1097/MOG.0000000887. PMC 9561020. PMID 36165037.
- ^ a b c d Lueschow SR, McElroy SJ (2020). "La célula Paneth: El curador y defensor de la pequeña inmaduro". Fronteras en inmunología. 11: 587. doi:10.3389/fimmu.2020.00587. PMC 7145889. PMID 32308658.
- ^ Bel S, Pendse M, Wang Y, Li Y, Ruhn KA, Hassell B, et al. (septiembre de 2017). "Las células de los padres secretan lysozyme vía autofagia secreto durante la infección bacteriana del intestino". Ciencia. 357 (6355): 1047-1052. Bibcode:2017Sci...357.1047B. doi:10.1126/science.aal4677. PMC 5702267. PMID 28751470.
- ^ Shankman LS, Fleury ST, Evans WB, Penberthy KK, Arandjelovic S, Blumberg RS, et al. (junio 2021). "Efferocitosis por células Paneth dentro del intestino". Biología actual. 31 (11): 2469–2476.e5. Bibcode:2021CBio...31E2469S. doi:10.1016/j.cub.2021.03.055. PMC 8281366. PMID 33852873.
- ^ Hauer-Jensen M, Denham JW, Andreyev HJ (agosto de 2014). "Enteropatía por radiación: patogénesis, tratamiento y prevención". Reseñas de la naturaleza. Gastroenterología & Hepatología. 11 (8): 470-479. doi:10.1038/nrgastro.2014.46. PMC 4346191. PMID 24686268.
- ^ Pentinmikko N, Iqbal S, Mana M, Andersson S, Cognetta AB, Suciu RM, et al. (Julio 2019). "Notum producido por células Paneth atenua la regeneración del epitelio intestinal envejecido". Naturaleza. 571 (7765): 398–402. doi:10.1038/s41586-019-1383-0. hdl:1721.1/126506. PMC 8151802. PMID 31292548. S2CID 195873343.
- ^ Podany AB, Wright J, Lamendella R, Soybel DI, Kelleher SL (mayo de 2016). "ZnT2-Mediated Zinc Import Into Paneth Cell Granules is Necessary for Coordinated Secretion and Paneth Cell Function in Mice". Gastroenterología celular y molecular y hepatología. 2 (3): 369–383. doi:10.1016/j.jcmgh.2015.12.006. PMC 5042355. PMID 28174721.
- ^ Wallaeys C, García-Gonzalez N, Libert C (Febrero 2023). "Paneth cells as the cornerstones of intestinal and organismal health: a primer". EMBO Medicina molecular. 15 (2): e16427. doi:10.15252/emmm.202216427. PMC 9906427. PMID 36573340.
- ^ Zhong W, Wei X, Hao L, Lin TD, Yue R, Sun X, et al. (Mayo 2020). "La disfunción de células madre media la esteatohepatitis relacionada con el alcohol mediante la promoción de la translocación bacteriana en ratones: el papel de la deficiencia de zinc". Hepatología. 71 (5): 1575–1591. doi:10.1002/hep.30945. PMC 7069794. PMID 31520476.
- ^ Wehkamp J, Salzman NH, Porter E, Nuding S, Weichenthal M, Petras RE, et al. (diciembre de 2005). "Célula Paneth reducida alfa-defensinas en la enfermedad de Crohn ileal". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 102 (50): 18129–18134. Bibcode:2005PNAS..10218129W. doi:10.1073/pnas.0505256102. PMC 1306791. PMID 16330776.
- ^ a b Salzman NH, Bevins CL (noviembre de 2013). "Dysbiosis - una consecuencia de la disfunción celular de Paneth". Seminarios en Inmunología. La microbiota y el sistema inmunitario, un asombroso mutualismo forjado por la co-evolución. 25 (5): 334-341. doi:10.1016/j.smim.2013.09.006. PMID 24239045.
- ^ Liu TC, Gurram B, Baldridge MT, Head R, Lam V, Luo C, et al. (junio 2016). "Los defectos de células madre en los pacientes de enfermedad de Crohn promueven la disbiosis". JCI Insight. 1 (8): e86907. doi:10.1172/jci.insight.86907. PMC 5033844. PMID 27699268.
- ^ McElroy SJ, Weitkamp JH (septiembre de 2011). "Innate Immunity in the Small Intestine of the Preterm Infant". NeoReviews. 12 (9): e517–e526. doi:10.1542/neo.12-9-e517. PMC 3359837. PMID 22639551.
- ^ Garabedian EM, Roberts LJ, McNevin MS, Gordon JI (septiembre de 1997). "Examinar el papel de las células Paneth en el intestino delgado por ablación de linaje en ratones transgénicos". El Diario de Química Biológica. 272 (38): 23729–23740. doi:10.1074/jbc.272.38.23729. PMID 9295317.
- ^ Niemarkt HJ, de Meij TG, van de Velde ME, van der Schee MP, van Goudoever JB, Kramer BW, et al. (Febrero 2015). "Enterocolitis necrotizante: una revisión clínica sobre biomarcadores diagnósticos y el papel de la microbiota intestinal". Enfermedades inflamatorias del intestino. 21 (2): 436-444. doi:10.1097/MIB.0000000000184. PMID 25268636. S2CID 26788165.
- ^ Stappenbeck TS, McGovern DP (febrero de 2017). "Alteraciones de células madre en el desarrollo y fenotipo de la enfermedad de Crohn". Gastroenterología. 152 (2): 322–326. doi:10.1053/j.gastro.2016.10.003. PMC 5209278. PMID 27729212.
- ^ Zhou H, Zhou SY, Gillilland M, Li JY, Lee A, Gao J, et al. (octubre 2020). "La toxicidad del ácido hídrico en las células de Paneth contribuye a la disbiosis intestinal inducida por la alimentación de alta grasa". JCI Insight. 5 (20). doi:10.1172/jci.insight.138881. PMC 7605541. PMID 33055426.
- ^ Nakamura S, Nakamura K, Yokoi Y, Shimizu Y, Ohira S, Hagiwara M, et al. (Marzo 2023). "Las defensinas α-defensinas de células Paneth reducidas promueven la fibrosis en un modelo de ratón inducido por la dieta alta en grasa definida por L-aminoácido-deficiente de la esteatohepatitis nonalcoholica mediante la interrupción de la microbiota intestinal". Scientific Reports. 13 (1): 3953. Bibcode:2023NatSR..13.3953N. doi:10.1038/s41598-023-30997-y. PMC 9998432. PMID 36894646.
- ^ Zhang S, Tun HM, Zhang D, Chau HT, Huang FY, Kwok H, et al. (2022-02-25). "Alleviation of Hepatic Steatosis: Dithizone-Related Gut Microbiome Restoration During Paneth Cell Dysfunction". Fronteras en Microbiología. 13: 813783. doi:10.3389/fmicb.2022.813783. PMC 8914291. PMID 35283810.
Más lectura
- Ganz T (octubre de 1999). "Defensinas y defensa anfitriona". Ciencia. 286 (5439): 420–421. doi:10.1126/science.286.5439.420. PMID 10577203. S2CID 5526644.
- Ganz T (agosto de 2000). "Células de los padres, guardianes de la hatchery de la célula intestinal". Nature Immunology. 1 (2): 99–100. doi:10.1038/77884. PMID 11248797. S2CID 36784170.