Cefalópodo
Un cefalópodo es cualquier miembro de la clase de moluscos Cephalopoda (plural griego κεφαλόποδες, kefalópodos; "cabeza-pies") como un calamar, un pulpo, una sepia o un nautilus. Estos animales exclusivamente marinos se caracterizan por una simetría corporal bilateral, una cabeza prominente y un conjunto de brazos o tentáculos (hidrostatos musculares) modificados a partir del primitivo pie de molusco. Los pescadores a veces llaman a los cefalópodos "pez tinta", refiriéndose a su habilidad común para arrojar tinta. El estudio de los cefalópodos es una rama de la malacología conocida como teutología.
Los cefalópodos se hicieron dominantes durante el período Ordovícico, representados por nautiloides primitivos. La clase ahora contiene dos subclases existentes, solo lejanamente relacionadas: Coleoidea, que incluye pulpos, calamares y sepias; y Nautiloidea, representada por Nautilus y Allonautilus. En Coleoidea, el caparazón de molusco se ha internalizado o está ausente, mientras que en Nautiloidea, permanece el caparazón externo. Se han identificado unas 800 especies vivas de cefalópodos. Dos importantes taxones extintos son Ammonoidea (ammonites) y Belemnoidea (belemnites). Los cefalópodos existentes varían en tamaño desde el Idiosepius thailandicus de 10 mm (0,3 pulgadas) hasta el calamar colosal de 14 m (45,1 pies), el invertebrado más grande que existe.
Distribución
Existen más de 800 especies de cefalópodos, aunque se siguen describiendo nuevas especies. Se han descrito unos 11.000 taxones extintos, aunque la naturaleza blanda de los cefalópodos hace que no se fosilicen fácilmente.
Los cefalópodos se encuentran en todos los océanos de la Tierra. Ninguno de ellos puede tolerar el agua dulce, pero el calamar pequeño, Lolliguncula brevis, que se encuentra en la bahía de Chesapeake, es una notable excepción parcial, ya que tolera el agua salobre. Se cree que los cefalópodos no pueden vivir en agua dulce debido a múltiples restricciones bioquímicas, y en sus más de 400 millones de años de existencia nunca se han aventurado en hábitats de agua dulce.
Los cefalópodos ocupan la mayor parte de la profundidad del océano, desde la llanura abisal hasta la superficie del mar. Su diversidad es mayor cerca del ecuador (~40 especies recuperadas en redes a 11°N por un estudio de diversidad) y disminuye hacia los polos (~5 especies capturadas a 60°N).
Biología
Sistema nervioso y comportamiento
Los cefalópodos son ampliamente considerados como los invertebrados más inteligentes y tienen sentidos bien desarrollados y cerebros grandes (más grandes que los de los gasterópodos). El sistema nervioso de los cefalópodos es el más complejo de los invertebrados y su relación cerebro-masa corporal se encuentra entre la de los vertebrados endotérmicos y ectotérmicos. También se sabe que los cefalópodos cautivos salen de sus acuarios, maniobran una distancia del piso del laboratorio, ingresan a otro acuario para alimentarse de los cangrejos y regresan a su propio acuario.
El cerebro está protegido en un cráneo cartilaginoso. Las fibras nerviosas gigantes del manto de los cefalópodos han sido ampliamente utilizadas durante muchos años como material experimental en neurofisiología; su gran diámetro (debido a la falta de mielinización) los hace relativamente fáciles de estudiar en comparación con otros animales.
Muchos cefalópodos son criaturas sociales; cuando se aísla de su propia especie, se ha observado que algunas especies se juntan con peces.
Algunos cefalópodos pueden volar por el aire distancias de hasta 50 m. Si bien los cefalópodos no son particularmente aerodinámicos, logran estos rangos impresionantes mediante propulsión a chorro; el agua continúa siendo expulsada del embudo mientras el organismo está en el aire. Los animales extendieron sus aletas y tentáculos para formar alas y controlar activamente la fuerza de sustentación con la postura del cuerpo. Una especie, Todarodes pacificus, ha sido observada extendiendo tentáculos en forma de abanico plano con una película de moco entre los tentáculos individuales mientras que otra, Sepioteuthis sepioidea, ha sido observada colocando los tentáculos en un arreglo circular.
Sentidos
Los cefalópodos tienen una visión avanzada, pueden detectar la gravedad con estatocistos y tienen una variedad de órganos sensoriales químicos. Los pulpos usan sus brazos para explorar su entorno y pueden usarlos para la percepción de profundidad.
Visión
La mayoría de los cefalópodos dependen de la visión para detectar depredadores y presas, y para comunicarse entre sí. En consecuencia, la visión de los cefalópodos es aguda: los experimentos de entrenamiento han demostrado que el pulpo común puede distinguir el brillo, el tamaño, la forma y la orientación horizontal o vertical de los objetos. La construcción morfológica da a los ojos de los cefalópodos el mismo rendimiento que los ojos de los tiburones, sin embargo, su construcción difiere, ya que los cefalópodos carecen de córnea y tienen la retina evertida. Cefalópodos' los ojos también son sensibles al plano de polarización de la luz. A diferencia de muchos otros cefalópodos, los nautilos no tienen buena visión; su estructura ocular está muy desarrollada, pero carece de una lente sólida. Tienen un simple "agujero de alfiler" ojo por donde puede pasar el agua. En lugar de la visión, se cree que el animal usa el olfato como el sentido principal para buscar comida, así como para localizar o identificar parejas potenciales.
Sorprendentemente, dada su capacidad para cambiar de color, se considera que todos los pulpos y la mayoría de los cefalópodos son daltónicos. Los cefalópodos coleoides (pulpo, calamar, sepia) tienen un solo tipo de fotorreceptor y carecen de la capacidad de determinar el color comparando la intensidad de los fotones detectados en múltiples canales espectrales. Cuando se camuflan, usan sus cromatóforos para cambiar el brillo y el patrón de acuerdo con el fondo que ven, pero su capacidad para igualar el color específico de un fondo puede provenir de células como los iridóforos y los leucóforos que reflejan la luz del entorno. También producen pigmentos visuales en todo su cuerpo y pueden sentir los niveles de luz directamente de su cuerpo. Se ha encontrado evidencia de la visión del color en el calamar enope espumoso (Watasenia scintillans). Logra la visión del color con tres fotorreceptores, que se basan en la misma opsina, pero utilizan distintas moléculas retinales como cromóforos: A1 (retinal), A3 (3-deshidrorretinal) y A4 (4-hidroxiretinal). El fotorreceptor A1 es más sensible a la luz verde-azul (484 nm), el fotorreceptor A2 a la luz azul-verde (500 nm) y el fotorreceptor A4 a la luz azul (470 nm).
En 2015, se describió un mecanismo novedoso para la discriminación espectral en cefalópodos. Esto se basa en la explotación de la aberración cromática (dependencia de la longitud de onda de la distancia focal). El modelado numérico muestra que la aberración cromática puede generar información cromática útil a través de la dependencia de la agudeza de la imagen en la acomodación. Las inusuales hendiduras fuera del eje y las formas anulares de las pupilas en los cefalópodos mejoran esta capacidad al actuar como prismas que dispersan la luz blanca en todas las direcciones.
Fotorrecepción
En 2015, se publicó evidencia molecular que indica que los cromatóforos de los cefalópodos son fotosensibles; Las reacciones en cadena de la polimerasa con transcripción inversa (RT-PCR) revelaron transcritos que codifican rodopsina y retinocromo dentro de las retinas y la piel del calamar costero de aleta larga (Doryteuthis pealeii), y la sepia común (Sepia officinalis) y la sepia (Sepia latimanus). Los autores afirman que esta es la primera evidencia de que los tejidos dérmicos de los cefalópodos pueden poseer la combinación requerida de moléculas para responder a la luz.
Oído
Se ha demostrado que algunos calamares detectan el sonido usando sus estatocistos, pero, en general, los cefalópodos son sordos.
Uso de la luz
La mayoría de los cefalópodos poseen un conjunto de componentes de la piel que interactúan con la luz. Estos pueden incluir iridóforos, leucóforos, cromatóforos y (en algunas especies) fotóforos. Los cromatóforos son células pigmentarias coloreadas que se expanden y contraen para producir colores y patrones que pueden usar en una asombrosa variedad de formas. Además de camuflarse con su fondo, algunos cefalópodos emiten bioluminiscencia, proyectando luz hacia abajo para ocultar sus sombras de cualquier depredador que pueda acechar debajo. La bioluminiscencia es producida por simbiontes bacterianos; el cefalópodo anfitrión es capaz de detectar la luz producida por estos organismos. La bioluminiscencia también se puede usar para atraer presas, y algunas especies usan pantallas coloridas para impresionar a sus parejas, asustar a los depredadores o incluso comunicarse entre sí.
Coloración
Los cefalópodos pueden cambiar sus colores y patrones en milisegundos, ya sea para señalización (tanto dentro de la especie como para advertencia) o camuflaje activo, ya que sus cromatóforos se expanden o contraen. Aunque los cambios de color parecen depender principalmente de la entrada de la visión, existe evidencia de que las células de la piel, específicamente los cromatóforos, pueden detectar la luz y adaptarse a las condiciones de luz independientemente de los ojos. El pulpo cambia el color y la textura de la piel durante los ciclos de sueño tranquilo y activo.
Los cefalópodos pueden usar cromatóforos como un músculo, por lo que pueden cambiar el tono de su piel tan rápido como lo hacen. La coloración suele ser más fuerte en las especies cercanas a la costa que en las que viven en el océano abierto, cuyas funciones tienden a estar restringidas al camuflaje disruptivo. Estos cromatóforos se encuentran en todo el cuerpo del pulpo, sin embargo, están controlados por la misma parte del cerebro que controla el alargamiento durante la propulsión a chorro para reducir la resistencia. Como tal, los pulpos jet pueden palidecer porque el cerebro no puede lograr controlar el alargamiento y controlar los cromatóforos. La mayoría de los pulpos imitan estructuras seleccionadas en su campo de visión en lugar de convertirse en un color compuesto de todo su fondo.
Se ha detectado evidencia de la coloración original en fósiles de cefalópodos que datan del Silúrico; estos individuos ortocónicos tenían rayas concéntricas, que se cree que servían como camuflaje. Los cefalópodos del Devónico tienen patrones de color más complejos, de función desconocida.
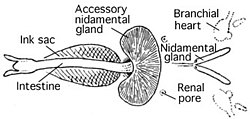
Tinta
Con la excepción de los Nautilidae y las especies de pulpo pertenecientes al suborden Cirrina, todos los cefalópodos conocidos tienen un saco de tinta, que puede usarse para expulsar una nube de tinta oscura para confundir a los depredadores. Este saco es una bolsa muscular que se originó como una extensión del intestino posterior. Se encuentra debajo del intestino y se abre hacia el ano, en el que se puede inyectar su contenido, casi melanina pura; su proximidad a la base del embudo significa que la tinta puede ser distribuida por el agua expulsada cuando el cefalópodo usa su propulsión a chorro. La nube de melanina expulsada generalmente se mezcla, al momento de la expulsión, con moco, producido en otras partes del manto y, por lo tanto, forma una nube espesa, lo que resulta en un deterioro visual (y posiblemente quimiosensorial) del depredador, como una cortina de humo. Sin embargo, se ha observado un comportamiento más sofisticado, en el que el cefalópodo libera una nube, con mayor contenido de moco, que se asemeja aproximadamente al cefalópodo que la liberó (este señuelo se denomina pseudomorfo). Esta estrategia a menudo da como resultado que el depredador ataque al pseudomorfo, en lugar de que su presa se vaya rápidamente. Para obtener más información, consulte Comportamientos de entrada manuscrita.
El saco de tinta de los cefalópodos ha llevado al nombre común de "pez tinta", anteriormente el pez pluma y tinta.
Sistema circulatorio
Los cefalópodos son los únicos moluscos con un sistema circulatorio cerrado. Los coleoides tienen dos corazones branquiales (también conocidos como corazones branquiales) que mueven la sangre a través de los capilares de las branquias. Un solo corazón sistémico luego bombea la sangre oxigenada a través del resto del cuerpo.
Como la mayoría de los moluscos, los cefalópodos utilizan hemocianina, una proteína que contiene cobre, en lugar de hemoglobina, para transportar oxígeno. Como resultado, su sangre es incolora cuando se desoxigena y se vuelve azul cuando se une al oxígeno. En ambientes ricos en oxígeno y en agua ácida, la hemoglobina es más eficiente, pero en ambientes con poco oxígeno y bajas temperaturas, la hemocianina tiene la ventaja. La molécula de hemocianina es mucho más grande que la molécula de hemoglobina, lo que le permite unirse con 96 O2 o CO 2 moléculas, en lugar de las cuatro de la hemoglobina. Pero a diferencia de la hemoglobina, que se adhiere por millones a la superficie de un solo glóbulo rojo, las moléculas de hemocianina flotan libremente en el torrente sanguíneo.
Respiración
Los cefalópodos intercambian gases con el agua de mar forzando el agua a través de sus branquias, que están adheridas al techo del organismo. El agua ingresa a la cavidad del manto en el exterior de las branquias y la entrada de la cavidad del manto se cierra. Cuando el manto se contrae, el agua es forzada a través de las branquias, que se encuentran entre la cavidad del manto y el embudo. La expulsión del agua a través del embudo se puede utilizar para impulsar la propulsión a chorro. Si la respiración se usa simultáneamente con la propulsión a chorro, se pueden esperar grandes pérdidas en la velocidad o en la generación de oxígeno. Las branquias, que son mucho más eficientes que las de otros moluscos, están adheridas a la superficie ventral de la cavidad del manto. Existe una compensación con el tamaño de las branquias con respecto al estilo de vida. Para lograr velocidades rápidas, las branquias deben ser pequeñas: el agua pasará rápidamente a través de ellas cuando se necesite energía, lo que compensará su pequeño tamaño. Sin embargo, los organismos que pasan la mayor parte de su tiempo moviéndose lentamente a lo largo del fondo no pasan naturalmente mucha agua a través de su cavidad para moverse; por lo tanto, tienen branquias más grandes, junto con sistemas complejos para garantizar que el agua lave constantemente a través de sus branquias, incluso cuando el organismo está estacionario. El flujo de agua está controlado por las contracciones de los músculos de la cavidad radial y circular del manto.
Las branquias de los cefalópodos están sostenidas por un esqueleto de proteínas fibrosas robustas; la falta de mucopolisacáridos distingue esta matriz del cartílago. También se cree que las branquias participan en la excreción, ya que el NH4+ se intercambia con el K+ del agua de mar.
Locomoción y flotabilidad
Si bien la mayoría de los cefalópodos pueden moverse por propulsión a chorro, esta es una forma de viajar que consume mucha energía en comparación con la propulsión de la cola que usan los peces. La eficiencia de un chorro de agua impulsado por hélice (es decir, la eficiencia de Froude) es mayor que la de un cohete. La eficiencia relativa de la propulsión a chorro disminuye aún más a medida que aumenta el tamaño del animal; las paralarvas son mucho más eficientes que los individuos juveniles y adultos. Desde la era paleozoica, cuando la competencia con los peces producía un entorno en el que el movimiento eficiente era crucial para la supervivencia, la propulsión a chorro ha tenido un papel secundario, con aletas y tentáculos utilizados para mantener una velocidad constante. Si bien la propulsión a chorro nunca es el único modo de locomoción, el movimiento de parada y arranque proporcionado por los chorros sigue siendo útil para proporcionar ráfagas de alta velocidad, sobre todo al capturar presas o evitar a los depredadores. De hecho, convierte a los cefalópodos en los invertebrados marinos más rápidos, y pueden acelerar más que la mayoría de los peces. El chorro se complementa con movimiento de aletas; en el calamar, las aletas se agitan cada vez que se suelta un chorro, amplificando el empuje; luego se extienden entre chorros (presumiblemente para evitar hundirse). El agua oxigenada se lleva a la cavidad del manto hasta las branquias y, a través de la contracción muscular de esta cavidad, el agua gastada se expulsa a través del hiponomo, creado por un pliegue en el manto. La diferencia de tamaño entre los extremos posterior y anterior de este órgano controla la velocidad del chorro que puede producir el organismo. La velocidad del organismo se puede predecir con precisión para una masa y morfología dadas del animal. El movimiento de los cefalópodos suele ser hacia atrás, ya que el agua es expulsada anteriormente a través del hiponomo, pero la dirección se puede controlar de alguna manera apuntándola en diferentes direcciones. Algunos cefalópodos acompañan esta expulsión de agua con un estallido similar a un disparo, que se cree que funciona para ahuyentar a los depredadores potenciales.
Los cefalópodos emplean un método de propulsión similar a pesar de que su tamaño aumenta (a medida que crecen) cambiando la dinámica del agua en la que se encuentran. Por lo tanto, sus paralarvas no usan mucho sus aletas (que son menos eficientes con números de Reynolds bajos) y usan principalmente sus chorros para impulsarse hacia arriba, mientras que los cefalópodos adultos grandes tienden a nadar con menos eficiencia y dependen más de sus aletas.
Se cree que los primeros cefalópodos producían chorros metiendo su cuerpo dentro de sus caparazones, como lo hace hoy Nautilus. Nautilus también es capaz de crear un chorro por ondulaciones de su embudo; este flujo de agua más lento es más adecuado para la extracción de oxígeno del agua. Cuando está inmóvil, Nautilus solo puede extraer el 20% del oxígeno del agua. La velocidad del chorro en Nautilus es mucho más lenta que en los coleoides, pero se involucra menos musculatura y energía en su producción. El empuje del chorro en los cefalópodos está controlado principalmente por el diámetro máximo del orificio del embudo (o, quizás, el diámetro promedio del embudo) y el diámetro de la cavidad del manto. Los cambios en el tamaño del orificio se usan más a velocidades intermedias. La velocidad absoluta alcanzada está limitada por el requisito del cefalópodo de inhalar agua para su expulsión; esta ingesta limita la velocidad máxima a ocho longitudes corporales por segundo, una velocidad que la mayoría de los cefalópodos pueden alcanzar después de dos embudos. El agua vuelve a llenar la cavidad entrando no solo a través de los orificios, sino también a través del embudo. Los calamares pueden expulsar hasta el 94% del fluido dentro de su cavidad en un solo chorro. Para adaptarse a los rápidos cambios en la toma y expulsión de agua, los orificios son muy flexibles y pueden cambiar su tamaño por un factor de veinte; el radio del embudo, por el contrario, cambia solo por un factor de alrededor de 1,5.
Algunas especies de pulpos también son capaces de caminar por el fondo marino. Los calamares y las sepias pueden moverse distancias cortas en cualquier dirección mediante la ondulación de un colgajo de músculo alrededor del manto.
Si bien la mayoría de los cefalópodos flotan (es decir, tienen una flotabilidad neutra o casi; de hecho, la mayoría de los cefalópodos son entre un 2 y un 3 % más densos que el agua de mar), lo logran de diferentes maneras. Algunos, como Nautilus, permiten que el gas se difunda en el espacio entre el manto y el caparazón; otros permiten que agua más pura fluya de sus riñones, expulsando agua salada más densa de la cavidad del cuerpo; otros, como algunos pescados, acumulan aceites en el hígado; y algunos pulpos tienen un cuerpo gelatinoso con iones de cloruro más ligeros que reemplazan al sulfato en la química del cuerpo.
Los calamares son los principales afectados por la flotabilidad negativa en los cefalópodos. La flotabilidad negativa significa que algunos calamares, especialmente aquellos cuyas profundidades de hábitat son poco profundas, tienen que regular activamente sus posiciones verticales. Esto significa que deben gastar energía, a menudo a través de chorros u ondulaciones, para mantener la misma profundidad. Como tal, el costo de transporte de muchos calamares es bastante alto. Dicho esto, los calamares y otros cefalópodos que habitan en aguas profundas tienden a tener una flotabilidad más neutral, lo que elimina la necesidad de regular la profundidad y aumenta su eficiencia locomotora.
El Macrotritopus defilippi, o el pulpo que habita en la arena, fue visto imitando tanto la coloración como los movimientos de natación del lenguado que habita en la arena Bothus lunatus para evitar a los depredadores. Los pulpos pudieron aplanar sus cuerpos y poner sus brazos hacia atrás para tener la misma apariencia que las platijas y moverse con la misma velocidad y movimientos.
Las hembras de dos especies, Ocythoe tuberculata y Haliphron atlanticus, han desarrollado una verdadera vejiga natatoria.
Locomoción pulpo vs calamar
Dos de las categorías de cefalópodos, pulpos y calamares, son muy diferentes en sus movimientos a pesar de ser de la misma clase. Los pulpos generalmente no son vistos como nadadores activos; a menudo se encuentran hurgando en el fondo del mar en lugar de nadar largas distancias a través del agua. Los calamares, por otro lado, se pueden encontrar para viajar grandes distancias, y algunos se mueven hasta 2000 km en 2,5 meses a un ritmo promedio de 0,9 longitudes corporales por segundo. Hay una razón importante para la diferencia en el tipo de movimiento y la eficiencia: la anatomía.
Tanto los pulpos como los calamares tienen mantos (mencionados anteriormente) que funcionan para la respiración y la locomoción en forma de chorro. Sin embargo, la composición de estos mantos difiere entre las dos familias. En los pulpos, el manto se compone de tres tipos de músculos: longitudinales, radiales y circulares. Los músculos longitudinales corren paralelos a la longitud del pulpo y se utilizan para mantener el manto de la misma longitud durante todo el proceso de chorro. Dado que son músculos, se puede notar que esto significa que el pulpo debe flexionar activamente los músculos longitudinales durante el chorro para mantener el manto en una longitud constante. Los músculos radiales corren perpendiculares a los músculos longitudinales y se utilizan para engrosar y adelgazar la pared del manto. Finalmente, los músculos circulares se utilizan como principales activadores en el jetting. Son bandas musculares que rodean el manto y expanden/contraen la cavidad. Los tres tipos de músculos trabajan al unísono para producir un chorro como mecanismo de propulsión.
Los calamares no tienen los músculos longitudinales que tienen los pulpos. En cambio, tienen una túnica. Esta túnica está hecha de capas de colágeno y rodea la parte superior e inferior del manto. Debido a que están hechas de colágeno y no de músculo, las túnicas son cuerpos rígidos que son mucho más fuertes que las contrapartes musculares. Esto proporciona a los calamares algunas ventajas para nadar con propulsión a chorro. La rigidez significa que no hay flexión muscular necesaria para mantener el manto del mismo tamaño. Además, las túnicas ocupan solo el 1 % del grosor de la pared del manto del calamar, mientras que las fibras musculares longitudinales ocupan hasta el 20 % del grosor de la pared del manto de los pulpos. También debido a la rigidez de la túnica, los músculos radiales del calamar pueden contraerse con más fuerza.
El manto no es el único lugar donde los calamares tienen colágeno. Las fibras de colágeno se encuentran a lo largo de las otras fibras musculares en el manto. Estas fibras de colágeno actúan como elásticos y, en ocasiones, se denominan "resortes de colágeno". Como su nombre lo indica, estas fibras actúan como resortes. Cuando los músculos radiales y circulares del manto se contraen, llegan a un punto en el que la contracción ya no es eficaz para el movimiento hacia adelante de la criatura. En tales casos, el exceso de contracción se almacena en el colágeno que luego comienza de manera eficiente o ayuda en la expansión del manto al final del chorro. En algunas pruebas, se ha demostrado que el colágeno puede comenzar a aumentar la presión del manto hasta 50 ms antes de que se inicie la actividad muscular.
Estas diferencias anatómicas entre los calamares y los pulpos pueden ayudar a explicar por qué se puede encontrar a los calamares nadando de manera similar a los peces, mientras que los pulpos generalmente dependen de otras formas de locomoción en el lecho marino, como caminar bípedo, gatear y nadar sin chorros.
Concha
Los nautiluses son los únicos cefalópodos que existen con un verdadero caparazón externo. Sin embargo, todas las conchas de moluscos se forman a partir del ectodermo (capa externa del embrión); en la sepia (Sepia spp.), por ejemplo, se forma una invaginación del ectodermo durante el período embrionario, lo que da como resultado una concha (hueso de sepia) que es interna en el adulto. Lo mismo ocurre con el gladius quitinoso de los calamares y los pulpos. Los pulpos cirrados tienen soportes de aletas cartilaginosas en forma de arco, que a veces se denominan "vestigios de concha" o "gladius". Los Incirrina tienen un par de estiletes en forma de varilla o ningún vestigio de caparazón interno, y algunos calamares también carecen de gladius. Los coleoides sin cáscara no forman un clado o incluso un grupo parafilético. La cáscara de Spirula comienza como una estructura orgánica y luego se mineraliza muy rápidamente. Conchas que están "perdidas" puede perderse por reabsorción del componente de carbonato de calcio.
Las hembras del género pulpo Argonauta secretan una caja de huevos especializada, delgada como el papel, en la que residen, y esto se considera popularmente como una "cáscara", aunque no está adherida al cuerpo del animal y tiene un origen evolutivo separado.
El grupo más grande de cefalópodos con caparazón, los ammonites, se extinguió, pero sus caparazones son muy comunes como fósiles.
La deposición de carbonato, que conduce a una concha mineralizada, parece estar relacionada con la acidez de la matriz orgánica de la concha (ver Concha de molusco); los cefalópodos que forman conchas tienen una matriz ácida, mientras que el gladius del calamar tiene una matriz básica. La disposición básica de la pared exterior del cefalópodo es: una capa prismática exterior (esferulítica), una capa laminar (nacarada) y una capa prismática interior. El grosor de cada capa depende de los taxones. En los cefalópodos modernos, el carbonato de Ca es aragonito. En cuanto a otras conchas de moluscos o esqueletos de coral, las unidades visibles más pequeñas son gránulos redondeados irregulares.
Apéndices de la cabeza
Los cefalópodos, como su nombre lo indica, tienen apéndices musculares que se extienden desde la cabeza y rodean la boca. Estos se utilizan en la alimentación, la movilidad e incluso la reproducción. En los coleoides son ocho o diez. Los decápodos como la sepia y el calamar tienen cinco pares. Los dos más largos, denominados tentáculos, participan activamente en la captura de presas; pueden alargarse rápidamente (en tan solo 15 milisegundos). En el calamar gigante pueden alcanzar una longitud de 8 metros. Pueden terminar en una maza ensanchada cubierta de ventosas. Los cuatro pares más cortos se denominan brazos y están involucrados en sostener y manipular el organismo capturado. Ellos también tienen ventosas, en el lado más cercano a la boca; estos ayudan a aferrarse a la presa. Los octópodos solo tienen cuatro pares de brazos cubiertos de ventosas, como sugiere el nombre, aunque las anomalías del desarrollo pueden modificar el número de brazos expresados.
El tentáculo consta de un cordón nervioso central grueso (que debe ser grueso para permitir controlar cada ventosa de forma independiente) rodeado de músculos circulares y radiales. Debido a que el volumen del tentáculo permanece constante, la contracción de los músculos circulares disminuye el radio y permite el rápido aumento de la longitud. Por lo general, se logra un alargamiento del 70 % al disminuir el ancho en un 23 %. Los brazos más cortos carecen de esta capacidad.
El tamaño del tentáculo está relacionado con el tamaño de la cavidad bucal; los tentáculos más grandes y fuertes pueden sujetar a la presa a medida que se le dan pequeños mordiscos; con tentáculos más numerosos y pequeños, la presa se traga entera, por lo que la cavidad bucal debe ser más grande.
Los nautilidos con caparazón externo (Nautilus y Allonautilus) tienen del orden de 90 apéndices en forma de dedos, denominados tentáculos, que carecen de ventosas pero en cambio, son pegajosos y son parcialmente retráctiles.
Alimentación
Todos los cefalópodos vivos tienen un pico de dos partes; la mayoría tiene una rádula, aunque está reducida en la mayoría de los pulpos y ausente por completo en Spirula. Se alimentan capturando presas con sus tentáculos, llevándolas a la boca y mordiéndolas. Tienen una mezcla de jugos digestivos tóxicos, algunos de los cuales son fabricados por algas simbióticas, que expulsan de sus glándulas salivales sobre sus presas capturadas en la boca. Estos jugos separan la carne de sus presas del hueso o caparazón. La glándula salival tiene un pequeño diente en su extremo que se puede clavar en un organismo para digerirlo desde dentro.
La glándula digestiva en sí es bastante corta. Tiene cuatro elementos, los alimentos pasan por el buche, el estómago y el ciego antes de ingresar al intestino. La mayor parte de la digestión, así como la absorción de nutrientes, ocurre en la glándula digestiva, a veces llamada hígado. Los nutrientes y los materiales de desecho se intercambian entre el intestino y la glándula digestiva a través de un par de conexiones que unen la glándula con la unión del estómago y el ciego. Las células de la glándula digestiva liberan directamente sustancias químicas excretoras pigmentadas en la luz del intestino, que luego se unen con moco que pasa a través del ano como hilos largos y oscuros, expulsados con la ayuda del agua exhalada del embudo. Los cefalópodos tienden a concentrar los metales pesados ingeridos en sus tejidos corporales. Sin embargo, los brazos de pulpo usan una familia de receptores quimiotáctiles (CR) específicos de cefalópodos para ser su "sabor al tacto" sistema.
Rádula
La rádula del cefalópodo consta de varias filas simétricas de hasta nueve dientes (trece en las clases de fósiles). El órgano es reducido o incluso vestigial en ciertas especies de pulpo y está ausente en Spirula. Los dientes pueden ser homodontes (es decir, de forma similar a lo largo de una fila), heterodontes (de lo contrario) o ctenodontos (en forma de peine). Su altura, ancho y número de cúspides es variable entre especies. El patrón de dientes se repite, pero cada fila puede no ser idéntica a la anterior; en el pulpo, por ejemplo, la secuencia se repite cada cinco filas.
Las rádulas de cefalópodos se conocen a partir de depósitos fósiles que datan del Ordovícico. Por lo general, se conservan dentro de la cámara del cuerpo del cefalópodo, comúnmente junto con las mandíbulas; pero esto no tiene por qué ser siempre el caso; muchas rádulas se conservan en una variedad de entornos en Mason Creek. Las rádulas suelen ser difíciles de detectar, incluso cuando se conservan en fósiles, ya que la roca debe erosionarse y agrietarse exactamente de la manera correcta para exponerlas; por ejemplo, las rádulas solo se han encontrado en nueve de los 43 géneros de ammonites, y son aún más raras en formas no ammonoideas: solo tres especies premesozoicas poseen una.
Sistema excretor
La mayoría de los cefalópodos poseen un solo par de grandes nefridios. Los desechos nitrogenados filtrados se producen en la cavidad pericárdica de los corazones branquiales, cada uno de los cuales está conectado a un nefridio por un canal estrecho. El canal lleva los excrementos a un saco renal similar a una vejiga y también reabsorbe el exceso de agua del filtrado. Varias excrecencias de la vena cava lateral se proyectan hacia el interior del saco renal, inflándose y desinflándose continuamente a medida que late el corazón branquial. Esta acción ayuda a bombear los desechos secretados hacia los sacos, para ser liberados en la cavidad del manto a través de un poro.
Nautilus, inusualmente, posee cuatro nefridios, ninguno de los cuales está conectado a las cavidades pericárdicas.
La incorporación de amoníaco es importante para la formación de caparazones en moluscos terrestres y otros linajes no moluscos. Debido a que la proteína (es decir, la carne) es un componente principal de la dieta de los cefalópodos, se producen grandes cantidades de iones de amonio como desechos. Los principales órganos involucrados en la liberación de este exceso de amonio son las branquias. La tasa de liberación es más baja en los cefalópodos sin caparazón Nautilus y Sepia como resultado del uso de nitrógeno para llenar sus caparazones con gas para aumentar la flotabilidad. Otros cefalópodos usan amonio de manera similar, almacenando los iones (como cloruro de amonio) para reducir su densidad general y aumentar la flotabilidad.
Reproducción y ciclo de vida
Los cefalópodos son un grupo diverso de especies, pero comparten rasgos de historia de vida comunes, por ejemplo, tienen una tasa de crecimiento rápida y una vida corta. Stearns (1992) sugirió que para producir el mayor número posible de crías viables, los eventos de desove dependen de los factores ambientales ecológicos del organismo. La mayoría de los cefalópodos no brindan cuidados parentales a sus crías, excepto, por ejemplo, el pulpo, que ayuda a este organismo a aumentar la tasa de supervivencia de sus crías. Especies marinas' Los ciclos de vida se ven afectados por diversas condiciones ambientales. El desarrollo de un embrión de cefalópodo puede verse muy afectado por la temperatura, la saturación de oxígeno, la contaminación, la intensidad de la luz y la salinidad. Estos factores son importantes para la tasa de desarrollo embrionario y el éxito de la eclosión de los embriones. La disponibilidad de alimentos también juega un papel importante en el ciclo reproductivo de los cefalópodos. Una limitación de alimentos influye en el momento del desove junto con su función y crecimiento. El tiempo de desove y el desove varían entre las especies marinas; está correlacionado con la temperatura, aunque los cefalópodos en aguas poco profundas se reproducen en los meses fríos para que la descendencia eclosione a temperaturas más cálidas. La reproducción puede durar desde varios días hasta un mes.
Madurez sexual
Los cefalópodos que son sexualmente maduros y de tamaño adulto comienzan a desovar y reproducirse. Después de la transferencia de material genético a la siguiente generación, los cefalópodos adultos mueren. La maduración sexual en cefalópodos machos y hembras se puede observar internamente por el agrandamiento de las gónadas y glándulas accesorias. El apareamiento sería un mal indicador de la maduración sexual en las hembras; pueden recibir espermatozoides cuando no están completamente maduros para la reproducción y almacenarlos hasta que estén listos para fertilizar los óvulos. Los machos son más agresivos en su competencia previa al apareamiento cuando están en presencia de hembras inmaduras que cuando compiten por una hembra sexualmente madura. La mayoría de los cefalópodos machos desarrollan un hectocótilo, una punta del brazo que es capaz de transferir sus espermatozoides a la cavidad del manto de la hembra. Aunque no todas las especies usan un hectocotylus; por ejemplo, el nautilo adulto suelta un espádice. Una indicación de la madurez sexual de las hembras es el desarrollo de fotóforos braquiales para atraer parejas.
Fertilización
Los cefalópodos no se reproducen por difusión. Durante el proceso de fecundación, las hembras utilizan el esperma proporcionado por el macho a través de la fecundación externa. La fertilización interna se ve solo en los pulpos. El inicio de la cópula comienza cuando el macho atrapa a una hembra y la rodea con su brazo, ya sea en un "cuello de macho a hembra" posición o boca a boca, dependiendo de la especie. Luego, los machos inician el proceso de fertilización contrayendo su manto varias veces para liberar los espermatozoides. Los cefalópodos a menudo se aparean varias veces, lo que influye en que los machos se apareen durante más tiempo con las hembras que lo han hecho anteriormente, casi triplicando el número de contracciones del manto. Para asegurar la fertilización de los óvulos, los cefalópodos hembras liberan un péptido que atrae espermatozoides a través de las capas gelatinosas del óvulo para dirigir los espermatozoides. Las hembras de cefalópodo ponen huevos en nidadas; cada huevo está compuesto por una capa protectora para garantizar la seguridad del embrión en desarrollo cuando se libera en la columna de agua. Las estrategias reproductivas difieren entre las especies de cefalópodos. En el pulpo gigante del Pacífico, los huevos grandes se ponen en una guarida; a menudo llevará varios días colocarlos todos. Una vez que los huevos se liberan y se adhieren a un sustrato protegido, las hembras mueren y se vuelven semelparas. En algunas especies de cefalópodos, las puestas de huevos están ancladas a sustratos por una sustancia adhesiva mucilaginosa. Estos huevos están hinchados con líquido perivitelino (PVF), un líquido hipertónico que evita la eclosión prematura. Los racimos de huevos fertilizados tienen una flotabilidad neutra dependiendo de la profundidad a la que fueron depositados, pero también se pueden encontrar en sustratos como arena, una matriz de corales o algas marinas. Debido a que estas especies no brindan cuidado parental a sus crías, la hembra puede inyectar tinta en las cápsulas de huevo para camuflar los embriones de los depredadores.
Competencia hombre-hombre
La mayoría de los cefalópodos tienen relaciones sexuales agresivas: una proteína en la vaina de la cápsula masculina estimula este comportamiento. También se involucran en la agresión macho-macho, donde los machos más grandes tienden a ganar las interacciones. Cuando una hembra está cerca, los machos se embisten continuamente y agitan los brazos. Si ninguno de los machos retrocede, los brazos se extienden hacia atrás, exponiendo la boca, seguido de mordidas en las puntas de los brazos. Durante la competencia de apareamiento, los machos también participan en una técnica llamada lavado. Esta técnica es utilizada por el segundo macho que intenta aparearse con una hembra. El lavado elimina los espermatóforos en la cavidad bucal que el primer compañero colocó allí al forzar el agua en la cavidad. Otro comportamiento en el que se involucran los machos es el apareamiento o el mimetismo: los machos más pequeños ajustan su comportamiento al de una hembra para reducir la agresión. Al usar esta técnica, pueden fertilizar los huevos mientras el macho más grande se distrae con un macho diferente. Durante este proceso, los machos zapateros insertan rápidamente esperma en forma de gota en el receptáculo seminal.
Elección de pareja
La elección de pareja se observa en especies de sepias, donde las hembras prefieren a algunos machos sobre otros, aunque se desconocen las características de los machos preferidos. Una hipótesis establece que las hembras rechazan a los machos por señales olfativas en lugar de señales visuales. Varias especies de cefalópodos son poliándricos: aceptan y almacenan múltiples espermatóforos masculinos, lo que ha sido identificado mediante huellas dactilares de ADN. Las hembras ya no son receptivas a los intentos de apareamiento cuando sostienen los huevos en sus brazos. Las hembras pueden almacenar esperma en dos lugares (1) la cavidad bucal donde los machos recién apareados colocan sus espermatóforos y (2) los receptáculos internos de almacenamiento de esperma donde se almacenan los paquetes de esperma de machos anteriores. El almacenamiento de espermatóforos da como resultado la competencia entre espermatozoides; que establece que la hembra controla qué compañero fertiliza los huevos. Con el fin de reducir este tipo de competencia, los machos desarrollan comportamientos agonísticos como la vigilancia de la pareja y el rubor. El Hapalochlaena lunulata, o pulpo de anillos azules, se aparea fácilmente tanto con machos como con hembras.
Dimorfismo sexual
En una variedad de organismos marinos, se observa que las hembras son más grandes en comparación con los machos en algunas especies estrechamente relacionadas. En algunos linajes, como el pulpo manta, los machos se vuelven estructuralmente más y más pequeños, asemejándose al término "enanismo" los machos enanos generalmente ocurren en bajas densidades. El pulpo manta macho es un ejemplo de enanismo sexual-evolutivo; las hembras crecen entre 10.000 y 40.000 veces más que los machos y la proporción de sexos entre machos y hembras se puede distinguir justo después de la eclosión de los huevos.
Embriología
Los huevos de cefalópodo abarcan una gran variedad de tamaños, de 1 a 30 mm de diámetro. El óvulo fertilizado inicialmente se divide para producir un disco de células germinales en un polo, y la yema permanece en el polo opuesto. El disco germinal crece para envolver y eventualmente absorber la yema, formando el embrión. Los tentáculos y los brazos aparecen primero en la parte trasera del cuerpo, donde estaría el pie en otros moluscos, y solo después migran hacia la cabeza.
El embudo de los cefalópodos se desarrolla en la parte superior de la cabeza, mientras que la boca se desarrolla en la superficie opuesta. Las primeras etapas embriológicas recuerdan a los gasterópodos ancestrales y Monoplacophora existentes.
Las conchas se desarrollan a partir del ectodermo como un marco orgánico que posteriormente se mineraliza. En Sepia, que tiene una coraza interna, el ectodermo forma una invaginación cuyo poro se obtura antes de que se deposite esta estructura orgánica.
Desarrollo
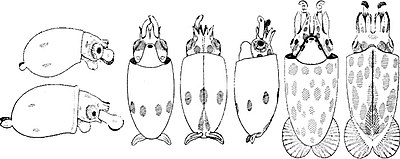
Bien. Una madura Chiroteu este veranyi. Esta especie tiene algunos de los tentáculos más largos en proporción a su tamaño de cualquier cefalopodo conocido.
El período de tiempo antes de la eclosión es muy variable; los huevos más pequeños en aguas más cálidas son los más rápidos en eclosionar, y los recién nacidos pueden emerger después de unos pocos días. Los huevos más grandes en aguas más frías pueden desarrollarse durante más de un año antes de eclosionar.
El proceso desde el desove hasta la eclosión sigue una trayectoria similar en todas las especies, siendo la principal variable la cantidad de yema disponible para las crías y cuándo es absorbida por el embrión.
A diferencia de la mayoría de los otros moluscos, los cefalópodos no tienen una etapa larval morfológicamente distinta. En cambio, los juveniles se conocen como paralarvas. Rápidamente aprenden a cazar, usando encuentros con presas para refinar sus estrategias.
El crecimiento de los juveniles suele ser alométrico, mientras que el crecimiento de los adultos es isométrico.
Evolución
La visión tradicional de la evolución de los cefalópodos sostiene que evolucionaron en el Cámbrico tardío a partir de un ancestro parecido a un monoplacóforo con una concha curva y afilada, que estaba estrechamente relacionado con los gasterópodos (caracoles). La similitud del primitivo cefalópodo sin caparazón Plectronoceras con algunos gasterópodos se usó en apoyo de esta opinión. El desarrollo de un sifón habría permitido que los caparazones de estas formas tempranas se llenaran de gas (por lo tanto, flotaran) para sostenerlos y mantener los caparazones en posición vertical mientras el animal se arrastraba por el suelo y separaba a los verdaderos cefalópodos de los antepasados putativos como como Knightoconus, que carecía de sifón. La flotabilidad neutra o positiva (es decir, la capacidad de flotar) habría llegado más tarde, seguida de la natación en Plectronocerida y, finalmente, la propulsión a chorro en cefalópodos más derivados.
Se han encontrado posibles restos del Cámbrico temprano en la península de Avalon, que coinciden con los datos genéticos para un origen precámbrico.
Sin embargo, algunas pruebas morfológicas son difíciles de conciliar con este punto de vista, y la redescripción de Nectocaris pteryx, que no tenía caparazón y parecía poseer propulsión a chorro a la manera de " derivado" cefalópodos, complicó la cuestión del orden en que se desarrollaron las características de los cefalópodos, siempre que Nectocaris sea un cefalópodo.
Los primeros cefalópodos probablemente eran depredadores en la parte superior de la cadena alimenticia. Después de que la extinción del Cámbrico tardío condujo a la desaparición de muchos anomalocarídidos, los nichos depredadores quedaron disponibles para otros animales. Durante el período Ordovícico, los cefalópodos primitivos experimentaron pulsos de diversificación para volverse diversos y dominantes en los mares Paleozoico y Mesozoico.
En el Paleozoico Temprano, su área de distribución era mucho más restringida que en la actualidad; se limitaron principalmente a las regiones sublitorales de las plataformas poco profundas de las latitudes bajas y, por lo general, se produjeron en asociación con trombolitos. Poco a poco se fue adoptando un hábito más pelágico a medida que avanzaba el Ordovícico. Los cefalópodos de aguas profundas, aunque raros, se han encontrado en el Ordovícico Inferior, pero solo en aguas de latitudes altas. El Ordovícico medio vio los primeros cefalópodos con tabiques lo suficientemente fuertes como para hacer frente a las presiones asociadas con aguas más profundas y podían habitar profundidades superiores a 100-200 m. La dirección del enrollamiento de la concha resultaría crucial para el éxito futuro de los linajes; el enrollamiento endogástrico solo permitiría alcanzar un gran tamaño con una concha recta, mientras que el enrollamiento exogástrico, inicialmente bastante raro, permitió que se desarrollaran las espirales familiares del registro fósil, con su correspondiente gran tamaño y diversidad. (Endogástrico significa que el caparazón está curvado de modo que el lado ventral o inferior sea cóncavo longitudinalmente (vientre hacia adentro); exogástrico significa que el caparazón está curvado de modo que el lado ventral sea convexo longitudinalmente (vientre hacia afuera) lo que permite que el embudo apunte hacia atrás debajo del caparazón.)
Los ancestros de los coleoides (incluidos la mayoría de los cefalópodos modernos) y los ancestros del nautilus moderno se separaron en la era floiana del período ordovícico temprano, hace más de 470 millones de años. Se considera que los Bactritida, un grupo de ortoconos del Silúrico-Triásico, son parafiléticos sin los coleoides y los amonoides, es decir, los últimos grupos surgieron dentro de los Bactritida. Se observa un aumento en la diversidad de los coleoides y amonoides alrededor del comienzo del período Devónico y se corresponde con un profundo aumento en la diversidad de peces. Esto podría representar el origen de los dos grupos derivados.
A diferencia de la mayoría de los cefalópodos modernos, la mayoría de las variedades antiguas tenían caparazones protectores. Estas conchas al principio eran cónicas, pero luego se desarrollaron en formas de nautiloide curvas que se ven en las especies modernas de nautilus. Se cree que la presión competitiva de los peces obligó a las formas con caparazón a sumergirse en aguas más profundas, lo que proporcionó una presión evolutiva hacia la pérdida de caparazón y dio lugar a los coleoides modernos, un cambio que condujo a mayores costos metabólicos asociados con la pérdida de flotabilidad, pero que permitió recolonizar aguas poco profundas. Sin embargo, algunos de los nautiloides de caparazón recto se convirtieron en belemnites, de los cuales algunos evolucionaron en calamares y sepias. La pérdida del caparazón también puede deberse a la presión evolutiva para aumentar la maniobrabilidad, lo que resultó en un hábito más parecido al de los peces.
Ha habido debate sobre el origen embriológico de los apéndices de los cefalópodos. Hasta mediados del siglo XX, el "Arms as Head" hipótesis fue ampliamente reconocida. En esta teoría, los brazos y tentáculos de los cefalópodos se parecen a los apéndices de la cabeza de los gasterópodos, lo que sugiere que podrían ser estructuras homólogas. Los apéndices de los cefalópodos rodean la boca, por lo que lógicamente podrían derivar de los tejidos embrionarios de la cabeza. Sin embargo, la función "Arms as Foot" la hipótesis, propuesta por Adolf Naef en 1928, se ha favorecido cada vez más; por ejemplo, el mapeo del destino de los brotes de las extremidades en el nautilus con cámara indica que los brotes de las extremidades se originan en "foot" tejidos embrionarios.
Genética
La secuenciación de un genoma completo de cefalópodos sigue siendo un desafío para los investigadores debido a la longitud y la repetición de su ADN. Inicialmente se planteó la hipótesis de que las características de los genomas de los cefalópodos eran el resultado de duplicaciones del genoma completo. Después de la secuenciación completa de un pulpo de dos puntos de California, el genoma mostró patrones similares a los de otros invertebrados marinos con adiciones significativas al genoma que se supone que son exclusivos de los cefalópodos. No se encontró evidencia de duplicación completa del genoma.
Dentro del genoma del pulpo de dos puntos de California hay replicaciones sustanciales de dos familias de genes. Significativamente, solo se sabía previamente que las familias de genes expandidos exhibían un comportamiento replicativo dentro de los vertebrados. La primera familia de genes se identificó como las protocadherinas, que se atribuyen al desarrollo de las neuronas. Las protocadherinas funcionan como moléculas de adhesión celular, esenciales para la especificidad sináptica. El mecanismo para la replicación de la familia de genes de protocadherina en vertebrados se atribuye a un empalme complejo, o corte y pegado, desde un locus. Tras la secuenciación del pulpo de dos puntos de California, los investigadores descubrieron que la familia de genes Prorocadherin en los cefalópodos se ha expandido en el genoma debido a la duplicación de genes en tándem. Los diferentes mecanismos de replicación de los genes de protocadherina indican una evolución independiente de la expansión del gen de protocadherina en vertebrados e invertebrados. El análisis de genes individuales de protocadherina de cefalópodo indica una evolución independiente entre especies de cefalópodo. Una especie de calamar de orilla Doryteuthis pealeii con familias de genes de protocadherina expandidas difieren significativamente de las del pulpo de dos manchas de California, lo que sugiere que la expansión de genes no ocurrió antes de la especiación dentro de los cefalópodos. A pesar de los diferentes mecanismos para la expansión de genes, los genes de protocadherina de pulpo de dos puntos eran más similares a los vertebrados que al calamar, lo que sugiere un mecanismo de evolución convergente. La segunda familia de genes conocida como C2H2 son pequeñas proteínas que funcionan como factores de transcripción de zinc. C2H2 son se entiende que modera las funciones del ADN, el ARN y las proteínas dentro de la célula.
El genoma secuenciado del pulpo de dos puntos de California también mostró una presencia significativa de elementos transponibles, así como expresión de transposones. Aunque el papel de los elementos transponibles en los vertebrados marinos aún es relativamente desconocido, se ha observado una expresión significativa de transposones en los tejidos del sistema nervioso. En un estudio realizado en vertebrados, la expresión de transposones durante el desarrollo en la mosca de la fruta Drosophila melanogaster activó la diversidad genómica entre neuronas. Esta diversidad se ha relacionado con una mayor memoria y aprendizaje en los mamíferos. La conexión entre los transposones y el aumento de la capacidad de las neuronas puede proporcionar información sobre la inteligencia, la memoria y la función observadas de los cefalópodos.
Usando la secuenciación de lectura larga, los investigadores han descifrado los genomas de los cefalópodos y han descubierto que se han batido y revuelto. Los genes se compararon con los de miles de otras especies y, aunque los bloques de tres o más genes coincidieron entre el calamar y el pulpo, los bloques de genes no se encontraron juntos en ningún otro animal. Muchas de las agrupaciones se encontraban en el tejido nervioso, lo que sugiere el curso al que adaptaron su inteligencia.
Filogenia
El consenso aproximado de la filogenia de los cefalópodos existentes, según Strugnell et al. 2007, se muestra en el cladograma. Los taxones mineralizados están en negrita. La unión del clado que incluye Sepia y Spirula no está clara; cualquiera de los puntos marcados con un asterisco puede representar la raíz de este clado.
| Cephalopoda |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
La filogenia interna de los cefalópodos es difícil de restringir; Se han adoptado muchas técnicas moleculares, pero los resultados producidos son contradictorios. Nautilus tiende a considerarse un grupo externo, con Vampyroteuthis formando un grupo externo a otros calamares; sin embargo, en un análisis, los nautiloides, pulpos y teútidos se trazan como una politomía. Algunas filogenias moleculares no recuperan los coleoides mineralizados (Spirula, Sepia y Metasepia) como clado; sin embargo, otros sí recuperan este clado de apariencia más parsimoniosa, con Spirula como un grupo hermano de Sepia y Metasepia en un clado que probablemente había divergido antes del final del Triásico.
Las estimaciones moleculares para la divergencia de clados varían. Uno 'estadísticamente robusto' la estimación tiene Nautilus divergiendo de Octopus en hace 415 ± 24 millones de años.
Taxonomía
La clasificación que se presenta aquí, para cefalópodos recientes, sigue en gran parte de la Clasificación actual de cefalópodos recientes (mayo de 2001), para cefalópodos fósiles toma de Arkell et al. 1957, Teichert y Moore 1964, Teichert 1988 y otros. Las tres subclases son tradicionales, correspondientes a los tres órdenes de cefalópodos reconocidos por Bather.
Clase Cephalopoda († indica grupos extintos)
- Subclase Nautiloidea: Cefalopodos ectococleliatos fundamentales que proporcionaron la fuente de la amonoidea y la Coleoidea.
- Orden † Plectronocerida: los cefalopodos ancestrales del período de Cambrian
- Ordenar † Ellesmerocerida ()500 a 470 Ma)
- Ordenar † Endocerida ()485 a 430 Ma)
- Orden † Actinocerida ()480 a 312 Ma)
- Orden † Discosorida ()482 a 392 Ma)
- Ordenar † Pseudorthocerida ()432 a 272 Ma)
- Orden † Tarphycerida ()485 a 386 Ma)
- Orden † Oncocerida ()478,5 a 324 Ma)
- Orden Nautilida (extante; 410.5 Ma to present)
- Orden † Orthocerida ()482.5 a 211,5 Ma)
- Ordenar † Ascocerida ()478 a 412 Ma)
- Orden † Bactritida ()418.1 a 260,5 Ma)
- Subclase † Ammonoidea: Ammonites (Amonita)479 a 66 Ma)
- Ordenar † Goniatitida ()388,5 a 252 Ma)
- Orden † Ceratitida ()254 a 200 Ma)
- Orden † Ammonitida ()215 a 66 Ma)
- Subclase Coleoidea (410.0 Ma-Rec)
- Cohort † Belemnoidea: Belemnites y parientes
- Genus † Jeletzkya
- Ordenar † Aulacocerida ()265 a 183 Ma)
- Orden † Phragmoteuthida ()189.6 a 183 Ma)
- Orden † Hematitida ()339.4 a 318.1 Ma)
- Ordenar † Belemnitida ()339.4 a 66 Ma)
- Genus † Belemnoteu ()189.6 a 183 Ma)
- Cohort Neocoleoidea
- Superorder Decapodiformes (también conocido como Decabrachia o Decembranchiata)
- Orden Spirulida: El calamar de Ram
- Orden Sepiida: cuttlefish
- Orden Sepiolida: pygmy, bobtail y frasco
- Orden Teuthida: squid
- Superorder Octopodiformes (también conocido como Vampyropoda)
- Familia † Trachyteuthididae
- Orden Vampyromorphida: Vampire squid
- Orden Octopoda: pulpo
- Superorden † Palaeoteuthomorpha
- Orden † Boletzkyida
- Superorder Decapodiformes (también conocido como Decabrachia o Decembranchiata)
- Cohort † Belemnoidea: Belemnites y parientes
Otras clasificaciones difieren, principalmente en cómo se relacionan los diversos órdenes de decápodos y si deben ser órdenes o familias.
Clasificación suprafamiliar del Tratado
Esta es la clasificación más antigua que combina las que se encuentran en las partes K y L del Tratado sobre Paleontología de Invertebrados, que forma la base y se mantiene en gran parte por las clasificaciones posteriores.
Nautiloides en general (Teichert y Moore, 1964) secuencia como se indica.
- Subclase † Endoceratoidea. No utilizado por Flower, por ejemplo, Flower y Kummel 1950, interjoceridos incluidos en la Endocerida.
- Ordenar † Endocerida
- Ordenar † Intejocerida
- Subclas † Actinoceratoidea No utilizado por Flower, ibíd.
- Orden † Actinocerida
- Subclase Nautiloidea Nautiloidea en el sentido restringido.
- Ordenar † Ellesmerocerida Plectronocerida posteriormente se dividió como orden independiente.
- Orden † Orthocerida Incluye ortopédicos y pseudorthoceroides
- Ordenar † Ascocerida
- Orden † Oncocerida
- Orden † Discosorida
- Orden † Tarphycerida
- Orden † Barrandeocerida Un grupo polifilético ahora incluido en la Tarphycerida
- Orden Nautilida
- Subclase † Bactritoidea
- Orden † Bactritida
Amonoidea paleozoica (Miller, Furnish y Schindewolf, 1957)
- Suborder † Anarcestina
- Suborder † Clymeniina
- Suborder † Goniatitina
- Suborder † Prolecanitina
Amonoidea mesozoica (Arkel et al., 1957)
- Suborder † Ceratitina
- Suborder † Phylloceratina
- Suborder † Lytoceratina
- Suborder † Ammonitina
Las revisiones posteriores incluyen el establecimiento de tres órdenes del Cámbrico superior, Plectronocerida, Protactinocerida y Yanhecerida; separación de los pseudorthocerids como Pseudorthocerida, y elevación de orthoceratid como Subclase Orthoceratoidea.
Clasificación de Shevyrev
Shevyrev (2005) sugirió una división en ocho subclases, que en su mayoría comprenden las formas fósiles más diversas y numerosas, aunque esta clasificación ha sido criticada como arbitraria, carente de evidencia y basada en interpretaciones erróneas de otros artículos.
Clase Cefalópodos
- Subclass † Ellesmeroceratoidea
- Orden † Plectronocerida ()501 a 490 Ma)
- Ordenar † Protactinocerida
- Orden † Yanhecerida
- Ordenar † Ellesmerocerida ()500 a 470 Ma)
- Subclass † Endoceratoidea ()485 a 430 Ma)
- Ordenar † Endocerida ()485 a 430 Ma)
- Ordenar † Intejocerida ()485 a 480 Ma)
- Subclas † Actinoceratoidea
- Orden † Actinocerida ()480 a 312 Ma)
- Subclase Nautiloidea (490.0 Ma- Rec)
- Ordenar † Basslerocerida ()490 a 480 Ma)
- Orden † Tarphycerida ()485 a 386 Ma)
- Orden † Lituitida ()485 a 480 Ma)
- Orden † Discosorida ()482 a 392 Ma)
- Orden † Oncocerida ()478,5 a 324 Ma)
- Orden Nautilida (410.5 Ma-Rec)
- Subclass † Orthoceratoidea ()482.5 a 211,5 Ma)
- Orden † Orthocerida ()482.5 a 211,5 Ma)
- Ordenar † Ascocerida ()478 a 412 Ma)
- Orden † Dissidocerida ()479 a 457,5 Ma)
- Ordenar † Bajkalocerida
- Subclase † Bactritoidea ()422 a 252 Ma)
- Subclase † Ammonoidea (Amonoidea)410 a 66 Ma)
- Subclase Coleoidea (410.0 Ma-rec)
Clasificación cladística
Otro sistema reciente divide todos los cefalópodos en dos clados. Uno incluye nautilus y la mayoría de los nautiloides fósiles. El otro clado (Neocephalopoda o Angusteradulata) está más cerca de los coleoides modernos e incluye belemnoides, ammonoideos y muchas familias de ortocéridos. También hay cefalópodos del grupo de tallos del Ellesmerocerida tradicional que no pertenecen a ningún clado.
Los coloides, a pesar de algunas dudas, parecen ser monofiléticos según los datos moleculares.
En la cultura
Los antiguos marineros conocían los cefalópodos, como lo demuestran obras de arte como una talla de piedra encontrada en la recuperación arqueológica de la Creta minoica de la Edad del Bronce en Knossos (1900-1100 a. C.) que tiene una representación de un pescador que lleva un pulpo. La terriblemente poderosa Gorgona de la mitología griega puede haberse inspirado en el pulpo o el calamar, el cuerpo del pulpo representa la cabeza cortada de Medusa, el pico como la lengua y los colmillos que sobresalen, y sus tentáculos como las serpientes.
Los kraken son monstruos marinos legendarios de proporciones gigantes que se dice que habitan frente a las costas de Noruega y Groenlandia, generalmente representados en el arte como cefalópodos gigantes que atacan a los barcos. Linneo lo incluyó en la primera edición de su Systema Naturae de 1735. Un mito hawaiano de la creación dice que el cosmos actual es el último de una serie que surgió por etapas a partir de las ruinas del universo anterior. En este relato, el pulpo es el único sobreviviente del universo alienígena anterior. El Akkorokamui es un gigantesco monstruo con tentáculos del folclore ainu.
Una batalla con un pulpo juega un papel importante en el libro de Victor Hugo Travailleurs de la mer (Trabajadores del mar), relacionado con su tiempo en exilio en Guernsey. La colección de cuentos de Ian Fleming de 1966 Octopussy and The Living Daylights y la película de James Bond de 1983 se inspiraron en parte en el libro de Hugo.
El arte erótico japonés, shunga, incluye xilografías de ukiyo-e, como la impresión de 1814 de Katsushika Hokusai Tako to ama (El sueño del pescador').;s Wife), en el que un buzo ama se entrelaza sexualmente con un pulpo grande y uno pequeño. El estampado es un precursor del tentáculo erótico. El biólogo P. Z. Myers señaló en su blog científico, Pharyngula, que los pulpos aparecen en "extraordinarios" ilustraciones gráficas que involucran mujeres, tentáculos y senos desnudos.
Sus muchos brazos que emanan de un centro común significan que el pulpo a veces se usa para simbolizar una organización poderosa y manipuladora.
Contenido relacionado
Cerdo hormiguero
5-metilcitosina
Hipermetamorfosis