Catepsina C
La catepsina C (CTSC), también conocida como dipeptidil peptidasa I (DPP-I), es una proteasa exocisteína lisosomal que pertenece a la familia de proteínas de la peptidasa C1, un subgrupo de las catepsinas de cisteína. En los seres humanos, está codificada por el gen CTSC.
Función
La catepsina C parece ser un coordinador central para la activación de muchas serina proteasas en células inmunes/inflamatorias.
La catepsina C cataliza la escisión de dipéptidos del extremo N de sustratos proteicos y peptídicos, excepto si (i) el grupo amino del extremo N está bloqueado, (ii) el sitio de escisión está a ambos lados de un residuo de prolina, (iii) el residuo del extremo N es lisina o arginina, o (iv) la estructura del péptido o proteína impide una mayor digestión desde el extremo N.
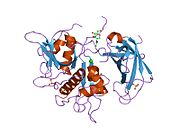
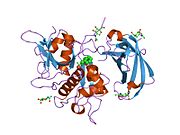
Estructura
Se han clonado y secuenciado los ADNc que codifican catepsinas C de rata, humana, murina, bovina, canina y dos esquistosomas, y se ha demostrado que la enzima está muy conservada. Los ADNc de catepsina C humana y de rata codifican precursores (prepro-catepsina C) que comprenden péptidos señal de 24 residuos, pro-regiones de 205 (catepsina C de rata) o 206 (catepsina C humana) residuos y dominios catalíticos de 233 residuos que contienen los residuos catalíticos y son 30-40% idénticos a las secuencias de aminoácidos maduras de la papaína y de varias otras catepsinas, incluidas las catepsinas B, H, K, L y S.
La prepro-catepsina C traducida se procesa hasta la forma madura mediante al menos cuatro escisiones de la cadena polipeptídica. El péptido señal se elimina durante la translocación o secreción de la proenzima (pro-catepsina C) y un fragmento grande de la prorregión N-terminal (también conocido como dominio de exclusión), que se conserva en la enzima madura, se separa del dominio catalítico mediante la escisión de una parte menor C-terminal de la prorregión, denominada péptido de activación. Una cadena pesada de aproximadamente 164 residuos y una cadena ligera de aproximadamente 69 residuos se generan mediante la escisión del dominio catalítico.
A diferencia de los demás miembros de la familia de la papaína, la catepsina C madura consta de cuatro subunidades, cada una compuesta por el fragmento de prorregión N-terminal, la cadena pesada y la cadena ligera. Tanto el fragmento de prorregión como la cadena pesada están glicosilados.
Significado clínico
Se ha demostrado que los defectos en la proteína codificada son una causa de la enfermedad de Papillon-Lefevre, un trastorno autosómico recesivo caracterizado por queratosis palmoplantar y periodontitis.
La catepsina C funciona como una enzima clave en la activación de las peptidasas de serina granular en las células inflamatorias, como la elastasa y la catepsina G en los neutrófilos y la quimasa y la triptasa en los mastocitos. En muchas enfermedades inflamatorias, como la artritis reumatoide, la enfermedad pulmonar obstructiva crónica (EPOC), la enfermedad inflamatoria intestinal, el asma, la sepsis y la fibrosis quística, una parte importante de la patogenia es causada por el aumento de la actividad de algunas de estas proteasas inflamatorias. Una vez activadas por la catepsina C, las proteasas son capaces de degradar varios componentes de la matriz extracelular, lo que puede provocar daño tisular e inflamación crónica.
Referencias
- ^ a b c GRCh38: Ensembl release 89: ENSG00000109861 – Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00030560 – Ensembl, May 2017
- ^ "Human PubMed Referencia:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Referencia:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Entrez Gene: CTSC cathepsin C".
- ^ Paris A, Strukelj B, Pungercar J, Renko M, Dolenc I, Turk V (Aug 1995). "La clonación molecular y el análisis de secuencias de la preprocathepsin humana C". Cartas FEBS. 369 (2–3): 326–30. doi:10.1016/0014-5793(95)00777-7. PMID 7649281. S2CID 45737414.
- ^ Hola-Jamriska L, Tort JF, Dalton JP, Day SR, Fan J, Aaskov J, Brindley PJ (Ago 1998). "Cathepsin C de Schistosoma japonicum--cDNA encodificando la preproenzima y sus relaciones filogenéticas". European Journal of Biochemistry. 255 (3): 527-34. doi:10.1046/j.1432-1327.1998.2550527.x. PMID 9738890.
- ^ Kominami E, Ishido K, Muno D, Sato N (Jul 1992). "La estructura primaria y distribución de tejidos de la catepsin C". Química Biológica Hoppe-Seyler. 373 (7): 367–73. doi:10.1515/bchm3.1992.373.2.367. PMID 1515062.
- ^ Turk D, Janjić V, Stern I, Podobnik M, Lamba D, Dahl SW, Lauritzen C, Pedersen J, Turk V, Turk B (Dec 2001). "Structure of human dipeptidyl peptidase I (cathepsin C): exclusion domain added to an endopeptidase framework creates the machine for activation of granular serine proteases". El Diario EMBO. 20 (23): 6570–82. doi:10.1093/emboj/20.23.6570. PMC 125750. PMID 11726493.
- ^ Wani AA, Devkar N, Patole MS, Shouche YS (Feb 2006). "Descripción de dos nuevas mutaciones genéticas de la catepsin C en pacientes con síndrome de Papillon-Lefèvre". Journal of Periodontology. 77 (2): 233–7. doi:10.1902/jop.2006.050124. PMID 16460249.
- ^ Meade JL, de Wynter EA, Brett P, Sharif SM, Woods CG, Markham AF, Cook GP (mayo de 2006). "Una familia con síndrome de Papillon-Lefevre revela un requisito para la cathepsin C en la activación de granzyme B y la actividad citolítica de células NK". Sangre. 107 (9): 3665-8. doi:10.1182/blood-2005-03-1140. PMID 16410452.
Más lectura
- McGuire MJ, Lipsky PE, Thiele DL (Jun 1992). "Purificación y caracterización de dipeptidil peptidase I del bazo humano". Archivos de Bioquímica y Biofísica. 295 (2): 280-8. doi:10.1016/0003-9861(92)90519-3. PMID 1586157.
- Paris A, Strukelj B, Pungercar J, Renko M, Dolenc I, Turk V (Aug 1995). "La clonación molecular y el análisis de secuencias de la preprocathepsin humana C". Cartas FEBS. 369 (2–3): 326–30. doi:10.1016/0014-5793(95)00777-7. PMID 7649281. S2CID 45737414.
- Dolenc I, Turk B, Pungercic G, Ritonja A, Turk V (Sep 1995). "La estructura oligomérica y la inhibición inducida del sustrato de la catepsin humana C". El Diario de Química Biológica. 270 (37): 21626–31. doi:10.1074/jbc.270.37.21626. PMID 7665576.
- Maruyama K, Sugano S (Jan 1994). "Oligo-capping: un método simple para reemplazar la estructura de capa de mRNAs eucariotas con oligoribonucleótidos". Gene. 138 (1–2): 171–4. doi:10.1016/0378-1119(94)90802-8. PMID 8125298.
- Rao NV, Rao GV, Hoidal JR (Apr 1997). "Human dipeptidyl-peptidase I. Caracterización genética, localización y expresión". El Diario de Química Biológica. 272 (15): 10260-5. doi:10.1074/jbc.272.15.10260. PMID 9092576.
- Fischer J, Blanchet-Bardon C, Prud'homme JF, Pavek S, Steijlen PM, Dubertret L, Weissenbach J (1997). "Mapping of Papillon-Lefevre symbol to the chromosome 11q14 region". European Journal of Human Genetics. 5 (3): 156–60. doi:10.1159/000484751. Hdl:2066/24363. PMID 92739.
- Suzuki Y, Yoshitomo-Nakagawa K, Maruyama K, Suyama A, Sugano S (Oct 1997). "Construcción y caracterización de una biblioteca de cDNA completamente rica y de 5'''''' enriquecida". Gene. 200 (1–2): 149–56. doi:10.1016/S0378-1119(97)00411-3. PMID 9373149.
- Cigić B, Krizaj I, Kralj B, Turk V, Pain RH (Jan 1998). "Stoichiometry and heterogeneity of the pro-region chain in tetrameric human cathepsin C". Biochimica et Biophysica Acta (BBA) - Estructura de proteínas y enzimología molecular. 1382 (1): 143–50. doi:10.1016/S0167-4838(97)00173-8. PMID 9507095.
- Toomes C, James J, Wood AJ, Wu CL, McCormick D, Lench N, Hewitt C, Moynihan L, Roberts E, Woods CG, Markham A, Wong M, Widmer R, Ghaffar KA, Pemberton M, Hussein IR, Temtamy SA, Davies R, Read AP, Sloan P, Dixon MJDecker 1999 "Las mutaciones perdidas de funcionamiento en el gen de la catepsin C resultan en enfermedad periodontal y ceratosis palmoplantar". Nature Genetics. 23 (4): 421-4. doi:10.1038/70525. PMID 10581027. S2CID 11433166.
- Hart TC, Hart PS, Bowden DW, Michalec MD, Callison SA, Walker SJ, Zhang Y, Firatli E (Dec 1999). "Las mutaciones del gen Cathepsin C son responsables del síndrome de Papillon-Lefèvre". Journal of Medical Genetics. 36 (12): 881–7. doi:10.1136/jmg.36.12.881. 1734286. PMID 10593994.
- Hart TC, Hart PS, Michalec MD, Zhang Y, Firatli E, Van Dyke TE, Stabholz A, Zlotogorski A, Shapira L, Soskolne WA, Zlorogorski A (Feb 2000). "El síndrome de Ham-Munk y el síndrome de Papillon-Lefèvre son mutaciones alelicas en la catepsin C". Journal of Medical Genetics. 37 (2): 88–94. doi:10.1136/jmg.37.2.88. PMC 1734521. PMID 10662807.
- Hart TC, Hart PS, Michalec MD, Zhang Y, Marazita ML, Cooper M, Yassin OM, Nusier M, Walker S (Feb 2000). "Localización de un gen para la periodontitis prepuberal al cromosoma 11q14 e identificación de una mutación del gen catepsin C". Journal of Medical Genetics. 37 (2): 95–101. doi:10.1136/jmg.37.2.95. PMC 1734516. PMID 10662808.
- Suzuki Y, Ishihara D, Sasaki M, Nakagawa H, Hata H, Tsunoda T, Watanabe M, Komatsu T, Ota T, Isogai T, Suyama A, Sugano S (Mar 2000). "Análisis estadístico de la región no traducida de 5' de mRNA humano utilizando bibliotecas de cDNA "Oligo-Capped". Genómica. 64 (3): 286–97. doi:10.1006/geno.2000.6076. PMID 10756096.
- Cigić B, Dahl SW, Pain RH (Oct 2000). "El pro-parte residual de la cathepsin C cumple los criterios requeridos para una chaperona intramolecular en plegar y estabilizar la proenzima humana". Bioquímica. 39 (40): 12382-90. doi:10.1021/bi0008837. PMID 11015218.
- Hartley JL, Temple GF, Brasch MA (Nov 2000). "DNA clonando usando recombinación específica de sitio in vitro". Genome Research. 10 (11): 1788–95. doi:10.1101/gr.143000. PMC 310948. PMID 11076863.
- Hart PS, Zhang Y, Firatli E, Uygur C, Lotfazar M, Michalec MD, Marks JJ, Lu X, Coates BJ, Seow WK, Marshall R, Williams D, Reed JB, Wright JT, Hart TC (Dec 2000). "Identificación de mutaciones de catepina C en pacientes con síndrome de papillón-Lefèvre étnicamente diversos". Journal of Medical Genetics. 37 (12): 927–32. doi:10.1136/jmg.37.12.927. PMC 1734492. PMID 11106356.
- Zhang Y, Lundgren T, Renvert S, Tatakis DN, Firatli E, Uygur C, Hart PS, Gorry MC, Marks JJ, Hart TC (Feb 2001). "Evidencia de un efecto fundador para cuatro mutaciones de genes de la catepsin C en pacientes con síndrome de Papillon-Lefèvre". Journal of Medical Genetics. 38 (2): 96–101. doi:10.1136/jmg.38.2.96. PMC 1734811. PMID 11158173.
- Nakano A, Nomura K, Nakano H, Ono Y, LaForgia S, Pulkkinen L, Hashimoto I, Uitto J (Feb 2001). "Síndrome de Papillon-Lefèvre: mutaciones y polimorfismos en el gen C de la catepsin". The Journal of Investigative Dermatology. 116 (2): 339-43. doi:10.1046/j.1523-1747.2001.01244.x. PMID 11180012.
- Allende LM, García-Pérez MA, Moreno A, Corell A, Carasol M, Martínez-Canut P, Arnaiz-Villena A (Feb 2001). "Cathepsin C gene: paciente heterocigous primer compuesto con síndrome de Papillon-Lefèvre y una mutación sin síntomas novedosa". Mutación humana. 17 (2): 152–3. doi:10.1002/1098-1004(200102)17:2 obtenidos152::AID-HUMU10 confianza3.0.CO;2-#. PMID 11180601. S2CID 196603893.
- Wiemann S, Weil B, Wellenreuther R, Gassenhuber J, Glassl S, Ansorge W, Böcher M, Blöcker H, Bauersachs S, Blum H, Lauber J, Düsterhöft A, Beyer A, Köhrer K, Strack N, Mewes HW, Ottenwälder B, Obermaier Bub "Hacia un catálogo de genes y proteínas humanos: secuenciación y análisis de 500 nuevas proteínas completas codificación de cDNAs humanos". Genome Research. 11 (3): 422–35. doi:10.1101/gr.GR1547R. PMC 311072. PMID 11230166.
Enlaces externos
- La base de datos en línea MEROPS para peptidases y sus inhibidores: C01.070
- Cathepsin+ C en la Biblioteca Nacional de Medicina de EE.UU.