Catálisis

La catálisis es el proceso de aumentar la velocidad de una reacción química mediante la adición de una sustancia conocida como catalizador. Los catalizadores no se consumen en la reacción y permanecen sin cambios después de ella. Si la reacción es rápida y el catalizador se recicla rápidamente, a menudo son suficientes cantidades muy pequeñas de catalizador;la mezcla, el área superficial y la temperatura son factores importantes en la velocidad de reacción. Los catalizadores generalmente reaccionan con uno o más reactivos para formar productos intermedios que posteriormente dan el producto de reacción final, en el proceso de regeneración del catalizador.
La catálisis se puede clasificar como homogénea, cuyos componentes se encuentran dispersos en la misma fase (generalmente gaseosa o líquida) que el reactivo, o heterogénea, cuyos componentes no se encuentran en la misma fase. Las enzimas y otros biocatalizadores a menudo se consideran una tercera categoría.
La catálisis es omnipresente en la industria química de todo tipo. Se estima que el 90% de todos los productos químicos producidos comercialmente involucran catalizadores en alguna etapa del proceso de fabricación.
El término "catalizador" se deriva del griego καταλύειν, katalúō, que significa "aflojar" o "desatar". El concepto de catálisis fue inventado por la química Elizabeth Fulhame, basándose en su novedoso trabajo en experimentos de oxidación-reducción.
Principios generales
Ilustración
Ilustrativa es la desproporción del peróxido de hidrógeno al agua y al oxígeno:2 H 2 O 2 → 2 H 2 O + O 2
Esta reacción procede porque los productos de reacción son más estables que el material de partida. La reacción no catalizada es lenta. De hecho, la descomposición del peróxido de hidrógeno es tan lenta que las soluciones de peróxido de hidrógeno están disponibles comercialmente. Esta reacción se ve fuertemente afectada por catalizadores como el dióxido de manganeso o la enzima peroxidasa en los organismos. Tras la adición de una pequeña cantidad de dióxido de manganeso, el peróxido de hidrógeno reacciona rápidamente. Este efecto se ve fácilmente por la efervescencia del oxígeno. El dióxido de manganeso no se consume en la reacción y, por lo tanto, puede recuperarse sin cambios y reutilizarse indefinidamente. En consecuencia, el dióxido de manganeso cataliza esta reacción.
Unidades
La unidad derivada del SI para medir la actividad catalítica de un catalizador es el katal, que se cuantifica en moles por segundo. La productividad de un catalizador se puede describir por el número de rotación (o TON) y la actividad catalítica por la frecuencia de rotación (TOF), que es la TON por unidad de tiempo. El equivalente bioquímico es la unidad enzimática. Para obtener más información sobre la eficiencia de la catálisis enzimática, consulte el artículo sobre enzimas.
Mecanismos de reacción catalítica
En general, las reacciones químicas ocurren más rápido en presencia de un catalizador porque el catalizador proporciona una vía de reacción alternativa, o mecanismo, con una energía de activación más baja que el mecanismo no catalizado. En los mecanismos catalizados, el catalizador suele reaccionar para formar un intermediario, que luego regenera el catalizador original en el proceso.
Como ejemplo sencillo en fase gas, la reacción 2 SO 2 + O 2 → 2 SO 3 se puede catalizar añadiendo óxido nítrico. La reacción ocurre en dos pasos:2 NO + O 2 → 2 NO 2 (determinación de la tasa)NO 2 + SO 2 → NO + SO 3 (rápido)
El catalizador de NO se regenera. La tasa global es la tasa del paso lento.v = 2k 1 [NO] [O 2 ].
Como ejemplo de un mecanismo para la catálisis heterogénea se puede ilustrar mediante la combinación de oxígeno e hidrógeno en la superficie del dióxido de titanio (TiO 2, o titania) para producir agua. La microscopía de efecto túnel mostró que las moléculas experimentan adsorción y disociación. Los átomos de O y H disociados unidos a la superficie se difunden juntos. Los estados de reacción intermedios son: HO 2, H 2 O 2, luego H 3 O 2 y el producto de reacción (dímeros de moléculas de agua), después de lo cual la molécula de agua se desorbe de la superficie del catalizador.
Energética de reacción
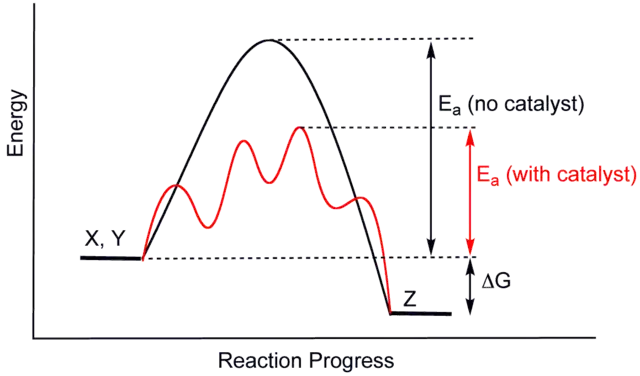
Los catalizadores permiten vías que difieren de las reacciones no catalizadas. Estas vías tienen menor energía de activación. En consecuencia, más colisiones moleculares tienen la energía necesaria para alcanzar el estado de transición. Por lo tanto, los catalizadores pueden permitir reacciones que de otro modo serían bloqueadas o ralentizadas por una barrera cinética. El catalizador puede aumentar la velocidad de reacción o la selectividad, o permitir la reacción a temperaturas más bajas. Este efecto se puede ilustrar con un diagrama de perfil de energía.
En la reacción elemental catalizada, los catalizadores no cambian la extensión de una reacción: no tienen efecto sobre el equilibrio químico de una reacción. La relación entre las velocidades de reacción directa e inversa no se ve afectada (ver también termodinámica). La segunda ley de la termodinámica describe por qué un catalizador no cambia el equilibrio químico de una reacción. Supongamos que hubiera tal catalizador que cambiara el equilibrio. Introducir el catalizador en el sistema daría como resultado una reacción para pasar al nuevo equilibrio, produciendo energía. La producción de energía es un resultado necesario ya que las reacciones son espontáneas solo si se produce energía libre de Gibbs, y si no hay barrera de energía, no hay necesidad de un catalizador. Luego, eliminar el catalizador también daría como resultado una reacción, produciendo energía; es decir, la adición y su proceso inverso, la eliminación, producirían energía. Así, un catalizador que podría cambiar el equilibrio sería una máquina de movimiento perpetuo, una contradicción a las leyes de la termodinámica. Por lo tanto, el catalizador noalterar la constante de equilibrio. (Sin embargo, un catalizador puede cambiar las concentraciones de equilibrio al reaccionar en un paso posterior. Luego se consume a medida que avanza la reacción y, por lo tanto, también es un reactivo. Es ilustrativa la hidrólisis de ésteres catalizada por base, donde el ácido carboxílico producido reacciona inmediatamente con el catalizador base y, por lo tanto, el equilibrio de la reacción se desplaza hacia la hidrólisis).
El catalizador estabiliza el estado de transición más de lo que estabiliza el material de partida. Disminuye la barrera cinética al disminuir la diferencia de energía entre el material de partida y el estado de transición. No cambia la diferencia de energía entre los materiales de partida y los productos (barrera termodinámica), ni la energía disponible (la proporciona el medio ambiente en forma de calor o luz).
Conceptos relacionados
Algunos de los llamados catalizadores son en realidad precatalizadores. Los precatalizadores se convierten en catalizadores en la reacción. Por ejemplo, el catalizador de Wilkinson RhCl(PPh 3) 3 pierde un ligando de trifenilfosfina antes de entrar en el verdadero ciclo catalítico. Los precatalizadores son más fáciles de almacenar pero se activan fácilmente in situ. Debido a este paso de preactivación, muchas reacciones catalíticas involucran un período de inducción.
En la catálisis cooperativa, las especies químicas que mejoran la actividad catalítica se denominan cocatalizadores o promotores.
En la catálisis en tándem, se acoplan dos o más catalizadores diferentes en una reacción de un solo recipiente.
En la autocatálisis, el catalizador es un producto de la reacción global, a diferencia de todos los demás tipos de catálisis considerados en este artículo. El ejemplo más simple de autocatálisis es una reacción de tipo A + B → 2 B, en uno o en varios pasos. La reacción general es solo A → B, por lo que B es un producto. Pero como B también es un reactivo, puede estar presente en la ecuación de velocidad y afectar la velocidad de reacción. A medida que avanza la reacción, la concentración de B aumenta y puede acelerar la reacción como catalizador. En efecto, la reacción se acelera o se autocataliza. Un ejemplo es la hidrólisis de un éster como la aspirina a un ácido carboxílico y un alcohol. En ausencia de catalizadores ácidos añadidos, el producto de ácido carboxílico cataliza la hidrólisis.
Un verdadero catalizador puede trabajar en conjunto con un catalizador de sacrificio. El verdadero catalizador se consume en la reacción elemental y se convierte en una forma desactivada. El catalizador de sacrificio regenera el verdadero catalizador para otro ciclo. El catalizador de sacrificio se consume en la reacción y, como tal, no es realmente un catalizador, sino un reactivo. Por ejemplo, el tetróxido de osmio (OsO 4) es un buen reactivo para la dihidroxilación, pero es altamente tóxico y costoso. En la dihidroxilación de Upjohn, el catalizador de sacrificio N-óxido de N-metilmorfolina (NMMO) regenera OsO 4 y solo se necesitan cantidades catalíticas de OsO 4.
Clasificación
La catálisis se puede clasificar como homogénea o heterogénea. Una catálisis homogénea es aquella cuyos componentes se encuentran dispersos en la misma fase (generalmente gaseosa o líquida) que las moléculas del reactivo. Una catálisis heterogénea es aquella en la que los componentes de la reacción no están en la misma fase. Las enzimas y otros biocatalizadores a menudo se consideran una tercera categoría. Se aplican principios mecánicos similares a heterogéneos, homogéneos y biocatálisis.
Catálisis heterogénea
Los catalizadores heterogéneos actúan en una fase diferente a la de los reactivos. La mayoría de los catalizadores heterogéneos son sólidos que actúan sobre sustratos en una mezcla de reacción líquida o gaseosa. Los catalizadores heterogéneos importantes incluyen zeolitas, alúmina, óxidos de orden superior, carbono grafítico, óxidos de metales de transición, metales como el níquel Raney para hidrogenación y óxido de vanadio (V) para la oxidación de dióxido de azufre en trióxido de azufre mediante el llamado proceso de contacto.
Se conocen diversos mecanismos de reacción sobre superficies, dependiendo de cómo se produzca la adsorción (Langmuir-Hinshelwood, Eley-Rideal y Mars-van Krevelen). El área superficial total del sólido tiene un efecto importante en la velocidad de reacción. Cuanto menor sea el tamaño de partícula del catalizador, mayor será el área superficial para una masa dada de partículas.
Un catalizador heterogéneo tiene sitios activos, que son los átomos o caras del cristal donde realmente ocurre la reacción. Según el mecanismo, el sitio activo puede ser una superficie plana de metal expuesta, un borde de cristal con una valencia de metal imperfecta o una combinación complicada de los dos. Por lo tanto, no solo la mayor parte del volumen sino también la mayor parte de la superficie de un catalizador heterogéneo puede ser catalíticamente inactiva. Descubrir la naturaleza del sitio activo requiere una investigación técnicamente desafiante. Por lo tanto, continúa la investigación empírica para encontrar nuevas combinaciones de metales para la catálisis.
Por ejemplo, en el proceso de Haber, el hierro finamente dividido sirve como catalizador para la síntesis de amoníaco a partir de nitrógeno e hidrógeno. Los gases reaccionantes se adsorben en los sitios activos de las partículas de hierro. Una vez adsorbidos físicamente, los reactivos experimentan quimisorción que da como resultado la disociación en especies atómicas adsorbidas, y se forman nuevos enlaces entre los fragmentos resultantes en parte debido a su proximidad. De esta forma se rompe el triple enlace particularmente fuerte del nitrógeno, lo que sería extremadamente raro en la fase gaseosa debido a su alta energía de activación. Por lo tanto, la energía de activación de la reacción general disminuye y la velocidad de reacción aumenta. Otro lugar donde se aplica un catalizador heterogéneo es en la oxidación de dióxido de azufre sobre óxido de vanadio (V) para la producción de ácido sulfúrico.
Los catalizadores heterogéneos suelen estar "soportados", lo que significa que el catalizador se dispersa en un segundo material que mejora la eficacia o minimiza su costo. Los soportes evitan o minimizan la aglomeración y la sinterización de pequeñas partículas de catalizador, exponiendo más área superficial, por lo que los catalizadores tienen una actividad específica más alta (por gramo) sobre un soporte. A veces, el soporte es simplemente una superficie sobre la que se extiende el catalizador para aumentar el área superficial. Más a menudo, el soporte y el catalizador interactúan, afectando la reacción catalítica. Los soportes también se pueden usar en la síntesis de nanopartículas al proporcionar sitios para que las moléculas individuales del catalizador se unan químicamente. Los soportes son materiales porosos con un área superficial alta, más comúnmente alúmina, zeolitas o varios tipos de carbón activado. Los soportes especializados incluyen dióxido de silicio,
En las reacciones en suspensión, los catalizadores heterogéneos pueden perderse al disolverse.
Muchos catalizadores heterogéneos son, de hecho, nanomateriales. Los catalizadores basados en nanomateriales con actividades que imitan a las enzimas se denominan colectivamente nanozimas.
Electrocatalizadores
En el contexto de la electroquímica, específicamente en la ingeniería de celdas de combustible, se utilizan varios catalizadores que contienen metales para mejorar las velocidades de las semirreacciones que componen la celda de combustible. Un tipo común de electrocatalizador de celdas de combustible se basa en nanopartículas de platino que se apoyan en partículas de carbono ligeramente más grandes. Cuando entra en contacto con uno de los electrodos de una celda de combustible, este platino aumenta la tasa de reducción de oxígeno a agua, hidróxido o peróxido de hidrógeno.
Catálisis homogénea
Los catalizadores homogéneos funcionan en la misma fase que los reactivos. Normalmente, los catalizadores homogéneos se disuelven en un disolvente con los sustratos. Un ejemplo de catálisis homogénea implica la influencia del H en la esterificación de ácidos carboxílicos, como la formación de acetato de metilo a partir de ácido acético y metanol. Los procesos de alto volumen que requieren un catalizador homogéneo incluyen hidroformilación, hidrosililación e hidrocianación. Para los químicos inorgánicos, la catálisis homogénea suele ser sinónimo de catalizadores organometálicos. Sin embargo, muchos catalizadores homogéneos no son organometálicos, como lo ilustra el uso de sales de cobalto que catalizan la oxidación de p-xileno a ácido tereftálico.
Organocatálisis
Mientras que los metales de transición a veces atraen la mayor parte de la atención en el estudio de la catálisis, las moléculas orgánicas pequeñas sin metales también pueden exhibir propiedades catalíticas, como se desprende del hecho de que muchas enzimas carecen de metales de transición. Por lo general, los catalizadores orgánicos requieren una mayor carga (cantidad de catalizador por unidad de cantidad de reactivo, expresada en % molar de sustancia) que los catalizadores basados en metales de transición (iones), pero estos catalizadores generalmente están disponibles comercialmente a granel, lo que ayuda a reducir costos A principios de la década de 2000, estos organocatalizadores se consideraban de "nueva generación" y son competitivos frente a los catalizadores tradicionales que contienen metales (iones). Se supone que los organocatalizadores funcionan de forma similar a las enzimas libres de metales utilizando, por ejemplo, interacciones no covalentes tales como enlaces de hidrógeno. La disciplina organocatálisis se divide en la aplicación de organocatalizadores covalentes (p. ej., prolina, DMAP) y no covalentes (p. ej., organocatálisis de tiourea) que se refieren a la unión e interacción catalizador-sustrato preferidas, respectivamente. El Premio Nobel de Química 2021 fue otorgado conjuntamente a Benjamin List y David WC MacMillan "por el desarrollo de la organocatálisis asimétrica".
Fotocatalizadores
La fotocatálisis es el fenómeno en el que el catalizador puede recibir luz para generar un estado excitado que efectúa reacciones redox. El oxígeno singlete generalmente se produce por fotocatálisis. Los fotocatalizadores son componentes de células solares sensibilizadas por colorante.
Enzimas y biocatalizadores
En biología, las enzimas son catalizadores basados en proteínas en el metabolismo y el catabolismo. La mayoría de los biocatalizadores son enzimas, pero otras clases de biomoléculas no basadas en proteínas también exhiben propiedades catalíticas, incluidas las ribozimas y las desoxirribozimas sintéticas.
Los biocatalizadores pueden considerarse intermedios entre los catalizadores homogéneos y heterogéneos, aunque estrictamente hablando, las enzimas solubles son catalizadores homogéneos y las enzimas unidas a la membrana son heterogéneas. Varios factores afectan la actividad de las enzimas (y otros catalizadores), incluidos la temperatura, el pH, la concentración de la enzima, el sustrato y los productos. Un reactivo particularmente importante en las reacciones enzimáticas es el agua, que es el producto de muchas reacciones de formación de enlaces y un reactivo en muchos procesos de ruptura de enlaces.
En la biocatálisis, las enzimas se emplean para preparar muchos productos químicos básicos, incluidos el jarabe de maíz con alto contenido de fructosa y la acrilamida.
Algunos anticuerpos monoclonales cuyo objetivo de unión es una molécula estable que se asemeja al estado de transición de una reacción química pueden funcionar como catalizadores débiles para esa reacción química al reducir su energía de activación. Dichos anticuerpos catalíticos a veces se denominan "abzimas".
Significado
Se estima que el 90% de todos los productos químicos producidos comercialmente involucran catalizadores en alguna etapa del proceso de fabricación. En 2005, los procesos catalíticos generaron alrededor de $900 mil millones en productos en todo el mundo. La demanda mundial de catalizadores en 2014 se estimó en 33 500 millones de USD. La catálisis es tan generalizada que las subáreas no se clasifican fácilmente. A continuación se analizan algunas áreas de especial concentración.
Procesamiento de energía
La refinación de petróleo hace un uso intensivo de la catálisis para la alquilación, el craqueo catalítico (romper los hidrocarburos de cadena larga en pedazos más pequeños), el reformado de nafta y el reformado con vapor (conversión de hidrocarburos en gas de síntesis). Incluso los gases de escape de la quema de combustibles fósiles se tratan mediante catálisis: los convertidores catalíticos, generalmente compuestos de platino y rodio, descomponen algunos de los subproductos más dañinos de los gases de escape de los automóviles.2 CO + 2 NO → 2 CO 2 + N 2
Con respecto a los combustibles sintéticos, un proceso antiguo pero aún importante es la síntesis Fischer-Tropsch de hidrocarburos a partir de gas de síntesis, que a su vez se procesa a través de reacciones de cambio de agua-gas, catalizadas por hierro. El biodiesel y los biocombustibles relacionados requieren procesamiento a través de biocatalizadores e inorgánicos.
Las pilas de combustible dependen de catalizadores para las reacciones tanto anódicas como catódicas.
Los calentadores catalíticos generan calor sin llama a partir de un suministro de combustible combustible.
Productos químicos a granel
Algunos de los productos químicos a mayor escala se producen mediante oxidación catalítica, a menudo utilizando oxígeno. Los ejemplos incluyen ácido nítrico (de amoníaco), ácido sulfúrico (de dióxido de azufre a trióxido de azufre por el proceso de contacto), ácido tereftálico de p-xileno, ácido acrílico de propileno o propano y acrilonitrilo de propano y amoníaco.
La producción de amoníaco es uno de los procesos a mayor escala y de mayor consumo energético. En el proceso de Haber, el nitrógeno se combina con hidrógeno sobre un catalizador de óxido de hierro. El metanol se prepara a partir de monóxido de carbono o dióxido de carbono pero utilizando catalizadores de cobre-zinc.
Los polímeros a granel derivados de etileno y propileno a menudo se preparan mediante catálisis Ziegler-Natta. Los poliésteres, las poliamidas y los isocianatos se obtienen mediante catálisis ácido-base.
La mayoría de los procesos de carbonilación requieren catalizadores metálicos, los ejemplos incluyen el proceso de ácido acético de Monsanto y la hidroformilación.
Productos químicos finos
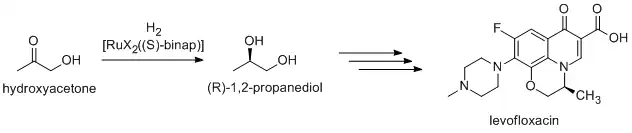
Muchos productos químicos finos se preparan mediante catálisis; los métodos incluyen los de la industria pesada, así como procesos más especializados que serían prohibitivamente caros a gran escala. Los ejemplos incluyen la reacción de Heck y las reacciones de Friedel-Crafts. Debido a que la mayoría de los compuestos bioactivos son quirales, muchos productos farmacéuticos se producen mediante catálisis enantioselectiva (síntesis asimétrica catalítica). El (R)-1,2-propandiol, precursor del antibacteriano levofloxacino, se puede sintetizar de manera eficiente a partir de hidroxiacetona mediante la hidrogenación asimétrica de Noyori:
Procesamiento de alimentos
Una de las aplicaciones más obvias de la catálisis es la hidrogenación (reacción con gas hidrógeno) de grasas usando un catalizador de níquel para producir margarina. Muchos otros productos alimenticios se preparan mediante biocatálisis (ver más abajo).
Medioambiente
La catálisis afecta al medio ambiente al aumentar la eficiencia de los procesos industriales, pero la catálisis también juega un papel directo en el medio ambiente. Un ejemplo notable es el papel catalítico de los radicales libres de cloro en la descomposición del ozono. Estos radicales se forman por la acción de la radiación ultravioleta sobre los clorofluorocarbonos (CFC).Cl + O 3 → Cl O + O 2ClO + O → Cl + O 2
Historia
En términos generales, cualquier cosa que aumente la velocidad de un proceso es un "catalizador", un término derivado del griego καταλύειν, que significa "anular", "desatar" o "recoger". El concepto de catálisis fue inventado por la química Elizabeth Fulhame y descrito en un libro de 1794, basado en su novedoso trabajo en experimentos de oxidación-reducción. La primera reacción química en química orgánica que utilizó un catalizador fue estudiada en 1811 por Gottlieb Kirchhoff, quien descubrió la conversión catalizada por ácido del almidón en glucosa. El término catálisis fue utilizado más tarde por Jöns Jakob Berzelius en 1835 para describir reacciones aceleradas por sustancias que permanecen sin cambios después de la reacción. Fulhame, anterior a Berzelius,Otros químicos del siglo XVIII que trabajaron en catálisis fueron Eilhard Mitscherlich, quien se refirió a ella como procesos de contacto, y Johann Wolfgang Döbereiner, quien habló de acción de contacto. Desarrolló la lámpara de Döbereiner, un encendedor a base de hidrógeno y una esponja de platino, que se convirtió en un éxito comercial en la década de 1820 que perdura en la actualidad. Humphry Davy descubrió el uso del platino en catálisis. En la década de 1880, Wilhelm Ostwald, de la Universidad de Leipzig, inició una investigación sistemática de las reacciones catalizadas por la presencia de ácidos y bases, y descubrió que las reacciones químicas ocurren a velocidades finitas y que estas velocidades se pueden usar para determinar la fuerza de los ácidos y las bases.. Por este trabajo, Ostwald recibió el Premio Nobel de Química de 1909.Vladimir Ipatieff realizó algunas de las primeras reacciones a escala industrial, incluido el descubrimiento y la comercialización de la oligomerización y el desarrollo de catalizadores para la hidrogenación.
Inhibidores, venenos y promotores
Una sustancia añadida que reduce la velocidad se denomina inhibidor de la reacción si es reversible y envenena al catalizador si es irreversible. Los promotores son sustancias que aumentan la actividad catalítica, aunque no son catalizadores por sí mismos.
Los inhibidores a veces se denominan "catalizadores negativos" ya que reducen la velocidad de reacción. Sin embargo, se prefiere el término inhibidor ya que no funcionan introduciendo una vía de reacción con mayor energía de activación; esto no reduciría la velocidad ya que la reacción continuaría ocurriendo por el camino no catalizado. En su lugar, actúan ya sea desactivando los catalizadores o eliminando los intermediarios de la reacción, como los radicales libres. En la catálisis heterogénea, la coquización inhibe el catalizador, que queda cubierto por productos secundarios poliméricos.
El inhibidor puede modificar la selectividad además de la velocidad. Por ejemplo, en la hidrogenación de alquinos a alquenos, puede usarse un catalizador de paladio (Pd) parcialmente "envenenado" con acetato de plomo (II) (Pb(CH 3 CO 2) 2). Sin la desactivación del catalizador, el alqueno producido se hidrogenaría más a alcano.
El inhibidor puede producir este efecto, por ejemplo, envenenando selectivamente solo ciertos tipos de sitios activos. Otro mecanismo es la modificación de la geometría de la superficie. Por ejemplo, en las operaciones de hidrogenación, los grandes planos de la superficie del metal funcionan como sitios de catálisis de hidrogenólisis, mientras que los sitios que catalizan la hidrogenación de insaturados son más pequeños. Por lo tanto, un veneno que cubre la superficie al azar tenderá a reducir el número de grandes planos no contaminados, pero dejará libres proporcionalmente más sitios más pequeños, cambiando así la selectividad de hidrogenación frente a hidrogenólisis. Muchos otros mecanismos también son posibles.
Los promotores pueden cubrir la superficie para evitar la producción de una capa de coque, o incluso eliminar activamente dicho material (p. ej., renio sobre platino en la formación de plataformas). Pueden ayudar a la dispersión del material catalítico o unirse a los reactivos.
Contenido relacionado
Síntesis total
Difusión
Amina