Carcinoma ductal in situ

El carcinoma ductal in situ (CDIS), también conocido como carcinoma intraductal, es una lesión precancerosa o cancerosa no invasiva de la mama. El CDIS se clasifica en estadio 0. Rara vez produce síntomas o un bulto en la mama que se pueda palpar, y normalmente se detecta mediante una mamografía de detección. Se ha diagnosticado en un porcentaje significativo de hombres (consulte cáncer de mama masculino).
En el DCIS, se encuentran células anormales en el revestimiento de uno o más conductos mamarios de la mama. In situ significa "en su lugar" y se refiere al hecho de que las células anormales no se han movido fuera del conducto mamario ni hacia ninguno de los tejidos circundantes de la mama ("precanceroso" indica que aún no se ha convertido en un cáncer invasivo). En algunos casos, el DCIS puede volverse invasivo y propagarse a otros tejidos, pero no hay forma de determinar qué lesiones permanecerán estables sin tratamiento y cuáles se volverán invasivas. El DCIS abarca un amplio espectro de enfermedades que van desde lesiones de bajo grado que no ponen en peligro la vida hasta lesiones de alto grado (es decir, potencialmente muy agresivas).
El DCIS se ha clasificado según el patrón arquitectónico de las células (sólido, cribiforme, papilar y micropapilar), el grado del tumor (alto, intermedio y bajo) o la presencia o ausencia de histología de comedones; o, en el caso del carcinoma in situ de células apocrinas, el carcinoma ductal apocrino in situ, se puede clasificar según el tipo de célula que forma la lesión. El DCIS se puede detectar en mamografías examinando pequeñas partículas de calcio conocidas como microcalcificaciones. Dado que pueden aparecer grupos sospechosos de microcalcificaciones incluso en ausencia de DCIS, puede ser necesaria una biopsia para el diagnóstico.
Entre el 20 y el 30 % de las personas que no reciben tratamiento desarrollan cáncer de mama. El DCIS es el tipo de precáncer más común en las mujeres. Existe cierto desacuerdo sobre su condición de cáncer; algunos organismos incluyen el DCIS al calcular las estadísticas de cáncer de mama, mientras que otros no lo hacen.
Terminología
El carcinoma ductal in situ (CDIS) significa literalmente grupos de células epiteliales "cancerosas" que permanecen en su ubicación normal (in situ) dentro de los conductos y lobulillos de la glándula mamaria. Clínicamente, el CDIS se considera una afección premaligna (es decir, potencialmente maligna), porque las células biológicamente anormales aún no han cruzado la membrana basal para invadir el tejido circundante. Cuando hay múltiples lesiones (conocidas como "focos" de CDIS) en diferentes cuadrantes de la mama, se habla de enfermedad "multicéntrica".
Para fines estadísticos, el DCIS a veces se considera un "cáncer", pero no siempre es así. Cuando se clasifica como cáncer, se lo denomina una forma "no invasiva" o "preinvasiva". El Instituto Nacional del Cáncer lo describe como una "afección no invasiva".
Signos y síntomas
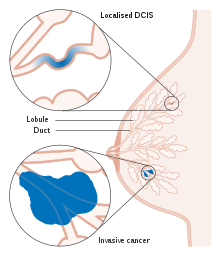

La mayoría de las mujeres que desarrollan DCIS no experimentan ningún síntoma. La mayoría de los casos (80-85%) se detectan mediante una mamografía de detección. Los primeros signos y síntomas pueden aparecer si el cáncer avanza. Debido a la falta de síntomas tempranos, el DCIS se detecta con mayor frecuencia mediante una mamografía de detección.
En algunos casos, el DCIS puede causar:
- Un bulto o engrosamiento en o cerca del pecho o bajo el brazo
- Un cambio en el tamaño o la forma de la mama
- Secreción de pezón o ternura de pezón; el pezón también puede ser invertido, o tirado de nuevo en el pecho
- Ridges or pitting of the breast; the skin may look like the skin of an orange
- Un cambio en la forma en que la piel de la mama, la areola o el pezón se ve o se siente como calor, hinchazón, enrojecimiento o estafabilidad.
Causas
Las causas específicas del DCIS aún se desconocen. Los factores de riesgo para desarrollar esta afección son similares a los del cáncer de mama invasivo.
Sin embargo, algunas mujeres son más propensas que otras a desarrollar DCIS. Se considera que tienen mayor riesgo aquellas que tienen antecedentes familiares de cáncer de mama, aquellas que han tenido la menstruación a una edad temprana o que han tenido una menopausia tardía. Además, las mujeres que nunca han tenido hijos o los han tenido en una etapa avanzada de la vida también tienen más probabilidades de padecer esta afección.
El uso prolongado de terapia de reemplazo hormonal (TRH) con estrógeno y progestina durante más de cinco años después de la menopausia, las mutaciones genéticas (genes BRCA1 o BRCA2), la hiperplasia atípica, así como la exposición a la radiación o a ciertas sustancias químicas, también pueden contribuir al desarrollo de la enfermedad. No obstante, el riesgo de desarrollar cáncer no invasivo aumenta con la edad y es mayor en mujeres mayores de 45 años.
Diagnosis
El 80% de los casos en los Estados Unidos se detectan mediante mamografías de detección. El diagnóstico más definitivo se realiza mediante una biopsia de mama para histopatología.
- Microcalcificaciones de mamografía en carcinoma ductal in situ
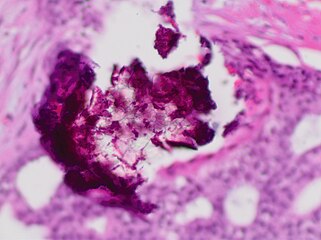
- Histopatología de microcalcificaciones distróficas en la mancha DCIS, H plagaE.
- Patrones arquitectónicos histopatológicos del DCIS.
- Histopatología del DCIS de alto grado.
RBC = glóbulos rojos. - DCIS con microinvasión, definido como foco de cáncer invasivo que mide hasta 1,0 mm de tamaño.
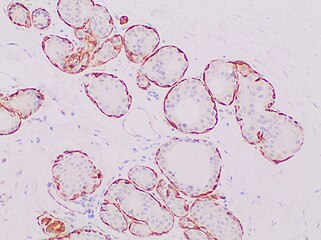
- Inmunohistoquímica para la calponina en carcinoma ductal in situ, destacando las células mioepiteliales alrededor de todas las células tumorales, descartando así el carcinoma ductal invasivo.
- Carcinoma ductal in situ con necrosis comedo que abarca el 30% de su diámetro, que generalmente se considera el tamaño mínimo para clasificarlo como comedo.
Tratamiento
Existen diferentes opiniones sobre el mejor tratamiento para el DCIS. El Instituto Nacional del Cáncer recomienda la extirpación quirúrgica, con o sin radioterapia adicional o tamoxifeno. La cirugía puede ser una lumpectomía para conservar la mama o una mastectomía (extirpación total o parcial de la mama afectada). Si se utiliza una lumpectomía, a menudo se combina con radioterapia. El tamoxifeno puede utilizarse como terapia hormonal si las células muestran positividad para el receptor de estrógeno. Las investigaciones muestran que la supervivencia es la misma con la lumpectomía que con la mastectomía, independientemente de si la mujer recibe o no radioterapia después de la lumpectomía. No es necesaria la quimioterapia para el DCIS, ya que la enfermedad no es invasiva.
Si bien la cirugía reduce el riesgo de cáncer posterior, muchas personas nunca desarrollan cáncer, incluso sin tratamiento y los efectos secundarios asociados. No hay evidencia que compare la cirugía con la conducta expectante y algunos creen que la conducta expectante puede ser una opción razonable en ciertos casos.
Radioterapia
El uso de radioterapia después de una tumorectomía proporciona tasas de supervivencia equivalentes a las de una mastectomía, aunque existe un riesgo ligeramente mayor de recurrencia de la enfermedad en la misma mama en forma de DCIS adicional o cáncer de mama invasivo. Las revisiones sistemáticas (incluida una revisión Cochrane) indican que la adición de radioterapia a la tumorectomía reduce la recurrencia de DCIS o la aparición posterior de cáncer de mama invasivo en comparación con la cirugía conservadora de mama sola, sin afectar la mortalidad. La revisión Cochrane no encontró ninguna evidencia de que la radioterapia tuviera efectos tóxicos a largo plazo. Si bien los autores advierten que se requerirá un seguimiento más prolongado antes de poder llegar a una conclusión definitiva con respecto a la toxicidad a largo plazo, señalan que las mejoras técnicas en curso deberían restringir aún más la exposición a la radiación en los tejidos sanos. Recomiendan que se proporcione información completa sobre los posibles efectos secundarios a las mujeres que reciben este tratamiento. La adición de radioterapia a la tumorectomía parece reducir el riesgo de recurrencia local a aproximadamente el 12%, del cual aproximadamente la mitad será DCIS y la otra mitad será cáncer de mama invasivo; El riesgo de recurrencia es del 1% para las mujeres que se someten a una mastectomía.
Mastectomía
No hay evidencia de que la mastectomía reduzca el riesgo de muerte en comparación con una lumpectomía. Sin embargo, la mastectomía puede reducir la tasa de aparición de DCIS o cáncer invasivo en la misma ubicación.
Las mastectomías siguen siendo una recomendación común en pacientes con afectación microscópica persistente de los márgenes después de una escisión local o con diagnóstico de DCIS y evidencia de microcalcificaciones difusas sospechosas.
Biopsia de ganglio centinela
Algunas instituciones que han encontrado altas tasas de cánceres invasivos recurrentes después de una mastectomía por DCIS han respaldado la biopsia de ganglio centinela de rutina (BGN). Sin embargo, las investigaciones indican que la biopsia de ganglio centinela tiene riesgos que superan los beneficios para la mayoría de las mujeres con DCIS. La BGN debe considerarse en el caso de diagnóstico de tejido de DCIS de alto riesgo (grado III con masa palpable o de mayor tamaño en las imágenes), así como en personas que se someten a una mastectomía después de un diagnóstico de DCIS por biopsia por escisión o por punción.
Prognosis
Con tratamiento, el pronóstico es excelente, con una supervivencia a largo plazo superior al 97%. Si no se trata, el DCIS progresa a cáncer invasivo en aproximadamente un tercio de los casos, generalmente en la misma mama y cuadrante que el DCIS anterior. Alrededor del 2% de las mujeres a las que se les diagnostica esta afección y reciben tratamiento mueren en un plazo de 10 años. Los biomarcadores pueden identificar qué mujeres a las que se les diagnosticó inicialmente DCIS tienen un riesgo alto o bajo de cáncer invasivo posterior.
Epidemiología

El DCIS suele detectarse mediante mamografías, pero rara vez se palpa. Con el aumento del uso de la mamografía de detección, los cánceres no invasivos se diagnostican con mayor frecuencia y ahora constituyen entre el 15% y el 20% de todos los cánceres de mama.
En Estados Unidos, los casos de DCIS se han quintuplicado entre 1983 y 2003 debido a la introducción de la mamografía de detección. En 2009, se diagnosticaron unos 62.000 casos.
Referencias
- ^ Sinn, HP; Kreipe, H (mayo de 2013). "Un breve resumen de la clasificación de tumores de mama de la OMS, 4a edición, enfocado en temas y actualizaciones de la 3a edición". Cuidado de la mama. 8 (2): 149–154. doi:10.1159/000350774. PMC 3683948. PMID 24415964.
- ^ Hindle, William H. (1999). Cuidado de la mama: Guía clínica para los proveedores de atención primaria de salud de las mujeres. Nueva York: Springer. p. 129. ISBN 978-0-387-98348-6.
- ^ DePolo, Jamie (13 octubre 2023). "Estadios de cáncer de mama: estadio 0 cáncer de mama". Breastcancer.org.
- ^ Welch HG, Woloshin S, Schwartz LM (febrero de 2008). "El mar de incertidumbre que rodea el carcinoma ductal in situ - el precio de la mamografía de detección". J. Natl. Inst de cáncer. 100 (4): 228-9. doi:10.1093/jnci/djn013. PMID 18270336.
- ^ Morris, Elizabeth A.; Liberman, Laura, Eds. (2005). RM: Diagnóstico e Intervención. Nueva York: Springer. p. 164. ISBN 978-0-387-21997-4.
- ^ Nofal MN, Yousef AJ (diciembre 2019). "El diagnóstico del cáncer de mama masculino". The Netherlands Journal of Medicine. 77 (10): 356–359. PMID 31880271.
- ^ a b Mannu, GS; Wang, Z; Broggio, J; Charman, J; Cheung, S; Kearins, O; Dodwell, D; Darby, SC (27 May 2020). "Cáncer de seno invasivo y mortalidad por cáncer de seno después del carcinoma ductal in situ en mujeres que asisten a la detección de senos en Inglaterra, 1988-2014: estudio de cohorte observacional basado en la población". BMJ (Clinical Research Ed.). 369: m1570. doi:10.1136/bmj.m1570. PMC 7251423. PMID 32461218.
- ^ a b Virnig BA, Shamliyan T, Tuttle TM, Kane RL, Wilt TJ (septiembre de 2009). "Diagnosis y gestión del carcinoma ductal in situ (DCIS)". Evidence Report/Technology AssessmentAHRQ Publication No.09-E018. (185): 1–549. PMC 4781639. PMID 20629475.
- ^ Quinn CM, D'Arcy C, Wells C (enero 2022). "Apocrine lesions of the breast". Virchows Archiv. 480 (1): 177–189. doi:10.1007/s00428-021-03185-4. PMC 8983539. PMID 34537861.
- ^ Rubin, Raphael; Strayer, David S., eds. (2008). Patología de Rubin: Clínica Fundaciones de Medicina (5a edición). Filadelfia: Lippincott Williams y Wilkins. p. 848. ISBN 978-0-7817-9516-6.
- ^ Early Breast Cancer Trialists' Collaborative Group (EBCTCG); Correa, C.; McGale, P.; Taylor, C.; Wang, Y.; Clarke, M.; Davies, C.; Peto, R.; Bijker, N. (2010). "Overview of the randomized trials of radiotherapy in ductal carcinoma in situ of the breast". Journal of the National Cancer Institute. Monografías. 2010 (41): 162–177. doi:10.1093/jncimonographs/lgq039. ISSN 1745-6614. PMC 5161078. PMID 20956824.
- ^ "Tratamiento del cáncer de estómago (PDQ®)". NCI11 de abril de 2014. Retrieved 19 de junio 2014.
- ^ a b c d e "Tratamiento del cáncer de estómago (PDQ®)". NCI. Enero de 1980. Retrieved 19 de junio 2014.
- ^ a b c Allred DC (2010). "Carcinoma ductal in situ: terminología, clasificación e historia natural". Journal of the National Cancer Institute. Monografías. 2010 (41): 134–8. doi:10.1093/jncimonographs/lgq035. PMC 5161057. PMID 20956817.
- ^ Hui, David; Leung, Alexander A.; Padwal, Raj, eds. (2011). Enfoque a la medicina interna: un libro de recursos para la práctica clínica (3a edición). Nueva York: Springer. p. 198. ISBN 978-1-4419-6505-9.
- ^ Tjandra, Joe J.; Collins, John P. (2006). "Operación de la Bestia". In Tjandra; et al. (eds.). Textbook of surgery (3a edición). Malden, Mass.: Blackwell Pub. p. 282. ISBN 9780470757796.
- ^ Chang, Alfred E.; Ganz, Patricia A.; Hayes, Daniel F.; et al., eds. (2007). Oncología: un enfoque basado en pruebas. Springer. p. 162. ISBN 978-0-387-31056-5.
- ^ Saclarides, Theodore J.; Myers, Jonathan A.; Millikan, Keith W., eds. (2008). Cirugía general Enfermedades: un enfoque algorítmico para resolver problemas (2a edición revisada). Nueva York: Springer. ISBN 978-0-387-75246-4.
- ^ "Cáncer de Bestia". Retrieved 28 de junio 2010.
- ^ "Signos y síntomas". Retrieved 28 de junio 2010.
- ^ "Después de la mamografía". Archivado desde el original el 7 de abril de 2010. Retrieved 28 de junio 2010.
- ^ "Carcinoma intraductal del pecho". Archivado desde el original el 11 de junio de 2010. Retrieved 28 de junio 2010.
- ^ "Carcinoma en Situ". cancer.gov. 9 de enero de 2015. Retrieved 5 de marzo 2015.
- ^ Imágenes superiores e inferiores de Mikael Häggström, MD. Imagen correcta desde:
Kulka, J.; Madaras, L.; Floris, G.; Lax, S.F. (2022). "Las lesiones papilares de la mama". Virchows Arch. 480 (1): 65–84. doi:10.1007/s00428-021-03182-7. PMC 8983543. PMID 34734332.
- "Este artículo está bajo una Licencia Creative Commons 4.0 Internacional" - ^ Imagen de Mikael Häggström, MD. Referencias para características:
- "Carcinoma ductal en Situ del Breast". Stanford Medical School27 de agosto de 2020. Archivado desde el original el 30 de marzo de 2023. Retrieved 29 de octubre 2023.
- Hayward, M.K.; Louise Jones, J.; Hall, A.; King, L.; Ironside, A.J.; Nelson, A.C.; et al. (2020). "Derivación de un índice de imagen de heterogeneidad nuclear al grado DCIS". Computadora de Biotechnol J. 18: 4063–4070. doi:10.1016/j.csbj.2020.11.040. PMC 7744935. PMID 33363702. - ^ Anotación de imagen por Mikael Häggström, MD, utilizando la imagen fuente de:
Moatasim A, Mamoon N (2022). "Primary Breast Mucinous Cystadenocarcinoma and Review of Literature". Cureus. 14 (3): e23098. doi:10.7759/cureus.23098. PMC 8997314. PMID 35464581.
- "Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons CC BY 4.0."
Fuente de microinvasión: "Protocolo para el examen de los especímenes de resección de pacientes con carcinoma ductal En Situ (DCIS) del pecho, Versión: 4.4.0.0. Protocolo Fecha de publicación: Junio 2021" (PDF). Colegio de Patólogos Americanos. - ^ Imagen de Mikael Häggström, MD.
- Referencia del 30% es la definición más común de la necrosis de comedo por tamaño:
- Harrison, B.T.; Hwang, E.S.; Partridge, A.H.; Thompson, A.M.; Schnitt, S.J. (2019). "Variabilidad en umbral de diagnóstico para la necrosis de comedo entre patólogos de mama: implicaciones para la elegibilidad del paciente para ensayos de vigilancia activa de carcinoma ductal in situ". Mod Pathol. 32 (9): 1257–1262. doi:10.1038/s41379-019-0262-4. PMID 30980039. - ^ Mannu, Gurdeep S.; Bettencourt-Silva, Joao H.; Ahmed, Farid; Cunnick, Giles (2015). "A Nationwide Cross-Sectional Survey of UK Breast Surgeons' Views on the Management of Ductal Carcinoma In Situ". International Journal of Breast Cancer. 2015: 104231. doi:10.1155/2015/104231. PMC 4677188. PMID 26697227.
- ^ Carcinoma ductal En Situ: Opciones de tratamiento para pacientes con DCIS". National Cancer Institute at NIH. Institutos Nacionales de Salud. 11 de julio de 2014.
- ^ a b c "Treatment of ductal carcinoma in situ: an uncertain harm-benefit balance". Prescrire Int. 22 (144): 298–303. Diciembre 2013. PMID 24600734.
- ^ J, Cuzick; I, Sestak; Se, Pinder; Io, Ellis; S, Forsyth; Nj, Bundred; Jf, Forbes; H, Bishop; Is, Fentiman (enero de 2011). "Efecto del tamoxifeno y la radioterapia en mujeres con carcinoma ductal localmente excitado en Situ: Resultados a largo plazo del juicio del Reino Unido/ANZ DCIS". El Lancet. Oncología. 12 (1): 21–9. doi:10.1016/S1470-2045(10)70266-7. 3018565. PMID 21145284.
- ^ Carcinoma ductal en Situ (DCIS) Archivado 24 abril 2015 en la máquina Wayback, Johns Hopkins Medicine
- ^ a b c d Goodwin A, Parker S, Ghersi D, Wilcken N (2013). "Radioterapia postoperatoria para el carcinoma ductal in situ de la mama". La base de datos Cochrane de revisiones sistemáticas. 11 (11): CD000563. doi:10.1002/14651858.CD000563.pub7. PMID 24259251.
- ^ Virnig, BA; Tuttle, TM; Shamliyan, T; Kane, RL (2010). "Carcinoma ductal in situ de la mama: una revisión sistemática de incidencia, tratamiento y resultados". Journal of the National Cancer Institute. 102 (3): 170-8. doi:10.1093/jnci/djp482. PMID 20071685.
- ^ Correa, C.; McGale, P.; Taylor, C.; Wang, Y.; Clarke, M.; Davies, C.; Peto, R.; Bijker, N.; Solin, L.; Darby, S.; Darby, S (2010). "Overview of the randomized trials of radiotherapy in ductal carcinoma in situ of the breast". Journal of the National Cancer Institute. Monografías. 2010 (41): 162–177. doi:10.1093/jncimonographs/lgq039. ISSN 1745-6614. PMC 5161078. PMID 20956824.
- ^ "Declaración de la Conferencia de Consenso de NNIH DCIS". Institutos Nacionales de Salud. Septiembre de 2009. Archivado desde el original el 13 de agosto de 2011. Retrieved 19 de junio 2014.
- ^ a b Virnig, BA; Shamliyan, T; Tuttle, TM; Kane, RL; Wilt, TJ (septiembre de 2009). "Diagnosis y gestión del carcinoma ductal in situ (DCIS)". Evidence Report/Technology Assessment (185): 4. PMC 4781639. PMID 20629475.
Encontraron que las mujeres sometidas a mastectomía eran menos propensos que las mujeres sometidas a bulectomía más radiación para experimentar el DCIS local o recurrencia invasiva. Las mujeres sometidas a la BCS por sí solas también tenían más probabilidades de experimentar una recurrencia local que las mujeres tratadas con mastectomía. No encontramos ningún estudio que muestre una reducción de mortalidad asociada a la mastectomía sobre cirugía de conservación de mamas con o sin radiación
- ^ a b "Carcinoma intraductal". Archivado desde el original el 10 de abril de 2016. Retrieved 28 de junio 2010.
- ^ Tan JC, McCready DR, Easson AM, Leong WL (Febrero 2007). "Role of centinel lin node biopsy in ductal carcinoma-in-situ treated by mastectomy". Annals of Surgical Oncology. 14 (2): 638–45. doi:10.1245/s10434-006-9211-9. PMID 17103256. S2CID 1924867.
- ^ Hung, Peiyin; Wang, Shi-Yi; Killelea, Brigid K.; Mougalian, Sarah S.; Evans, Suzanne B.; Sedghi, Tannaz; Gross, Cary P. (1 de diciembre de 2019). "Long-Term Outcomes of Sentinel Lymph Node Biopsy for Ductal Carcinoma in Situ". Espécimen de cáncer JNCI. 3 (4): pkz052. doi:10.1093/jncics/pkz052. PMC 7049982. PMID 32337481.
- ^ Mannu, GS; Groen, EJ; Wang, Z; Schaapveld, M; Lips, EH; Chung, M; Joore, I; van Leeuwen, FE; Teertstra, HJ; Winter-Warnars, GAO; Darby, SC; Wesseling, J (noviembre 2019). "Reliability of preoperative breast biopsies showing ductal carcinoma in situ and implications for non-operative treatment: a cohort study". Investigación y tratamiento del cáncer de mama. 178 (2): 409-418. doi:10.1007/s10549-019-05362-1. PMC 6797705. PMID 31388937.
- ^ van Deurzen CH, Hobbelink MG, van Hillegersberg R, van Diest PJ (abril de 2007). "¿Hay alguna indicación de biopsia de ganglio centinela en pacientes con carcinoma ductal in situ de la mama? Una revisión". European Journal of Cancer. 43 (6): 993–1001. doi:10.1016/j.ejca.2007.01.010. PMID 17300928.
- ^ Patología básica, Robbins (2018). Lactante. Copyright © 2018 por Elsevier Inc. p. 743. ISBN 978-0-323-35317-5.
- ^ a b c Kerlikowske, K (2010). "Epidemiología del carcinoma ductal in situ". Journal of the National Cancer Institute. Monografías. 2010 (41): 139–41. doi:10.1093/jncimonographs/lgq027. PMC 5161058. PMID 20956818.
- ^ Kerlikowske, K.; Molinaro, A. M.; Gauthier, M. L.; Berman, H. K.; Waldman, F.; Bennington, J.; Sánchez, H.; Jimenez, C.; Stewart, K.; et al. (2010). "Expresión y riesgo de tumores posteriores después del carcinoma ductal inicial en el diagnóstico situ". JNCI Journal of the National Cancer Institute. 102 (9): 627-637. doi:10.1093/jnci/djq101. PMC 2864293. PMID 20427430.
- ^ Witkiewicz AK, Dasgupta A, Nguyen KH, et al. (junio de 2009). "Los niveles de caveolina-1 predicen la progresión temprana del DCIS al cáncer de mama invasivo". Biología del cáncer. 8 11): 1071-1079. doi:10.4161/cbt.8.11.8874. PMID 19502809.

![Histopathologic architectural patterns of DCIS.[24]](https://upload.wikimedia.org/wikipedia/commons/thumb/5/58/Histopathologic_architectural_patterns_of_DCIS.png/288px-Histopathologic_architectural_patterns_of_DCIS.png)
![Histopathology of high-grade DCIS. H&E stain. RBC = red blood cell.[25]](https://upload.wikimedia.org/wikipedia/commons/thumb/3/3f/Histopathology_of_high-grade_DCIS.png/202px-Histopathology_of_high-grade_DCIS.png)
![DCIS with microinvasion, defined as focus of invasive cancer measuring up to 1.0 mm in size.[26]](https://upload.wikimedia.org/wikipedia/commons/thumb/d/d9/Histopathology_of_microinvasive_ductal_carcinoma_in_situ.png/289px-Histopathology_of_microinvasive_ductal_carcinoma_in_situ.png)
![Ductal carcinoma in situ with comedo necrosis spanning 30% of its diameter, which is generally regarded as the minimal size to classify it as comedo.[27]](https://upload.wikimedia.org/wikipedia/commons/thumb/4/41/Histopathology_of_ductal_carcinoma_in_situ_with_comedo_necrosis.jpg/321px-Histopathology_of_ductal_carcinoma_in_situ_with_comedo_necrosis.jpg)