Carbonato de magnesio
El
carbonato de magnesio, MgCO3 (nombre arcaico magnesia alba), es una sal inorgánica que es un sólido incoloro o blanco. También existen como minerales varias formas hidratadas y básicas de carbonato de magnesio.
Formularios
Las formas de carbonato de magnesio más comunes son la sal anhidra llamada magnesita (MgCO3), y los di, tri y pentahidratos conocidos como barringtonita (MgCO3·2H2O), nesquehonita (MgCO3·3H2O) y lansfordita (MgCO3·5H2O), respectivamente. Algunas formas básicas como la artinita (Mg2CO3(OH)2·3H2O), hidromagnesita ( Mg5(CO3) 4(OH)2·4H2O), y dypingita (Mg5(CO3)4(OH)2·5H2O) también se encuentran como minerales. Todos esos minerales son incoloros o blancos.
La magnesita está formada por cristales trigonales incoloros o blancos. La sal anhidra es prácticamente insoluble en agua, acetona y amoníaco. Todas las formas de carbonato de magnesio reaccionan con los ácidos. La magnesita cristaliza en la estructura de calcita en la que el Mg2+ está rodeado por seis átomos de oxígeno.
| Coordinación del carbono | Coordinación de magnesio | Unidad celular |
|---|---|---|
 | 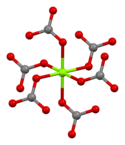 |  |
El dihidrato tiene una estructura triclínica, mientras que el trihidrato tiene una estructura monoclínica.
Did you mean:References to "light " and n#34;heavy" magnesium carbonates actually refer to the magnesium hydroxy carbonates hydromagnesite and dypingite, respectively.
Preparación
Did you mean:Magnesium carbonate is ordinarily obtained by mining the mineral magnesite. Seventy percent of the world 's supply is mined and prepared in China.
El carbonato de magnesio se puede preparar en laboratorio mediante la reacción entre cualquier sal de magnesio soluble y bicarbonato de sodio:
- MgCl2(aq) + 2 NaHCO3(aq) → MgCO3s) + 2 NaCl(aq) + H2O(l) + CO2g)
Si se trata cloruro (o sulfato) de magnesio con carbonato de sodio acuoso, se forma un precipitado de carbonato de magnesio básico (un complejo hidratado de carbonato de magnesio e hidróxido de magnesio) en lugar de carbonato de magnesio en sí:
- 5 MgCl2(aq) + 5 Na2CO3(aq) + 5 H2O(l) → Mg4(CO3)3(OH)2·3H2O(s) + Mg(HCO3)2(aq) + 10 NaCl(aq)
Las rutas industriales de alta pureza incluyen un camino a través del bicarbonato de magnesio, que se puede formar combinando una suspensión de hidróxido de magnesio y dióxido de carbono a alta presión y temperatura moderada. Luego, el bicarbonato se seca al vacío, lo que hace que pierda dióxido de carbono y una molécula de agua:
- Mg(OH)2 + 2 CO2 → Mg(HCO)3)2
- Mg(HCO)3)2 → MgCO3 + CO2 + H2O
Propiedades químicas
Con ácidos
Al igual que muchos carbonatos metálicos comunes del grupo 2, el carbonato de magnesio reacciona con ácidos acuosos para liberar dióxido de carbono y agua:
- MgCO3 + 2 HCl → MgCl2 + CO2 + H2O
- MgCO3 + H2SO4 → MgSO4 + CO2 + H2O
Descomposición
A altas temperaturas, el MgCO3 se descompone en óxido de magnesio y dióxido de carbono. Este proceso es importante en la producción de óxido de magnesio. Este proceso se llama calcinar:
- MgCO3 → MgO + CO2 (ΔH = +118 kJ/mol)
La temperatura de descomposición es de 350 °C (662 °F). Sin embargo, la calcinación del óxido generalmente no se considera completa por debajo de 900 °C debido a la interferencia en la readsorción del dióxido de carbono liberado.
Los hidratos de las sales pierden agua a diferentes temperaturas durante la descomposición. Por ejemplo, en el trihidrato MgCO3·3H2O, que La fórmula molecular se puede escribir como Mg(HCO3)(OH)·2H2O , los pasos de deshidratación ocurren a 157 °C y 179 °C de la siguiente manera:
- Mg(HCO)3)(OH)·2(H)2O) → Mg(HCO3)(OH)·(H)2O) + H2O a 157 °C
- Mg(HCO)3)(OH)·(H)2O) → Mg(HCO3)(OH) + H2O a 179 °C
Usos
El uso principal del carbonato de magnesio es la producción de óxido de magnesio mediante calcinación. Los minerales de magnesita y dolomita se utilizan para producir ladrillos refractarios. MgCO3 también se utiliza en pisos, composiciones ignífugas y extintoras, cosméticos, polvos para polvo y pasta de dientes.. Otras aplicaciones son como material de relleno, supresor de humo en plásticos, agente de refuerzo en caucho de neopreno, agente secante y retención de color en alimentos.

Debido a su baja solubilidad en agua y sus propiedades higroscópicas, MgCO3 se añadió por primera vez a la sal. en 1911 para que fluyera más libremente. La empresa Morton Salt adoptó el lema "Cuando llueve a cántaros", lo que significa que su sal contiene MgCO3 no se pegarían en climas húmedos. El carbonato de magnesio, más comúnmente denominado "tiza", también se utiliza como agente secante en la piel de los atletas. manos en escalada en roca, gimnasia, levantamiento de pesas y otros deportes en los que es necesario un agarre firme.
Como aditivo alimentario, el carbonato de magnesio se conoce como E504. Su único efecto secundario conocido es que puede funcionar como laxante en altas concentraciones.
El carbonato de magnesio se utiliza en taxidermia para blanquear el cráneo. Se puede mezclar con peróxido de hidrógeno para crear una pasta, que se extiende sobre el cráneo para darle un acabado blanco.
El carbonato de magnesio se utiliza como revestimiento blanco mate para pantallas de proyección.
Uso médico
Es un laxante para aflojar los intestinos.
Además, el carbonato de magnesio de alta pureza se utiliza como antiácido y como aditivo en la sal de mesa para mantenerla fluida. El carbonato de magnesio puede hacer esto porque no se disuelve en agua, sólo en ácido, donde hará efervescencia (burbuja).
Seguridad
El carbonato de magnesio no es tóxico ni inflamable.
Estado de compensación
- British Pharmacopoeia
- Japanese Pharmacopoeia
Notas y referencias
- ^ a b c d "carbonato de magnesio".
- ^ Bénézeth, Pascale; Saldi, Giuseppe D.; Dandurand, Jean-Louis; Schott, Jacques (2011). "Experimental determination of the solubility product of magnesite at 50 to 200 °C". Chemical Geology. 286 (1–2): 21–31. Código:2011ChGeo.286...21B. doi:10.1016/j.chemgeo.2011.04.016.
- ^ a b Ross, Nancy L. (1997). "La ecuación del comportamiento estatal y de alta presión de la magnesita". Am. Mineral. 82 (7–8): 682–688. Código de Procedimiento:1997AmMin..82..682R. doi:10.2138/am-1997-7-805. S2CID 43668770.
- ^ a b Zumdahl, Steven S. (2009). Principios químicos 6o Ed. Houghton Mifflin Company. p. A22. ISBN 978-0-618-94690-7.
- ^ NIOSH Pocket Guide to Chemical Hazards. "#0373". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c d Margarete Seeger; Walter Otto; Wilhelm Flick; Friedrich Bickelhaupt; Otto S. Akkerman. "Magnesium Compounds". Enciclopedia de Ullmann de Química Industrial. Wiley-VCH. doi:10.1002/14356007.a15_595.pub2.
- ^ Botha, A.; Strydom, C.A. (2001). "Preparación de un carbonato hidroxi de magnesio de hidroxido de magnesio". Hydrometallurgy. 62 (3): 175. Bibcode:2001HydMe.62..175B. doi:10.1016/S0304-386X(01)00197-9.
- ^ a b Allf, Bradley (21 de mayo de 2018). "El costo ambiental oculto del calcetín de escalada". Climbing Magazine. Cruz Bay Publishing. Retrieved 22 de mayo 2018.
De hecho, China produce el 70 por ciento de la magnesita del mundo. La mayor parte de esa producción, tanto la minería como el procesamiento, se concentra en un pequeño rincón de Liaoning, una provincia industrial montañosa del noreste de China entre Beijing y Corea del Norte.
- ^ "IAState MSDS".
- ^ Weast, Robert C.; et al. (1978). CRC Manual de Química y Física (59a edición). West Palm Beach, FL: CRC Press. p. B-133. ISBN 0-8493-0549-8.
- ^ a b "Evaluación convencional y controlada Análisis térmico de Mg(HCO3)(OH)·2(H2O)" (PDF).
- ^ "Her Debut - Morton Salt". Retrieved 27 de diciembre 2017.
- ^ "Food-Info.net: Números E: E504: carbonatos de magnesio". 080419 food-info.net
- ^ Noronha, Shonan (2015). Especialista en Tecnología Certificado-Instalación. McGraw Hill Education. p. 256. ISBN 978-0071835657.
- ^ "¿Qué es el carbonato de magnesio?". Sciencing. Retrieved 15 de abril 2018.
- ^ British Pharmacopoeia Commission Secretariat (2009). "Index, BP 2009" (PDF). Archivado desde el original (PDF) el 11 de abril de 2009. Retrieved 31 de enero 2010.
- ^ "Japonés Pharmacopoeia, 15a edición" (PDF). 2006. Archivado desde el original (PDF) el 22 de julio de 2011. Retrieved 31 de enero 2010.
Contenido relacionado
Nonoxinol-9
Colfax (pueblo), Wisconsin
Ácido erúcico