Caproato de hidroxiprogesterona
El caproato de hidroxiprogesterona, que se comercializa bajo la marca Delalutin, entre otras, es un medicamento que se utiliza para reducir el riesgo de parto prematuro en mujeres embarazadas de un bebé que tienen antecedentes de parto prematuro espontáneo. En marzo de 2023, el fabricante, Covis Pharma, acordó retirar el fármaco del mercado estadounidense. La Administración de Alimentos y Medicamentos de Estados Unidos (FDA) retiró la aprobación de esta sustancia farmacológica en abril de 2023. En mayo de 2024, el Comité de Evaluación de Riesgos de Farmacovigilancia de la Agencia Europea de Medicamentos recomendó suspender las autorizaciones de comercialización de medicamentos que contienen caproato de 17-hidroxiprogesterona en la Unión Europea.
El caproato de hidroxiprogesterona es un medicamento a base de progestina que se utilizaba para prevenir el parto prematuro en mujeres embarazadas con antecedentes de esta afección y para tratar trastornos ginecológicos. También se ha formulado en combinación con estrógenos para diversas indicaciones (nombres comerciales Gravibinon y Primosiston) y como una forma de anticonceptivo inyectable de larga duración (nombre comercial Chinese Injectable No. 1). No se utiliza por vía oral, sino que se administra mediante inyección en el músculo o la grasa.
El caproato de hidroxiprogesterona es generalmente bien tolerado y produce pocos efectos secundarios. Las reacciones en el lugar de la inyección, como dolor e hinchazón, son los efectos secundarios más comunes del caproato de hidroxiprogesterona. El medicamento puede aumentar el riesgo de diabetes gestacional cuando se utiliza en mujeres embarazadas. El caproato de hidroxiprogesterona es una progestina, o un progestágeno sintético, y por lo tanto es un agonista del receptor de progesterona, el objetivo biológico de los progestágenos como la progesterona. Tiene cierta actividad antimineralocorticoide y ninguna otra actividad hormonal importante. El medicamento muestra una serie de diferencias con la progesterona natural.
El caproato de hidroxiprogesterona se descubrió en 1953 y se introdujo para uso médico en 1954 o 1955. Se comercializó en los Estados Unidos con la marca Delalutin y en toda Europa con la marca Proluton. El medicamento se suspendió en los Estados Unidos en 1999. Sin embargo, el caproato de hidroxiprogesterona se reintrodujo posteriormente en los Estados Unidos con la marca Makena para el tratamiento del parto prematuro en 2011 hasta que la FDA prohibió el 17α-OHPC en 2023.
Usos médicos
Nacimiento prematuro
El uso de caproato de hidroxiprogesterona durante el embarazo para prevenir el parto prematuro en mujeres con antecedentes de parto prematuro entre las 20 y las 36 semanas y 6 días está respaldado por las pautas clínicas de la Sociedad de Medicina Materno-Fetal publicadas en mayo de 2012 como evidencia de nivel I y III, recomendación de nivel A. La evidencia de nivel I se refiere a un ensayo controlado aleatorio con la potencia adecuada, y la evidencia de nivel III es el respaldo de la opinión de expertos, mientras que una recomendación de nivel A confiere que la recomendación se basa en evidencia científica buena y consistente. Se recomienda caproato de hidroxiprogesterona 250 mg IM semanalmente, preferiblemente a partir de las 16-20 semanas hasta las 36 semanas. En estas mujeres, si la longitud cervical por ecografía transvaginal se acorta a <25 mm a <24 semanas, se puede ofrecer un cerclaje cervical. En el estudio de 2013 en el que se basa la recomendación de la guía, también se observó una disminución significativa de la morbilidad neonatal, incluidas tasas más bajas de enterocolitis necrotizante (0 en el grupo de tratamiento frente a 4 en el grupo de control), hemorragia intraventricular (4 en el grupo de tratamiento en comparación con 8 en el grupo de control, con un riesgo relativo de 0,25) y necesidad de oxígeno suplementario (14 % en el grupo de tratamiento frente a 24 % en el grupo placebo, con un riesgo relativo de 0,42). Además, este estudio incluyó a 463 mujeres, 310 de las cuales recibieron la inyección. De estas mujeres, 9 tenían bebés con malformaciones congénitas (2 %), pero no hubo un patrón consistente y ninguna afectaba a órganos internos.
No existen pruebas de riesgo fetal con el uso de caproato de hidroxiprogesterona durante el embarazo. Una revisión concluyó que faltaba información sobre los posibles daños. Tres estudios clínicos en embarazos de feto único con 250 mg/semana de caproato de hidroxiprogesterona intramuscular han mostrado una tendencia a un aumento en la pérdida del embarazo debido a aborto espontáneo en comparación con placebo. Uno de ellos, un gran estudio de los Institutos Nacionales de Salud (NIH) en 2003, analizó el efecto de las inyecciones de caproato de hidroxiprogesterona en mujeres con riesgo de parto prematuro repetido y encontró que el grupo tratado experimentó parto prematuro en un 37% frente al 55% en los controles. Un estudio de seguimiento de la descendencia no mostró evidencia de que el caproato de hidroxiprogesterona afectara a los niños en los primeros años de vida. Basándose en estos datos del NIH, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el caproato de hidroxiprogesterona en 2011 como medicamento para reducir el riesgo de parto prematuro en determinadas mujeres en riesgo.
La FDA expresó su preocupación por los abortos espontáneos en la reunión del comité asesor de 2006; el comité votó por unanimidad que era necesario realizar más estudios para evaluar la posible asociación del caproato de hidroxiprogesterona con un mayor riesgo de aborto espontáneo y muerte fetal en el segundo trimestre. Un estudio toxicológico en monos rhesus dio como resultado la muerte de todos los fetos rhesus expuestos a dosis equivalentes de 1 y 10 veces la dosis humana de caproato de hidroxiprogesterona. A partir de 2008, el caproato de hidroxiprogesterona era una progestina de categoría D según la FDA (es decir, hay evidencia de daño fetal). Se especula que el aceite de ricino en la formulación de caproato de hidroxiprogesterona puede no ser beneficioso para el embarazo. Cabe destacar que el estudio NEJM mencionado anteriormente de Meirs et al. compara el efecto del caproato de hidroxiprogesterona (con el componente de aceite de ricino) con la inyección de aceite de ricino como placebo.
Un estudio publicado en febrero de 2016, entre otras conclusiones, encontró lo siguiente:
OPPTIMUM sugiere firmemente que la eficacia de la progesterona para mejorar los resultados es inexistente o débil. Dada la heterogeneidad del síndrome laboral prematuro no podemos excluir beneficio en subgrupos fenotípicos o genotípicos específicos de mujeres en riesgo. Sin embargo, los subgrupos de mujeres que podrían beneficiarse no parecen ser fácilmente identificables por las estrategias de selección actuales, incluyendo la medición de longitud cervical y pruebas de fibronectina. Afortunadamente, nuestro estudio sugiere que la progesterona es segura para aquellos que desean tomarla para la profilaxis prematuro. La tasa general de acontecimientos adversos maternoinfantiles es similar en los grupos progesterona y placebo. Hubo pocas diferencias en la incidencia de resultados secundarios adversos en los dos grupos, con excepción de una tasa más alta de complicaciones renales, gastrointestinales y respiratorias en la infancia en los grupos de progesterona. Importantemente, las tasas absolutas de estas complicaciones fueron bajas. Seguimiento de otros bebés expuestos en utero a la progesterona vaginal sería útil para determinar si la tasa de aumento de algunas complicaciones renales, gastrointestinales y respiratorias es un efecto real o un error tipo I.
El revisor de la revista hizo el siguiente comentario notable sobre el estudio OPPTIMUM: "Eso es todo. Esta historia ha terminado y nadie necesita volver a usar progesterona vaginal para prevenir el parto prematuro".
Una revisión Cochrane sobre progestágenos para prevenir el parto prematuro concluyó que había poca evidencia de que la progesterona vaginal o intramuscular ayudara a reducir el riesgo de parto prematuro en mujeres con embarazos múltiples.
Trastornos ginecológicos
El caproato de hidroxiprogesterona se utiliza en el tratamiento de la amenaza de aborto, trastornos ginecológicos como la dismenorrea, el síndrome premenstrual, la enfermedad fibroquística de las mamas, la adenosis y el dolor de mamas. Además, el caproato de hidroxiprogesterona se utiliza en el tratamiento del cáncer de endometrio y se ha comprobado que es significativamente eficaz para prolongar la vida tanto en mujeres premenopáusicas como posmenopáusicas con esta enfermedad. El medicamento se utilizó ampliamente en los años 50 y 70 para tales indicaciones, pero más recientemente el caproato de hidroxiprogesterona ha recibido la mayor atención en la prevención del parto prematuro.
Control de natalidad
El caproato de hidroxiprogesterona está disponible en combinación con valerato de estradiol como anticonceptivo combinado inyectable que se administra una vez al mes en algunos países.
Otros usos
El caproato de hidroxiprogesterona se ha utilizado como componente de la terapia hormonal menopáusica en mujeres.
El caproato de hidroxiprogesterona se ha utilizado para tratar la hiperplasia prostática benigna en hombres, aunque la evidencia de su eficacia es marginal e incierta. También se ha utilizado para tratar el cáncer de próstata, en una dosis de 1.500 mg dos veces por semana. El mecanismo de acción del caproato de hidroxiprogesterona en estos usos es la supresión de la producción de andrógenos testiculares a través de la supresión de la secreción de la hormona luteinizante, que son el resultado de la actividad progestogénica y antigonadotrópica del caproato de hidroxiprogesterona. Sin embargo, pueden desarrollarse síntomas de hipogonadismo cuando se utiliza el caproato de hidroxiprogesterona para esta indicación, y se ha informado que dos tercios de los hombres experimentan impotencia.
El caproato de hidroxiprogesterona se ha utilizado como componente de la terapia hormonal feminizante para mujeres transgénero. Debido a la micronización, los progestágenos bioidénticos se utilizan con mayor frecuencia.
Formularios disponibles

El caproato de hidroxiprogesterona está disponible solo en forma de ampollas y viales de soluciones oleosas de 125 y 250 mg/ml para inyección intramuscular (nombres comerciales Proluton, Makena). También está disponible solo en forma de autoinyector de 250 mg/ml para uso por inyección subcutánea (nombre comercial Makena).
El caproato de hidroxiprogesterona está o estuvo disponible en combinación con valerato de estradiol en forma de ampollas y viales de 250 mg/ml de OHPC y soluciones oleosas de valerato de estradiol de 5 mg/ml para inyección intramuscular (nombres comerciales Gravibinon, Chinese Injectable No. 1). El medicamento está o estuvo disponible también en combinación con benzoato de estradiol en forma de ampollas de 125–250 mg de OHPC y 10 mg de benzoato de estradiol en solución oleosa para inyección intramuscular (nombre comercial Primosiston). Además, el caproato de hidroxiprogesterona se ha comercializado en combinación con dipropionato de estradiol en forma de 50 mg/ml de caproato de hidroxiprogesterona y 1 mg/ml de dipropionato de estradiol (nombre comercial EP Hormone Depot) en Japón.
Contraindicaciones
Las contraindicaciones del caproato de hidroxiprogesterona incluyen trombosis o enfermedad tromboembólica previa o actual, cáncer de mama conocido o sospechado, antecedentes pasados o presentes de otro cáncer sensible a las hormonas, sangrado vaginal anormal no diagnosticado no relacionado con el embarazo, ictericia colestásica del embarazo, tumores hepáticos o enfermedad hepática activa e hipertensión no controlada. También existen algunas contraindicaciones relativas para el caproato de hidroxiprogesterona.
Efectos secundarios
El caproato de hidroxiprogesterona es generalmente bien tolerado y produce relativamente pocos efectos secundarios. Las reacciones en el lugar de la inyección, como dolor, molestias, hinchazón, picazón, hematomas y bultos, son los efectos secundarios más comunes del caproato de hidroxiprogesterona. Sin embargo, a diferencia de las dosis altas de progesterona, que producen reacciones moderadas a severas, el caproato de hidroxiprogesterona está relativamente libre de reacciones en el lugar de la inyección. Los efectos secundarios del caproato de hidroxiprogesterona que ocurren en más del 2% de los usuarios incluyen dolor en el lugar de la inyección (34,8%), hinchazón en el lugar de la inyección (17,1%), urticaria (12,3%), prurito (7,7%), prurito en el lugar de la inyección (5,8%), náuseas (5,8%), nódulos en el lugar de la inyección (4,5%) y diarrea (2,3%). Se han observado tasas numéricamente mayores en relación con los controles de aborto espontáneo (2,4% frente a 0%), muerte fetal (2,0% frente a 1,3%), ingreso por parto prematuro (16,0% frente a 13,8%), preeclampsia o hipertensión gestacional (8,8% frente a 4,6%), diabetes gestacional (5,6% frente a 4,6%) y oligohidramnios (3,6% frente a 1,3%) con el uso de caproato de hidroxiprogesterona en ensayos clínicos en los que se administró a mujeres embarazadas para prevenir el parto prematuro.
Sobredosis
No se han notificado casos de sobredosis de caproato de hidroxiprogesterona. En caso de sobredosis, el tratamiento debe basarse en los síntomas. El caproato de hidroxiprogesterona se ha estudiado en humanos en dosis altas de 2000 a 5000 mg por semana mediante inyección intramuscular, sin problemas de seguridad.
Interacciones
No es probable que el caproato de hidroxiprogesterona afecte a la mayoría de las enzimas del citocromo P450 en concentraciones terapéuticas. No se han realizado estudios de interacción farmacológica con el caproato de hidroxiprogesterona.
Farmacología
Farmacodynamics
El caproato de hidroxiprogesterona tiene actividad progestágena, cierta actividad antimineralocorticoide y ninguna otra actividad hormonal importante.
| Compuesto | hPR-A | hPR-B | rbPR | rbGR | rbER | |||
|---|---|---|---|---|---|---|---|---|
| Progesterona | 100 | 100 | 100 | c) | c) | |||
| 17α-Hydroxyprogesterone | 1 | 1 | 3 | 1 | c) | |||
| Caprota de hidroxiprogesterona | 26 | 30 | 28 | 4 | c) | |||
| Acetato de hidroxiprogesterona | 38 | 46 | 115 | 3 | ? | |||
| Notas: Los valores son porcentajes (%). Los ligandos de referencia (100%) fueron progesterona para el PR, dexamethasone para el GR, y estradiol para el ER. Fuentes: Ver plantilla. | ||||||||
| Compuesto | Formulario | Dosis para usos específicos (mg) | DOA | |||
|---|---|---|---|---|---|---|
| TFD | POICD | CICD | ||||
| Algestone acetophenide | Soln de aceite. | – | – | 75–150 | 14 a 32 d | |
| Gestonorone caproate | Soln de aceite. | 25–50 | – | – | 8 a 13 d | |
| Hydroxyprogest. acetato | Aq. susp. | 350 | – | – | 9 a 16 d | |
| Hydroxyprogest. caproate | Soln de aceite. | 250–500 | – | 250–500 | 5 a 21 d | |
| Medroxyprog. acetato | Aq. susp. | 50 a 100 | 150 | 25 | 14–50+ d | |
| Acetato megestrol | Aq. susp. | – | – | 25 | √14 d | |
| Norethisterone enanthate | Soln de aceite. | 100–200 | 200 | 50 | 11 a 52 d | |
| Progesterona | Soln de aceite. | 200 | – | – | 2 a 6 d | |
| Aq. soln. | ? | – | – | 1–2 d | ||
| Aq. susp. | 50–200 | – | – | 7 a 14 d | ||
Notas y fuentes:
| ||||||
Actividad progestogénica
El caproato de hidroxiprogesterona, también conocido como caproato de 17α-hidroxiprogesterona, es más parecido a la progesterona en términos de estructura y farmacología que la mayoría de las demás progestinas, y es esencialmente un progestágeno puro, es decir, un agonista selectivo del receptor de progesterona (PR) con mínima o ninguna otra actividad hormonal. Sin embargo, el caproato de hidroxiprogesterona tiene una farmacocinética mejorada en comparación con la progesterona, es decir, una duración mucho más prolongada con la inyección intramuscular en solución oleosa.
Administrado por inyección intramuscular, la dosis de transformación endometrial de caproato de hidroxiprogesterona por ciclo es de 250 a 500 mg, y la dosis de sustitución semanal de caproato de hidroxiprogesterona es de 250 mg, mientras que la dosis efectiva de caproato de hidroxiprogesterona en la prueba de retraso menstrual (Greenblatt) es de 25 mg por semana. Una dosis efectiva de caproato de hidroxiprogesterona para inhibir la ovulación es de 500 mg una vez al mes por inyección intramuscular. Sin embargo, la dosis de caproato de hidroxiprogesterona utilizada en anticonceptivos inyectables combinados una vez al mes es de 250 mg, y esta combinación es efectiva para inhibir la ovulación de manera similar. A modo de comparación, la dosis de acetato de medroxiprogesterona (MPA; acetato de 6α-metil-17α-hidroxiprogesterona), un análogo cercano del caproato de hidroxiprogesterona, utilizado por inyección intramuscular en suspensión acuosa microcristalina en anticonceptivos inyectables combinados de administración mensual, es de 25 mg. También se ha dicho que administrado por inyección intramuscular, 250 mg de caproato de hidroxiprogesterona en solución oleosa es equivalente en potencia progestágena a 50 mg de acetato de medroxiprogesterona en suspensión acuosa microcristalina. Aunque la semivida de eliminación del caproato de hidroxiprogesterona intramuscular en solución oleosa en mujeres no embarazadas es de aproximadamente 8 días, la semivida de eliminación del acetato de medroxiprogesterona intramuscular en suspensión acuosa microcristalina en mujeres es de alrededor de 50 días. El caproato de hidroxiprogesterona también es, en cierta medida, menos potente que el éster más estrechamente relacionado, el acetato de hidroxiprogesterona (OHPA; acetato de 17α-hidroxiprogesterona).
La 17α-hidroxiprogesterona (OHP) tiene una actividad progestágena débil, pero la esterificación de C17α da como resultado una actividad progestágena mayor. De una variedad de ésteres diferentes, se descubrió que el éster de caproato (hexanoato) tenía la actividad progestágena más fuerte, y esto sirvió como base para el desarrollo del caproato de hidroxiprogesterona, así como otros ésteres de progestágeno de caproato, como el caproato de gestonorona. El caproato de hidroxiprogesterona es un progestágeno mucho más potente que la 17α-hidroxiprogesterona, pero no tiene una afinidad tan alta por el PR como la progesterona. El caproato de hidroxiprogesterona tiene aproximadamente el 26% y el 30% de la afinidad de la progesterona por el PR-A y el PR-B humanos, respectivamente. El medicamento no fue más eficaz que la progesterona para activar estos receptores y provocar la expresión de genes asociados in vitro.
Efectos antigonadotrópicos
Debido a la activación del PR, el caproato de hidroxiprogesterona tiene efectos antigonadotrópicos, o produce supresión del eje hipotálamo-hipofisario-gonadal, y puede suprimir significativamente la secreción de gonadotropina y la producción de hormonas sexuales gonadales en dosis suficientemente altas. Un estudio encontró que el caproato de hidroxiprogesterona por inyección intramuscular en una dosis de 200 mg dos veces por semana durante las primeras dos semanas y luego 200 mg una vez por semana durante 12 semanas no influyó significativamente en la excreción urinaria de estrógenos, hormona luteinizante u hormona folículo estimulante en hombres con hiperplasia prostática benigna. En otro estudio que utilizó una dosis no especificada de caproato de hidroxiprogesterona intramuscular, se evaluó la secreción de testosterona en un solo hombre y se encontró que disminuyó de 4,2 mg/día a 2,0 mg/día (o aproximadamente un 52%) a las 6 semanas de tratamiento, mientras que la secreción de hormona luteinizante permaneció sin cambios en el hombre. Otro estudio encontró que 3000 mg/semana de caproato de hidroxiprogesterona por inyección intramuscular suprimieron los niveles de testosterona de 640 ng/dl a 320–370 ng/dl (en un 42–50%) en un solo hombre con cáncer de próstata, lo que fue similar a la supresión de testosterona con acetato de ciproterona o acetato de clormadinona. Se encontró que el caproato de gestonorona, una progestina estrechamente relacionada con el caproato de hidroxiprogesterona con una potencia aproximadamente 5 a 10 veces mayor en humanos, suprimía los niveles de testosterona en un 75% en una dosis de 400 mg/semana en hombres con cáncer de próstata. A modo de comparación, la orquiectomía disminuyó los niveles de testosterona en un 91%. En general, las progestinas pueden suprimir al máximo los niveles de testosterona en un 70 a 80%. Los efectos antigonadotrópicos del caproato de hidroxiprogesterona y, por lo tanto, su supresión de la testosterona son la base del uso del caproato de hidroxiprogesterona en el tratamiento de la hiperplasia prostática benigna y el cáncer de próstata en hombres. También se ha observado una supresión de los niveles de hormona luteinizante por el caproato de hidroxiprogesterona en mujeres.
Actividad glucocorticoidea
Se dice que el caproato de hidroxiprogesterona no tiene actividad glucocorticoide. De acuerdo con esto, se ha descubierto que el caproato de hidroxiprogesterona no altera los niveles de cortisol en humanos, incluso con dosis muy altas por inyección intramuscular. Esto es relevante porque los medicamentos con una actividad glucocorticoide significativa suprimen los niveles de cortisol debido al aumento de la retroalimentación negativa en el eje hipotálamo-hipofisario-adrenal. El caproato de hidroxiprogesterona se ha estudiado en humanos en dosis tan altas como 5000 mg por semana por inyección intramuscular, con seguridad y sin efectos glucocorticoides observados. Sin embargo, el medicamento interactúa con el receptor de glucocorticoides; tiene aproximadamente un 4% de la afinidad de la dexametasona por el receptor de glucocorticoides de conejo. Pero actúa como un agonista parcial del receptor y no tiene mayor eficacia que la progesterona para activar el receptor y provocar la expresión génica asociada in vitro.
Otras actividades
Como progestágeno puro, el caproato de hidroxiprogesterona no tiene actividad androgénica, antiandrogénica, estrogénica ni glucocorticoide. La ausencia de actividad androgénica y antiandrogénica del caproato de hidroxiprogesterona contrasta con la mayoría de las demás progestinas derivadas de la 17α-hidroxiprogesterona. Debido a su falta de propiedades androgénicas, al igual que la progesterona, el caproato de hidroxiprogesterona no tiene efectos teratogénicos en el feto, lo que lo hace seguro para su uso durante el embarazo. Aunque el caproato de hidroxiprogesterona se ha descrito como un progestágeno puro, hay evidencia de que posee cierta actividad antimineralocorticoide, al igual que la progesterona y la 17α-hidroxiprogesterona. Esto incluye efectos diuréticos clínicamente importantes y la reversión de la retención de líquidos y el edema inducidos por el estrógeno. A diferencia de la progesterona, no se prevé que el caproato de hidroxiprogesterona y sus metabolitos interactúen con receptores no genómicos, como los receptores de progesterona de membrana o el receptor GABAA. En consecuencia, no se cree que el caproato de hidroxiprogesterona posea las actividades neuroesteroides de la progesterona ni sus efectos sedantes asociados.
En relación con las enzimas del citocromo P450, el caproato de hidroxiprogesterona no tiene efecto sobre CYP1A, CYP2D6, CYP2C9 o CYP3A4, pero es un inductor modesto de CYP2C19.
Diferencias de la progesterona
Existen diferencias farmacodinámicas entre la progesterona y el caproato de hidroxiprogesterona que pueden tener implicaciones para el uso obstétrico. Entre ellas se incluyen las siguientes:
- Reducción de la actividad miometrial con progesterona in vitro pero sin efecto ni aumento de actividad miometrial con caproato de hidroxiprogesterona
- Prevención de la maduración cervical con progesterona pero efecto desconocido con caproato de hidroxiprogesterona
- Una tasa no significativamente mayor de mortandad y abortos con caproato de hidroxiprogesterona (en un estudio)
- Una incidencia posiblemente mayor de diabetes gestacional con caproato de hidroxiprogesterona (aumentado en dos estudios, sin diferencia en un estudio) pero sin tal efecto con progesterona
- Un riesgo significativamente mayor de efectos adversos perinatales tales como pérdida fetal y parto prematuro en múltiples gestaciones con caproato de hidroxiprogesterona (en dos estudios)
Las diferencias en el metabolismo de la progesterona y el caproato de hidroxiprogesterona y las diferencias en la formación y las actividades de los metabolitos pueden ser responsables o estar implicadas en estas diferencias biológicas y farmacológicas observadas. La progesterona es metabolizada por las 5α- y 5β-reductasas, las 3α- y 3β-hidroxiesteroide deshidrogenasas y las 20α- y 20β-hidroxiesteroide deshidrogenasas en varios tejidos. En los tejidos diana, en particular el cuello uterino y el miometrio, estas enzimas regulan las concentraciones locales de progesterona y pueden activar o inactivar la señalización de la progesterona. Además, estas enzimas catalizan la formación de metabolitos de la progesterona, como la 5β-dihidroprogesterona y la alopregnanolona, que envían señales a través de sus propios receptores no genómicos, como los receptores de progesterona de membrana y el receptor GABAA, y tienen sus propios efectos importantes en el embarazo. Como ejemplos, se ha descubierto que la 5β-dihidroprogesterona desempeña un papel importante en la supresión de la actividad miometrial, mientras que la alopregnanolona tiene potentes efectos sedantes y anestésicos en la madre y, especialmente, en el feto, y está implicada en el desarrollo del sistema nervioso fetal. A diferencia de la progesterona, el caproato de hidroxiprogesterona no es metabolizado por las enzimas tradicionales que transforman esteroides, sino que se metaboliza exclusivamente a través de la oxidación en la cadena lateral del caproato por las enzimas del citocromo P450. Por lo tanto, no se cree que tenga los mismos patrones de activación e inactivación específicos de tejido que la progesterona ni las mismas acciones no genómicas que poseen la progesterona y sus metabolitos.
Se espera que más investigaciones clínicas proporcionen datos adicionales que ayuden a aclarar la cuestión de la seguridad del caproato de hidroxiprogesterona. En cualquier caso, el Colegio Americano de Obstetras y Ginecólogos ha recomendado que las mujeres embarazadas tratadas con caproato de hidroxiprogesterona reciban asesoramiento sobre sus riesgos y beneficios.
Farmacocinética
| Parámetro | Singleton | Twin |
|---|---|---|
| Cmax (ng/mL) | 22.6 (15.8–27.4) | 17.3 (12 a 27) |
| Cmean(0-t) (ng/mL) | 16.8 (12.8–22.7) | 12.3 (8.4–18.7) |
| Ctrough (ng/mL) | (10 a 18.1) | 11.2 (4.8 a 16.3) |
| AUC0-t (ng/mL/día) | 117.3 (89.9 a 159.1) | 86.1 (59–131) |
| t1/2 (días) | 16.2 (10,6–21.0) | 10 (6 a 16) |
| Tmax (días) | 1.0 (1–3) | 1.2 (1–2) |
| Vd/F (×103(L) | 56 (25.2–69.6) | 16.9 (9.1 a 24.5) |
| Cl/F (×103(L) | 2.1 (1.5–2.7) | 1.2 (0,9–1,7) |
| Notas al pie de página: a = OHPC 250 mg una vez por semana por inyección intramuscular. Fuentes: | ||
Absorción
En animales, la biodisponibilidad del caproato de hidroxiprogesterona con inyección intramuscular es cercana al 100%, pero su biodisponibilidad oral es muy baja, menos del 3%. En mujeres, 70 mg/día de caproato de hidroxiprogesterona oral tiene una potencia endometrial similar a 70 mg/día de OHPA oral y 2,5 mg/día de acetato de medroxiprogesterona oral, lo que indica que el caproato de hidroxiprogesterona oral y el OHPA tienen una potencia casi 30 veces menor que el acetato de medroxiprogesterona por vía oral. Sin embargo, los estudios sobre los cambios endometriales progestogénicos con caproato de hidroxiprogesterona oral en mujeres son mixtos: uno encontró efectos débiles con 100 mg/día, mientras que otro encontró que dosis de 250 a 1000 mg no produjeron efectos. Debido a su baja potencia oral, el caproato de hidroxiprogesterona no se ha utilizado por vía oral y, en su lugar, se ha administrado mediante inyección intramuscular. Sin embargo, se está desarrollando una nueva formulación oral de caproato de hidroxiprogesterona (nombre clave de desarrollo LPCN-1107) que ha demostrado ser eficaz, aunque requirió su administración dos veces al día en un estudio clínico.
Se produce un efecto de depósito cuando se inyecta caproato de hidroxiprogesterona por vía intramuscular o subcutánea, de modo que el medicamento tiene una duración de acción prolongada. Después de una única inyección intramuscular de 1000 mg de caproato de hidroxiprogesterona en cinco mujeres con cáncer de endometrio, los niveles máximos de caproato de hidroxiprogesterona fueron de 27,8 ± 5,3 ng/ml y el tiempo hasta alcanzar las concentraciones máximas fue de 4,6 ± 1,7 (3–7) días. Después de 13 semanas de administración continua de 1000 mg de caproato de hidroxiprogesterona por semana, los niveles mínimos de caproato de hidroxiprogesterona fueron de 60,0 ± 14 ng/ml. También se han estudiado los parámetros farmacocinéticos de 250 mg de caproato de hidroxiprogesterona una vez por semana mediante inyección intramuscular en mujeres embarazadas con gestación única y múltiple (gemelos y trillizos). Los niveles de estado estacionario del medicamento se alcanzan entre 4 y 12 semanas después de la administración en mujeres embarazadas. También se ha estudiado la duración del efecto biológico clínico del caproato de hidroxiprogesterona por inyección intramuscular en mujeres. Se ha descubierto que una única inyección intramuscular de 65 a 500 mg de caproato de hidroxiprogesterona en solución oleosa tiene una duración de acción de 5 a 21 días en términos de efecto en el útero y en la temperatura corporal en mujeres.
Se ha descubierto que el caproato de hidroxiprogesterona posee una farmacocinética similar, incluidos los niveles máximos, el tiempo hasta alcanzar los niveles máximos, los niveles del área bajo la curva (es decir, la exposición total) y la semivida de eliminación, con la administración por inyección intramuscular o autoinyección subcutánea. Sin embargo, hubo una mayor incidencia de dolor en el lugar de la inyección con la autoinyección subcutánea que con la inyección intramuscular (37,3 % frente a 8,2 %).
Distribución
El caproato de hidroxiprogesterona se une ampliamente a las proteínas plasmáticas, entre las que se encuentra la albúmina. A diferencia de la progesterona y la 17α-hidroxiprogesterona, el caproato de hidroxiprogesterona tiene una afinidad muy baja por la globulina transportadora de corticosteroides (menos del 0,01% de la del cortisol). La progesterona y la 17α-hidroxiprogesterona tienen una afinidad baja por la globulina transportadora de hormonas sexuales y, por esta razón, solo una fracción muy pequeña de ellas (menos del 0,5%) se une a esta proteína en la circulación.
Metabolismo
El caproato de hidroxiprogesterona parece ser metabolizado principalmente por las enzimas CYP3A4 y CYP3A5 del citocromo P450. También puede ser metabolizado por CYP3A7 en el hígado fetal y la placenta. A diferencia de la progesterona, el caproato de hidroxiprogesterona no es metabolizado por las enzimas tradicionales que transforman esteroides y no forma metabolitos similares. El metabolismo del caproato de hidroxiprogesterona se realiza por reducción, hidroxilación y conjugación, incluyendo glucuronidación, sulfatación y acetilación. El éster de caproato de hidroxiprogesterona no se escinde durante el metabolismo, por lo que la 17α-hidroxiprogesterona no se forma a partir del caproato de hidroxiprogesterona. Como tal, el caproato de hidroxiprogesterona no es un profármaco de la 17α-hidroxiprogesterona ni de la progesterona.
Se ha descubierto que el caproato de hidroxiprogesterona tiene una semivida de eliminación de 7,8 días cuando se administra por inyección intramuscular en una formulación a base de aceite a mujeres no embarazadas. Se dice que su duración total es de 10 a 14 días, que es mucho más larga que la duración de la progesterona administrada por vía intramuscular en una formulación a base de aceite (2 a 3 días). En las mujeres embarazadas, la semivida de eliminación del caproato de hidroxiprogesterona parece ser más larga, alrededor de 16 o 17 días. Sin embargo, en mujeres embarazadas de gemelos en lugar de un embarazo único, se descubrió que la semivida de eliminación del caproato de hidroxiprogesterona era más corta que esto, a 10 días. Se ha detectado caproato de hidroxiprogesterona en mujeres embarazadas hasta 44 días después de la última dosis.
Eliminación
El caproato de hidroxiprogesterona se elimina en un 50% en las heces y en un 30% en la orina cuando se administra por inyección intramuscular a mujeres embarazadas. Tanto el esteroide libre como los conjugados se excretan por estas vías, siendo los conjugados los que se excretan en mayor proporción en las heces.
Curvas de concentración del tiempo
- Los niveles de OHPC después de una sola inyección intramuscular de 1.000 mg OHPC en cinco mujeres con cáncer de endometrio.
- Los niveles de OHPC durante un mes después de una dosis final después de la terapia continua con 250 mg por semana OHPC por inyección intramuscular en mujeres embarazadas con gestación de un solotón.
Química
El caproato de hidroxiprogesterona, también conocido como caproato de 17α-hidroxiprogesterona o como 17α-hidroxipregn-4-eno-3,20-diona 17α-hexanoato, es un esteroide sintético de pregnano y un derivado de la progesterona. Es específicamente un derivado de la 17α-hidroxiprogesterona con un éster de hexanoato (caproato) en la posición C17α. Los análogos del caproato de hidroxiprogesterona incluyen otros derivados de la 17α-hidroxiprogesterona, como el acetofenuro de algestona (acetofenuro de dihidroxiprogesterona), el acetato de clormadinona, el acetato de ciproterona, el acetato de hidroxiprogesterona, el heptanoato de hidroxiprogesterona, el acetato de medroxiprogesterona y el acetato de megestrol, así como los ésteres de caproato caproato de clormadinona, caproato de gestonorona (caproato de norhidroxiprogesterona), caproato de medroxiprogesterona, caproato de megestrol y caproato de metenmadinona.
Síntesis
Se han descrito las síntesis químicas del caproato de hidroxiprogesterona.
Historia
Junto con el acetato de hidroxiprogesterona, el caproato de hidroxiprogesterona fue desarrollado por Karl Junkmann de Schering AG en 1953 y fue reportado por primera vez por él en la literatura médica en 1954. Se dice que fue comercializado por primera vez en Japón en 1954 o 1955, y posteriormente fue introducido como Delalutin en los Estados Unidos en 1956. Debido a su duración mucho más larga que la progesterona parenteral, el caproato de hidroxiprogesterona había reemplazado en gran medida a la progesterona en la práctica clínica en 1975. Después de décadas de uso, Squibb, el fabricante, retiró voluntariamente el producto Delalutin en los Estados Unidos en 1999. El renovado interés en el caproato de hidroxiprogesterona en los Estados Unidos fue provocado con un gran estudio patrocinado por los NIH en 2003 que encontró que el caproato de hidroxiprogesterona reducía el riesgo de parto prematuro en mujeres embarazadas seleccionadas en riesgo. En febrero de 2011, la FDA aprobó el medicamento Makena, patrocinado por KV Pharmaceutical, como medicamento huérfano, dado que los datos de seguimiento no mostraron evidencia de efectos nocivos para la descendencia, para reducir el riesgo de parto prematuro en mujeres con un solo feto antes de las 37 semanas de gestación que habían tenido al menos un parto prematuro previo.
En virtud de los Programas de Aprobación Acelerada de la FDA, los medicamentos que cubren una necesidad no satisfecha en el caso de enfermedades graves pueden aprobarse en función de un criterio de valoración sustituto. La empresa farmacéutica debe realizar estudios confirmatorios para demostrar que el medicamento proporciona un beneficio clínico. El ensayo confirmatorio, el estudio PROLONG, se completó en 2019 y no mostró ningún beneficio en la prevención del parto prematuro. La FDA propuso retirar la aprobación de Makena en 2020.
Sociedad y cultura
Nombres
El caproato de hidroxiprogesterona es el nombre genérico de OHPC y su DCI, USAN, BANM y JAN, mientras que el hexanoato de hidroxiprogesterona era su antiguo BANM.
El caproato de hidroxiprogesterona suele etiquetarse erróneamente como progesterona y 17α-hidroxiprogesterona y confundirse con ellas. Tampoco debe confundirse con acetato de hidroxiprogesterona, heptanoato de hidroxiprogesterona o acetato de medroxiprogesterona.
El caproato de hidroxiprogesterona se comercializa en todo el mundo bajo una variedad de marcas comerciales, entre las que se incluyen Proluton, Proluton Depot y Makena, entre muchas otras. También se comercializaba anteriormente bajo marcas comerciales como Delalutin, Prodrox y Hylutin, entre otras, pero estas formulaciones se han descontinuado. Se ha comercializado bajo las marcas comerciales Gravibinon e Injectable No. 1 (o Chinese Injectable No. 1) en combinación con valerato de estradiol y bajo la marca comercial Primosiston en combinación con benzoato de estradiol.
Disponibilidad
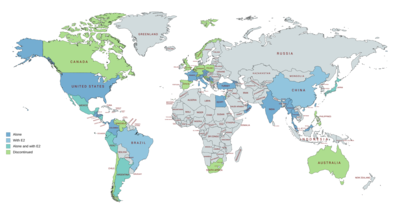
El caproato de hidroxiprogesterona se comercializa en los Estados Unidos y en toda Europa, Asia, América Central y del Sur. No está disponible en Canadá, el Reino Unido, Nueva Zelanda o Sudáfrica, y solo se comercializan formulaciones veterinarias en Australia. El caproato de hidroxiprogesterona también se comercializa en combinación con valerato de estradiol como anticonceptivo inyectable combinado en varios países, incluidos Sudamérica, México, Japón y China. También se ha comercializado como preparación inyectable en combinación con benzoato de estradiol en algunos países.
Economía
Con la designación del caproato de hidroxiprogesterona como medicamento huérfano por parte de la FDA y la aprobación de Makena en 2011, el precio del caproato de hidroxiprogesterona en los Estados Unidos iba a aumentar de US$15 a US$1.500 para una dosis única, o de aproximadamente US$300 a entre US$25.000 y US$30.000 para un único mes de tratamiento típico. Esto supuso un aumento de alrededor de 100 veces en el coste, con un "beneficio clínico mínimo adicional", y fue una estrategia de fijación de precios muy criticada. Posteriormente, la FDA anunció que las farmacias que preparan preparados podrían seguir vendiendo caproato de hidroxiprogesterona a su costo habitual de aproximadamente US$10 a US$20 por dosis sin temor a que la agencia tomara medidas coercitivas. KV Pharmaceutical también optó por reducir el precio de Makena a US$690 por dosis. El caproato de hidroxiprogesterona siguió estando disponible a bajo costo en las farmacias que preparan preparados hasta fines de 2016, momento en el que la FDA publicó nuevos documentos de orientación que prohibían a las farmacias que preparan preparados vender productos que sean "esencialmente copias" de productos farmacéuticos disponibles comercialmente.
Research
En un estudio preliminar, se determinó que la terapia cíclica con 150 mg de caproato de hidroxiprogesterona por inyección intramuscular era eficaz en el tratamiento de 76 mujeres con acné persistente y refractario al tratamiento; el 84 % respondió a la terapia y experimentó una mejoría "buena a excelente" de los síntomas.
Schering estudió el caproato de hidroxiprogesterona para su uso como anticonceptivo inyectable con solo progestágeno en dosis de 250 a 500 mg una vez al mes por inyección intramuscular, pero produjo un control deficiente del ciclo con estas dosis y nunca se comercializó.
Se ha comprobado que el caproato de hidroxiprogesterona por sí solo tiene poca o ninguna eficacia en el tratamiento del cáncer de mama en mujeres. Por el contrario, se ha comprobado que la combinación de valerato de estradiol y caproato de hidroxiprogesterona es eficaz en el tratamiento del cáncer de mama en mujeres. Las investigaciones iniciales basadas en datos clínicos limitados indicaron que la tasa de respuesta al cáncer de mama con una combinación de valerato de estradiol y caproato de hidroxiprogesterona parecía ser mayor que con un estrógeno solo (35% frente a 50%). Sin embargo, investigaciones posteriores que utilizaron el caproato de gestonorona, un progestágeno relacionado pero más potente, descubrieron que la combinación de valerato de estradiol y caproato de gestonorona tenía una eficacia que no era significativamente diferente de la de un estrógeno solo en el tratamiento del cáncer de mama en mujeres.
Usos veterinarios
Se ha estudiado la farmacocinética del caproato de hidroxiprogesterona en diversos ungulados, incluidos el ganado vacuno, los búfalos, las ovejas y las cabras.
Referencias
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y Deeks ED (October 2011). "17 α-Hydroxyprogesterone caproate (Makena): in the prevention of preterm birth". Paediatric Drugs. 13 (5): 337–45. doi:10.2165/11208140-000000000-00000. PMID 21888448. S2CID 207297651.
- ^ a b c d Krop J, Kramer WG (December 2017). "Comparative Bioavailability of Hydroxyprogesterone Caproate Administered via Intramuscular Injection or Subcutaneous Autoinjector in Healthy Postmenopausal Women: A Randomized, Parallel Group, Open-label Study". Clinical Therapeutics. 39 (12): 2345–2354. doi:10.1016/j.clinthera.2017.10.020. PMID 29191450.
- ^ a b c d e f g h i j k l "Makena- hydroxyprogesterone caproate injection". DailyMed. 19 December 2022. Archived from the original on 13 March 2023. Retrieved 13 March 2023.
- ^ a b c d e Shaik IH, Bastian JR, Zhao Y, Caritis SN, Venkataramanan R (2015). "Route of administration and formulation dependent pharmacokinetics of 17-hydroxyprogesterone caproate in rats". Xenobiotica; the Fate of Foreign Compounds in Biological Systems. 46 (2): 169–74. doi:10.3109/00498254.2015.1057547. PMC 4809632. PMID 26153441.
- ^ a b Mickelson KE, Forsthoefel J, Westphal U (October 1981). "Steroid-protein interactions. Human corticosteroid binding globulin: some physicochemical properties and binding specificity". Biochemistry. 20 (21): 6211–8. doi:10.1021/bi00524a047. PMID 7306509.
- ^ a b Dunn JF, Nisula BC, Rodbard D (July 1981). "Transport of steroid hormones: binding of 21 endogenous steroids to both testosterone-binding globulin and corticosteroid-binding globulin in human plasma". The Journal of Clinical Endocrinology and Metabolism. 53 (1): 58–68. doi:10.1210/jcem-53-1-58. PMID 7195404.
- ^ a b c d e f g h i Onsrud M, Paus E, Haug E, Kjørstad K (1985). "Intramuscular administration of hydroxyprogesterone caproate in patients with endometrial carcinoma. Pharmacokinetics and effects on adrenal function". Acta Obstetricia et Gynecologica Scandinavica. 64 (6): 519–23. doi:10.3109/00016348509156732. PMID 2932883. S2CID 12007439.
- ^ a b c d e Hines M, Lyseng-Williamson KA, Deeks ED (March 2013). "17 α-hydroxyprogesterone caproate (Makena): a guide to its use in the prevention of preterm birth". Clinical Drug Investigation. 33 (3): 223–7. doi:10.1007/s40261-013-0060-6. PMID 23413110. S2CID 23221264.
- ^ a b c d e f g h i j k l m n Feghali M, Venkataramanan R, Caritis S (December 2014). "Prevention of preterm delivery with 17-hydroxyprogesterone caproate: pharmacologic considerations". Seminars in Perinatology. 38 (8): 516–22. doi:10.1053/j.semperi.2014.08.013. PMC 4253874. PMID 25256193.
- ^ a b "FDA Commissioner and Chief Scientist Announce Decision to Withdraw Approval of Makena". U.S. Food and Drug Administration (Press release). 6 April 2023. Archived from the original on 6 April 2023. Retrieved 7 April 2023.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain.
- ^ Jewett C (8 March 2023). "Preterm Birth Drug Withdrawn After 12 Years". The New York Times. Archived from the original on 10 March 2023. Retrieved 10 March 2023.
- ^ Dillinger K (8 March 2023). "Maker of preterm birth drug Makena to withdraw it from market". CNN. Archived from the original on 10 March 2023. Retrieved 10 March 2023.
- ^ "Covis Pharma Responds to Presiding Officer's Report Summarizing FDA Advisory Committee Hearing" (Press release). Covis Pharma. 7 March 2023. Archived from the original on 13 March 2023. Retrieved 13 March 2023 – via GlobeNewswire.
- ^ "Hydroxyprogesterone caproate medicines to be suspended from the EU market". European Medicines Agency (EMA). 17 May 2024. Retrieved 18 May 2024. Text was copied from this source which is copyright European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ^ Manuck TA (December 2017). "17-alpha hydroxyprogesterone caproate for preterm birth prevention: Where have we been, how did we get here, and where are we going?". Seminars in Perinatology. 41 (8): 461–467. doi:10.1053/j.semperi.2017.08.004. PMID 28947068. S2CID 36945947. Archived from the original on 12 December 2020. Retrieved 2 November 2021.
- ^ a b Newton JR, D'arcangues C, Hall PE (1994). "A review of "once-a-month" combined injectable contraceptives". Journal of Obstetrics and Gynaecology. 4 (Suppl 1): S1-34. doi:10.3109/01443619409027641. PMID 12290848.
- ^ a b c d e f g h Romero R, Stanczyk FZ (June 2013). "Progesterone is not the same as 17α-hydroxyprogesterone caproate: implications for obstetrical practice". American Journal of Obstetrics and Gynecology. 208 (6): 421–6. doi:10.1016/j.ajog.2013.04.027. PMC 4120746. PMID 23643669.
- ^ a b Horsky J, Presl J (6 December 2012). Ovarian Function and its Disorders: Diagnosis and Therapy. Springer Science & Business Media. pp. 95–. ISBN 978-94-009-8195-9. Archived from the original on 8 March 2023. Retrieved 16 September 2018.
- ^ a b c Dorfman RI (5 December 2016). Steroidal Activity in Experimental Animals and Man. Elsevier Science. pp. 398–. ISBN 978-1-4832-7299-3. Archived from the original on 8 March 2023. Retrieved 2 February 2018.
Intramuscular administration of 17α-hydroxyprogesterone caproate produced signs and symptoms of adrenal insufficiency in Addisonians maintained on cortisol and 9α-fluorocortisol (Melby, 1961) and thereby showed properties similar to progesterone and 17α-hydroxyprogesterone. However, further tests will be required to eludicate its pharmacodynamics properties. Contrastingly, there was no evidence for salt dissipation with the test of a smaller dose of the steroid to normal subjects (Landau et al., 1958).
- ^ a b c Sammour MB, El-Kabarity H, Khalifa AS (1975). "Progesterone therapy in pre-eclamptic toxaemia". Acta Obstetricia et Gynecologica Scandinavica. 54 (3): 195–202. doi:10.3109/00016347509157760. PMID 1163210. S2CID 38002155.
Melby (14) found that when progesterone was administered to patients suffering from the syndrome of idiopathic oedema, they experienced a diuresis, with a high excretion of sodium and water within 24 hours after a single injection of 500 mg of 17-α-hydroxyprogesterone caproate.
- ^ a b c d Geller J, Bora R, Roberts T, Newman H, Lin A, Silva R (July 1965). "Treatment of benign prostatic hypertrophy with hydroxyprogesterone caproate: effect on clinical symptoms, morphology, and endocrine function". JAMA. 193 (2): 121–8. doi:10.1001/jama.1965.03090020035009. PMID 14304354.
- ^ a b c d e f Meis PJ (May 2005). "17 hydroxyprogesterone for the prevention of preterm delivery". Obstetrics and Gynecology. 105 (5 Pt 1): 1128–35. doi:10.1097/01.AOG.0000160432.95395.8f. PMID 15863556.
- ^ a b c d e f g h i j k l m n o Byrns MC (January 2014). "Regulation of progesterone signaling during pregnancy: implications for the use of progestins for the prevention of preterm birth". The Journal of Steroid Biochemistry and Molecular Biology. 139: 173–81. doi:10.1016/j.jsbmb.2013.01.015. PMID 23410596. S2CID 23414730.
- ^ a b International Agency for Research on Cancer (1979). Sex Hormones (II). International Agency for Research on Cancer. p. 401. ISBN 978-92-832-1221-8.
17α-Hydroxyprogesterone caproate was first marketed commercially in Japan in 1954-1955.
- ^ a b c d e f g h i j Index Nominum 2000: International Drug Directory. Taylor & Francis. January 2000. pp. 532–. ISBN 978-3-88763-075-1.
- ^ a b Kim S. "The Orphan Drug Act: How the FDA Unlawfully Usurped Market Exclusivity". Northwestern Journal of Technology and Intellectual Property. 11. Heinonline: [, v]. Archived from the original on 8 March 2023. Retrieved 18 July 2016.
- ^ a b c d e f Armstrong J (May 2011). "Unintended consequences--the cost of preventing preterm births after FDA approval of a branded version of 17OHP". The New England Journal of Medicine. 364 (18): 1689–91. doi:10.1056/NEJMp1102796. PMID 21410391.
- ^ SMFM Clinical Guideline: Progesterone and preterm birth prevention: translating clinical trials data into clinical practice, AJOG May 2012
- ^ a b c d Meis PJ, Klebanoff M, Thom E, Dombrowski MP, Sibai B, Moawad AH, et al. (June 2003). "Prevention of recurrent preterm delivery by 17 alpha-hydroxyprogesterone caproate". The New England Journal of Medicine. 348 (24): 2379–85. doi:10.1056/NEJMoa035140. PMID 12802023.
- ^ Keirse MJ (September 2004). "Progesterone and preterm: seventy years of "déjà vu" or "still to be seen"?". Birth. 31 (3): 230–5. doi:10.1111/j.0730-7659.2004.00315.x. PMID 15330887.
- ^ Johnson JW, Austin KL, Jones GS, Davis GH, King TM (October 1975). "Efficacy of 17alpha-hydroxyprogesterone caproate in the prevention of premature labor". The New England Journal of Medicine. 293 (14): 675–80. doi:10.1056/nejm197510022931401. PMID 1099445.
- ^ Yemini M, Borenstein R, Dreazen E, Apelman Z, Mogilner BM, Kessler I, et al. (March 1985). "Prevention of premature labor by 17 alpha-hydroxyprogesterone caproate". American Journal of Obstetrics and Gynecology. 151 (5): 574–7. doi:10.1016/0002-9378(85)90141-3. PMID 3976757.
- ^ Northen AT, Norman GS, Anderson K, Moseley L, Divito M, Cotroneo M, et al. (October 2007). "Follow-up of children exposed in utero to 17 alpha-hydroxyprogesterone caproate compared with placebo". Obstetrics and Gynecology. 110 (4): 865–72. doi:10.1097/01.AOG.0000281348.51499.bc. PMID 17906021. S2CID 29485152.
- ^ "Advisory Committees: CDER 2006 Meeting Documents". Food and Drug Administration. Archived from the original on 8 May 2017. Retrieved 16 December 2019.
- ^ Hendrickx AG, Korte R, Leuschner F, Neumann BW, Poggel A, Binkerd P, et al. (February 1987). "Embryotoxicity of sex steroidal hormones in nonhuman primates: II. Hydroxyprogesterone caproate, estradiol valerate". Teratology. 35 (1): 129–36. doi:10.1002/tera.1420350116. PMID 3563931.
- ^ Duke University Medical Center, New England Journal of Medicine, correspondence, vol 349.
- ^ Hauth JC, Gilstrap LC, Brekken AL, Hauth JM (May 1983). "The effect of 17 alpha-hydroxyprogesterone caproate on pregnancy outcome in an active-duty military population". American Journal of Obstetrics and Gynecology. 146 (2): 187–90. doi:10.1016/0002-9378(83)91051-7. PMID 6682631.
- ^ Norman JE, Marlow N, Messow CM, Shennan A, Bennett PR, Thornton S, et al. (May 2016). "Vaginal progesterone prophylaxis for preterm birth (the OPPTIMUM study): a multicentre, randomised, double-blind trial". Lancet. 387 (10033): 2106–2116. doi:10.1016/S0140-6736(16)00350-0. PMC 5406617. PMID 26921136.
- ^ "BMJ Blogs: The BMJ » Blog Archive » Richard Lehman's journal review—23 May 2016". blogs.bmj.com. 23 May 2016. Archived from the original on 26 May 2016. Retrieved 25 May 2016.
- ^ Dodd JM, Grivell RM, OBrien CM, Dowswell T, Deussen AR (November 2019). "Prenatal administration of progestogens for preventing spontaneous preterm birth in women with a multiple pregnancy". The Cochrane Database of Systematic Reviews. 2019 (11). doi:10.1002/14651858.CD012024.pub3. PMC 6864412. PMID 31745984.
- ^ Reifenstein EC (March 1971). "Hydroxyprogesterone caproate therapy in advanced endometrial cancer". Cancer. 27 (3): 485–502. doi:10.1002/1097-0142(197103)27:3<485::AID-CNCR2820270302>3.0.CO;2-1. PMID 5549492. S2CID 37473914.
- ^ a b c d e f "Hydroxyprogesterone". Archived from the original on 29 July 2017. Retrieved 29 July 2017.
- ^ Shoupe D, Mishell DR (1987). "Therapeutic Regimens". In Mishell DR (ed.). Menopause: Physiology and Pharmacology. Year Book Medical. pp. 335–351. ISBN 9780815159148. Archived from the original on 8 March 2023. Retrieved 3 December 2019.
- ^ Agostini R, Casini ML, Costabile L, Paragona M, Marzano F, Unfer V (November 2005). "Efficacy and safety of 17alpha-hydroxyprogesterone caproate in hormone replacement therapy". Gynecological Endocrinology. 21 (5): 265–267. doi:10.1080/09513590500368650. PMID 16373245. S2CID 71508663.
- ^ a b c Benign Prostatic Hypertrophy. Springer Science & Business Media. 6 December 2012. pp. 266–. ISBN 978-1-4612-5476-8. Archived from the original on 11 January 2023. Retrieved 3 October 2016.
- ^ a b Ablin RJ, Mason MD (5 September 2007). Metastasis of Prostate Cancer. Springer Science & Business Media. pp. 286–. ISBN 978-1-4020-5847-9. Archived from the original on 8 March 2023. Retrieved 23 December 2018.
- ^ Smith PH (29 June 2013). Cancer of the Prostate and Kidney. Springer Science & Business Media. pp. 309, 339. ISBN 978-1-4684-4349-3. Archived from the original on 8 March 2023. Retrieved 23 December 2018.
- ^ a b Hafez ES, Spring-Mills E (6 December 2012). Prostatic Carcinoma: Biology and Diagnosis. Springer Science & Business Media. pp. 128–. ISBN 978-94-009-8887-3. Archived from the original on 8 March 2023. Retrieved 23 December 2018.
- ^ a b c Castro JE (9 March 2013). The Treatment of Prostatic Hypertrophy and Neoplasia. Springer Science & Business Media. pp. 39, 132. ISBN 978-94-015-7190-6.
Geller has also demonstrated significant decreases in plasma or urine testosterone glucuronide levels following the administration of three other anti-androgens. These include Delalutin [hydroxyprogesterone caproate], chlormadinone acetate, and PH-218. It would appear that decreased androgen production is a property shared by all anti-androgens to date.
- ^ Aronson JK (21 February 2009). Meyler's Side Effects of Endocrine and Metabolic Drugs. Elsevier. pp. 289–. ISBN 978-0-08-093292-7. Archived from the original on 8 March 2023. Retrieved 3 October 2016.
- ^ Israel GE, Tarver DE, Shaffer JD (1 March 2001). Transgender Care: Recommended Guidelines, Practical Information, and Personal Accounts. Temple University Press. pp. 58–. ISBN 978-1-56639-852-7. Archived from the original on 8 March 2023. Retrieved 3 October 2016.
- ^ Ekins R, King D (23 October 2006). The Transgender Phenomenon. SAGE Publications. pp. 48–. ISBN 978-1-84787-726-0. Archived from the original on 8 March 2023. Retrieved 3 October 2016.
- ^ Adler RK, Hirsch S, Mordaunt M (1 May 2012). Voice and Communication Therapy for The Transgender/Transsexual Client: A Comprehensive Clinical Guide. Plural Publishing. pp. 486–. ISBN 978-1-59756-631-5.
- ^ Masumori N (May 2012). "Status of sex reassignment surgery for gender identity disorder in Japan". International Journal of Urology. 19 (5): 402–414. doi:10.1111/j.1442-2042.2012.02975.x. PMID 22372595. S2CID 38888396.
- ^ Chekir C, Emi Y, Arai F, Kikuchi Y, Sasaki A, Matsuda M, et al. (June 2012). "Altered arterial stiffness in male-to-female transsexuals undergoing hormonal treatment". The Journal of Obstetrics and Gynaecology Research. 38 (6): 932–940. doi:10.1111/j.1447-0756.2011.01815.x. PMID 22487218. S2CID 39877004. Archived from the original on 8 March 2023. Retrieved 18 August 2019.
- ^ a b Becker KL (2001). Principles and Practice of Endocrinology and Metabolism. Lippincott Williams & Wilkins. pp. 757–759, 2168. ISBN 978-0-7817-1750-2. Archived from the original on 8 March 2023. Retrieved 2 February 2018.
- ^ Nema S, Ludwig JD (19 April 2016). Pharmaceutical Dosage Forms - Parenteral Medications, Third Edition: Volume 1: Formulation and Packaging. CRC Press. pp. 161–. ISBN 978-1-4200-8644-7. Archived from the original on 8 March 2023. Retrieved 15 September 2018.
- ^ a b Muller NF, Dessing RP (19 June 1998). European Drug Index: European Drug Registrations (Fourth ed.). CRC Press. pp. 561–. ISBN 978-3-7692-2114-5. Archived from the original on 8 March 2023. Retrieved 15 September 2018.
- ^ a b Garza-Flores J (April 1994). "Pharmacokinetics of once-a-month injectable contraceptives". Contraception. 49 (4): 347–59. doi:10.1016/0010-7824(94)90032-9. PMID 8013219.
- ^ a b c d e f Sang GW (April 1994). "Pharmacodynamic effects of once-a-month combined injectable contraceptives". Contraception. 49 (4): 361–385. doi:10.1016/0010-7824(94)90033-7. PMID 8013220.
- ^ a b Bagade O, Pawar V, Patel R, Patel B, Awasarkar V, Diwate S (2014). "Increasing use of long-acting reversible contraception: safe, reliable, and cost-effective birth control" (PDF). World J Pharm Pharm Sci. 3 (10): 364–392. ISSN 2278-4357. Archived from the original (PDF) on 10 August 2017. Retrieved 15 September 2018.
- ^ a b c Leidenberger FA (17 April 2013). Klinische Endokrinologie für Frauenärzte. Springer-Verlag. pp. 533–. ISBN 978-3-662-08110-5. Archived from the original on 8 March 2023. Retrieved 15 September 2018.
- ^ a b c d e Knörr K, Beller FK, Lauritzen C (17 April 2013). Lehrbuch der Gynäkologie. Springer-Verlag. pp. 214, 255. ISBN 978-3-662-00942-0. Archived from the original on 11 January 2023. Retrieved 15 September 2018.
- ^ a b c Kahr H (8 March 2013). Konservative Therapie der Frauenkrankheiten: Anzeigen, Grenzen und Methoden Einschliesslich der Rezeptur. Springer-Verlag. pp. 22–. ISBN 978-3-7091-5694-0. Archived from the original on 8 March 2023. Retrieved 15 September 2018.
- ^ a b c Kern W, Auterhoff H, Neuwald F, Schmid W (9 March 2013). Hagers Handbuch der Pharmazeutischen Praxis: Für Apotheker, Arzneimittelhersteller, Drogisten, Ärzte und Medizinalbeamte. Springer-Verlag. pp. 1163–. ISBN 978-3-642-49759-9. Archived from the original on 8 March 2023. Retrieved 15 September 2018.
- ^ a b c d e f g h Ufer J (1968). "Die therapeutische Anwendung der Gestagene beim Menschen" [Therapeutic Use of Progestogens in Humans]. Die Gestagene [Progestogens]. Handbuch der experimentellen Pharmakologie / Handbook of Experimental Pharmacology. Springer-Verlag. pp. 1026–1124. doi:10.1007/978-3-642-99941-3_7. ISBN 978-3-642-99941-3. Archived from the original on 8 March 2023. Retrieved 15 September 2018.
Depotinjektionen [...] 2. Einmalige Injektion von 125mg oder 250mg 17α-Hydroxyprogesteroncapronat als Depotgestagen und 10 mg Oestradiolbenzoat in öliger Lösung (Primosiston) [47, 81, 110, 563, 523, 571, 718, 721, 732, 733, 864, 872, 933, 973, 400].
- ^ "EP Hormone - Drugs.com". Archived from the original on 7 April 2019. Retrieved 1 June 2019.
- ^ Noguchi M, Tajiri K, Taniya T, Kumaki T, Ashikari A, Miyazaki I (1990). "Influence of hormones on proliferation of ER-positive cells and ER-negative cells of human breast cancer (MCF-7)". Oncology. 47 (1): 19–24. doi:10.1159/000226779. PMID 2137212.
After the transplantation, each mouse received an intramuscular injection of 0.1 ml EP Hormone Depot consisting of 1 mg/ml 17-β-estradiol dipropionate and 50 mg/ml hydroxyprogesterone caproate every week.
- ^ Tyler ET, Olson HJ (April 1959). "Fertility promoting and inhibiting effects of new steroid hormonal substances". J Am Med Assoc. 169 (16): 1843–54. doi:10.1001/jama.1959.03000330015003. PMID 13640942.
- ^ a b Hall NR (June 2011). "What agent should be used to prevent recurrent preterm birth: 17-P or natural progesterone?". Obstetrics and Gynecology Clinics of North America. 38 (2): 235–46, ix–x. doi:10.1016/j.ogc.2011.02.014. PMID 21575799.
- ^ a b Varga A, Henriksen E. Clinical and Histopathologic Evaluation of the Effect of 17-alpha-Hydroxyprogesterone-17-n-caproate on Endometrial Carcinoma. Obstetrics & Gynecology. December 1961. Volume 18. Issue 6. pp. 658-672.
- ^ Knörr K, Beller FK, Lauritzen C (17 April 2013). Lehrbuch der Gynäkologie. Springer-Verlag. pp. 214–. ISBN 978-3-662-00942-0.
- ^ Knörr K, Knörr-Gärtner H, Beller FK, Lauritzen C (8 March 2013). Geburtshilfe und Gynäkologie: Physiologie und Pathologie der Reproduktion. Springer-Verlag. pp. 583–. ISBN 978-3-642-95583-9.
- ^ Labhart A (6 December 2012). Clinical Endocrinology: Theory and Practice. Springer Science & Business Media. pp. 554–. ISBN 978-3-642-96158-8.
- ^ Horský J, Presl J (1981). "Hormonal Treatment of Disorders of the Menstrual Cycle". In Horsky J, Presl K (eds.). Ovarian Function and its Disorders: Diagnosis and Therapy. Springer Science & Business Media. pp. 309–332. doi:10.1007/978-94-009-8195-9_11. ISBN 978-94-009-8195-9.
- ^ Ufer J (1969). The Principles and Practice of Hormone Therapy in Gynaecology and Obstetrics. de Gruyter. p. 49. ISBN 9783110006148.
17α-Hydroxyprogesterone caproate is a depot progestogen which is entirely free of side actions. The dose required to induce secretory changes in primed endometrium is about 250 mg. per menstrual cycle.
- ^ Pschyrembel W (1968). Praktische Gynäkologie: für Studierende und Ärzte. Walter de Gruyter. pp. 598, 601. ISBN 978-3-11-150424-7.
- ^ Ferin J (September 1972). "Effects, Duration of Action and Metabolism in Man". In Tausk M (ed.). Pharmacology of the Endocrine System and Related Drugs: Progesterone, Progestational Drugs and Antifertility Agents. Vol. II. Pergamon Press. pp. 13–24. ISBN 978-0080168128. OCLC 278011135.
- ^ Henzl MR, Edwards JA (10 November 1999). "Pharmacology of Progestins: 17α-Hydroxyprogesterone Derivatives and Progestins of the First and Second Generation". In Sitruk-Ware R, Mishell DR (eds.). Progestins and Antiprogestins in Clinical Practice. Taylor & Francis. pp. 101–132. ISBN 978-0-8247-8291-7.
- ^ Brotherton J (1976). Sex Hormone Pharmacology. Academic Press. p. 114. ISBN 978-0-12-137250-7.
- ^ a b c Toppozada MK (April 1994). "Existing once-a-month combined injectable contraceptives". Contraception. 49 (4): 293–301. doi:10.1016/0010-7824(94)90029-9. PMID 8013216.
- ^ Goebelsmann U (1986). "Pharmacokinetics of Contraceptive Steroids in Humans". In Gregoire AT, Blye RP (eds.). Contraceptive Steroids: Pharmacology and Safety. Springer Science & Business Media. pp. 67–111. doi:10.1007/978-1-4613-2241-2_4. ISBN 978-1-4613-2241-2.
- ^ Becker H, Düsterberg B, Klosterhalfen H (1980). "[Bioavailability of cyproterone acetate after oral and intramuscular application in men (author's transl)]" [Bioavailability of Cyproterone Acetate after Oral and Intramuscular Application in Men]. Urologia Internationalis. 35 (6): 381–385. doi:10.1159/000280353. PMID 6452729.
- ^ Moltz L, Haase F, Schwartz U, Hammerstein J (May 1983). "[Treatment of virilized women with intramuscular administration of cyproterone acetate]" [Efficacy of Intra muscularly Applied Cyproterone Acetate in Hyperandrogenism]. Geburtshilfe und Frauenheilkunde. 43 (5): 281–287. doi:10.1055/s-2008-1036893. PMID 6223851.
- ^ Wright JC, Burgess DJ (29 January 2012). Long Acting Injections and Implants. Springer Science & Business Media. pp. 114–. ISBN 978-1-4614-0554-2.
- ^ Chu YH, Li Q, Zhao ZF (April 1986). "Pharmacokinetics of megestrol acetate in women receiving IM injection of estradiol-megestrol long-acting injectable contraceptive". The Chinese Journal of Clinical Pharmacology.
The results showed that after injection the concentration of plasma MA increased rapidly. The meantime of peak plasma MA level was 3rd day, there was a linear relationship between log of plasma MA concentration and time (day) after administration in all subjects, elimination phase half-life t1/2β = 14.35 ± 9.1 days.
- ^ Runnebaum BC, Rabe T, Kiesel L (6 December 2012). Female Contraception: Update and Trends. Springer Science & Business Media. pp. 429–. ISBN 978-3-642-73790-9.
- ^ Artini PG, Genazzani AR, Petraglia F (11 December 2001). Advances in Gynecological Endocrinology. CRC Press. pp. 105–. ISBN 978-1-84214-071-0.
- ^ King TL, Brucker MC, Kriebs JM, Fahey JO (21 October 2013). Varney's Midwifery. Jones & Bartlett Publishers. pp. 495–. ISBN 978-1-284-02542-2.
- ^ a b Kuhl H (August 2005). "Pharmacology of estrogens and progestogens: influence of different routes of administration" (PDF). Climacteric. 8 (Suppl 1): 3–63. doi:10.1080/13697130500148875. PMID 16112947. S2CID 24616324. Archived (PDF) from the original on 22 August 2016. Retrieved 25 March 2018.
- ^ a b Knörr K, Knörr-Gärtner H, Beller FK, Lauritzen C (8 March 2013). Geburtshilfe und Gynäkologie: Physiologie und Pathologie der Reproduktion. Springer-Verlag. pp. 583–. ISBN 978-3-642-95583-9. Archived from the original on 11 January 2023. Retrieved 29 March 2019.
- ^ Lauritzen C (September 1990). "Clinical use of oestrogens and progestogens". Maturitas. 12 (3): 199–214. doi:10.1016/0378-5122(90)90004-P. PMID 2215269.
- ^ a b Siegel I (June 1963). "Conception control by long-acting progestogens: preliminary report". Obstetrics and Gynecology. 21: 666–8. PMID 13992789. Archived from the original on 12 February 2020. Retrieved 12 February 2020.
- ^ Kistner RW (December 1960). "The use of progestational agents in obstetrics and gynecology". Clinical Obstetrics and Gynecology. 3 (4): 1047–67. doi:10.1097/00003081-196003040-00019. PMID 13756432.
50 mg of [medroxyprogesterone acetate], intramuscularly, is equivalent to 250 mg [hydroxyprogesterone caproate]
- ^ "Depo_Provera" (PDF). FDA. 2016. Archived (PDF) from the original on 29 July 2020. Retrieved 31 March 2018.
- ^ a b c d e f g h Attardi BJ, Zeleznik A, Simhan H, Chiao JP, Mattison DR, Caritis SN (December 2007). "Comparison of progesterone and glucocorticoid receptor binding and stimulation of gene expression by progesterone, 17-alpha hydroxyprogesterone caproate, and related progestins". American Journal of Obstetrics and Gynecology. 197 (6): 599.e1–7. doi:10.1016/j.ajog.2007.05.024. PMC 2278032. PMID 18060946.
- ^ Yang D, Zhu RL (April 1994). "[Changes in reproductive hormones levels in the treatment of endometrial precancerous lesion with hydroxyprogesterone caproate]". Zhonghua Fu Chan Ke Za Zhi (in Chinese). 29 (4): 205–6, 251. PMID 8082440.
In this paper, 14 cases of precancerous lesion of endometrium were treated with hydroxyprogesterone caproate and a series of hormone determination was analysed before and after treatment. Results showed that LH and LH/FSH were dramatically decreased. (LH P < 0.05, LH/FSH P < 0.01).
- ^ Benign Prostatic Hypertrophy. Springer Science & Business Media. 6 December 2012. pp. 266–. ISBN 978-1-4612-5476-8. Archived from the original on 11 January 2023. Retrieved 3 October 2016.
Since the initial report by Geller and associates28 on the use of hydroxyprogesterone caproate in the treatment of BPH, a variety of progestins have been studied in the medical management of this disease: hydroxyprogesterone caproate, chlormadinone acetate,27 and medrogestone (6-methyl-6-dehydro-17-methylprogesterone).50 These drugs should have a beneficial effect in BPH as they inhibit testicular function by suppressing serum LH and have no intrinsic estrogenic or androgenic activity.
- ^ Meiraz D, Margolin Y, Lev-Ran A, Lazebnik J (February 1977). "Treatment of benign prostatic hyperplasia with hydroxyprogesterone-caproate: placebo-controlled study". Urology. 9 (2): 144–8. doi:10.1016/0090-4295(77)90184-4. PMID 65818.
- ^ Geller J, Fruchtman B, Newman H, Roberts T, Silva R (February 1967). "Effect of progestational agents on carcinoma of the prostate". Cancer Chemother Rep. 51 (1): 41–6. PMID 6039663.
- ^ Karlstedt K (April 1971). "Progesterone treatment for local recurrence and metastases in carcinoma corporis uteri". Acta Radiologica. 10 (2): 187–92. doi:10.3109/02841867109129755. PMID 5556820.
The preparations used were Proluton Depot (17a-hydroxy-progesterone caproate) and in 3 patients SH 5132 (17a-hydroxy-19-norprogesterone caproate); 100 mg of the latter corresponds to 1000 mg of Proluton Depot.
- ^ a b Moe N (1972). "Short-term progestogen treatment of endometrial carcinoma. Histological, histochemical and hormonal studies". Acta Obstetricia et Gynecologica Scandinavica. 51 (1): 55–62. doi:10.3109/00016347209154968. PMID 4261828. S2CID 7181971.
- ^ a b c Sander S, Nissen-Meyer R, Aakvaag A (1978). "On gestagen treatment of advanced prostatic carcinoma". Scandinavian Journal of Urology and Nephrology. 12 (2): 119–21. doi:10.3109/00365597809179977. PMID 694436.
- ^ a b Kjeld JM, Puah CM, Kaufman B, Loizou S, Vlotides J, Gwee HM, et al. (November 1979). "Effects of norgestrel and ethinyloestradiol ingestion on serum levels of sex hormones and gonadotrophins in men". Clinical Endocrinology. 11 (5): 497–504. doi:10.1111/j.1365-2265.1979.tb03102.x. PMID 519881. S2CID 5836155.
Another synthetic gestogen, 17-hydroxy-19-norprogesterone caproate (Depostat-Schering), 400 mg by i.m. weekly injections suppressed T levels to 25% of pretreatment values (Sander er al., 1978).
- ^ Wein AJ, Kavoussi LR, Novick AC, Partin AW, Peters CA (25 August 2011). Campbell-Walsh Urology: Expert Consult Premium Edition: Enhanced Online Features and Print, 4-Volume Set. Elsevier Health Sciences. pp. 2938–. ISBN 978-1-4160-6911-9. Archived from the original on 11 January 2023. Retrieved 23 December 2018.
- ^ Knuth UA, Hano R, Nieschlag E (November 1984). "Effect of flutamide or cyproterone acetate on pituitary and testicular hormones in normal men". The Journal of Clinical Endocrinology and Metabolism. 59 (5): 963–9. doi:10.1210/jcem-59-5-963. PMID 6237116.
- ^ Jacobi GH, Altwein JE, Kurth KH, Basting R, Hohenfellner R (June 1980). "Treatment of advanced prostatic cancer with parenteral cyproterone acetate: a phase III randomised trial". British Journal of Urology. 52 (3): 208–15. doi:10.1111/j.1464-410x.1980.tb02961.x. PMID 7000222.
- ^ Sherman AI, Woolf RB (February 1959). "An endocrine basis for endometrial carcinoma". American Journal of Obstetrics and Gynecology. 77 (2): 233–42. doi:10.1016/0002-9378(59)90223-6. PMID 13617315.
- ^ Geer EB (1 December 2016). The Hypothalamic-Pituitary-Adrenal Axis in Health and Disease: Cushing's Syndrome and Beyond. Springer. pp. 28–. ISBN 978-3-319-45950-9. Archived from the original on 8 March 2023. Retrieved 2 February 2018.
- ^ Aschenbrenner DS, Venable SJ (2009). Drug Therapy in Nursing. Lippincott Williams & Wilkins. pp. 674–. ISBN 978-0-7817-6587-9. Archived from the original on 8 March 2023. Retrieved 2 February 2018.
- ^ Gerber AN, Masuno K, Diamond MI (March 2009). "Discovery of selective glucocorticoid receptor modulators by multiplexed reporter screening". Proceedings of the National Academy of Sciences of the United States of America. 106 (12): 4929–34. Bibcode:2009PNAS..106.4929G. doi:10.1073/pnas.0812308106. PMC 2660744. PMID 19255438.
- ^ a b Bardin CW, Brown T, Isomaa VV, Jänne OA (1983). "Progestins can mimic, inhibit and potentiate the actions of androgens". Pharmacology & Therapeutics. 23 (3): 443–59. doi:10.1016/0163-7258(83)90023-2. PMID 6371845.
- ^ a b c Crowley LG, Macdonald I (April 1965). "Delalutin and estrogens for the treatment of advanced mammary carcinoma in the postmenopausal woman". Cancer. 18 (4): 436–446. doi:10.1002/1097-0142(196504)18:4<436::AID-CNCR2820180407>3.0.CO;2-D. PMID 14278040. S2CID 31370289.
- ^ a b Anderson L, Martin W, Higgins C, Nelson SM, Norman JE (November 2009). "The effect of progesterone on myometrial contractility, potassium channels, and tocolytic efficacy". Reproductive Sciences. 16 (11): 1052–61. doi:10.1177/1933719109340926. PMID 19602723. S2CID 6856556.
- ^ Cupps PT (20 February 1991). Reproduction in Domestic Animals. Elsevier. pp. 101–. ISBN 978-0-08-057109-6.
- ^ a b Gellersen B, Fernandes MS, Brosens JJ (2009). "Non-genomic progesterone actions in female reproduction". Human Reproduction Update. 15 (1): 119–38. doi:10.1093/humupd/dmn044. PMID 18936037.
- ^ a b Schumacher M, Mattern C, Ghoumari A, Oudinet JP, Liere P, Labombarda F, et al. (February 2014). "Revisiting the roles of progesterone and allopregnanolone in the nervous system: resurgence of the progesterone receptors". Progress in Neurobiology. 113: 6–39. doi:10.1016/j.pneurobio.2013.09.004. hdl:11336/6678. PMID 24172649. S2CID 207407117.
- ^ Mellor DJ, Diesch TJ, Gunn AJ, Bennet L (November 2005). "The importance of 'awareness' for understanding fetal pain". Brain Research. Brain Research Reviews. 49 (3): 455–71. doi:10.1016/j.brainresrev.2005.01.006. PMID 16269314. S2CID 9833426.
- ^ Lagercrantz H, Changeux JP (March 2009). "The emergence of human consciousness: from fetal to neonatal life". Pediatric Research. 65 (3): 255–60. doi:10.1203/PDR.0b013e3181973b0d. PMID 19092726. S2CID 39391626. Archived from the original on 15 October 2021. Retrieved 18 August 2019.
[...] the fetus is sedated by the low oxygen tension of the fetal blood and the neurosteroid anesthetics pregnanolone and the sleep-inducing prostaglandin D2 provided by the placenta (36).
- ^ a b c Caritis SN, Sharma S, Venkataramanan R, Hankins GD, Miodovnik M, Hebert MF, et al. (November 2012). "Pharmacology and placental transport of 17-hydroxyprogesterone caproate in singleton gestation". American Journal of Obstetrics and Gynecology. 207 (5): 398.e1–8. doi:10.1016/j.ajog.2012.08.015. PMC 3586341. PMID 22967833.
- ^ a b Caritis SN, Sharma S, Venkataramanan R, Rouse DJ, Peaceman AM, Sciscione A, et al. (July 2011). "Pharmacokinetics of 17-hydroxyprogesterone caproate in multifetal gestation". American Journal of Obstetrics and Gynecology. 205 (1): 40.e1–8. doi:10.1016/j.ajog.2011.03.028. PMC 3165062. PMID 21620357.
- ^ Ferin J (September 1972). "Orally Active Progestational Compounds. Human Studies: Effects on the Utero-Vaginal Tract". In Tausk M (ed.). Pharmacology of the Endocrine System and Related Drugs: Progesterone, Progestational Drugs and Antifertility Agents. Vol. II. Pergamon Press. pp. 245–273. ISBN 978-0080168128. OCLC 278011135.
- ^ Boschann HW (July 1958). "Observations of the role of progestational agents in human gynecologic disorders and pregnancy complications". Ann. N. Y. Acad. Sci. 71 (5): 727–52. Bibcode:1958NYASA..71..727B. doi:10.1111/j.1749-6632.1958.tb46803.x. PMID 13583829.
- ^ Pots P (April 1957). "Die perorale wirksamkeit synthetischer gestagene" [The effectiveness of peroral synthetic gestagens]. Zentralbl Gynakol (in German). 79 (14): 529–39. PMID 13443471.
- ^ "Hydroxyprogesterone caproate oral - Lipocine - AdisInsight". Archived from the original on 1 November 2017. Retrieved 24 February 2019.
- ^ DelConte A, Chidambaram N, Nachaegari S, Patel M, Venkateshwaran S (January 2015). "770: Pharmacokinetics and tolerability of oral 17-hydroxyprogesterone caproate (HPC) relative to intramuscular (IM) HPC". American Journal of Obstetrics & Gynecology. 212 (1): S374. doi:10.1016/j.ajog.2014.10.976.
- ^ Boggess KA, Baker JB, Murtha AP, Peaceman AM, Shah DM, Siegfried SL, et al. (April 2018). "Pharmacokinetics of Hydroxyprogesterone Caproate and its Primary Metabolites during Pregnancy". AJP Reports. 8 (2): e106 – e112. doi:10.1055/s-0038-1639331. PMC 5951785. PMID 29765789.
- ^ a b "Highlight of Prescribing Information: MAKENATM (hydroxyprogesterone caproate injection) for intramuscular use" (PDF). U.S. Food and Drug Administration. February 2011. Archived from the original (PDF) on 27 February 2017.
- ^ a b Ferin J (September 1972). "Effects, Duration of Action and Metabolism in Man". In Tausk M (ed.). Pharmacology of the Endocrine System and Related Drugs: Progesterone, Progestational Drugs and Antifertility Agents. Vol. II. Pergamon Press. pp. 13–24. ISBN 978-0080168128. OCLC 278011135.
- ^ a b Baker KC (November 1958). "Treatment of persistent acne in women with 17 alpha hydroxyprogesterone caproate (delalutin); a preliminary report". The Journal of Investigative Dermatology. 31 (5): 247–50. doi:10.1038/jid.1958.114. PMID 13598928.
- ^ a b c d e f g Elks J (14 November 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. pp. 664–. ISBN 978-1-4757-2085-3.
- ^ Engel J, Kleemann A, Kutscher B, Reichert D (14 May 2014). Pharmaceutical Substances, 5th Edition, 2009: Syntheses, Patents and Applications of the most relevant APIs. Thieme. pp. 677–679. ISBN 978-3-13-179275-4. Archived from the original on 8 March 2023. Retrieved 6 September 2018.
- ^ William Andrew Publishing (22 October 2013). Pharmaceutical Manufacturing Encyclopedia. Elsevier. pp. 1865–1866. ISBN 978-0-8155-1856-3. Archived from the original on 8 March 2023. Retrieved 6 September 2018.
- ^ Junkmann K, Langecker H, Damrosch L (1968). "Chemie der Gestagene" [Chemistry of Progestogens]. Die Gestagene [Progestogens]. Handbuch der experimentellen Pharmakologie / Handbook of Experimental Pharmacology. Springer-Verlag. pp. 1–44. doi:10.1007/978-3-642-99941-3_1. ISBN 978-3-642-99941-3. Archived from the original on 8 March 2023. Retrieved 15 September 2018.
3. Hydroxyprogesteron-caproat. C27H4004, Mol.-Gew.: 428,62; chemische Bezeichnung Δ4-Pregnen-17α-ol-3,20-dion-17α-capronat, Trivialnamen: Hydroxyprogesteroncapronat, 17α-Hydroxyprogesteron-17α-capronat. Synthese: [88]. Darstellung: [88]. Eigenschaften: weißes kristallines Pulver (aus Isopropyläther) oder Methanol, F.: 119-122⁰, [α]D: +60⁰ (Chlf.) UV-Absorption: λmax.: 240 mμ, ε = 17000. Dipolmoment: [μ = 2,21 (Benzol). Leicht löslich in Äthanol, Äther, Essigester, Benzol, Chloroform, löslich in: Petroläther, unlöslich in Wasser. Bei 20⁰ lösen 100 ml Sesamöl ca. 4,0 g, Ricinusöl ca. 2,5 g, Ricinusöl: Benzylbenzoat (4: 6) ca. 26,5 g, Benzylbenzoat ca. 36,0 g. [...] Abb. 3. IR-Spektrum [126] und Formel des Hydroxyprogesteron-caproat.
- ^ Junkmann K (1954). "Über protrahiert wirksame Gestagene". Naunyn-Schmiedebergs Archiv für Experimentelle Pathologie und Pharmakologie. 223 (3). doi:10.1007/BF00246995. S2CID 33591186.
- ^ Wied GL, Davis ME (July 1958). "Comparative activity of progestational agents on the human endometrium and vaginal epithelium of surgical castrates". Annals of the New York Academy of Sciences. 71 (5): 599–616. Bibcode:1958NYASA..71..599W. doi:10.1111/j.1749-6632.1958.tb46791.x. PMID 13583817.
In the group of new parenteral progestational agents, three substances developed by Karl Junkmann1,2 are the most outstanding and interesting: 17a-hydroxyprogesterone caproate and 17a-hydroxyprogesterone acetate, introduced in 1953, and the most potent of all new parenteral progestational agents, 17-ethynyl-19-nortestosterone enanthate, introduced in 1956.
- ^ ACRH. U.S. Dept. of Energy. 1960. p. 71.
[The] minimal activity [of 17(a)-hydroxyprogesterone] is magnified to an unexpected degree by the esterification of this steroid with caproic acid to produce 17(a)-hydroxyprogesterone-17-n-caproate, first reported by Karl Junkmann in 1954.6,7
- ^ Dorfman RI (1966). Methods in Hormone Research. Academic Press. p. 86.
Junkmann (1954) reported that the acetate, butyrate, and caproate forms had both increased and prolonged activity, [...]
- ^ Applezweig N (1962). Steroid Drugs. Blakiston Division, McGraw-Hill. pp. 101–102.
Junkmann of Schering, AG., however, was able to show that long chain esters of 17a-hydroxyprogesterones such as the 17a-caproate produced powerful long-acting progestational effect. This compound is marketed in the United States as Delalutin by Squibb, and has been heavily used for the treatment of habitual abortion.
- ^ New and Nonofficial Drugs. Lippincott. 1958. p. 662.
Supplied by.—E. R. Squibb & Sons (Delalutin). Year of introduction: 1956.
- ^ Tausk M (1975). Pharmacology of hormones. Thieme. p. 105. ISBN 978-3-13-518901-7.
Progesterone itself is now almost never used for the management of any imminent threat to pregnancy. For oral therapy, it is in any event unsuitable and for injections, it has now been replaced by the long-acting esters of 17α-hydroxyprogesterone. The caproate (Proluton, Delalutin), a long-acting ester, is available in [...] Progesterone is rarely used therapeutically. It has largely been superseded by a long-acting ester of 17α-hydroxyprogesterone, for parenteral therapy.
- ^ "FDA press release regarding Makena approval". Food and Drug Administration. Archived from the original on 18 January 2017. Retrieved 16 December 2019.
- ^ "Accelerated Approval Program". Food and Drug Administration. 30 January 2023. Archived from the original on 13 March 2023. Retrieved 14 March 2023.
- ^ Blackwell, SC, et al. (January 2020). "17-OHPC to Prevent Recurrent Preterm Birth in Singleton Gestations (PROLONG Study): A Multicenter, International, Randomized Double-Blind Trial". American Journal of Perinatology. 37 (2): 127–136. doi:10.1055/s-0039-3400227. PMID 31652479. S2CID 204908640.
- ^ "CDER proposes withdrawal of approval for Makena". Food and Drug Administration. 5 October 2020. Archived from the original on 7 April 2023. Retrieved 14 March 2023.
- ^ O'Brien JM (September 2013). "Medication safety is still an issue in obstetrics 50 years after the Kefauver-Harris amendments: the case of progestogens". Ultrasound in Obstetrics & Gynecology. 42 (3): 247–53. doi:10.1002/uog.12456. PMID 23495199. S2CID 45600479.
- ^ a b c Sweetman SC, ed. (2009). "Sex hormones and their modulators". Martindale: The Complete Drug Reference (36th ed.). London: Pharmaceutical Press. pp. 2110–2111. ISBN 978-0-85369-840-1.
- ^ "Macleans.ca - Canada's national current affairs and news magazine since 1905". Archived from the original on 14 December 2011. Retrieved 30 March 2011.
- ^ "Price of preterm birth medicine cut". Boston.com. Associated Press. 2 April 2011. Archived from the original on 3 November 2012. Retrieved 2 April 2011.
- ^ "Compounded Drug Products That Are Essentially Copies of a Commercially Available Drug Product Under Section 503A of the Federal Food, Drug, and Cosmetic Act Guidance for Industry". U.S. Food and Drug Administration. 1 April 2019. Archived from the original on 19 June 2019. Retrieved 14 June 2019.
- ^ "FDA to Restrict Compounders from Making Copies of Commercially Available Drugs". RAPS.com. 7 July 2016. Archived from the original on 6 October 2019. Retrieved 14 June 2019.
- ^ Antibiotic Medicine and Clinical Therapy. 1959. p. 249.
- ^ Toppozada MK (1983). "Monthly Injectable Contraceptives". In Goldsmith A, Toppozada M (eds.). Long-Acting Contraception. pp. 93–103. OCLC 35018604. Archived from the original on 10 June 2022. Retrieved 27 December 2019.
- ^ Toppozada M (June 1977). "The clinical use of monthly injectable contraceptive preparations". Obstetrical & Gynecological Survey. 32 (6): 335–47. doi:10.1097/00006254-197706000-00001. PMID 865726.
- ^ Dao TL (1975). "Pharmacology and Clinical Utility of Hormones in Hormone Related Neoplasms". In Sartorelli AC, Johns DG (eds.). Antineoplastic and Immunosuppressive Agents. Handbuch der experimentellen Pharmakologie / Handbook of Experimental Pharmacology. Springer. pp. 170–192. doi:10.1007/978-3-642-65806-8_11. ISBN 978-3-642-65806-8. Archived from the original on 10 January 2023. Retrieved 31 May 2019.
- ^ Crowley LG, Macdonald I (1962). "Clinical trial of delautin in the treatment of advanced mammary carcinoma in postmenopausal women". Cancer. 15 (6): 1218–1220. doi:10.1002/1097-0142(196211/12)15:6<1218::AID-CNCR2820150619>3.0.CO;2-Y. PMID 14024037. S2CID 8005246.
- ^ Geller J, Volk H, Lewin M (October 1961). "Objective remission of metastatic breast carcinoma in a male who received 17-alpha hydroxy progesterone caproate (delalutin)". Cancer Chemotherapy Reports. 14: 77–81. PMID 13897631.
- ^ Crowley LG, MacDonald J (1966). "Delalutin und Östrogene als Behandlung des vorgeschrittenen Mammakarzinoms bei Frauen nach der Menopause" [Delalutin and estrogens as a treatment for advanced breast cancer in postmenopausal women]. Gynäkologisch-geburtshilfliche Rundschau. 3 (4): 271–272. doi:10.1159/000266855. ISSN 1018-8843.
- ^ Firusian N, Schietzel M (September 1976). "[Additive treatment of metastasizing breast cancer with special reference to postmenopausal age (results of a randomized study)]" [Additive treatment of metastasizing breast cancer with special reference to postmenopausal age (results of a randomized study)]. Strahlentherapie (in German). 152 (3): 235–247. PMID 968923.
- ^ Santhosh CR (2006). Pharmacokinetics of 17α-Hydroxy Progesterone Caproate in Cattle, Buffalo, Sheep and Goat (Ph.D. thesis). Karnataka Veterinary, Animal and Fisheries Sciences University, Bidar. Archived from the original on 15 December 2018.
Más lectura
- Meis PJ (mayo de 2005). "17 hidroxiprogesterona para la prevención de la entrega prematuro". Obstetricia y ginecología. 105 (5 Pt 1): 1128–35. doi:10.1097/01.AOG.0000160432.95395.8f. PMID 15863556.
- Facchinetti F, Vaccaro V (octubre de 2009). "El uso farmacológico de la progesterona y el caproato de 17-alfa-hidroxiprogesterona en la prevención de la entrega prematuro". Minerva Ginecologica. 61 5): 401 –9. PMID 19749671.
- Deeks ED (octubre de 2011). "17 α-Hydroxyprogesterone caproate (MakenaTM): en la prevención del nacimiento prematuro". Drogas pediátricas. 13 5): 337 –45. doi:10.2165/11208140-000000-00000. PMID 21888448. S2CID 207297651.
- Merlob P, Stahl B, Klinger G (enero de 2012). "17α caproato de hidroxiprogesterona para la prevención del nacimiento espontáneo recurrente". Reproductive Toxicology. 33 1): 15–9. Bibcode:2012RepTx..33...15M. doi:10.1016/j.reprotox.2011.10.017. PMID 22120850.
- O'Brien JM (octubre de 2012). "La seguridad de la progesterona y la administración de caproato de 17 hidroxiprogesterona para la prevención del nacimiento prematuro: una evaluación basada en pruebas". American Journal of Perinatology. 29 (9): 665 –72. doi:10.1055/s-0032-1316444. S2CID 20625020.
- Romero R, Stanczyk FZ (junio 2013). "La progesterona no es la misma que el caproato de 17α-hidroxiprogesterona: implicaciones para la práctica obstétrica". American Journal of Obstetrics and Gynecology. 208 (6): 421 –6. doi:10.1016/j.ajog.2013.04.027. PMC 4120746. PMID 23643669.
- Feghali M, Venkataramanan R, Caritis S (diciembre de 2014). "Prevención de entrega prematuro con caproato de 17 hidroxiprogesterona: consideraciones farmacológicas". Seminarios en Perinatología. 38 (8): 516 –22. doi:10.1053/j.semperi.2014.08.013. PMC 4253874. PMID 25256193.
- Saccone G, Suhag A, Berghella V (julio de 2015). "17-alpha-hidroxyprogesterone caproate for maintenance tocolysis: a systematic review and metaanalysis of randomized trials". American Journal of Obstetrics and Gynecology. 213 1): 16 –22. doi:10.1016/j.ajog.2015.01.054. PMID 25659469.
- O'Brien JM, Lewis DF (enero 2016). "Prevención de nacimiento prematuro con progesterona vaginal o caproato de 17 alfa-hidroxiprogesterona: un examen crítico de eficacia y seguridad". American Journal of Obstetrics and Gynecology. 214 1): 45 –56. doi:10.1016/j.ajog.2015.10.934. PMID 26558340. S2CID 39636928.
- Caritis SN, Feghali MN, Grobman WA, Rouse DJ (agosto 2016). "Lo que hemos aprendido sobre el papel del caproato de 17-alfa-hidroxiprogesterona en la prevención del nacimiento prematuro". Seminarios en Perinatología. 40 5): 273 –80. doi:10.1053/j.semperi.2016.03.002. PMC 4983195. PMID 27105940.
- Saccone G, Khalifeh A, Elimian A, Bahrami E, Chaman-Ara K, Bahrami MA, et al. (marzo de 2017). "Progesterona vaginal vs intramuscular 17α-hidroxiprogesterona caproato para la prevención del nacimiento espontáneo recidivante en gestaciones monotonales: revisión sistemática y metaanálisis de ensayos controlados aleatorizados". Ultrasonido en Ginecología y Obstetricia. 49 3): 315 –321. doi:10.1002/uog.17245. PMID 27546354. S2CID 11445977. Archivado desde el original el 30 de mayo de 2020. Retrieved 19 de mayo 2019.
- Oler E, Eke AC, Hesson A (Julio 2017). "Meta-análisis de ensayos controlados aleatorizados que comparan el caproato de 17α-hidroxiprogesterona y la progesterona vaginal para la prevención de la entrega periódica espontánea preterm". International Journal of Gynaecology and Obstetrics. 138 1): 12–16. doi:10.1002/ijgo.12166. Hdl:2027.42/137297. PMID 28369874. S2CID 24480427.
- Manuck TA (diciembre de 2017). "17-alpha hydroxyprogesterone caproate for preterm birth prevention: ¿Dónde hemos estado, cómo llegamos aquí, y a dónde vamos?". Seminarios en Perinatología. 41 (8): 461 –467. doi:10.1053/j.semperi.2017.08.004. PMID 28947068. S2CID 36945947. Archivado desde el original el 12 de diciembre de 2020. Retrieved 2 de noviembre 2021.
![OHPC levels after a single intramuscular injection of 1,000 mg OHPC in five women with endometrial cancer.[7]](https://upload.wikimedia.org/wikipedia/commons/thumb/d/df/Hydroxyprogesterone_caproate_levels_after_a_single_intramuscular_injection_of_1%2C000_mg_hydroxyprogesterone_caproate_in_women.png/447px-Hydroxyprogesterone_caproate_levels_after_a_single_intramuscular_injection_of_1%2C000_mg_hydroxyprogesterone_caproate_in_women.png)
![OHPC levels over the course of a month after a final dose following continuous therapy with 250 mg per week OHPC by intramuscular injection in pregnant women with singleton gestation.[120]](https://upload.wikimedia.org/wikipedia/commons/thumb/b/b2/Hydroxyprogesterone_caproate_levels_after_a_final_dose_following_continuous_therapy_with_250_mg_per_week_by_intramuscular_injection_in_pregnant_women.png/461px-Hydroxyprogesterone_caproate_levels_after_a_final_dose_following_continuous_therapy_with_250_mg_per_week_by_intramuscular_injection_in_pregnant_women.png)