Capacidad calorífica específica
En termodinámica, la capacidad calorífica específica (símbolo cp ) de una sustancia es la capacidad calorífica de una muestra de la sustancia dividida por la masa de la muestra, también denominada a veces capacidad calorífica masiva. De manera informal, es la cantidad de calor que debe agregarse a una unidad de masa de la sustancia para provocar un aumento de una unidad en la temperatura. La unidad SI de capacidad calorífica específica es joule por kelvin por kilogramo, J⋅kg−1⋅K−1. Por ejemplo, el calor necesario para elevar la temperatura de 1 kg de agua en 1 K es 4184 julios, por lo que la capacidad calorífica específica del agua es 4184 J⋅kg− 1⋅K−1.
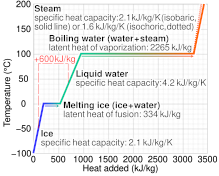
La capacidad calorífica específica a menudo varía con la temperatura y es diferente para cada estado de la materia. El agua líquida tiene una de las capacidades caloríficas específicas más altas entre las sustancias comunes, alrededor de 4184 J⋅kg−1⋅K−1 a 20 °C; pero la del hielo, justo por debajo de 0 °C, es solo 2093 J⋅kg−1⋅K−1. Las capacidades caloríficas específicas del hierro, el granito y el gas hidrógeno son aproximadamente 449 J⋅kg−1⋅K−1, 790 J⋅kg−1⋅K−1 y 14300 J⋅kg−1⋅K−1, respectivamente. Mientras la sustancia experimenta una transición de fase, como fusión o ebullición, su capacidad calorífica específica es técnicamente infinita, porque el calor cambia su estado en lugar de aumentar su temperatura.
La capacidad de calor específica de una sustancia, especialmente un gas, puede ser significativamente mayor cuando se permite expandirse ya que se calienta (capacidad de calor específica) a presión constante) que cuando se calienta en un recipiente cerrado que evita la expansión (capacidad de calor específica a volumen constante). Estos dos valores generalmente se denotan cp{displaystyle c_{p} y cV{displaystyle C_{V}, respectivamente; su coeficiente γ γ =cp/cV{displaystyle gamma =c_{p}/c_{V}es la relación de capacidad de calor.
El término calor específico también puede referirse a la relación entre las capacidades caloríficas específicas de una sustancia a una temperatura determinada y de una sustancia de referencia a una temperatura de referencia, como el agua a 15 °C; mucho en la moda de la gravedad específica. La capacidad calorífica específica también está relacionada con otras medidas intensivas de capacidad calorífica con otros denominadores. Si la cantidad de sustancia se mide como un número de moles, se obtiene la capacidad calorífica molar, cuya unidad SI es joule por kelvin por mol, J⋅mol−1⋅K−1 . Si se toma la cantidad como el volumen de la muestra (como se hace a veces en ingeniería), se obtiene la capacidad calorífica volumétrica, cuya unidad SI es joule por kelvin por metro cúbico, J⋅m−3⋅K−1.
Uno de los primeros científicos en utilizar el concepto fue Joseph Black, médico del siglo XVIII y profesor de medicina en la Universidad de Glasgow. Midió las capacidades de calor específico de muchas sustancias, utilizando el término capacidad de calor.
Definición
La capacidad de calor específica de una sustancia, generalmente denotada por c{displaystyle c} o s, es la capacidad de calor C{displaystyle C} de una muestra de la sustancia, dividida por la masa M{displaystyle M} de la muestra:
- c=CM=1M⋅ ⋅ dQdT{displaystyle c={frac {C} {M}={frac} {1}{M}cdot {fnMicroc {m} ¿Qué?
Donde dQ{displaystyle mathrm {d} Q} representa la cantidad de calor necesaria para elevar uniformemente la temperatura de la muestra por un pequeño aumento dT{displaystyle mathrm {d} T}.
Como la capacidad de calor de un objeto, la capacidad de calor específica de una sustancia puede variar, a veces sustancialmente, dependiendo de la temperatura inicial T{displaystyle T} de la muestra y la presión p{displaystyle p} aplicado a ella. Por lo tanto, debe considerarse una función c()p,T){displaystyle c(p,T)} de esas dos variables.
Estos parámetros se especifican generalmente al dar la capacidad de calor específica de una sustancia. Por ejemplo, "Water (liquid): cp{displaystyle c_{p} = 4187 J⋅kg−1⋅K−1 (15 °C)" Cuando no se especifican, se publican valores de la capacidad de calor específica c{displaystyle c} generalmente son válidos para algunas condiciones estándar de temperatura y presión.
Sin embargo, la dependencia c{displaystyle c} sobre la temperatura inicial y la presión a menudo se puede ignorar en contextos prácticos, por ejemplo cuando se trabaja en rangos estrechos de esas variables. En esos contextos uno generalmente omite el calificativo ()p,T){displaystyle (p,T)}, y aproxima la capacidad de calor específica por una constante c{displaystyle c} adecuado para esos rangos.
La capacidad calorífica específica es una propiedad intensiva de una sustancia, una característica intrínseca que no depende del tamaño o la forma de la cantidad en consideración. (El calificador "específico" delante de una propiedad extensiva a menudo indica una propiedad intensiva derivada de ella).
Variaciones
La inyección de energía térmica en una sustancia, además de elevar su temperatura, generalmente causa un aumento en su volumen y/o su presión, dependiendo de cómo se confina la muestra. La elección de este último afecta la capacidad de calor específica medida, incluso por la misma presión de inicio p{displaystyle p} y temperatura inicial T{displaystyle T}. Dos opciones particulares son ampliamente utilizadas:
- Si la presión se mantiene constante (por ejemplo, a la presión atmosférica ambiental), y se permite ampliar la muestra, la expansión genera trabajo a medida que la fuerza de la presión desplaza el recinto o el líquido circundante. Ese trabajo debe provenir de la energía térmica proporcionada. Se dice que la capacidad de calor específica obtenida se mide a presión constante (o isobaric), y es a menudo denotado cp{displaystyle c_{p}, cp{displaystyle c_{mathrm {}}}, etc.
- Por otra parte, si se evita la expansión, por ejemplo por un recinto suficientemente rígido, o aumentando la presión externa para contrarrestar el interior, no se genera trabajo, y la energía térmica que hubiera entrado en él debe contribuir en cambio a la energía interna de la muestra, incluyendo elevar su temperatura por una cantidad adicional. Se dice que la capacidad de calor específica obtenida de esta manera se mide a volumen constante (o isochoric) y denotado cV{displaystyle C_{V}, cv{displaystyle c_{v}, cv{displaystyle c_{mathrm {}}, etc.
El valor de cV{displaystyle C_{V} es generalmente menos que el valor de cp{displaystyle c_{p}. Esta diferencia es particularmente notable en los gases donde los valores bajo presión constante son generalmente 30% a 66,7% mayor que los que tienen volumen constante. Por lo tanto, la relación de la capacidad de calor de los gases es típicamente entre 1.3 y 1.67.
Aplicabilidad
La capacidad calorífica específica se puede definir y medir para gases, líquidos y sólidos de composición y estructura molecular bastante generales. Estos incluyen mezclas de gases, soluciones y aleaciones, o materiales heterogéneos como leche, arena, granito y hormigón, si se consideran a una escala suficientemente grande.
La capacidad calorífica específica también se puede definir para materiales que cambian de estado o composición a medida que cambian la temperatura y la presión, siempre que los cambios sean reversibles y graduales. Así, por ejemplo, los conceptos son definibles para un gas o líquido que se disocia a medida que aumenta la temperatura, siempre que los productos de la disociación se recombinen rápida y completamente cuando ésta desciende.
La capacidad calorífica específica no es significativa si la sustancia sufre cambios químicos irreversibles, o si hay un cambio de fase, como fusión o ebullición, a una temperatura aguda dentro del rango de temperaturas que abarca la medición.
Medición
La capacidad calorífica específica de una sustancia generalmente se determina de acuerdo con la definición; es decir, midiendo la capacidad calorífica de una muestra de la sustancia, generalmente con un calorímetro, y dividiéndola por la masa de la muestra. Se pueden aplicar varias técnicas para estimar la capacidad calorífica de una sustancia como, por ejemplo, la calorimetría diferencial de barrido rápido.
Las capacidades caloríficas específicas de los gases se pueden medir a volumen constante, encerrando la muestra en un recipiente rígido. Por otro lado, medir la capacidad calorífica específica a volumen constante puede ser prohibitivamente difícil para líquidos y sólidos, ya que a menudo se necesitarían presiones poco prácticas para evitar la expansión que sería causada incluso por pequeños aumentos de temperatura. En cambio, la práctica común es medir la capacidad calorífica específica a presión constante (permitiendo que el material se expanda o contraiga como desee), determinar por separado el coeficiente de expansión térmica y la compresibilidad del material, y calcular la capacidad calorífica específica a presión constante. volumen de estos datos de acuerdo con las leyes de la termodinámica.
Unidades
Sistema internacional
La unidad SI para la capacidad calorífica específica es joule por kelvin por kilogramo J/kg⋅K, J⋅K−1⋅kg−1. Dado que un incremento de temperatura de un grado Celsius es lo mismo que un incremento de un kelvin, eso es lo mismo que un joule por grado Celsius por kilogramo: J/(kg⋅°C). A veces se utiliza el gramo en lugar del kilogramo para la unidad de masa: 1 J⋅g−1⋅K−1 = 0,001 J⋅kg−1⋅K−1.
La capacidad calorífica específica de una sustancia (por unidad de masa) tiene la dimensión L2⋅Θ−1⋅T−2, o (L/T)2/Θ. Por lo tanto, la unidad SI J⋅kg−1⋅K−1 es equivalente al metro cuadrado por segundo al cuadrado por kelvin (m2⋅K −1⋅s−2).
Unidades de ingeniería imperiales
Los profesionales de la construcción, la ingeniería civil, la ingeniería química y otras disciplinas técnicas, especialmente en los Estados Unidos, pueden utilizar unidades de ingeniería inglesas, incluida la libra (lb = 0,45359237 kg) como unidad de masa, el grado Fahrenheit o Rankine (°R = 5/9 K, alrededor de 0,555556 K) como unidad de incremento de temperatura, y la unidad térmica británica (BTU ≈ 1055,056 J), como unidad de calor.
En esos contextos, la unidad de capacidad calorífica específica es BTU/lb⋅°R, o 1 BTU /lb⋅°R = 4186,68J/kg⋅K. El BTU se definió originalmente de modo que la capacidad calorífica específica promedio del agua fuera de 1 BTU/lb⋅°F. Tenga en cuenta la similitud del valor con el de la caloría - 4187 J/kg⋅°C ≈ 4184 J/kg⋅°C (~0,07 %) - ya que esencialmente miden la misma energía, usando agua como base referencia, escalado a sus sistemas' respectivas libras y °F, o kg y °C.
Calorías
En química, las cantidades de calor a menudo se miden en calorías. De manera confusa, dos unidades con ese nombre, indicadas como "cal" o "Cal", se han utilizado comúnmente para medir cantidades de calor:
- la "pequeña calorías" (o "gram-calorie", "cal") es 4.184 J, exactamente. Se definió originalmente para que la capacidad de calor específica del agua líquida fuera 1 cal/°C⋅g.
- La "grand calorías" (también "kilocalorie", "kilogram-calorie", o "calor de alimentos"; "kcal" o "Cal") es 1000 calorías pequeñas, es decir, 4184 J, exactamente. Se definió de modo que la capacidad de calor específica del agua sería 1 Cal/°C⋅kg.
Si bien estas unidades todavía se usan en algunos contextos (como el kilogramo de calorías en la nutrición), su uso ahora está en desuso en los campos técnico y científico. Cuando el calor se mide en estas unidades, la unidad de capacidad calorífica específica suele ser
- 1Cal/°C⋅g ("pequeña calorías") = 1Cal/°C⋅kg = 1kcal/°C⋅kg ("gran calorías") = 4184J/kg⋅°K = 4.184kJ/kg⋅°K.
Tenga en cuenta que mientras cal es 1⁄1000 de una Cal o kcal, también es por gramo en lugar de kilogramo: ergo, en unidad, la capacidad calorífica específica del agua es aproximadamente 1.
Base física
La temperatura de una muestra de una sustancia refleja la energía cinética promedio de sus partículas constituyentes (átomos o moléculas) en relación con su centro de masa. Sin embargo, no toda la energía proporcionada a una muestra de una sustancia se destinará a elevar su temperatura, ejemplificado a través del teorema de equipartición.
Gases monoatómicos
La mecánica cuántica predice que, a temperatura ambiente y presiones ordinarias, un átomo aislado en un gas no puede almacenar ninguna cantidad significativa de energía excepto en forma de energía cinética. Así, la capacidad de calor por topo es la misma para todos los gases monatámicos (como los gases nobles). Más precisamente, cV,m=3R/2.. 12,5J⋅ ⋅ K− − 1⋅ ⋅ mol− − 1{displaystyle c_{V,mathrm {m}=3R/2approx mathrm {12.5,Jcdot K^{-1}cdot mol^{-1} y cP,m=5R/2.. 21J⋅ ⋅ K− − 1⋅ ⋅ mol− − 1{displaystyle c_{P,mathrm {m}=5R/2approx mathrm {21,Jcdot K^{-1}cdot mol^{-1}, donde R.. 8.31446J⋅ ⋅ K− − 1⋅ ⋅ mol− − 1{displaystyle Rapprox mathrm {8.31446,Jcdot K^{-1}cdot mol^{-1} es la unidad de gas ideal (que es el producto de la constante de conversión Boltzmann de la unidad de energía microscópica kelvin a la unidad de energía macroscópica joule, y el número Avogadro).
Por lo tanto, la capacidad de calor específica (por unidad de masa, no por topo) de un gas monatomico será inversamente proporcional a su peso atómico (adimensional) A{displaystyle A}. Eso es, aproximadamente,
- cV.. 12470J⋅ ⋅ K− − 1⋅ ⋅ kg− − 1/Acp.. 20785J⋅ ⋅ K− − 1⋅ ⋅ kg− − 1/A{displaystyle c_{V}approx mathrm {12470,Jcdot K^{-1}cdot kg^{-1} /Aquad quad quad c_{p}approx mathrm {20785,Jcdot K^{-1}cdot kg^{-1} /A}
Para los gases nobles, desde helio hasta xenón, estos valores calculados son
| Gas | Él | Ne | Ar | Kr | Xe |
|---|---|---|---|---|---|
| A{displaystyle A} | 4.00 | 20.17 | 39.95 | 83.80 | 131.29 |
| cV{displaystyle C_{V} (J⋅K−1⋅kg−1) | 3118 | 618.3 | 312.2 | 148.8 | 94.99 |
| cp{displaystyle c_{p} (J⋅K−1⋅kg−1) | 5197 | 1031 | 520.3 | 248.0 | 158.3 |
Gases poliatómicos
Por otro lado, una molécula de gas poliatómico (que consta de dos o más átomos unidos entre sí) puede almacenar energía térmica en otras formas además de su energía cinética. Estas formas incluyen la rotación de la molécula y la vibración de los átomos en relación con su centro de masa.
Estos grados de libertad adicionales o "modos" contribuyen a la capacidad calorífica específica de la sustancia. Es decir, cuando se inyecta energía térmica en un gas con moléculas poliatómicas, solo una parte se destinará a aumentar su energía cinética y, por lo tanto, la temperatura; el resto irá a esos otros grados de libertad. Para lograr el mismo aumento de temperatura, se deberá proporcionar más energía térmica a un mol de esa sustancia que a un mol de un gas monoatómico. Por lo tanto, la capacidad calorífica específica de un gas poliatómico depende no solo de su masa molecular, sino también del número de grados de libertad que tienen las moléculas.
La mecánica cuántica dice además que cada modo de rotación o vibración solo puede tomar o perder energía en cierta cantidad discreta (cuantos). Dependiendo de la temperatura, la energía térmica promedio por molécula puede ser demasiado pequeña en comparación con los cuantos necesarios para activar algunos de esos grados de libertad. Se dice que esos modos están "congelados". En ese caso, la capacidad calorífica específica de la sustancia aumentará con la temperatura, a veces de forma escalonada, a medida que más modos se descongelen y comiencen a absorber parte de la energía térmica de entrada.
Por ejemplo, la capacidad de calor molar del nitrógeno N
2 a volumen constante cV,m=20.6J⋅ ⋅ K− − 1⋅ ⋅ mol− − 1{displaystyle c_{V,mathrm {m}=mathrm {20.6,Jcdot K^{-1}cdot mol^{-1} (a 15 °C, 1 atm), que es 2.49R{displaystyle 2.49R}. Ese es el valor esperado de la teoría si cada molécula tenía 5 grados de libertad. Estos resultan ser tres grados del vector de velocidad de la molécula, más dos grados de su rotación sobre un eje a través del centro de masa y perpendicular a la línea de los dos átomos. Debido a esos dos grados extra de libertad, la capacidad de calor específica cV{displaystyle C_{V} de N
2 (736 J⋅K−1⋅kg−1) es mayor que el de un hipotético gas monatomico con la misma masa molecular 28 (445 J⋅K)−1⋅kg−1), por un factor de 5/3.
Este valor para la capacidad de calor específica del nitrógeno es prácticamente constante desde abajo −150 °C a unos 300 °C. En ese rango de temperatura, los dos grados adicionales de libertad que corresponden a las vibraciones de los átomos, estirando y comprendiendo el vínculo, siguen "congelados". En torno a esa temperatura, esos modos comienzan a "incongelarse", y como resultado cV{displaystyle C_{V} comienza a aumentar rápidamente al principio, luego más lento ya que tiende a otro valor constante. It is 35.5 J⋅K−1⋅mol−1 a 1500 °C, 36.9 a 2500 °C, y 37.5 a 3500 °C. El último valor corresponde casi exactamente al valor predicho para 7 grados de libertad por molécula.
Derivaciones de la capacidad calorífica
Relación entre capacidades caloríficas específicas
A partir de la relación termodinámica fundamental que se puede mostrar,
- cp− − cv=α α 2T*** *** β β T{displaystyle c_{p}-c_{v}={frac {alpha ^{2}T}{rho beta ♪♪
dónde,
- α α {displaystyle alpha } es el coeficiente de expansión térmica,
- β β T{displaystyle beta _{T} es la compresibilidad isotérmica, y
- *** *** {displaystyle rho } es densidad.
Se analiza una derivación en el artículo Relaciones entre calores específicos.
Para un gas ideal, si *** *** {displaystyle rho } se expresa como densidad molar en la ecuación anterior, esta ecuación reduce simplemente a la relación de Mayer,
- Cp,m− − Cv,m=R{displaystyle C_{p, ¡Oh!
Donde Cp,m{displaystyle C_{p,m} y Cv,m{displaystyle C_{v,m} son las capacidades de calor de propiedades intensivas expresadas sobre una base de lunares a presión constante y volumen constante, respectivamente.
Capacidad calorífica específica
La capacidad calorífica específica de un material por masa es
- c=∂ ∂ C∂ ∂ m,{displaystyle c={partial C over partial m},}
que en ausencia de transiciones de fase es equivalente a
- c=Em=Cm=C*** *** V,{displaystyle c=E_{m}={C over m}={C over {rho V}}}
dónde
- C{displaystyle C} es la capacidad de calor de un cuerpo hecho del material en cuestión,
- m{displaystyle m} es la masa del cuerpo,
- V{displaystyle V} es el volumen del cuerpo, y
- *** *** =mV{displaystyle rho ={frac {m}{V}} es la densidad del material.
Para los gases, y también para otros materiales bajo altas presiones, es necesario distinguir entre diferentes condiciones de límites para los procesos en estudio (ya que los valores difieren significativamente entre diferentes condiciones). Procesos típicos para los cuales se puede definir una capacidad de calor incluyen isobarico (presión constante, dp=0{displaystyle dp=0}) o isocoric (constant volume, dV=0{displaystyle dV=0}) procesos. Las capacidades de calor específicas correspondientes se expresan como
- cp=()∂ ∂ C∂ ∂ m)p,{displaystyle c_{p}=left({frac {partial C}{partial m}right)_{p}}
- cV=()∂ ∂ C∂ ∂ m)V.{displaystyle c_{V}=left({frac {partial C}{partial m}right)_{V}
A related parameter to c{displaystyle c} es CV− − 1{displaystyle CV^{-1}, la capacidad de calor volumétrica. En la práctica de ingeniería, cV{displaystyle C_{V} para sólidos o líquidos a menudo significa una capacidad de calor volumétrica, en lugar de un volumen constante. En tales casos, la capacidad de calor específica en masa se escribe explícitamente con el subscript m{displaystyle m}, como cm{displaystyle C_{m}. Por supuesto, desde las relaciones anteriores, para sólidos uno escribe
- cm=Cm=cV*** *** .{displaystyle C_{m}={frac {C} {m}={frac} {c_{V}{rho }}
Para compuestos químicos homogéneos puros con masa molecular o molar establecida o una cantidad molar establecida, la capacidad calorífica como propiedad intensiva se puede expresar por mol en lugar de por masa mediante las siguientes ecuaciones análogas a por masa ecuaciones:
- Cp,m=()∂ ∂ C∂ ∂ n)p=capacidad de calor molar a presión constante{displaystyle C_{p,m}=left({frac {partial C}{partial n}right)_{p}={text{molar capacidad de calor a presión constante}}}
- CV,m=()∂ ∂ C∂ ∂ n)V=capacidad de calor molar a volumen constante{displaystyle C_{V,m}=left({frac {partial C}{partial n}right)_{V}={text{molar capacidad de calor en volumen constante
donde n = número de moles en el cuerpo o sistema termodinámico. Uno puede referirse a tal cantidad por mol como capacidad calorífica molar para distinguirla de la capacidad calorífica específica por masa.
Capacidad calorífica politrópica
La capacidad calorífica politrópica se calcula en los procesos si cambian todas las propiedades termodinámicas (presión, volumen, temperatura)
- Ci,m=()∂ ∂ C∂ ∂ n)=capacidad de calor molar en proceso politrópico{displaystyle C_{i,m}=left({frac {partial C}{partial n}right)={text{molar heat capacity at polytropic process}}
Los procesos politrópicos más importantes se dan entre las funciones adiabática e isoterma, el índice politrópico está entre 1 y el exponente adiabático (γ o κ)
Capacidad calorífica adimensional
La capacidad calorífica adimensional de un material es
- CAlternativa Alternativa =CnR=CNkB{displaystyle C^{*}={C over nR}={ C over {Nk_{text{B}}}
dónde
- C es la capacidad de calor de un cuerpo hecho del material en cuestión (J/K)
- n es la cantidad de sustancia en el cuerpo (mol)
- R es la constante del gas (J⋅K−1⋅mol−1)
- N es el número de moléculas en el cuerpo. (sin distinción)
- kB es la constante de Boltzmann (J⋅K−1)
Nuevamente, las unidades SI se muestran como ejemplo.
Lea más sobre las cantidades de dimensión uno en BIPM
En el artículo de gas ideal, capacidad de calor sin dimensiones CAlternativa Alternativa {displaystyle C^{*} se expresa como c^ ^ {displaystyle {hat {c}}.
Capacidad calorífica en el cero absoluto
De la definición de entropía
- TdS=δ δ Q{displaystyle TdS=delta Q}
La entropía absoluta se puede calcular integrando desde la temperatura de cero Kelvin hasta la temperatura final Tf
- S()Tf)=∫ ∫ T=0Tfδ δ QT=∫ ∫ 0Tfδ δ QdTdTT=∫ ∫ 0TfC()T)dTT.{displaystyle S(T_{f}=int ¿Qué? {delta ¿Qué? ¿Qué? Q}{dT}{frac {dT} {T}= ¿Qué? {dT} {T}}
La capacidad calorífica debe ser cero a temperatura cero para que la integral anterior no produzca una entropía absoluta infinita, violando así la tercera ley de la termodinámica. Uno de los puntos fuertes del modelo de Debye es que (a diferencia del modelo anterior de Einstein) predice la forma matemática adecuada del acercamiento de la capacidad calorífica a cero, a medida que se acerca la temperatura al cero absoluto.
Fase sólida
La capacidad calorífica máxima teórica para gases multiatómicos cada vez más grandes a temperaturas más altas también se acerca al límite de Dulong-Petit de 3R, siempre que se calcule por mol de átomos, no moléculas. La razón es que los gases con moléculas muy grandes, en teoría, tienen casi la misma capacidad calorífica a alta temperatura que los sólidos, y solo carecen de la (pequeña) contribución de capacidad calorífica que proviene de la energía potencial que no se puede almacenar entre moléculas separadas en un gas.
El límite de Dulong-Petit resulta del teorema de equipartición y, como tal, solo es válido en el límite clásico de un continuo de microestados, que es un límite de alta temperatura. Para los elementos ligeros y no metálicos, así como para la mayoría de los sólidos moleculares comunes basados en compuestos de carbono a temperatura ambiente estándar, los efectos cuánticos también pueden desempeñar un papel importante, como lo hacen en los gases multiatómicos. Estos efectos generalmente se combinan para dar capacidades caloríficas inferiores a 3R por mol de átomos en el sólido, aunque en sólidos moleculares, las capacidades caloríficas se calculan por mol de moléculas en sólidos moleculares puede ser más de 3R. Por ejemplo, la capacidad calorífica del hielo de agua en el punto de fusión es de aproximadamente 4,6R por mol de moléculas, pero solo 1,5R por mol de átomos. El número menor que 3R "por átomo" (como es el caso del diamante y el berilio) resulta de la "congelación" de los posibles modos de vibración de los átomos ligeros a temperaturas adecuadamente bajas, al igual que en muchos gases de átomos de baja masa a temperatura ambiente. Debido a las altas energías de unión de los cristales, estos efectos se observan con más frecuencia en los sólidos que en los líquidos: por ejemplo, la capacidad calorífica del agua líquida es el doble que la del hielo a casi la misma temperatura, y nuevamente está cerca de 3R por mol de átomos del máximo teórico de Dulong-Petit.
Para un análisis más moderno y preciso de las capacidades caloríficas de los sólidos, especialmente a bajas temperaturas, es útil utilizar la idea de los fonones. Ver modelo Debye.
Estimación teórica
El método Monte Carlo de la integral de trayectoria es un enfoque numérico para determinar los valores de la capacidad calorífica, basado en principios de dinámica cuántica. Sin embargo, se pueden hacer buenas aproximaciones para gases en muchos estados utilizando métodos más simples que se describen a continuación. Para muchos sólidos compuestos de átomos relativamente pesados (número atómico > hierro), a temperaturas no criogénicas, la capacidad calorífica a temperatura ambiente se aproxima a 3R = 24,94 julios por kelvin por mol de átomos (ley de Dulong-Petit, R es la constante de los gases). Las aproximaciones a baja temperatura para gases y sólidos a temperaturas inferiores a sus temperaturas características de Einstein o Debye se pueden realizar mediante los métodos de Einstein y Debye que se analizan a continuación. Agua (líquida): CP = 4185,5 J⋅K−1⋅kg−1 (15 °C, 101,325 kPa) Agua (líquida): CVH = 74,539 J⋅K−1⋅mol−1 (25 °C) Para líquidos y gases, es importante conocer la presión a la que se refieren los datos de capacidad calorífica. La mayoría de los datos publicados se dan para presión estándar. Sin embargo, diferentes organizaciones han definido diferentes condiciones estándar para la temperatura y la presión. La Unión Internacional de Química Pura y Aplicada (IUPAC) cambió su recomendación de una atmósfera al valor redondo de 100 kPa (≈750,062 Torr).
Cálculo a partir de primeros principios
El método Monte Carlo de la integral de trayectoria es un enfoque numérico para determinar los valores de la capacidad calorífica, basado en principios de dinámica cuántica. Sin embargo, se pueden hacer buenas aproximaciones para gases en muchos estados utilizando métodos más simples que se describen a continuación. Para muchos sólidos compuestos de átomos relativamente pesados (número atómico > hierro), a temperaturas no criogénicas, la capacidad calorífica a temperatura ambiente se aproxima a 3R = 24,94 julios por kelvin por mol de átomos (Dulong– Petit law, R es la constante de los gases). Las aproximaciones a baja temperatura para gases y sólidos a temperaturas inferiores a sus temperaturas características de Einstein o Debye se pueden realizar mediante los métodos de Einstein y Debye que se analizan a continuación.
Relación entre capacidades caloríficas
Medir la capacidad calorífica específica a volumen constante puede ser prohibitivamente difícil para líquidos y sólidos. Es decir, los pequeños cambios de temperatura generalmente requieren grandes presiones para mantener un líquido o un sólido a un volumen constante, lo que implica que el recipiente que lo contiene debe ser casi rígido o al menos muy fuerte (consulte el coeficiente de expansión térmica y compresibilidad). En cambio, es más fácil medir la capacidad calorífica a presión constante (permitiendo que el material se expanda o se contraiga libremente) y resolver la capacidad calorífica a volumen constante utilizando relaciones matemáticas derivadas de las leyes termodinámicas básicas.
La relación de capacidad calorífica, o índice adiabático, es la relación entre la capacidad calorífica a presión constante y la capacidad calorífica a volumen constante. A veces también se conoce como el factor de expansión isoentrópica.
Gases ideales
Para un gas ideal, evaluando las derivadas parciales anteriores según la ecuación de estado, donde R es la constante de los gases, para un gas ideal
- PV=nRT,{displaystyle PV=nRT,}
- CP− − CV=T()∂ ∂ P∂ ∂ T)V,n()∂ ∂ V∂ ∂ T)P,n,{displaystyle ¿Por qué?
- P=nRTV⇒ ⇒ ()∂ ∂ P∂ ∂ T)V,n=nRV,{displaystyle P={frac {nRT}{V}fn} Rightarrow left({frac {partial P}{partial T}right)_{V,n}={frac {nR}{V},}
- V=nRTP⇒ ⇒ ()∂ ∂ V∂ ∂ T)P,n=nRP.{displaystyle V={frac "Rightarrow left"({frac {partial V}{partial T}right)_{P,n}={frac {nR}{P}}
Sustitución
- T()∂ ∂ P∂ ∂ T)V,n()∂ ∂ V∂ ∂ T)P,n=TnRVnRP=nRTVnRP=PnRP=nR,{displaystyle Tleft({frac {partial P}{partial T}right)_{V,n}left({frac {partial V}{partial T}right)_{P,n}=T{frac} {nR}{V}{frac} {nR}{}={frac} {fn} {fn} {fnK} {fnK}} {fnK}} {fn} {fn}}} {fn}} {fn}} {fn}}}} {fn}} {f}} {fnK}}}} {fnKf}}} {f}}}} {f}}}}}} {f}}}}} {f}f}}f}f}f}f}f}f}}f}f}f}fnKf}fnf}f}f}f}f}fnfnKfnKf}fnf}fnf}}fnfnfnh}f}fnfnKfnKfnKf}}fnKf}fnh}}}}}fn {nR} {fn}=P{frac} {nR}=nR,}
esta ecuación se reduce simplemente a la relación de Mayer:
- CP,m− − CV,m=R.{displaystyle C_{P,m}-C_{V,m}=R.
Las diferencias en las capacidades caloríficas definidas por la anterior relación de Mayer solo son exactas para un gas ideal y serían diferentes para cualquier gas real.
Capacidad calorífica específica
La capacidad calorífica específica de un material por masa es
- c=∂ ∂ C∂ ∂ m,{displaystyle c={frac {partial C}{partial m}}}
que en ausencia de transiciones de fase es equivalente a
- c=Em=Cm=C*** *** V,{displaystyle c=E_{m}={frac {C} {m}={frac} {C}{rho V}}
dónde
- C{displaystyle C} es la capacidad de calor de un cuerpo hecho del material en cuestión,
- m{displaystyle m} es la masa del cuerpo,
- V{displaystyle V} es el volumen del cuerpo,
- *** *** =mV{displaystyle rho ={frac {m}{V}} es la densidad del material.
Para los gases, y también para otros materiales bajo altas presiones, es necesario distinguir entre diferentes condiciones de límites para los procesos en estudio (ya que los valores difieren significativamente entre diferentes condiciones). Procesos típicos para los cuales se puede definir una capacidad de calor incluyen isobarico (presión constante, dP=0{displaystyle {text{d}P=0}) o isocoric (constant volume, dV=0{displaystyle {text{d}V=0}) procesos. Las capacidades de calor específicas correspondientes se expresan como
- cP=()∂ ∂ C∂ ∂ m)P,{displaystyle c_{P}=left({frac {partial C}{partial m}right)_{P}
- cV=()∂ ∂ C∂ ∂ m)V.{displaystyle c_{V}=left({frac {partial C}{partial m}right)_{V}
De los resultados de la sección anterior, al dividir entre la masa se obtiene la relación
- cP− − cV=α α 2T*** *** β β T.{displaystyle c_{P}-c_{V}={frac {alpha ^{2}T}{rho beta - Sí.
A related parameter to c{displaystyle c} es C/V{displaystyle C/V}, la capacidad de calor volumétrica. En la práctica de ingeniería, cV{displaystyle C_{V} para sólidos o líquidos a menudo significa una capacidad de calor volumétrica, en lugar de un volumen constante. En tales casos, la capacidad de calor específica se escribe explícitamente con el subscript m{displaystyle m}, como cm{displaystyle C_{m}. Por supuesto, desde las relaciones anteriores, para sólidos uno escribe
- cm=Cm=cvolumétrico*** *** .{displaystyle C_{m}={frac {C} {m}={frac} {c_{text{volumetric}{rho }}
Para compuestos químicos homogéneos puros con masa molecular o molar establecida, o una cantidad molar, la capacidad calorífica como una propiedad intensiva se puede expresar por mol en lugar de por masa mediante las siguientes ecuaciones análogas a por ecuaciones de masa:
- CP,m=()∂ ∂ C∂ ∂ n)P=capacidad de calor molar a presión constante,{displaystyle C_{P,m}=left({frac {partial C}{partial n}right)_{P}={text{molar capacidad de calor a presión constante.
- CV,m=()∂ ∂ C∂ ∂ n)V=capacidad de calor molar a volumen constante,{displaystyle C_{V,m}=left({frac {partial C}{partial n}right)_{V}={text{molar capacidad de calor en volumen constante,}}
donde n es el número de moles en el cuerpo o sistema termodinámico. Uno puede referirse a una cantidad por mol como capacidad calorífica molar para distinguirla de la capacidad calorífica específica por masa.
Capacidad calorífica politrópica
La capacidad calorífica politrópica se calcula en los procesos si cambian todas las propiedades termodinámicas (presión, volumen, temperatura):
- Ci,m=()∂ ∂ C∂ ∂ n)=Capacidad de calor molar en proceso politrópico.{displaystyle C_{i,m}=left({frac {partial C}{partial n}right)={text{molar heat capacity at polytropic process.}}
Los procesos politrópicos más importantes se dan entre las funciones adiabática e isoterma, el índice politrópico está entre 1 y el exponente adiabático (γ o κ).
Capacidad calorífica adimensional
La capacidad calorífica adimensional de un material es
- CAlternativa Alternativa =CnR=CNkB,{displaystyle C^{*}={frac {C}{nR}={frac} {C}{Nk_{text{B}}}}}
dónde
- C{displaystyle C} es la capacidad de calor de un cuerpo hecho del material en cuestión (J/K),
- n es la cantidad de sustancia en el cuerpo (mol),
- R es la constante de gas (J/(K⋅mol)),
- N es el número de moléculas en el cuerpo (sin digerir),
- kB es la constante de Boltzmann (J/(K⋅molecule)).
En el artículo ideal del gas, la capacidad de calor sin dimensiones CAlternativa Alternativa {displaystyle C^{*} se expresa como c^ ^ {displaystyle {hat {c}} y está relacionado directamente con la mitad del número de grados de libertad por partícula. Esto es cierto para los grados cuadráticos de la libertad, consecuencia del teorema de la equipartición.
Más generalmente, la capacidad de calor sin dimensiones relaciona el aumento logarítmico de la temperatura con el aumento de la entropía sin dimensiones por partícula SAlternativa Alternativa =S/NkB{displaystyle S^{*}=S/Nk_{text{B}, medido en nueces.
- CAlternativa Alternativa =dSAlternativa Alternativa d()In T).{displaystyle ¿Qué? T)}}
Alternativamente, usando logaritmos base-2, CAlternativa Alternativa {displaystyle C^{*} relaciona el aumento de la temperatura base-2 al aumento de la entropía sin dimensiones medido en bits.
Capacidad calorífica en el cero absoluto
De la definición de entropía
- TdS=δ δ Q,{displaystyle T,{text{d}S=delta Q,}
la entropía absoluta se puede calcular integrando desde cero hasta la temperatura final Tf:
- S()Tf)=∫ ∫ T=0Tfδ δ QT=∫ ∫ 0Tfδ δ QdTdTT=∫ ∫ 0TfC()T)dTT.{displaystyle S(T_{text{f})=int ¿Qué? {delta Q}{T}= ¿Qué? {delta Q}{text{d}T}{frac} {f}} {f}}} {f}}} {f} {fnK}T} {fnMicrosoft} {fnMicrosoft}}T} {f}}} {f}}} {f}}}} {f}}}} {f}}}}} {f}}}}}}} {f}}}} {f}}} {f}}}}}}}}}}}}}}}}}}}}}} { ¿Qué? {fnMicrosoft Sans Serif}
Derivación termodinámica
En teoría, la capacidad calorífica específica de una sustancia también se puede derivar de su modelo termodinámico abstracto mediante una ecuación de estado y una función de energía interna.
Estado de la materia en una muestra homogénea
Para aplicar la teoría, se considera la muestra de la sustancia (sólido, líquido o gas) para la cual se puede definir la capacidad de calor específica; en particular, que tiene composición homogénea y masa fija M{displaystyle M}. Supongamos que la evolución del sistema es siempre lo suficientemente lenta para la presión interna P{displaystyle P} y temperatura T{displaystyle T} ser considerado uniforme en todo. La presión P{displaystyle P} sería igual a la presión que le aplica el recinto o algún líquido circundante, como el aire.
El estado del material puede ser especificado por tres parámetros: su temperatura T{displaystyle T}, la presión P{displaystyle P}, y su volumen específico .. =V/M{displaystyle nu =V/M}, donde V{displaystyle V} es el volumen de la muestra. (Esta cantidad es la reciproca 1/*** *** {displaystyle 1/rho } de la densidad del material *** *** =M/V{displaystyle rho =M/V}.) Como T{displaystyle T} y P{displaystyle P}, el volumen específico .. {displaystyle nu } es una propiedad intensiva del material y su estado, que no depende de la cantidad de sustancia en la muestra.
Esas variables no son independientes. Los estados permitidos se definen por una ecuación de estado relativa a esas tres variables: F()T,P,.. )=0.{displaystyle F(T,P,nu)=0.} La función F{displaystyle F} depende del material que se esté examinando. La energía interna específica almacenada internamente en la muestra, por unidad de masa, será entonces otra función U()T,P,.. ){displaystyle U(T,P,nu)} de estas variables estatales, que también es específica del material. La energía interna total en la muestra será entonces MU()T,P,.. ){displaystyle M,U(T,P,nu)}.
Para algunos materiales simples, como un gas ideal, uno puede derivar de la teoría básica la ecuación del estado F=0{displaystyle F=0} e incluso la energía interna específica U{displaystyle U} En general, estas funciones deben determinarse experimentalmente para cada sustancia.
Conservación de energía
El valor absoluto de esta cantidad es indefinido, y (a los efectos de la termodinámica) el estado de "ergia interna cero" puede ser elegido arbitrariamente. Sin embargo, por la ley de conservación de la energía, cualquier aumento infinitesimal MdU{displaystyle M,mathrm {d} U} energía interna total MU{displaystyle MUY debe ser igualado por el flujo neto de energía térmica dQ{displaystyle mathrm {d} Q} en la muestra, además de cualquier energía mecánica neta que se le proporciona por recinto o medio circundante en ella. Este último es − − PdV{displaystyle - ¿Qué?, donde dV{displaystyle mathrm {d} V} es el cambio en el volumen de la muestra en ese paso infinitesimal. Por lo tanto
- dQ− − PdV=MdU{displaystyle mathrm {d} Q-P,mathrm {d} V=M,mathrm {d} U}
por lo tanto
- dQM− − Pd.. =dU{displaystyle {frac {mathrm} Q} {M}-P,mathrm {d} nu =mathrm {d} U}
Si el volumen de la muestra (de ahí el volumen específico del material) se mantiene constante durante la inyección de la cantidad de calor dQ{displaystyle mathrm {d} Q}, entonces el término Pd.. {displaystyle P,mathrm {d} nu } es cero (no se realiza ningún trabajo mecánico). Entonces, dividiendo dT{displaystyle mathrm {d} T},
- dQMdT=dUdT{displaystyle {frac {mathrm} Q}{M,mathrm {d} T}={frac {mathrm {d} ¿Qué?
Donde dT{displaystyle mathrm {d} T} es el cambio de temperatura resultante de la entrada de calor. El lado izquierdo es la capacidad de calor específica en volumen constante cV{displaystyle C_{V} del material.
Para la capacidad de calor a presión constante, es útil definir la enthalpy específica del sistema como la suma h()T,P,.. )=U()T,P,.. )+P.. {displaystyle h(T,P,nu)=U(T,P,nu)+Pnu. Un cambio infinitesimal en la enthalpy específica será entonces
- dh=dU+VdP+PdV{displaystyle mathrm {d} h=mathrm {d} U+V,mathrm {d} P+P,mathrm {d} V}
por lo tanto
- dQM+VdP=dh{displaystyle {frac {mathrm} ¿Qué? P=mathrm {d} h}
Si la presión se mantiene constante, el segundo término del lado izquierdo es cero y
- dQMdT=dhdT{displaystyle {frac {mathrm} Q}{M,mathrm {d} T}={frac {mathrm {d} h}{mathrm {d} T}
El lado izquierdo es la capacidad de calor específica a presión constante cP{displaystyle C_{P} del material.
Conexión a la ecuación de estado
En general, las cantidades infinitesimal dT,dP,dV,dU{displaystyle mathrm {d} T,mathrm {d} P,mathrm {d} V,mathrm {d} U} están limitadas por la ecuación del estado y la función energética interna específica. Es decir,
- {}dT∂ ∂ F∂ ∂ T()T,P,V)+dP∂ ∂ F∂ ∂ P()T,P,V)+dV∂ ∂ F∂ ∂ V()T,P,V)=0dT∂ ∂ U∂ ∂ T()T,P,V)+dP∂ ∂ U∂ ∂ P()T,P,V)+dV∂ ∂ U∂ ∂ V()T,P,V)=dU{fnMicrosoft Sans Serif}
Aquí. ()∂ ∂ F/∂ ∂ T)()T,P,V){displaystyle (partial F/partial T)(T,P,V)} denota el derivado (partial) de la ecuación estatal F{displaystyle F} con respecto a su T{displaystyle T} argumentación, mantener los otros dos argumentos fijos, evaluados en el estado ()T,P,V){displaystyle (T,P,V)} en cuestión. Los otros derivados parciales se definen de la misma manera. Estas dos ecuaciones de los cuatro incrementos infinitesimal normalmente los limitan a un espacio subespacial lineal bidimensional de posibles cambios de estado infinitesimal, que depende del material y del estado. Los cambios de volumen constante y presión constante son sólo dos direcciones particulares en este espacio.
Este análisis también sostiene no importa cómo aumenta la energía dQ{displaystyle mathrm {d} Q} se inyecta en la muestra, a saber, por conducción de calor, irradiación, inducción electromagnética, decaimiento radioactivo, etc.
Relación entre capacidades caloríficas
Para cualquier volumen específico .. {displaystyle nu }, denota p.. ()T){displaystyle p_{nu }(T)} la función que describe cómo la presión varía con la temperatura T{displaystyle T}, según lo permitido por la ecuación de estado, cuando el volumen específico del material se mantiene forzadamente constante en .. {displaystyle nu }. Analógicamente, para cualquier presión P{displaystyle P}, vamos .. P()T){displaystyle nu _{P}(T)} ser la función que describe cómo el volumen específico varía con la temperatura, cuando la presión se mantiene constante a P{displaystyle P}. Es decir, esas funciones son tales
Entonces, de la relación termodinámica fundamental se sigue que
- cP()T,P,.. )− − cV()T,P,.. )=T[dp.. dT()T)][d.. PdT()T)]{displaystyle c_{P}(T,P,nu)-c_{V}(T,P,nu)=Tleft[{frac] {fnK} p_{nu }{mathrm {d} t} {derecha]left[{frac {mathrm {d} nu _{m}{mathrm {d} t} {derecha]}
Esta ecuación se puede reescribir como
- cP()T,P,.. )− − cV()T,P,.. )=.. Tα α 2β β T,{displaystyle c_{P}(T,P,nu)-c_{V}(T,P,nu)=nu T{frac {alpha ^{2}{beta ♪♪
dónde
- α α {displaystyle alpha } es el coeficiente de expansión térmica,
- β β T{displaystyle beta _{T} es la compresibilidad isotérmica,
ambos dependiendo del estado ()T,P,.. ){displaystyle (T,P,nu)}.
La relación de capacidad de calor, o índice adiabático, es la relación cP/cV{displaystyle C_{P}/c_{V} de la capacidad de calor a presión constante a la capacidad de calor a volumen constante. A veces también se conoce como el factor de expansión istrópico.
Cálculo a partir de primeros principios
El método Monte Carlo de la integral de trayectoria es un enfoque numérico para determinar los valores de la capacidad calorífica, basado en principios de dinámica cuántica. Sin embargo, se pueden hacer buenas aproximaciones para gases en muchos estados utilizando métodos más simples que se describen a continuación. Para muchos sólidos compuestos de átomos relativamente pesados (número atómico > hierro), a temperaturas no criogénicas, la capacidad calorífica a temperatura ambiente se aproxima a 3R = 24,94 julios por kelvin por mol de átomos (Dulong– Petit law, R es la constante de los gases). Las aproximaciones a baja temperatura para gases y sólidos a temperaturas inferiores a sus temperaturas características de Einstein o Debye se pueden realizar mediante los métodos de Einstein y Debye que se analizan a continuación. Sin embargo, se debe prestar atención a la consistencia de tales consideraciones ab-initio cuando se usan junto con una ecuación de estado para el material considerado.
Gases ideales
Para un gas ideal, evaluando las derivadas parciales anteriores según la ecuación de estado, donde R es la constante del gas, para un gas ideal
- PV=nRT,{displaystyle PV=nRT,}
- CP− − CV=T()∂ ∂ P∂ ∂ T)V,n()∂ ∂ V∂ ∂ T)P,n,{displaystyle ¿Por qué?
- P=nRTV⇒ ⇒ ()∂ ∂ P∂ ∂ T)V,n=nRV,{displaystyle P={frac {nRT}{V}fn} Rightarrow left({frac {partial P}{partial T}right)_{V,n}={frac {nR}{V},}
- V=nRTP⇒ ⇒ ()∂ ∂ V∂ ∂ T)P,n=nRP.{displaystyle V={frac "Rightarrow left"({frac {partial V}{partial T}right)_{P,n}={frac {nR}{P}}
Sustitución
- T()∂ ∂ P∂ ∂ T)V,n()∂ ∂ V∂ ∂ T)P,n=TnRVnRP=nRTVnRP=PnRP=nR,{displaystyle Tleft({frac {partial P}{partial T}right)_{V,n}left({frac {partial V}{partial T}right)_{P,n}=T{frac} {nR}{V}{frac} {nR}{}={frac} {fn} {fn} {fnK} {fnK}} {fnK}} {fn} {fn}}} {fn}} {fn}} {fn}}}} {fn}} {f}} {fnK}}}} {fnKf}}} {f}}}} {f}}}}}} {f}}}}} {f}f}}f}f}f}f}f}f}}f}f}f}fnKf}fnf}f}f}f}f}fnfnKfnKf}fnf}fnf}}fnfnfnh}f}fnfnKfnKfnKf}}fnKf}fnh}}}}}fn {nR} {fn}=P{frac} {nR}=nR,}
esta ecuación se reduce simplemente a la relación de Mayer:
- CP,m− − CV,m=R.{displaystyle C_{P,m}-C_{V,m}=R.
Las diferencias en las capacidades caloríficas definidas por la anterior relación de Mayer solo son exactas para un gas ideal y serían diferentes para cualquier gas real.
Contenido relacionado
Nucleosíntesis
Modulador electro-óptico
Onza

































































































![{displaystyle {begin{cases}displaystyle mathrm {d} T{frac {partial F}{partial T}}(T,P,V)+mathrm {d} P{frac {partial F}{partial P}}(T,P,V)+mathrm {d} V{frac {partial F}{partial V}}(T,P,V)&=&0\[2ex]displaystyle mathrm {d} T{frac {partial U}{partial T}}(T,P,V)+mathrm {d} P{frac {partial U}{partial P}}(T,P,V)+mathrm {d} V{frac {partial U}{partial V}}(T,P,V)&=&mathrm {d} Uend{cases}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/957c9a178ff753bc04a30bed2819d7e5155314a0)







![{displaystyle c_{P}(T,P,nu)-c_{V}(T,P,nu)=Tleft[{frac {mathrm {d} p_{nu }}{mathrm {d} T}}(T)right]left[{frac {mathrm {d} nu _{P}}{mathrm {d} T}}(T)right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/24554d2ae7d16cbb75b6ad485bf92856b55cf7bd)


