Pizarra (roca)
La pizarra es una roca metamórfica homogénea, foliada y de grano fino derivada de una roca sedimentaria original de tipo esquisto compuesta de arcilla o... (leer más)
La caolinita o caolín es un mineral arcilloso, de composición química Al 2 Si 2 O 5 (OH) 4. Es un importante mineral industrial. Es un mineral de silicato en capas, con una hoja tetraédrica de sílice (SiO 4) unida a través de átomos de oxígeno a una hoja octaédrica de alúmina (AlO 6) octaedro. Las rocas ricas en caolinita se conocen como caolín o arcilla china. A veces se hace referencia al caolín con el término anticuado lithomarge, del griego antiguo litho- y latín marga, que significa "piedra de marga". Actualmente, el nombre lithomarge puede referirse a una forma compacta y masiva de caolín.
El nombre caolín se deriva de Gaoling (chino:高嶺; pinyin: Gāolǐng; literalmente, 'High Ridge'), un pueblo chino cerca de Jingdezhen en la provincia de Jiangxi, en el sureste de China. El nombre entró en inglés en 1727 a partir de la versión francesa de la palabra: caolín, siguiendo los informes de François Xavier d'Entrecolles sobre la fabricación de porcelana Jingdezhen.
La caolinita tiene una baja capacidad de contracción-hinchamiento y una baja capacidad de intercambio catiónico (1–15 meq/100 g). Es un mineral blando, terroso, generalmente blanco (arcilla de filosilicato dioctaédrico), producido por la meteorización química de minerales de silicato de aluminio como el feldespato. En muchas partes del mundo es de color rosa-naranja-rojo por el óxido de hierro, lo que le da un tono óxido distintivo. Concentraciones más bajas producen colores blanco, amarillo o naranja claro. A veces se encuentran capas alternas, como en el Parque Estatal Providence Canyon en Georgia, Estados Unidos. Los grados comerciales de caolín se suministran y transportan como polvo seco, fideos semisecos o suspensión líquida.
La fórmula química de la caolinita utilizada en mineralogía es Al 2 Si 2 O 5 (OH) 4; sin embargo, en las aplicaciones cerámicas, la fórmula se suele escribir en términos de óxidos, por lo que la fórmula de la caolinita es Al 2 O 3 ·2SiO 2 · 2H2O. _ _
En comparación con otros minerales arcillosos, la caolinita es química y estructuralmente simple. Se describe como un mineral arcilloso 1:1 o TO porque sus cristales consisten en capas TO apiladas. Cada capa TO consta de una lámina tetraédrica (T) compuesta por iones de silicio y oxígeno unidos a una lámina octaédrica (O) compuesta por iones de oxígeno, aluminio e hidroxilo. La hoja T se llama así porque cada ion de silicio está rodeado por cuatro iones de oxígeno que forman un tetraedro. la ohoja se llama así porque cada ion de aluminio está rodeado por seis iones de oxígeno o hidroxilo dispuestos en las esquinas de un octaedro. Las dos láminas de cada capa están fuertemente unidas mediante iones de oxígeno compartidos, mientras que las capas están unidas mediante puentes de hidrógeno entre el oxígeno en la cara exterior de la lámina T de una capa y el hidroxilo en la cara exterior de la lámina O de la siguiente capa.
 Vista de la estructura de la lámina tetraédrica (T) de caolinita
Vista de la estructura de la lámina tetraédrica (T) de caolinita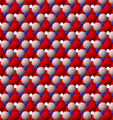 Vista de la estructura de la lámina octaédrica (O) de caolinita
Vista de la estructura de la lámina octaédrica (O) de caolinita Estructura cristalina de caolinita mirando a lo largo de las capas.
Estructura cristalina de caolinita mirando a lo largo de las capas.Una capa de caolinita no tiene carga eléctrica neta y, por lo tanto, no hay grandes cationes (como calcio, sodio o potasio) entre las capas como ocurre con la mayoría de los otros minerales arcillosos. Esto explica la capacidad de intercambio iónico relativamente baja de la caolinita. El estrecho enlace de hidrógeno entre las capas también impide que las moléculas de agua se infiltren entre las capas, lo que explica el carácter no hinchable de la caolinita.
Cuando se humedecen, los pequeños cristales de caolinita en forma de placa adquieren una capa de moléculas de agua que hacen que los cristales se adhieran entre sí y le dan a la arcilla de caolín su cohesión. Los enlaces son lo suficientemente débiles como para permitir que las placas se deslicen entre sí cuando se moldea la arcilla, pero lo suficientemente fuertes como para mantener las placas en su lugar y permitir que la arcilla moldeada conserve su forma. Cuando la arcilla se seca, la mayoría de las moléculas de agua se eliminan y las placas de hidrógeno se unen directamente entre sí, de modo que la arcilla seca es rígida pero aún frágil. Si la arcilla se vuelve a humedecer, volverá a ser plástica.
Las arcillas del grupo de las caolinitas sufren una serie de transformaciones de fase tras el tratamiento térmico en aire a presión atmosférica.
La molienda de alta energía de la caolinita da como resultado la formación de una fase mecanoquímicamente amorfa similar al metacaolín, aunque las propiedades de este sólido son bastante diferentes. El proceso de molienda de alta energía es altamente ineficiente y consume una gran cantidad de energía.
Por debajo de 100 °C (212 °F), la exposición al aire seco eliminará lentamente el agua líquida del caolín. El estado final de esta transformación se denomina "cuero seco". Entre 100 °C y aproximadamente 550 °C (1022 °F), el agua líquida restante se expulsa de la caolinita. El estado final de esta transformación se denomina "completamente seco". A lo largo de este rango de temperatura, la expulsión de agua es reversible: si el caolín se expone al agua líquida, se reabsorberá y se desintegrará en su forma de partículas finas. Las transformaciones posteriores no son reversibles y representan cambios químicos permanentes.
La deshidratación endotérmica de la caolinita comienza a 550–600 °C produciendo metacaolín desordenado, pero se observa una pérdida continua de hidroxilo hasta los 900 °C (1650 °F). Aunque históricamente hubo mucho desacuerdo sobre la naturaleza de la fase de metacaolín, una extensa investigación ha llevado a un consenso general de que el metacaolín no es una simple mezcla de sílice amorfa (SiO 2) y alúmina (Al 2 O 3), sino más bien un compuesto amorfo complejo. estructura que conserva cierto orden de mayor alcance (pero no estrictamente cristalino) debido al apilamiento de sus capas hexagonales.
El calentamiento adicional a 925-950 ° C convierte el metacaolín en una espinela de aluminio y silicio que a veces también se denomina estructura de tipo gamma-alúmina:
Tras la calcinación por encima de 1050 °C, la fase espinela se nuclea y se transforma en mullita plaquetaria y cristobalita altamente cristalina:
Finalmente, a 1400 °C aparece la forma de "aguja" de mullita, que ofrece aumentos sustanciales en la resistencia estructural y la resistencia al calor. Esta es una transformación estructural pero no química. Ver gres para más información en este formulario.
La caolinita es uno de los minerales más comunes; se extrae, como caolín, en Malasia, Pakistán, Vietnam, Brasil, Bulgaria, Bangladesh, Francia, Reino Unido, Irán, Alemania, India, Australia, Corea del Sur, República Popular China, República Checa, España, Sur África, Tanzania y Estados Unidos.
Los mantos de saprolita caolinítica son comunes en Europa occidental y septentrional. Las edades de estos mantos son del Mesozoico al Cenozoico Temprano.
La arcilla de caolinita se encuentra en abundancia en los suelos que se han formado a partir de la meteorización química de las rocas en climas cálidos y húmedos, por ejemplo, en áreas de selva tropical. Comparando suelos a lo largo de un gradiente hacia climas progresivamente más fríos o secos, la proporción de caolinita disminuye, mientras que la proporción de otros minerales arcillosos como la ilita (en climas más fríos) o la esmectita (en climas más secos) aumenta. Tales diferencias relacionadas con el clima en el contenido de minerales arcillosos a menudo se utilizan para inferir cambios en el clima en el pasado geológico, donde los suelos antiguos han sido enterrados y preservados.
En el sistema de clasificación del Institut National pour l'Étude Agronomique au Congo Belge (INEAC), los suelos en los que la fracción arcillosa es predominantemente caolinita se denominan caolisol (de caolín y suelo).
En los EE. UU., los principales depósitos de caolín se encuentran en el centro de Georgia, en un tramo de la línea de caída de la costa atlántica entre Augusta y Macon. Esta área de trece condados se llama el cinturón de "oro blanco"; Sandersville es conocida como la "Capital mundial del caolín" debido a su abundancia de caolín. A fines del siglo XIX, existía una industria activa de minería a cielo abierto de caolín en el extremo sureste de Pensilvania, cerca de las ciudades de Landenberg y Kaolin, y en lo que hoy es White Clay Creek Preserve. El producto fue llevado por tren a Newark, Delaware, en la línea Newark-Pomeroy, a lo largo de la cual todavía se pueden ver muchas minas de arcilla a cielo abierto. Los depósitos se formaron entre finales del Cretácico y principios del Paleógeno, hace unos 100 a 45 millones de años, en sedimentos derivados de rocas ígneas y metacaolín erosionadas.La producción de caolín en EE. UU. durante 2011 fue de 5,5 millones de toneladas.
Durante el Máximo Térmico del Paleoceno-Eoceno, los sedimentos depositados en el área de Esplugafreda de España se enriquecieron con caolinita de una fuente detrítica debido a la denudación.
Se encuentran dificultades cuando se trata de explicar la formación de caolinita en condiciones atmosféricas mediante la extrapolación de datos termodinámicos de las síntesis de alta temperatura más exitosas. La Iglesia y Van Oosterwijk-Gastuche (1978)pensó que las condiciones bajo las cuales se nucleará la caolinita se pueden deducir de los diagramas de estabilidad, basados en datos de disolución. Sin embargo, debido a la falta de resultados convincentes en sus propios experimentos, La Iglesia y Van Oosterwijk-Gastuche (1978) tuvieron que concluir que había otros factores, aún desconocidos, involucrados en la nucleación a baja temperatura de la caolinita. Debido a las velocidades de cristalización muy lentas observadas de la caolinita en solución a temperatura ambiente, Fripiat y Herbillon (1971) postularon la existencia de altas energías de activación en la nucleación de la caolinita a baja temperatura.
A altas temperaturas, los modelos termodinámicos de equilibrio parecen ser satisfactorios para la descripción de la disolución y nucleación de caolinita, porque la energía térmica es suficiente para superar las barreras energéticas involucradas en el proceso de nucleación. La importancia de las síntesis a temperatura ambiente y presión atmosférica para la comprensión del mecanismo implicado en la nucleación de minerales arcillosos radica en la superación de estas barreras energéticas. Como indican Caillère y Hénin (1960), los procesos involucrados deberán estudiarse en experimentos bien definidos, porque es virtualmente imposible aislar los factores involucrados por mera deducción de sistemas fisicoquímicos naturales complejos como el medio ambiente del suelo. Fripiat y Herbillon (1971),en una revisión sobre la formación de caolinita, planteó la pregunta fundamental de cómo un material desordenado (es decir, la fracción amorfa de los suelos tropicales) podría alguna vez transformarse en una estructura ordenada correspondiente. Esta transformación parece tener lugar en los suelos sin grandes cambios en el medio ambiente, en un período de tiempo relativamente corto ya temperatura (y presión) ambiente.
La síntesis a baja temperatura de minerales arcillosos (con caolinita como ejemplo) tiene varios aspectos. En primer lugar, el ácido silícico que se suministrará al cristal en crecimiento debe estar en forma monomérica, es decir, la sílice debe estar presente en una solución muy diluida (Caillère et al., 1957; Caillère y Hénin, 1960; Wey y Siffert, 1962). Millot, 1970). Para evitar la formación de geles de sílice amorfa que se precipitan a partir de soluciones sobresaturadas sin reaccionar con los cationes de aluminio o magnesio para formar silicatos cristalinos, el ácido silícico debe estar presente en concentraciones por debajo de la solubilidad máxima de la sílice amorfa. El principio detrás de este requisito previo se puede encontrar en la química estructural: "Dado que los iones de polisilicato no tienen un tamaño uniforme, no pueden organizarse junto con los iones metálicos en una red cristalina regular". (Iler, 1955, pág. 182)
El segundo aspecto de la síntesis a baja temperatura de caolinita es que los cationes de aluminio deben estar hexacoordinados con respecto al oxígeno (Caillère y Hénin, 1947; Caillère et al., 1953; Hénin y Robichet, 1955). Gastuche et al. (1962)y Caillère y Hénin (1962) concluyeron que la caolinita solo puede formarse cuando el hidróxido de aluminio está en forma de gibbsita. De lo contrario, el precipitado formado será un "gel mixto alumino-silícico" (como dice Millot, 1970, p. 343). Si fuera el único requisito, se podrían recolectar grandes cantidades de caolinita simplemente agregando polvo de gibbsita a una solución de sílice. Sin duda, tendrá lugar un marcado grado de adsorción de la sílice en solución por las superficies de gibbsita, pero, como se dijo antes, la mera adsorción no crea la red de capas típica de los cristales de caolinita.
El tercer aspecto es que estos dos componentes iniciales deben incorporarse en un cristal mixto con una estructura de capas. De la siguiente ecuación (dada por Gastuche y DeKimpe, 1962) para la formación de caolinita
se puede ver que se deben eliminar cinco moléculas de agua de la reacción por cada molécula de caolinita formada. Gastuche y DeKimpe (1962) han proporcionado pruebas de campo que ilustran la importancia de la eliminación del agua de la reacción de la caolinita. Mientras estudiaban la formación del suelo en una roca basáltica en Kivu (Zaire), notaron cómo la aparición de caolinita dependía del "grado de drenaje"del área involucrada. Se encontró una clara distinción entre áreas con buen drenaje (es decir, áreas con una marcada diferencia entre las estaciones húmeda y seca) y aquellas áreas con mal drenaje (es decir, áreas perennemente pantanosas). La caolinita solo se encontró en las áreas con claras alternancias estacionales entre húmedo y seco. Tamura y Jackson (1953) han subrayado la posible importancia de la alternancia de condiciones húmedas y secas en la transición de alofana a caolinita. Moore (1964) también ha señalado el papel de las alternancias entre humectación y secado en la formación de caolinita.
Las síntesis de caolinita a altas temperaturas (más de 100 °C [212 °F]) son relativamente bien conocidas. Están, por ejemplo, las síntesis de Van Nieuwenberg y Pieters (1929); Noll (1934); Noll (1936); norton (1939); Roy y Osborn (1954); Rey (1961); Hawkins y Roy (1962); Tomura et al. (1985); Satokawa et al. (1994) y Huertas et al. (1999). Se conocen relativamente pocas síntesis a baja temperatura (cf. Brindley y DeKimpe (1961); DeKimpe (1969); Bogatyrev et al. (1997)).
Las síntesis de laboratorio de caolinita a temperatura ambiente y presión atmosférica han sido descritas por DeKimpe et al. (1961). A partir de esas pruebas, el papel de la periodicidad se vuelve convincentemente claro. De Kimpe et al. (1961) habían utilizado adiciones diarias de alúmina (como AlCl 3 ·6 H 2 O) y sílice (en forma de silicato de etilo) durante al menos dos meses. Además, se realizaron ajustes de pH todos los días mediante la adición de ácido clorhídrico o hidróxido de sodio. Tales adiciones diarias de Si y Al a la solución en combinación con las titulaciones diarias con ácido clorhídrico o hidróxido de sodio durante al menos 60 días habrán introducido el elemento necesario de periodicidad. Sólo ahora el papel real de lo que se ha descrito como el "envejecimiento" (La alteración) de los aluminosilicatos amorfos (como, por ejemplo, había señalado Harder, 1978) puede entenderse completamente. Como tal, el tiempo no provoca ningún cambio en un sistema cerrado en equilibrio; pero una serie de alternancias de condiciones que cambian periódicamente (por definición, que tienen lugar en un sistema abierto) provocarán la formación a baja temperatura de más y más caolinita en fase estable en lugar de aluminosilicatos amorfos (mal definidos).
A partir de 2009, hasta el 70% de la caolinita se utilizó en la producción de papel. Su uso proporciona brillo en algunos grados de papel estucado.
El caolín también es conocido por sus capacidades para inducir y acelerar la coagulación de la sangre. En abril de 2008, el Instituto de Investigación Médica Naval de EE. UU. anunció el uso exitoso de una infusión de aluminosilicato derivado de caolinita en una gasa tradicional, conocida comercialmente como gasa de combate QuikClot, que sigue siendo la pinza hemostática elegida por todas las ramas del ejército de EE. UU.
El caolín se usa (o se usó en el pasado):
Los humanos a veces comen caolín por placer o para suprimir el hambre, una práctica conocida como geofagia. En África, el caolín utilizado para tales fines se conoce como kalaba (en Gabón y Camerún), calaba y calabachop (en Guinea Ecuatorial). El consumo es mayor entre las mujeres, especialmente durante el embarazo, y en ocasiones las mujeres de la región dicen que su uso es un hábito análogo al de fumar cigarrillos entre los hombres.
Esta práctica también se ha observado dentro de una pequeña población de mujeres afroamericanas en el sur de los Estados Unidos, especialmente en Georgia, probablemente traída con las tradiciones de los africanos antes mencionados a través de la esclavitud. Allí, el caolín se llama tierra blanca, tiza o arcilla blanca.
| Diamante de fuego NFPA 704 |
|---|
 100Caolín 100Caolín |
El caolín generalmente se reconoce como seguro, pero puede causar una irritación leve de la piel o las membranas mucosas. Los productos de caolín también pueden contener trazas de sílice cristalina, un carcinógeno conocido.
Las personas pueden estar expuestas al caolín en el lugar de trabajo al inhalar el polvo o por contacto con la piel o los ojos.
La Administración de Salud y Seguridad Ocupacional (OSHA) ha establecido el límite legal (límite de exposición permisible) para la exposición al caolín en el lugar de trabajo en 15 mg/m3 de exposición total y 5 mg/m3 de exposición respiratoria durante una jornada laboral de 8 horas. El Instituto Nacional para la Seguridad y Salud Ocupacional (NIOSH) ha establecido un límite de exposición recomendado (REL) de 10 mg/m de exposición total TWA 5 mg/m de exposición respiratoria durante una jornada laboral de 8 horas.
Los resultados de la investigación muestran que la utilización de caolinita en la ingeniería geotécnica puede reemplazarse alternativamente por ilita más segura, especialmente si su presencia es inferior al 10,8% de la masa rocosa total.
La pizarra es una roca metamórfica homogénea, foliada y de grano fino derivada de una roca sedimentaria original de tipo esquisto compuesta de arcilla o... (leer más)
(leer más)
La antroposfera es esa parte del medio ambiente que los humanos crean o modifican para su uso en actividades humanas y hábitats humanos. Es una de las... (leer más)