Cáncer papilar de tiroides
El cáncer papilar de tiroides (carcinoma papilar de tiroides, PTC) es el tipo más común de cáncer de tiroides y representa entre el 75 y el 85 por ciento de todos los casos de cáncer de tiroides. Se presenta con mayor frecuencia en mujeres y en el grupo de edad de 20 a 55 años. También es el tipo de cáncer predominante en niños con cáncer de tiroides y en pacientes con cáncer de tiroides que han recibido radiación previa en la cabeza y el cuello. A menudo está bien diferenciado, crece lentamente y está localizado, aunque puede hacer metástasis.
Diagnosis
El carcinoma papilar de tiroides se descubre habitualmente en un examen de rutina como un nódulo tiroideo asintomático que aparece como una masa en el cuello. En algunos casos, la masa puede haber producido síntomas locales. Esta masa normalmente se deriva a una biopsia por aspiración con aguja fina (PAAF) para su investigación. La precisión de la PAAF es muy alta y es un proceso ampliamente utilizado en estos casos. Otros métodos de investigación incluyen la ecografía y la gammagrafía. La ecografía es una prueba útil para distinguir lesiones sólidas de quísticas y para identificar calcificaciones. La ecografía tiroidea también es muy eficaz para descubrir microcarcinomas, que son carcinomas muy pequeños (<1 cm).
Los carcinomas papilares de tiroides también se descubren cuando se encuentra un nódulo duro en un bocio multinodular, cuando se detectan ganglios linfáticos cervicales agrandados o cuando hay lesiones metastásicas no identificadas en otras partes del cuerpo. Las lesiones en expansión que se encuentran en la glándula tiroides, especialmente si son dolorosas, deben examinarse ya que pueden indicar la presencia de carcinoma papilar de tiroides. Otros signos clínicos que podrían indicar la presencia de un carcinoma papilar de tiroides son la fijación a la tráquea, una masa firme en el cuello, daño a los nervios simpáticos cervicales o laríngeos recurrentes. El cinco por ciento de la población puede tener nódulos tiroideos y la mayoría serán benignos.
La evaluación adecuada incluye una ecografía del cuello, seguida de estudios de laboratorio. Los pacientes suelen consultar a un endocrinólogo y a un cirujano (cirujano de cabeza y cuello o cirujano endocrino).
Marcadores
La tiroglobulina puede utilizarse como marcador tumoral en el cáncer papilar de tiroides bien diferenciado. La tinción con HBME-1 puede ser útil para diferenciar carcinomas papilares de carcinomas foliculares; en las lesiones papilares tiende a ser positiva.
La expresión reducida de ATP5E está significativamente asociada con el diagnóstico de cáncer papilar de tiroides y puede servir como un marcador tumoral temprano de la enfermedad. Los microARN séricos han demostrado un buen rendimiento diagnóstico para distinguir a los pacientes con cáncer papilar de tiroides de los pacientes con nódulos tiroideos benignos y controles sanos, y se sugieren como un enfoque diagnóstico novedoso y mínimamente invasivo en la práctica clínica.
Patología

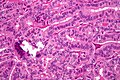
El cáncer papilar de tiroides recibe su nombre de las papilas que hay entre sus células, visibles en el microscopio. Entre sus características se incluyen:
- Características Huérfano Annie eye nuclear clearings (nuclei with uniform tinte, which appear empty due to dusty chromatin and marginal micronucleoli) and psammoma bodies on light microscopy. El primero es útil para identificar la variante folicular de carcinomas de tiroides papilares.
- La diseminación linfática es más común que la diseminación hematogénea
- La multifocalidad es común
- El llamado tiroides aberrantes laterales es generalmente una metástasis de ganglios linfáticos de un carcinoma tiroideo papilar.
- El microcarcinoma papilar es un subconjunto de cáncer de tiroides papilar definido como medición inferior o igual a 1 cm. La mayor incidencia de microcarcinoma papilar de tiroides en una serie de autopsias fue reportada por Harach et al. en 1985, quien encontró 36 de 101 autopsias consecutivas para tener un microcarcinoma incidental. Michael Pakdaman et al. reportar la mayor incidencia en una serie quirúrgica retrospectiva en 49,9% de 860 casos. Las estrategias de gestión del microcarcinoma papilar incidental en ultrasonido (y confirmadas en FNAB) van desde la tiroidectomía total con ablación de yodo radiactivo hasta la observación sola. Harach et al. sugerir el uso del término "Tumor papilar culto" para evitar dar a los pacientes angustia por tener cáncer. Fue Woolner et al. quien primero acuñó arbitrariamente el término "carcinoma papilar culto" en 1960, para describir carcinomas papilares ≤ 1,5 cm de diámetro.
Se reconocen varias variantes, aunque el carcinoma papilar de tiroides clásico es el más frecuente: variante folicular microscópica, variante esclerosante difusa, variante de células altas, variante de células columnares, variante en uña de clavo y otras. La variante folicular encapsulada, específicamente cuando no es invasiva, ha sido recientemente reclasificada como neoplasia folicular de tiroides no invasiva con características nucleares papilares.
Aunque el carcinoma papilar tiene una propensión a invadir los vasos linfáticos, es menos probable que invada los vasos sanguíneos. Este tipo de tumores no suelen estar encapsulados y tienen una alta tendencia a hacer metástasis localmente en los ganglios linfáticos, lo que puede producir estructuras quísticas cerca de la tiroides que son difíciles de diagnosticar debido a la escasez de tejido maligno. Además, los tumores papilares pueden hacer metástasis en los pulmones y producir algunos nódulos o los campos pulmonares pueden presentar un aspecto de copo de nieve en toda su extensión.
Otras características del carcinoma papilar son que en la ecografía se observan mitocondrias aumentadas, RER aumentado, así como microvellosidades apicales aumentadas. Además, los carcinomas papilares tienen un crecimiento indolente y en el 40 por ciento de los casos se extienden fuera de la cápsula.
- Micrografía de carcinoma tiroideo papilar que demuestra papilla prominente con núcleos fibrovasculares. Mancha.
- Micrografo mostrando que la papilla en el carcinoma tiroideo papilar se compone de células cuboideales. Mancha.
- Los surcos nucleares (las flechas indican uno de ellos)
- Seudoinclusiones nucleares, que son invaginaciones de citoplasma en el núcleo.
- Micrografo (vista de alta potencia) mostrando cambios nucleares en el carcinoma de tiroides papilar (PTC), que incluyen formación de groove, despejado óptico, inclusiones eosinofílicas y superposición de núcleos. Mancha.
- Micrograph (alta vista de la energía) del PTC demostrando núcleos nucleares de limpieza y superposición. Mancha.
- Micrografo de carcinoma tiroideo papilar metastásico a un ganglio linfático. Mancha.
- Micrografía de carcinoma tiroideo papilar, variante celular alta - alta magnificación. Mancha.
- Micrografía de carcinoma tiroideo papilar, variante celular alta - aumento intermedio. Mancha.
mutaciones asociadas
Las mutaciones asociadas con el cáncer papilar de tiroides son principalmente dos formas de translocación cromosómica y una forma de mutación puntual. Estas alteraciones conducen a la activación de una vía carcinógena común: la vía MAPK/ERK.
Las translocaciones cromosómicas que involucran al protooncogén RET (que codifica un receptor de tirosina quinasa que desempeña papeles esenciales en el desarrollo de células neuroendocrinas) ubicado en el cromosoma 10q11 ocurren en aproximadamente una quinta parte de los cánceres papilares de tiroides. Las oncoproteínas de fusión generadas se denominan proteínas RET/PTC (ret/carcinoma papilar de tiroides) y activan constitutivamente RET y la vía MAPK/ERK. La frecuencia de translocaciones ret/PTC es significativamente mayor en los cánceres papilares que surgen en niños y después de la exposición a la radiación. El gen NTRK1 (que codifica el receptor TrkA), ubicado en el cromosoma 1q, se transloca de manera similar en aproximadamente el 5 por ciento al 10 por ciento de los cánceres papilares de tiroides.
Aproximadamente entre un tercio y la mitad de los carcinomas papilares de tiroides presentan mutaciones puntuales en el oncogén BRAF, que también activan la vía MAPK/ERK. En estos casos, las mutaciones BRAF encontradas fueron la mutación V600E. Tras realizar un análisis multivariante, se encontró que la ausencia de cápsula tumoral era el único parámetro asociado (P=0,0005) con la mutación BRAF V600E. Según estudios recientes, los cánceres papilares portadores de la mutación común V600E tienden a tener un curso a largo plazo más agresivo. Las mutaciones BRAF son frecuentes en el carcinoma papilar y en los cánceres indiferenciados que se han desarrollado a partir de tumores papilares.
Actualmente se están investigando muchos más cambios en la expresión génica. Estudios anteriores demostraron la desregulación de diferentes microARN en el cáncer de tiroides. Por ejemplo, la regulación negativa de miR-369-3p y la consiguiente regulación positiva de su diana TSPAN13 parecen estar implicadas en la fisiopatología del cáncer de tiroides.
Mutaciones mitocondriales: los haplogrupos de mtADN (mitocondriales), caracterizados por conjuntos únicos de polimorfismos no patológicos de mtADN, pueden modular la patogénesis de diferentes enfermedades en poblaciones específicas debido a su influencia en la expresión de genes relacionados con la producción de ROS y la eficiencia de acoplamiento de OXPHOS y la regulación de la apoptosis. En las poblaciones asiáticas, el haplogrupo D4a se asocia con un mayor riesgo de cáncer de tiroides, mientras que en las poblaciones europeas, se considera que el haplogrupo K protege contra el cáncer de tiroides.
Tratamiento
La cirugía sigue siendo el pilar del tratamiento del cáncer papilar de tiroides. Las directrices revisadas de 2009 de la Asociación Estadounidense de Tiroides para el cáncer papilar de tiroides establecen que el procedimiento inicial debe ser una tiroidectomía casi total o total. La lobectomía tiroidea por sí sola puede ser un tratamiento suficiente para carcinomas papilares intratiroideos pequeños (<1 cm), de bajo riesgo, unifocales, en ausencia de irradiación previa de cabeza y cuello o metástasis ganglionar cervical radiológica o clínicamente comprometida.
- Enfermedades mínimas (diámetro hasta 1,0 centímetros) - hemitiroidectomía (o lobectomía unilateral) e istectomía pueden ser suficientes. Hay alguna discusión de si esto es todavía preferible sobre la tiroidectomía total para este grupo de pacientes.
- Enfermedad bruta (diámetro más de 1.0 centímetros) - la tiroidectomía total, y la eliminación central de ganglios linfáticos compartimiento es la terapia de elección. Los ganglios laterales adicionales de cuello se pueden eliminar al mismo tiempo si un ultrasonido guiado FNA y el lavado de cáncer de tiroglobulina TG fue positivo en la evaluación de ultrasonido del nodo preoperatorio.
- Reducción del riesgo de recurrencia, si se eliminan los nodos del compartimento central en la cirugía original.
- El 30-85% del carcinoma papilar es enfermedad multifocal. La hemitiroidectomía puede dejar la enfermedad en el otro lóbulo. Sin embargo, la enfermedad multifocal en el lóbulo remanente puede no necesariamente ser clínicamente significativa o servir como un detrimento para la supervivencia del paciente.
- La facilidad de monitoreo con la tiroglobulina (sensibilidad para recoger la recurrencia se aumenta en presencia de la tiroidectomía total, y la ablación de la tiroides normal remanente por radioiodo de baja dosis 131 después de una dieta baja de yodo (LID).
- Facilidad de detección de enfermedades metastásicas por ultrasonido de nodos de tiroides y cuello.
- Las complicaciones postoperatorias en centros de cirugía tiroidea de alto volumen con cirujanos experimentados son comparables a las de la hemitiroidectomía.
Argumentos a favor de la hemitiroidectomía:
- La mayoría de los pacientes tienen cáncer de bajo riesgo con un pronóstico excelente, con resultados de supervivencia similares en pacientes de bajo riesgo que sufren tiroidectomía total versus hemitiroidectomía.
- Menos probabilidad de paciente que requiera reemplazo de hormona tiroidea durante toda la vida después de la cirugía.
Las exploraciones corporales totales de la tiroides son menos confiables para detectar recurrencias que la TG y la ecografía.
Los tumores papilares tienden a ser más agresivos en pacientes mayores de 45 años. En tales casos, puede ser necesario realizar una resección más extensa que incluya partes de la tráquea. También se deben extirpar el músculo esternocleidomastoideo, la vena yugular y el nervio accesorio si dicho procedimiento permite una resección tumoral aparentemente completa. Si queda una cantidad significativa de tumor residual en el cuello, se ha indicado la radioterapia externa, que ha demostrado ser útil especialmente en aquellos casos en los que el tumor residual no capta yodo radiactivo.
Después de la extirpación quirúrgica de la tiroides, el paciente espera alrededor de 4 a 6 semanas para luego recibir terapia con yodo radiactivo. Esta terapia tiene como objetivo detectar y destruir cualquier metástasis y tejido residual en la tiroides. El tratamiento puede repetirse entre 6 y 12 meses después del tratamiento inicial de la enfermedad metastásica cuando la enfermedad reaparece o no ha respondido por completo.
A los pacientes se les administra levotiroxina como terapia de reemplazo hormonal de por vida después de la cirugía, especialmente después de una tiroidectomía total. La quimioterapia con cisplatino o doxorrubicina ha demostrado una eficacia limitada, sin embargo, podría ser útil para los pacientes con metástasis óseas para mejorar su calidad de vida. A los pacientes también se les prescribe levotiroxina y yodo radiactivo después de la cirugía. La levotiroxina influye en el crecimiento y la maduración de los tejidos y está involucrada en el crecimiento, el metabolismo y el desarrollo normales. En caso de metástasis, a los pacientes se les prescriben agentes antineoplásicos que inhiben el crecimiento y la proliferación celular y ayudan a paliar los síntomas en la enfermedad progresiva.
Después de un tratamiento exitoso, el 35 por ciento de los pacientes pueden experimentar una recurrencia en un lapso de 40 años. Además, los pacientes pueden experimentar una alta incidencia de metástasis en nódulos, con un 35 por ciento de casos de metástasis en ganglios cervicales. Aproximadamente el 20 por ciento de los pacientes desarrollarán múltiples tumores dentro de la glándula tiroides.
Existe un debate en curso sobre el mejor tratamiento en relación con el procedimiento quirúrgico óptimo para el cáncer papilar de tiroides. Se ha descubierto que el pronóstico de los pacientes con cáncer papilar de tiroides depende de la edad del paciente, el tamaño del tumor, la presencia de enfermedad metastásica y la presencia de invasión tumoral en los tejidos adyacentes cerca de la glándula tiroides. Estudios recientes han examinado un enfoque más conservador de la cirugía y han demostrado que la hemitiroidectomía puede ser aceptable para pacientes con cáncer papilar de tiroides de bajo riesgo con un tamaño de tumor de 1 cm a 4 cm sin presencia de invasión a los tejidos que rodean la tiroides o metástasis. Estudios que examinan grandes bases de datos de pacientes con cáncer papilar de tiroides han concluido que no existe una ventaja de supervivencia para los pacientes con cáncer papilar de tiroides en estadio I de 1 a 4 cm que reciben tiroidectomía total frente a hemitiroidectomía. A la luz de estos datos, la elección del curso óptimo de tratamiento quirúrgico y médico del cáncer papilar de tiroides debe implicar la toma de decisiones compartida por el paciente, los endocrinólogos y los cirujanos.
Prognosis
Según la fuente, la tasa de supervivencia general a 5 años para el cáncer papilar de tiroides es del 96 o 97 por ciento, con una tasa de supervivencia a 10 años del 93 por ciento.
Para un pronóstico más específico de casos individuales, existen al menos 13 sistemas de puntuación conocidos para el pronóstico; entre los más utilizados se encuentran:
- AGES - Edad, Grado, Extensión de enfermedad, tamaño
- AMES - Edad, Metastasis, Extensión de enfermedad, Tamaño
- MACIS - Metastasis, Edad en presentación, Completo de resección quirúrgica, Invasión (extratiroidal), Tamaño (es una modificación del sistema AGES). Es probablemente el método de estadificación más fiable disponible. También conocido como el sistema MAICS.
- TNM - Tumor, nodo, metástasis. Para el carcinoma tiroideo (diferenciado) es notable que el marcador es diferente según la edad.
MACIS
El sistema MACIS para estimar el pronóstico del cáncer papilar de tiroides fue desarrollado por Clive S. Grant en la Clínica Mayo y se basó en una evaluación cuidadosa de un grupo grande de pacientes. Es probablemente el método de estadificación más confiable disponible.
Asigna puntuaciones a los principales factores implicados y utiliza la suma de estas puntuaciones para calcular el pronóstico:
| Factores | Puntuación | |
|---|---|---|
| Distante Métasis: diseminación del cáncer a áreas fuera del cuello | Sí. | 3 |
| No | 0 | |
| Age en el momento en que se descubrió el tumor | Menos de 39 años | 3.1 |
| Más de 40 años | 0,08 x edad | |
| Invasión en las áreas circundantes del cuello como se ve por el ojo desnudo | Sí. | 1 |
| No | 0 | |
| Costensidad de la resección quirúrgica (o extirpación) del tumor | Incompleto | 1 |
| Completa | 0 | |
| Sel tamaño del tumor | 0.3 x tamaño en cm | |
| Suma de la puntuación de MACIS | 20 años de supervivencia |
|---|---|
| ▪ 6.0 | 99% |
| 6.0 - 6.99 | 89% |
| 7.0 - 7.99 | 56% |
| ■ 8.0 | 24% |
La mayoría de los pacientes entran en la categoría de bajo riesgo (puntuación MACIS inferior a 6,0) y se curan del cáncer en el momento de la cirugía.
Los niños con metástasis pulmonares múltiples y/o aspecto miliar aún tienen un pronóstico excelente a largo plazo si se les brinda el tratamiento adecuado.
Etapa
Según la estadificación general del cáncer en estadios I a IV, el cáncer papilar de tiroides tiene una tasa de supervivencia a 5 años del 100 por ciento para los estadios I y II, del 93 por ciento para el estadio III y del 51 por ciento para el estadio IV.
Epidemiología

Según el informe Surveillance, Epidemiology, and End Results (SEER), la incidencia del cáncer papilar ha aumentado de 4,8 a 14,9 por 100.000 entre 1975 y 2012. Las mujeres tienen más probabilidades de padecer cáncer papilar en comparación con los hombres, con una relación de incidencia de 2,5 a 1, donde la mayoría de los cánceres se diagnostican entre los 40 y los 50 años en las mujeres. Sin embargo, las tasas de mortalidad por cáncer papilar se mantuvieron estáticas entre 2003 y 2012 en 0,5 por 100.000 hombres y mujeres. Hubo un aumento de la incidencia de cáncer papilar entre 1910 y 1960 debido al uso de radiación ionizante en el tratamiento de cánceres de cabeza y cuello infantiles. La incidencia disminuyó después de que se abandonara la radioterapia. La exposición ambiental a la radiación, como los bombardeos atómicos de Hiroshima y Nagasaki y el desastre de Chernóbil, también provocan un aumento del cáncer papilar de tiroides en la infancia entre 5 y 20 años después de la exposición a la radiación. Los antecedentes familiares de síndrome de cáncer de tiroides, como la poliposis adenomatosa familiar, el complejo de Carney, la neoplasia endocrina múltiple tipo 2 (MEN-2), el síndrome de Werner y el síndrome de Cowden, aumentan el riesgo de padecer cáncer papilar.
Referencias
- ^ a b c d e f Capítulo 20: Mitchell, Richard Sheppard; Kumar, Vinay; Abbas, Abul K; Fausto, Nelson (2007). Robbins Basic Pathology. Filadelfia: Saunders. ISBN 978-1-4160-2973-1. Octava edición.
- ^ Hu MI, Vassilopoulou-Sellin R, Lustig R, Lamont JP "Thyroid and Parathyroid Cancers" Archivado 2010-02-28 en el Wayback Machine in Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ (Eds) Cancer Management: A Multidisciplinary Approach. Archivado para 2013-10-04 en el Wayback Machine 11 ed. 2008.
- ^ Dinets A, Hulchiy M, Sofiadis A, Ghaderi M, Höög A, Larsson C, Zedenius J (junio de 2012). "Carcinoma tiroideo papilar post-cornobyl caracterización clínica, genética e inmunohistoquímica de 70 casos de adultos ucranianos". European Journal of Endocrinology. 166 (6): 1049-1060. doi:10.1530/EJE-12-0144. PMC 3361791. PMID 22457234.
- ^ Al-Brahim N, Asa SL (julio de 2006). "Carcinoma de tiroides papilar: una visión general". Archivos de Patología & Laboratorio Medicina. 130 (7): 1057-1062. doi:10.5858/2006-130-1057-PTCAO. PMID 16831036.
- ^ a b c "La tiroides y sus enfermedades". Archivado desde el original el 2010-07-01. Retrieved 2010-07-15.
- ^ Recordaje quirúrgico 7a edición ISBN 978-1451192919
- ^ Lin JD (febrero de 2008). "Troglobulina y cáncer de tiroides humano". Clinica Chimica Acta; Revista Internacional de Química Clínica. 388 (1–2): 15–21. doi:10.1016/j.cca.2007.11.002. PMID 18060877.
- ^ Tuttle RM, Leboeuf R, Martorella AJ (septiembre de 2007). "Cáncer de tiroides papilar: monitoreo y terapia". Clínicas de Endocrinología y Metabolismo de América del Norte. 36 (3): 753–78, vii. doi:10.1016/j.ecl.2007.04.004. PMID 17673127.
- ^ Papotti M, Rodriguez J, De Pompa R, Bartolazzi A, Rosai J (abril de 2005). "Expresión Galectin-3 y HBME-1 en tumores tiroideos bien diferenciados con arquitectura folicular de potencial maligno incierto". Patología moderna. 18 (4): 541-546. doi:10.1038/modpathol.3800321. PMID 15529186.
- ^ Hurtado-López LM, Fernández-Ramírez F, Martínez-Peñafiel E, Carrillo Ruiz JD, Herrera González NE (junio 2015). "Análisis molecular de las subunidades de ATPase Mitocondrial en cáncer de tiroides papilar: ¿Es ATP5E una posible marcadora de tumores tempranos?". Medical Science Monitor. 21: 1745-1751. doi:10.12659/MSM.893597. PMC 4482184. PMID 26079849.
- ^ Chen, Yuping; Dong, Bingtian; Huang, Lichun; Huang, Huibin (2022-06-10). "MicroRNAs suero como biomarcadores para el diagnóstico de carcinoma tiroideo papilar: un metaanálisis". Bosnian Journal of Basic Medical Sciences. 22 (6): 862–871. doi:10.17305/bjbms.2022.7343. ISSN 1840-4812. PMC 9589316. PMID 35678022.
- ^ "Carcinoma papilar de tiroides (Hi Pow)". University of Connecticut Health Center. Archivado desde el original el 2012-07-09. Retrieved 2008-09-14.
- ^ Yang GC, Liebeskind D, Messina AV (junio de 2001). "Aspiración de aguja fina guiada por Ultrasound de la tiroides evaluada por la mancha Ultrafast Papanicolaou: datos de 1135 biopsias con un seguimiento de dos a seis años". Tiroides. 11 (6): 581-589. doi:10.1089/105072501750302895. PMID 11442006.
- ^ Escofet X, Khan AZ, Mazarani W, Woods WG (enero de 2007). "Las razones para aprender: un enfoque de estudio de caso. Tejido tiroideo aberrante postre: ¿Siempre es maligno?". The Journal of the Royal Society for the Promotion of Health. 127 (1): 45–46. doi:10.1177/1466424007073207. PMID 17319317. S2CID 33217834.
- ^ Shaha AR (mayo de 2007). "Clasificación TNM del carcinoma tiroideo". World Journal of Surgery. 31 (5): 879-887. doi:10.1007/s00268-006-0864-0. PMID 17308849. S2CID 23121159.
- ^ Harach HR, Fransila KO, Wasenius VM (agosto de 1985). "Carcinoma papilar culto de la tiroides. Un hallazgo "normal" en Finlandia. Un estudio sistemático de autopsia". Cáncer. 56 (3): 531-538. doi:10.1002/1097-0142(19850801)56:3 obtenidos531::AID-CNCR2820560321]3.0.CO;2-3PMID 2408737. S2CID 23922855.
- ^ Pakdaman MN, Rochon L, Gologan O, Tamilia M, Garfield N, Hier MP, et al. (noviembre de 2008). "Incidencia y comportamiento histopatológico de microcarcinomas papilares: estudio de 429 casos". Otolaryngología – Cirugía de la cabeza y el cuello. 139 (5): 718–722. doi:10.1016/j.otohns.2008.014. PMID 18984270. S2CID 5937993.
- ^ Woolner LB, Lemmon ML, Beahrs OH, Black BM, Keating FR (enero de 1960). "Carcinoma papilar culto de la glándula tiroides: un estudio de 140 casos observados en un período de 30 años". The Journal of Clinical Endocrinology and Metabolism. 20 (1): 89-105. doi:10.1210/jcem-20-1-89. PMID 13845950.
- ^ Nikiforov YE, Seethala RR, Tallini G, Baloch ZW, Basolo F, Thompson LD, et al. (agosto 2016). "Revisión de Nomenclatura para Variante Follicular Encapsulado de Carcinoma Tiroideo Papillario: Un Cambio Paradigma para Reducir el Tratamiento Sobrevoltorio de Tumores Indolentos". JAMA Oncología. 2 (8): 1023-1029. doi:10.1001/jamaoncol.2016.0386. PMC 5539411. PMID 27078145.
- ^ a b Carcinoma tiroideo papilar en eMedicine
- ^ Grani G, Fumarola A (junio de 2014). "Troglobulina en el lavado de aspiración fina de ganglios linfáticos: revisión sistemática y metaanálisis de la precisión diagnóstica". The Journal of Clinical Endocrinology and Metabolism. 99 (6): 1970-1982. doi:10.1210/jc.2014-1098. PMID 24617715.
- ^ "Carcinomas papilares". Archivado desde el original el 19 de abril de 2010. Retrieved 2010-07-15.
- ^ Ip YT, Dias Filho MA, Chan JK (diciembre de 2010). "Inclusiones núcleas y pseudoinclusiones: amigos o enemigos del patólogo quirúrgico?". International Journal of Surgical Pathology. 18 (6): 465–481. doi:10.1177/1066896910385342. PMID 21081532. S2CID 22429137.
- ^ Li P, Dong M, Wang Z (mayo 2019). "La regulación de la TSPAN13 por miR-369-3p inhibe la proliferación celular en el cáncer de tiroides papilar (PTC)". Bosnian Journal of Basic Medical Sciences. 19 (2): 146–154. doi:10.17305/bjbms.2018.2865. PMC 6535391. PMID 30114378.
- ^ Bai RK, Leal SM, Covarrubias D, Liu A, Wong LJ (mayo de 2007). "El fondo genético mitocondrial modifica el riesgo de cáncer de mama". Cancer Research. 67 (10): 4687–4694. doi:10.1158/0008-5472.CAN-06-3554. PMID 17510395.
- ^ Fang H, Shen L, Chen T, He J, Ding Z, Wei J, et al. (agosto de 2010). "Modulación específica para el cáncer de mama, colorrectal y tiroides de los haplogrupos mitocondriales". BMC Cáncer. 10 (1): 421. doi:10.1186/1471-2407-10-421. PMC 2933623. PMID 20704735.
- ^ Cocoş R, Schipor S, Badiu C, Raicu F (marzo 2018). "El haplogrupo K de ADN mitocondrial contribuye a la protección contra el cáncer de tiroides en una población del sudeste de Europa". Mitocondrion. 39: 43–50. doi:10.1016/j.mito.2017.08.012. PMID 28851673.
- ^ Cooper DS, Doherty GM, Haugen BR, Hauger BR, Kloos RT, Lee SL, et al. (noviembre de 2009). "Revisado guías de gestión de la Asociación Americana de Tiroides para pacientes con nódulos tiroideos y cáncer diferenciado de tiroides". Tiroides. 19 11): 1167–1214. doi:10.1089/thy.2009.0110. Hdl:2027.42/78131. PMID 19860577.
- ^ Udelsman R, Shaha AR (julio de 2005). "¿Es la tiroidectomía total la mejor gestión quirúrgica posible para el cáncer de tiroides bien diferenciado?". El Lancet. Oncología. 6 (7): 529–531. doi:10.1016/S1470-2045(05)70247-3. PMID 15992702.
- ^ Carcinoma tiroideo papilar ~ tratamiento en eMedicine
- ^ "Carcinoma de tiroides papilar". Archivado desde el original el 19 de julio de 2008. Retrieved 2010-07-15.
- ^ Adam MA, Pura J, Goffredo P, Dinan MA, Hyslop T, Reed SD, et al. (enero 2015). "Impact of extent of surgery on survival for papillary thyroid cancer patients younger than 45 years". The Journal of Clinical Endocrinology and Metabolism. 100 (1): 115–121. doi:10.1210/jc.2014-3039. PMC 5399499. PMID 25337927.
- ^ a b Números de base de datos nacionales sobre cáncer en los Estados Unidos, desde la página 10 en: Biersack, H-J; Grünwald, F, eds. (2005). Cáncer de tiroides. Berlín: Springer. ISBN 978-3-540-22309-2. (Nota: Book also states that the 14 percent 10-year survival for anaplastic tiroid cancer was overestimated)
- ^ "New York Thyroid Center: Prognosis Staging for Thyroid Cancer". Archivado desde el original el 14 de julio de 2007. Retrieved 2007-12-22.
- ^ a b c d e f Centro de Tiroides de Nueva York Cáncer de tiroides Estadificación del pronóstico Consultado el 30 de abril de 2010
- ^ Vermeer-Mens JC, Goemaere NN, Kuenen-Boumeester V, de Muinck Keizer-Schrama SM, Zwaan CM, Devos AS, de Krijger RR (diciembre de 2006). "Carcinoma tiroides papilar infantil con metástasis pulmonar miliaria". Journal of Clinical Oncology. 24 (36): 5788–5789. doi:10.1200/JCO.2006.08.8732. PMID 17179115.
- ^ cancer.org Cáncer de tiroides Por la Sociedad Americana del Cáncer. A su vez citó: AJCC Cancer Staging Manual (7th ed).
- ^ Andrey Bychkov, doctor, doctor. "Tyroid & paratiroides - anomalías congénitas / metabólicas - quiste del conducto tiroglosal". PathologyOutlines.
{{cite web}}: CS1 maint: múltiples nombres: lista de autores (link) Tema Completado: 14 marzo 2016. Cambios menores: 27 de enero de 2021. - ^ a b Tuttle RM, Ross DS, Mulder JE. "Cáncer de tiroides papilar". UpToDate. Retrieved 13 de octubre 2017.
- ^ Vaisman F, Corbo R, Vaisman M (2011). "Carcinoma tiroideo en niños y adolescentes revisión sistemática de la literatura". Journal of Thyroid Research. 2011: 845362. doi:10.4061/2011/845362. PMC 3166725. PMID 21904689.
Enlaces externos
- Cáncer de tiroides en DMOZ
- Gestión del cáncer Manual: Cánceres de tiroides y paratiroides
- Haugen BR, Alexander EK, Bible KC, Doherty GM, Mandel SJ, Nikiforov YE, et al. (enero 2016). "2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer". Tiroides. 26 (1): 1–133. doi:10.1089/thy.2015.0020. PMC 4739132. PMID 26462967.



![Nuclear pseudoinclusions, which are invaginations of cytoplasm into the nucleus.[23]](https://upload.wikimedia.org/wikipedia/commons/thumb/9/9d/Histopathology_of_papillary_thyroid_cancer_in_a_thyroglossal_cyst%2C_high_magnification%2C_annotated.jpg/120px-Histopathology_of_papillary_thyroid_cancer_in_a_thyroglossal_cyst%2C_high_magnification%2C_annotated.jpg)