Cáncer de pulmón
El cáncer de pulmón, también conocido como carcinoma de pulmón (dado que aproximadamente el 98-99 % de todos los cánceres de pulmón son carcinomas), es un tumor de pulmón maligno caracterizado por un crecimiento celular descontrolado. en los tejidos del pulmón. Los carcinomas de pulmón se derivan de células malignas transformadas que se originan como células epiteliales o de tejidos compuestos por células epiteliales. Otros cánceres de pulmón, como los raros sarcomas de pulmón, se generan por la transformación maligna de los tejidos conectivos (es decir, nervio, grasa, músculo, hueso), que surgen de las células mesenquimales. Los linfomas y los melanomas (de linajes de células linfoides y melanocíticas) rara vez pueden provocar cáncer de pulmón.
Con el tiempo, este crecimiento descontrolado puede hacer metástasis (es decir, extenderse más allá del pulmón) ya sea por extensión directa, ingresando a la circulación linfática, o mediante diseminación hematógena transmitida por la sangre, hacia tejidos cercanos u otras partes más distantes del cuerpo. La mayoría de los cánceres que se originan dentro de los pulmones, conocidos como cánceres de pulmón primarios, son carcinomas. Los dos tipos principales son el carcinoma de pulmón de células pequeñas (SCLC) y el carcinoma de pulmón de células no pequeñas (NSCLC). Los síntomas más comunes son tos (incluida la tos con sangre), pérdida de peso, dificultad para respirar y dolores en el pecho.
La gran mayoría (85 %) de los casos de cáncer de pulmón se deben al consumo prolongado de tabaco. Alrededor del 10 al 15% de los casos ocurren en personas que nunca han fumado. Estos casos a menudo son causados por una combinación de factores genéticos y exposición al gas radón, asbesto, humo de segunda mano u otras formas de contaminación del aire. El cáncer de pulmón se puede ver en radiografías de tórax y tomografías computarizadas (TC). El diagnóstico se confirma mediante biopsia, que generalmente se realiza mediante broncoscopia o guía por TC.
El principal método de prevención es evitar los factores de riesgo, incluidos el tabaquismo y la contaminación del aire. El tratamiento y los resultados a largo plazo dependen del tipo de cáncer, la etapa (grado de propagación) y la salud general de la persona. La mayoría de los casos no son curables. Los tratamientos comunes incluyen cirugía, quimioterapia y radioterapia. El NSCLC a veces se trata con cirugía, mientras que el SCLC generalmente responde mejor a la quimioterapia y la radioterapia.
En 2020, el cáncer de pulmón se presentó en 2,2 millones de personas en todo el mundo y provocó 1,8 millones de muertes. Es la causa más común de muerte relacionada con el cáncer tanto en hombres como en mujeres. La edad promedio al diagnóstico es de 71 años. En la mayoría de los países, la tasa de supervivencia a cinco años es de alrededor del 10 al 20 %, mientras que en Japón es del 33 %, en Israel del 27 % y en la República de Corea del 25 %. Los resultados suelen ser peores en el mundo en desarrollo.
Signos y síntomas
El cáncer de pulmón temprano a menudo no presenta síntomas. Cuando surgen síntomas, a menudo son problemas respiratorios inespecíficos (tos, dificultad para respirar y/o dolor en el pecho) que pueden diferir de una persona a otra. Aquellos que experimentan tos tienden a informar una tos nueva o un aumento en la frecuencia o la fuerza de una tos preexistente. Alrededor de una cuarta parte tose con sangre, desde pequeñas estrías en el esputo hasta grandes cantidades. Alrededor de la mitad de las personas diagnosticadas con cáncer de pulmón experimentan dificultad para respirar, mientras que entre el 25 y el 50 % experimentan un dolor torácico persistente y sordo que permanece en el mismo lugar con el tiempo. Además de los síntomas respiratorios, algunos experimentan síntomas sistémicos que incluyen pérdida de apetito, pérdida de peso, debilidad general, fiebre y sudores nocturnos.
Algunos síntomas menos comunes sugieren tumores en ubicaciones particulares. Los tumores en el tórax pueden causar problemas respiratorios al obstruir la tráquea o interrumpir el nervio del diafragma, dificultad para tragar al comprimir el esófago, ronquera al interrumpir los nervios de la laringe y el síndrome de Horner al interrumpir el sistema nervioso simpático. El síndrome de Horner también es común en los tumores en la parte superior del pulmón, conocidos como tumores de Pancoast, que también causan dolor en el hombro que se irradia hacia el lado del dedo meñique del brazo, así como la destrucción de las costillas superiores. Los ganglios linfáticos inflamados por encima de la clavícula pueden indicar un tumor que se ha diseminado dentro del tórax. Los tumores que obstruyen el flujo de sangre al corazón pueden causar el síndrome de la vena cava superior, mientras que los tumores que se infiltran en el área alrededor del corazón pueden causar acumulación de líquido alrededor del corazón, arritmia e insuficiencia cardíaca.
Alrededor de un tercio de las personas diagnosticadas con cáncer de pulmón tienen síntomas causados por metástasis en sitios distantes del pulmón. El cáncer de pulmón puede hacer metástasis en cualquier parte del cuerpo, con diferentes síntomas según la ubicación. Las metástasis cerebrales pueden causar dolor de cabeza, náuseas, vómitos, convulsiones y déficits neurológicos. Las metástasis óseas pueden causar dolor, fracturas óseas y compresión de la médula espinal. La metástasis en la médula ósea puede agotar las células sanguíneas y causar leucoeritroblastosis (células inmunes inmaduras en la sangre). Las metástasis hepáticas pueden causar agrandamiento del hígado, dolor en el cuadrante superior derecho del abdomen, fiebre y pérdida de peso.
Los tumores de pulmón a menudo también provocan la liberación de hormonas que alteran el cuerpo, que a su vez causan síntomas inusuales, llamados síndromes paraneoplásicos. La liberación inadecuada de hormonas puede causar cambios drásticos en las concentraciones de minerales en la sangre. La más común es la hipercalcemia causada por la producción excesiva de proteína relacionada con la hormona paratiroidea u hormona paratiroidea. La hipercalcemia puede manifestarse como náuseas, vómitos, dolor abdominal, estreñimiento, aumento de la sed, micción frecuente y alteración del estado mental. Las personas con cáncer de pulmón también suelen experimentar hipopotasemia debido a la secreción inadecuada de la hormona adrenocorticotrópica, así como hiponatremia debido a la sobreproducción de hormona antidiurética o péptido natriurético auricular. Alrededor de un tercio de las personas con cáncer de pulmón desarrollan acropaquias, mientras que uno de cada diez experimenta osteoartropatía primaria hipertrófica. Una variedad de trastornos autoinmunes pueden surgir como síndromes paraneoplásicos en personas con cáncer de pulmón, incluido el síndrome miasténico de Lambert-Eaton (que causa debilidad muscular), neuropatías sensoriales, inflamación muscular, inflamación del cerebro y deterioro autoinmune del cerebelo, el sistema límbico o el tronco encefálico. Hasta 1 de cada 12 personas con cáncer de pulmón tiene problemas de coagulación paraneoplásica, incluida la tromboflebitis venosa migratoria, coágulos en el corazón y coagulación intravascular diseminada. Los síndromes paraneoplásicos que involucran la piel y los riñones son raros y cada uno ocurre en hasta el 1% de las personas con cáncer de pulmón.
Diagnóstico
A una persona sospechosa de tener cáncer de pulmón primero se le realizarán varias pruebas de imagen para evaluar la presencia, extensión y ubicación de los tumores. Primero, muchos proveedores de atención primaria realizan una radiografía de tórax para buscar una masa dentro del pulmón. La radiografía puede revelar una masa evidente, el ensanchamiento del mediastino (sugestivo de diseminación a los ganglios linfáticos allí), atelectasia (colapso pulmonar), consolidación (neumonía) o derrame pleural; sin embargo, algunos tumores de pulmón no son visibles por rayos X. A continuación, muchos se someten a una tomografía computarizada (TC), que puede revelar el tamaño y la ubicación de los tumores.
Un diagnóstico definitivo de cáncer de pulmón requiere una biopsia del tejido sospechoso y un examen histológico de células cancerosas. Dada la ubicación de los tumores de cáncer de pulmón, las biopsias a menudo se pueden obtener mediante técnicas mínimamente invasivas: un broncoscopio de fibra óptica que puede recuperar tejido (a veces guiado por ultrasonido endobronquial), aspiración con aguja fina u otra biopsia guiada por imágenes a través de la piel. A aquellos que no pueden someterse a un procedimiento de biopsia típico, se les puede tomar una biopsia líquida (es decir, una muestra de algún fluido corporal) que puede contener ADN tumoral circulante que se puede usar para pruebas moleculares.
Las imágenes también se utilizan para evaluar la extensión de la propagación del cáncer. La tomografía por emisión de positrones (PET, por sus siglas en inglés) o la combinación de PET-CT a menudo se usan para localizar metástasis en el cuerpo. Dado que la tomografía por emisión de positrones (PET) no se puede utilizar en el cerebro, la Red Nacional Integral del Cáncer recomienda la resonancia magnética nuclear (RMN), o la TC cuando la RMN no esté disponible, para escanear el cerebro en busca de metástasis en personas con NSCLC y tumores grandes, o tumores que se han propagado a los ganglios linfáticos cercanos. Cuando se sospecha la diseminación a los ganglios linfáticos oa un solo sitio, a menudo se realiza una biopsia de la sospecha de metástasis para confirmar que es cancerosa. Los cánceres de pulmón comúnmente hacen metástasis en el cerebro, los huesos, el hígado y las glándulas suprarrenales.
El cáncer de pulmón a menudo puede aparecer como un nódulo pulmonar solitario en una radiografía de tórax. Sin embargo, el diagnóstico diferencial es amplio y muchas otras enfermedades también pueden dar esta apariencia, incluyendo cáncer metastásico, hamartomas y granulomas infecciosos causados por tuberculosis, histoplasmosis o coccidioidomicosis.
Clasificación
| Tipo histológico | Incidencia por 100.000 al año |
|---|---|
| Todos los tipos | 66,9 |
| Adenocarcinoma | 22.1 |
| Carcinoma de células escamosas | 14.4 |
| Carcinoma de células pequeñas | 9.8 |
En el momento del diagnóstico, los cánceres de pulmón se clasifican según el tipo de células de las que se deriva el tumor; los tumores derivados de diferentes células progresan y responden al tratamiento de manera diferente. Hay dos tipos principales de cáncer de pulmón, clasificados por el tamaño y la apariencia de las células malignas vistas por un histopatólogo bajo un microscopio: cáncer de pulmón de células pequeñas (CPCP; 15 % de los diagnósticos de cáncer de pulmón) y cáncer de pulmón de células no pequeñas (NSCLC; 85% de los diagnósticos). Los tumores SCLC a menudo se encuentran cerca del centro de los pulmones, en las vías respiratorias principales. Sus células parecen pequeñas con límites mal definidos, sin mucho citoplasma, muchas mitocondrias y tienen núcleos distintivos con ADN de aspecto granular y sin nucléolos visibles. Los NSCLC comprenden un grupo de tres tipos de cáncer: adenocarcinoma, carcinoma de células escamosas y carcinoma de células grandes. Casi el 40 % de los cánceres de pulmón son adenocarcinomas, que generalmente provienen del tejido pulmonar periférico. Sus células crecen en grupos tridimensionales, se parecen a las células glandulares y pueden producir mucina. El carcinoma de células escamosas causa alrededor del 30% de los cánceres de pulmón. Por lo general, ocurren cerca de las vías respiratorias grandes. Los tumores consisten en láminas de células, con capas de queratina. Una cavidad hueca y muerte celular asociada se encuentran comúnmente en el centro del tumor. Menos del 10% de los cánceres de pulmón son carcinomas de células grandes, llamados así porque las células son grandes, con exceso de citoplasma, núcleos grandes y nucléolos conspicuos.
Varios tipos de cáncer de pulmón se subclasifican según las características de crecimiento de las células cancerosas. Los adenocarcinomas se clasifican como lepídicos (que crecen a lo largo de la superficie de las paredes alveolares intactas), acinares y papilares o micropapilares y de patrón sólido. Los adenocarcinomas lepídicos tienden a ser menos agresivos; los adenocarcinomas micropapilares y de patrón sólido son los más agresivos.
Además de examinar la morfología celular, las biopsias también suelen teñirse con inmunohistoquímica para confirmar la clasificación del cáncer de pulmón. Los SLCL portan los marcadores de células neuroendocrinas, como cromogranina, sinaptofisina y CD56. Los adenocarcinomas tienden a expresar Napsin-A y TTF-1; los carcinomas de células escamosas carecen de Napsin-A y TTF-1, pero expresan p63 y su isoforma p40 específica del cáncer. CK7 y CK20 también se usan comúnmente para diferenciar los cánceres de pulmón. CK20 se encuentra en varios tipos de cáncer, pero por lo general está ausente en el cáncer de pulmón. CK7 está presente en muchos cánceres de pulmón, pero está ausente en los carcinomas de células escamosas. Además, el material de biopsia del tumor original o las metástasis a menudo se analizan para determinar su perfil molecular a fin de determinar la elegibilidad para terapias dirigidas.
Alrededor del 10 % de los cánceres de pulmón son tipos más raros. Estos incluyen mezclas de los subtipos anteriores, como el carcinoma adenoescamoso. Los subtipos raros incluyen tumores carcinoides, carcinomas de glándulas bronquiales y carcinomas sarcomatoides. Un subgrupo de adenocarcinomas de pulmón muestra un crecimiento lepídico. Anteriormente conocido como carcinoma bronquioloalveolar, estos cánceres suelen tener un mejor pronóstico que otros tipos de cáncer de pulmón.
| Tipo histológico | Napsin-A | TTF-1 |
|---|---|---|
| Carcinoma de células escamosas | Negativo | Negativo |
| Adenocarcinoma | Positivo | Positivo |
| Carcinoma de células pequeñas | Negativo | Positivo |
Puesta en escena
La estadificación del cáncer de pulmón es una evaluación del grado de propagación del cáncer desde su fuente original. Es uno de los factores que afectan tanto al pronóstico como al tratamiento potencial del cáncer de pulmón.
El SCLC suele organizarse con un sistema relativamente simple; los cánceres se califican como "estadio limitado" o "etapa extensiva". Alrededor de un tercio de las personas son diagnosticadas en la etapa limitada, lo que significa que el cáncer se limita a un lado del tórax, dentro del alcance de un solo campo de radioterapia tolerable. Los otros dos tercios se diagnostican en la "etapa extensa", con cáncer diseminado a ambos lados del tórax o a otras partes del cuerpo.
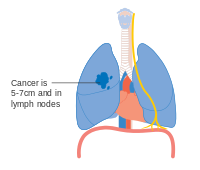
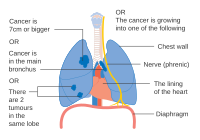
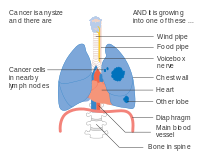
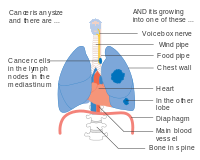
El NSCLC, y algunas veces el SCLC, generalmente se estadifica con el sistema de estadificación del American Joint Committee on Cancer's Tumor, Node, Metástasis (TNM). El tamaño y la extensión del tumor (T), la diseminación a los ganglios linfáticos regionales (N) y las metástasis distantes (M) se califican individualmente y se combinan para formar 'grupos por etapas'. Los tumores relativamente pequeños se denominan T1, que se subdividen según el tamaño: los tumores de ≤ 1 centímetro (cm) de ancho se denominan T1a; 1-2 cm T1b; 2–3 cm T1c. Los tumores de hasta 5 cm de ancho, o aquellos que se han diseminado a la pleura visceral (tejido que cubre el pulmón) oa los bronquios principales, se denominan T2. T2a designa tumores de 3 a 4 cm; Tumores T2b de 4-5 cm. Los tumores T3 miden hasta 7 cm de ancho, tienen múltiples nódulos en el mismo lóbulo del pulmón o invaden la pared torácica, el diafragma (o el nervio que lo controla) o el área alrededor del corazón. Los tumores que miden más de 7 cm, tienen nódulos diseminados en diferentes lóbulos de un pulmón o invaden el mediastino (centro de la cavidad torácica), el corazón, los vasos sanguíneos más grandes que irrigan el corazón, la tráquea, el esófago o la columna vertebral se denominan T4. La estadificación de los ganglios linfáticos depende de la extensión de la diseminación local: con el cáncer metastásico sin ganglios linfáticos (N0), ganglios pulmonares o hiliares (a lo largo de los bronquios) del mismo lado que el tumor (N1), ganglios linfáticos mediastínicos o subcarinales (en medio de los pulmones, N2), o ganglios linfáticos en el lado opuesto del pulmón del tumor (N3). Las metástasis se clasifican como sin metástasis (M0), metástasis cercanas (M1a; el espacio alrededor del pulmón o el corazón, o el pulmón opuesto), una metástasis distante única (M1b) o metástasis múltiples (M1c). Estas puntuaciones T, N y M se combinan para designar un "grupo de etapa" por el cancer Los cánceres que se limitan a tumores más pequeños se denominan estadio I. Los que tienen tumores más grandes o se propagan a los ganglios linfáticos más cercanos se clasifican en estadio II. Los que tienen los tumores más grandes o la diseminación extensa de los ganglios linfáticos se encuentran en el estadio III. Los cánceres que han hecho metástasis están en etapa IV. Cada etapa se subdivide en función de la combinación de puntuaciones T, N y M. Alrededor del 40% de los diagnosticados con NSCLC tienen enfermedad en estadio IV en el momento del diagnóstico.
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| TNM | Grupo de estudio |
|---|---|
| T1a N0 M0 | IA1 |
| T1b N0 M0 | IA2 |
| T1c N0 M0 | IA3 |
| T2a N0 M0 | IB |
| T2b N0 M0 | IIA |
| T1–T2 N1 M0 | IIB |
| T3 N0 M0 | |
| T1–T2 N2 M0 | IIIA |
| T3 N1 M0 | |
| T4 N0-N1 M0 | |
| T1–T2 N3 M0 | IIIB |
| T3-T4 N2 M0 | |
| T3-T4 N3 M0 | IIIC |
| Cualquier T, cualquier N, M1a-M1b | IVA |
| Cualquier T, cualquier N, M1c | IVB |
- Diagramas de características principales de estadificación
Proyección
Algunas formas de evaluación de la población pueden permitir la detección y el tratamiento más tempranos de los casos de cáncer de pulmón, lo que reduce las muertes por cáncer de pulmón. En algunos ensayos, los programas de detección que proporcionaron tomografías computarizadas de dosis baja de personas con alto riesgo de cáncer de pulmón (es decir, personas que fuman tabaco y tienen entre 55 y 74 años) redujeron la mortalidad general por cáncer de pulmón. El Grupo de Trabajo de Servicios Preventivos de los Estados Unidos recomienda la detección anual con TC de dosis baja en aquellos que tienen un historial de tabaquismo total de al menos 30 paquetes-año y tienen entre 55 y 80 años.
Tratamiento
El tratamiento para el cáncer de pulmón depende del tipo de célula específico del cáncer, cuánto se ha propagado y el estado funcional de la persona. Los tratamientos comunes para los cánceres en etapa temprana incluyen la extirpación quirúrgica del tumor, la quimioterapia y la radioterapia. Para los cánceres en etapas posteriores, la quimioterapia y la radioterapia se combinan con terapias moleculares dirigidas más nuevas e inhibidores de puntos de control inmunitarios. Todos los regímenes de tratamiento del cáncer de pulmón se combinan con cambios en el estilo de vida y cuidados paliativos para mejorar la calidad de vida.
Cáncer de pulmón de células pequeñas
El SCLC en etapa limitada generalmente se trata con una combinación de quimioterapia y radioterapia. Para la quimioterapia, las pautas de la Red Nacional Integral del Cáncer y del Colegio Americano de Médicos del Tórax recomiendan de cuatro a seis ciclos de un quimioterapéutico a base de platino (cisplatino o carboplatino) combinado con etopósido o irinotecán. Esto generalmente se combina con radioterapia torácica (45 Gray (Gy) dos veces al día) junto con los dos primeros ciclos de quimioterapia. La terapia de primera línea causa remisión hasta en el 80% de quienes la reciben; sin embargo, la mayoría de las personas recaen con una enfermedad resistente a la quimioterapia. Aquellos que recaen reciben quimioterapias de segunda línea. El topotecán y la lurbinectedina están aprobados por la FDA de EE. UU. para este propósito. A veces también se utilizan irinotecán, paclitaxel, docetaxel, vinorelbina, etopósido y gemcitabina, que tienen una eficacia similar. La irradiación craneal profiláctica también puede reducir el riesgo de metástasis cerebrales y mejorar la supervivencia en aquellos con enfermedad en etapa limitada.
De manera similar, el SCLC en etapa extensa se trata primero con etopósido junto con cisplatino o carboplatino. La radioterapia se usa solo para reducir los tumores que causan síntomas particularmente graves. La combinación de quimioterapia estándar con un inhibidor del punto de control inmunitario puede mejorar la supervivencia de una minoría de los afectados, extendiendo la vida útil de la persona promedio en alrededor de 2 meses.
Cáncer de pulmón de células no pequeñas
Para el NSCLC en estadio I y estadio II, la primera línea de tratamiento suele ser la extirpación quirúrgica del lóbulo pulmonar afectado. Para aquellos que no toleran la extirpación completa del lóbulo, se puede extirpar un trozo más pequeño de tejido pulmonar mediante resección en cuña o cirugía de segmentectomía. Aquellos con tumores ubicados en el centro y sistemas respiratorios por lo demás sanos pueden someterse a una cirugía más extrema para extirpar un pulmón completo (neumonectomía). Cirujanos torácicos experimentados y una clínica de cirugía de alto volumen mejoran las posibilidades de supervivencia. Aquellos que no pueden o no quieren someterse a una cirugía pueden recibir radioterapia. La radioterapia corporal estereotáctica es la mejor práctica, generalmente administrada varias veces durante 1 a 2 semanas. La quimioterapia tiene poco efecto en aquellos con NSCLC en etapa I y puede empeorar los resultados de la enfermedad en aquellos con la enfermedad más temprana. En aquellos con enfermedad en etapa II, la quimioterapia generalmente se inicia de seis a doce semanas después de la cirugía, con hasta cuatro ciclos de cisplatino, o carboplatino en aquellos con problemas renales, neuropatía o discapacidad auditiva, combinado con vinorelbina, pemetrexed, gemcitabina o docetaxel..
El tratamiento para las personas con NSCLC en estadio III depende de la naturaleza de su enfermedad. Aquellos con una propagación más limitada pueden someterse a una cirugía para extirpar el tumor y los ganglios linfáticos afectados, seguidos de quimioterapia y posiblemente radioterapia. Aquellos con tumores particularmente grandes (T4) y aquellos para quienes la cirugía no es práctica se tratan con quimioterapia y radioterapia combinadas junto con la inmunoterapia durvalumab. La combinación de quimioterapia y radiación mejora la supervivencia en comparación con la quimioterapia seguida de radiación, aunque la terapia combinada tiene efectos secundarios más severos.
Las personas con enfermedad en etapa IV se tratan con combinaciones de analgésicos, radioterapia, inmunoterapia y quimioterapia. Muchos casos de enfermedad avanzada se pueden tratar con terapias dirigidas según la composición genética de las células cancerosas. Hasta el 30% de los tumores tienen mutaciones en el gen EGFR que resultan en una proteína EGFR hiperactiva; estos pueden tratarse con inhibidores de EGFR osimertinib, erlotinib, gefitinib, afatinib o dacomitinib; se sabe que osimertinib es superior a erlotinib y gefitinib, y todos superiores a la quimioterapia sola. Hasta el 7 % de las personas con NSCLC albergan mutaciones que dan como resultado una proteína ALK hiperactiva, que puede tratarse con los inhibidores de ALK crizotinib o sus sucesores alectinib, brigatinib y ceritinib. Aquellos tratados con inhibidores de ALK que recaen pueden ser tratados con el inhibidor de ALK de tercera generación lorlatinib. Hasta el 5 % con NSCLC tiene MET hiperactiva, que se puede inhibir con los inhibidores de MET capmatinib o tepotinib. Las terapias dirigidas también están disponibles para algunos tipos de cáncer con mutaciones raras. Los cánceres con BRAF hiperactivo (alrededor del 2% de NSCLC) pueden tratarse con dabrafenib combinado con el inhibidor de MEK trametinib; aquellos con ROS1 activado (alrededor del 1 % de NSCLC) pueden ser inhibidos por crizotinib, lorlatinib o entrectinib; NTRK hiperactiva (<1% de NSCLC) por entrectinib o larotrectinib; RET activo (alrededor del 1% de NSCLC) por selpercatinib.
Las personas cuyo NSCLC no es un objetivo de las terapias moleculares dirigidas actuales pueden ser tratadas con quimioterapia combinada más inhibidores de puntos de control inmunitarios, que evitan que las células cancerosas inactiven las células T inmunitarias. El agente quimioterapéutico de elección depende del subtipo de NSCLC: cisplatino más gemcitabina para el carcinoma de células escamosas, cisplatino más pemetrexed para el carcinoma de células no escamosas. Los inhibidores de puntos de control inmunitarios son más efectivos contra los cánceres que expresan la proteína PD-L1, pero a veces son efectivos en aquellos que no la expresan. El tratamiento con pembrolizumab, atezolizumab o la combinación de nivolumab más ipilimumab son todos superiores a la quimioterapia sola contra los tumores que expresan PD-L1. Aquellos que recaen en lo anterior son tratados con quimioterapéuticos de segunda línea docetaxel y ramucirumab.
Se pueden proporcionar varios tratamientos mediante broncoscopia para el manejo de la obstrucción o el sangrado de las vías respiratorias. Si una vía aérea se obstruye por el crecimiento del cáncer, las opciones incluyen broncoscopia rígida, broncoplastia con globo, colocación de stent y microdesbridamiento. La fotosección con láser implica la entrega de luz láser dentro de las vías respiratorias a través de un broncoscopio para extirpar el tumor que obstruye.
Cuidados paliativos
La integración de los cuidados paliativos (es decir, la atención médica centrada en mejorar los síntomas y disminuir las molestias) en el tratamiento del cáncer de pulmón desde el momento del diagnóstico mejora el tiempo de supervivencia y la calidad de vida de las personas con cáncer de pulmón. Los síntomas particularmente comunes del cáncer de pulmón son dificultad para respirar y dolor. El oxígeno suplementario, la mejora del flujo de aire, la reorientación de una persona afectada en la cama y la morfina en dosis bajas pueden mejorar la dificultad para respirar. Otras causas de dificultad para respirar asociada con el cáncer de pulmón se pueden tratar directamente, como antibióticos para una infección pulmonar, diuréticos para el edema pulmonar, benzodiazepinas para la ansiedad y esteroides para la obstrucción de las vías respiratorias. Hasta el 92% de las personas con cáncer de pulmón informan dolor, ya sea por daño tisular en el sitio del tumor o daño nervioso. La Organización Mundial de la Salud (OMS) ha desarrollado un sistema de tres niveles para controlar el dolor del cáncer. Para aquellos con dolor leve (nivel uno), la OMS recomienda acetaminofén o un medicamento antiinflamatorio no esteroideo. Alrededor de un tercio de las personas experimenta dolor moderado (nivel dos) o intenso (nivel tres), para el cual la OMS recomienda analgésicos opioides. Los opioides suelen ser efectivos para aliviar el dolor nociceptivo (dolor causado por el daño a varios tejidos del cuerpo). En ocasiones, los opioides son efectivos para aliviar el dolor neuropático (dolor causado por daño a los nervios); Los agentes neuropáticos, como los anticonvulsivos, los antidepresivos tricíclicos y los inhibidores de la recaptación de serotonina y norepinefrina, a menudo se usan para aliviar el dolor neuropático, ya sea solos o en combinación con opioides.
Para los pacientes con NSCLC y SCLC, se pueden usar dosis más pequeñas de radiación en el tórax para controlar los síntomas (radioterapia paliativa). Con una condición física adecuada, mantener la quimioterapia durante la paliación del cáncer de pulmón ofrece de 1,5 a 3 meses de prolongación de la supervivencia, alivio sintomático y una mejora en la calidad de vida, con mejores resultados observados con los agentes modernos.
Para las personas que tienen una enfermedad más avanzada, el cuidado de hospicio también puede ser apropiado.
Intervenciones no invasivas
La intervención más eficaz para evitar la muerte por cáncer de pulmón es dejar de fumar; incluso se alienta a las personas que ya tienen cáncer de pulmón a que dejen de fumar. Aquellos con cáncer de pulmón que dejan de fumar tienden a sobrevivir más tiempo, con menos efectos secundarios y una mejor calidad de vida que aquellos que continúan fumando.
Alguna evidencia débil sugiere que ciertas intervenciones de atención de apoyo (no invasivas) que se enfocan en el bienestar de las personas con cáncer de pulmón pueden mejorar la calidad de vida. Las intervenciones como los seguimientos de enfermería, la psicoterapia, la terapia psicosocial y los programas educativos pueden ser beneficiosas; sin embargo, la evidencia no es sólida (se necesita más investigación). El asesoramiento puede ayudar a las personas a sobrellevar los síntomas emocionales relacionados con el cáncer de pulmón. La reflexología puede ser efectiva a corto plazo, sin embargo, se necesita más investigación. No se ha encontrado evidencia que sugiera que las intervenciones nutricionales o los programas de ejercicio para una persona con cáncer de pulmón produzcan una mejora en la calidad de vida que sea relevante o que dure mucho tiempo.
Para aquellos con cáncer de pulmón operable, el ejercicio aeróbico y/o de resistencia regular en las semanas previas a la cirugía puede reducir las estadías en el hospital y las complicaciones posoperatorias. Como tal, la Sociedad Estadounidense de Oncología Clínica recomienda regímenes de ejercicio preoperatorio para las personas con cáncer de pulmón en particular. La Sociedad Estadounidense de Oncología Clínica también recomienda el ejercicio aeróbico y de resistencia como complemento del tratamiento de cualquier cáncer en una etapa lo suficientemente temprana como para que el cáncer se pueda curar.
Pronóstico
| Etapa clínica | Supervivencia de cinco años (%) | |
|---|---|---|
| Carcinoma pulmonar no pequeño | Carcinoma pulmonar de células pequeñas | |
| IA | 50 | 38 |
| IB | 47 | 21 |
| IIA | 36 | 38 |
| IIB | 26 | 18 |
| IIIA | 19 | 13 |
| IIIB | 7 | 9 |
| IV | 2 | 1 |
Alrededor del 19 % de las personas diagnosticadas con cáncer de pulmón sobreviven cinco años desde el diagnóstico. La supervivencia a cinco años es mayor en las mujeres (22 %) que en los hombres (16 %); las mujeres tienden a ser diagnosticadas con una enfermedad menos avanzada y tienen mejores resultados que los hombres diagnosticados en la misma etapa. En Inglaterra y Gales, entre 2013 y 2017, la supervivencia general a cinco años para el cáncer de pulmón se estimó en un 13,8 %. Los resultados son generalmente peores en el mundo en desarrollo. En los EE. UU., las personas con seguro médico tienen más probabilidades de obtener mejores resultados.
La supervivencia para el cáncer de pulmón disminuye a medida que la etapa del diagnóstico se vuelve más avanzada; los datos ingleses sugieren que alrededor del 70 % de los pacientes sobreviven al menos un año cuando se les diagnostica en la etapa más temprana, pero esto se reduce a solo el 14 % para aquellos diagnosticados con la enfermedad más avanzada (etapa IV).
SCLC es particularmente agresivo. La mayoría de las personas tratadas por SCLC recaen y eventualmente desarrollan cáncer resistente a la quimioterapia. La persona promedio diagnosticada con SCLC en la etapa limitada sobrevive de 12 a 20 meses desde el diagnóstico; la persona promedio diagnosticada en la etapa extensa sobrevive alrededor de 12 meses. Del 10 al 15 % de las personas con SCLC sobreviven 5 años después del diagnóstico. Aquellos con SCLC en etapa limitada que entra en remisión completa después de la quimioterapia y la radioterapia tienen un 50 % de posibilidades de desarrollar metástasis cerebrales en los próximos dos años, una posibilidad que se reduce con la irradiación craneal profiláctica.
Para el NSCLC, el mejor pronóstico se logra con la resección quirúrgica completa de la enfermedad en estadio IA, con hasta un 70 % de supervivencia a los cinco años. El pronóstico de los pacientes con NSCLC mejoró significativamente en los últimos años con la introducción de la inmunoterapia. Del 68 al 92 % de los diagnosticados con NSCLC en estadio I sobreviven al menos 5 años después del diagnóstico, al igual que del 53 al 60 % de los diagnosticados con NSCLC en estadio II.
Varios factores personales y de enfermedad están asociados con mejores resultados. Los diagnosticados en una etapa más temprana de la enfermedad tienden a tener mejores pronósticos, al igual que los diagnosticados a una edad más temprana. Aquellos que fuman o experimentan pérdida de peso como síntoma tienden a tener peores resultados. Las metástasis grandes/activas (por exploración PET) y las mutaciones tumorales en KRAS se asocian con una supervivencia reducida.
Experiencia
La incertidumbre del pronóstico del cáncer de pulmón a menudo causa estrés y dificulta la planificación futura para las personas con cáncer de pulmón y sus familias. Aquellos cuyo cáncer entra en remisión a menudo experimentan miedo de que su cáncer regrese o progrese, asociado con una mala calidad de vida, un estado de ánimo negativo y un deterioro funcional. Este temor se ve exacerbado por las imágenes de vigilancia frecuentes o prolongadas y otros recordatorios de los riesgos de cáncer.
Causas
El cáncer se desarrolla después de un daño genético en el ADN y cambios epigenéticos. Esos cambios afectan las funciones normales de la célula, incluida la proliferación celular, la muerte celular programada (apoptosis) y la reparación del ADN. A medida que se acumula más daño, aumenta el riesgo de cáncer.
Fumar
Fumar tabaco es, con diferencia, el principal factor que contribuye al cáncer de pulmón, ya que provoca entre el 80 % y el 90 % de los casos. El riesgo de cáncer de pulmón aumenta con la cantidad de cigarrillos consumidos. El efecto carcinogénico del tabaquismo se debe a varias sustancias químicas en el humo del tabaco que causan mutaciones en el ADN, lo que aumenta la posibilidad de que las células se vuelvan cancerosas. La Agencia Internacional para la Investigación del Cáncer identifica al menos 50 químicos en el humo del tabaco como cancerígenos, siendo los más potentes las nitrosaminas específicas del tabaco. La exposición a estos químicos causa varios tipos de daños en el ADN: aductos de ADN, estrés oxidativo y roturas en las hebras de ADN. Estar cerca del humo del tabaco, llamado tabaquismo pasivo, también puede causar cáncer de pulmón. Vivir con un fumador de tabaco aumenta el riesgo de desarrollar cáncer de pulmón en un 24%. Se estima que el 17% de los casos de cáncer de pulmón en personas que no fuman son causados por altos niveles de humo de tabaco ambiental.
El vapeo puede ser un factor de riesgo para el cáncer de pulmón, pero menor que el de los cigarrillos, y se necesita más investigación debido al tiempo que puede tardar en desarrollarse el cáncer de pulmón después de una exposición a carcinógenos.
No se sabe que fumar productos que no sean tabaco esté asociado con el desarrollo de cáncer de pulmón. Fumar marihuana no parece causar cáncer de pulmón de forma independiente, a pesar de los niveles relativamente altos de alquitrán y carcinógenos conocidos en el humo de la marihuana. No se ha estudiado la relación entre fumar cocaína y desarrollar cáncer de pulmón.
Exposiciones ambientales
La exposición a una variedad de otras sustancias químicas tóxicas, que normalmente se encuentran en ciertas ocupaciones, se asocia con un mayor riesgo de cáncer de pulmón. En total, se estima que las exposiciones ocupacionales a carcinógenos causan entre el 9 y el 15 % de los cánceres de pulmón. Un ejemplo destacado es el asbesto, que causa cáncer de pulmón directa o indirectamente al inflamar el pulmón. La exposición a todas las formas de asbesto disponibles comercialmente aumenta el riesgo de cáncer, y el riesgo de cáncer aumenta con el tiempo de exposición. El amianto y el tabaquismo aumentan el riesgo de forma sinérgica, es decir, el riesgo de que alguien que fuma y esté expuesto al amianto muera de cáncer de pulmón es mucho mayor de lo que se esperaría al sumar los dos riesgos. De manera similar, la exposición al radón, un producto de descomposición natural del uranio de la Tierra, se asocia con un mayor riesgo de cáncer de pulmón. Esto es particularmente cierto en los mineros subterráneos, que tienen la mayor exposición; sino también en el aire interior de los espacios residenciales. Al igual que el asbesto, fumar cigarrillos y la exposición al radón aumentan el riesgo de manera sinérgica. La exposición al radón es responsable de entre el 3% y el 14% de los casos de cáncer de pulmón.
Varias otras sustancias químicas que se encuentran en varias ocupaciones también están asociadas con un mayor riesgo de cáncer de pulmón, incluido el arsénico utilizado en la conservación de la madera, la aplicación de pesticidas y la fundición de algunos minerales; radiación ionizante encontrada durante la extracción de uranio; cloruro de vinilo en la fabricación de papel; berilio en joyeros, ceramistas, técnicos de misiles y trabajadores de reactores nucleares; cromo en la producción de acero inoxidable, soldadura y curtido de pieles; el níquel en electrochapadores, vidrieros, metalúrgicos, soldadores y los que fabrican pilas, cerámica y joyería; y escape de diesel encontrado por los mineros.
La exposición a la contaminación del aire, especialmente a las partículas finas, aumenta el riesgo de cáncer de pulmón. Las partículas finas (PM2,5) y los aerosoles de sulfato, que pueden liberarse en los gases de escape del tráfico, están asociados con un riesgo ligeramente mayor. Para el dióxido de nitrógeno, un aumento incremental de 10 partes por billón aumenta el riesgo de cáncer de pulmón en un 14%. Se estima que la contaminación del aire exterior causa del 1 al 2% de los cánceres de pulmón. La contaminación del aire interior por la quema de madera, carbón o residuos de cultivos para cocinar y calentar también se ha relacionado con un mayor riesgo de desarrollar cáncer de pulmón. La Agencia Internacional para la Investigación del Cáncer ha clasificado las emisiones de la quema doméstica de carbón y biomasa como "carcinogénicas" y "probablemente cancerígeno" respectivamente.
Otras enfermedades
Varias otras enfermedades que causan inflamación del pulmón aumentan el riesgo de cáncer de pulmón. Esta asociación es más fuerte para el trastorno pulmonar obstructivo crónico: el riesgo es mayor en aquellos con la mayor inflamación y se reduce en aquellos cuya inflamación se trata con corticosteroides inhalados. Otras enfermedades inflamatorias de los pulmones y del sistema inmunitario, como la deficiencia de alfa-1 antitripsina, la fibrosis intersticial, la esclerodermia, la infección por Chlamydia pneumoniae, la tuberculosis y la infección por el VIH también se asocian con un mayor riesgo de desarrollar cáncer de pulmón. El virus de Epstein-Barr está asociado con el desarrollo del raro carcinoma similar al linfoepitelioma del cáncer de pulmón en personas de Asia, pero no en personas de países occidentales. Se ha estudiado el papel de varios otros agentes infecciosos en el desarrollo del cáncer de pulmón, pero sigue sin ser concluyente, a saber, virus del papiloma humano, virus BK, virus JC, citomegalovirus humano, SV40, virus del sarampión y virus Torque teno.
Genética
Alrededor del 8 % de los casos de cáncer de pulmón son causados por factores hereditarios (genéticos). En familiares de personas a las que se les diagnostica cáncer de pulmón, el riesgo se duplica, probablemente debido a una combinación de genes. Los estudios de asociación de todo el genoma han identificado muchas variantes genéticas asociadas con el riesgo de cáncer de pulmón, cada una de las cuales contribuye con un pequeño aumento del riesgo. Muchos de estos genes participan en vías que se sabe que están implicadas en la carcinogénesis, a saber, la reparación del ADN, la inflamación, el ciclo de división celular, las respuestas al estrés celular y la remodelación de la cromatina.
Patogénesis
Al igual que con todos los cánceres, el cáncer de pulmón se desencadena por mutaciones que permiten que las células tumorales se multipliquen sin fin, estimulan el crecimiento de los vasos sanguíneos, evitan la apoptosis (muerte celular programada), generan moléculas de señalización a favor del crecimiento, ignoran las moléculas de señalización contra el crecimiento y eventualmente se disemina al tejido circundante o hace metástasis en todo el cuerpo. Diferentes tumores pueden adquirir estas habilidades a través de diferentes mutaciones, aunque generalmente las mutaciones que contribuyen al cáncer activan los oncogenes e inactivan los supresores de tumores. Algunas mutaciones, denominadas "mutaciones impulsoras" – son particularmente comunes en los adenocarcinomas y contribuyen de manera desproporcionada al desarrollo del tumor. Estos suelen ocurrir en los receptores tirosina quinasas EGFR, BRAF, MET, KRAS y PIK3CA. De manera similar, algunos adenocarcinomas son impulsados por reordenamientos cromosómicos que dan como resultado una sobreexpresión de tirosina cinasas ALK, ROS1, NTRK y RET. Un tumor dado normalmente tendrá solo una mutación conductora. Por el contrario, los SCLC rara vez tienen estas mutaciones conductoras y, en cambio, a menudo tienen mutaciones que han inactivado los supresores de tumores p53 y RB. Un grupo de genes supresores de tumores en el brazo corto del cromosoma 3 a menudo se pierde temprano en el desarrollo de todos los cánceres de pulmón.
La metástasis del cáncer de pulmón requiere una transición del tipo de célula epitelial al mesenquimatoso. Esto puede ocurrir mediante la activación de vías de señalización como Akt/GSK3Beta, MEK-ERK, Fas y Par6.
Prevención
La prevención y el abandono del hábito de fumar son formas eficaces de reducir el riesgo de cáncer de pulmón.
Dejar de fumar
Aquellos que fuman pueden reducir su riesgo de cáncer de pulmón si dejan de fumar; la reducción del riesgo es mayor cuanto más tiempo pasa una persona sin fumar. Los programas de autoayuda tienden a tener poca influencia en el éxito del abandono del hábito de fumar, mientras que el asesoramiento y la farmacoterapia combinados mejoran las tasas de abandono. La FDA de EE. UU. ha aprobado las terapias antidepresivas y la vareniclina de reemplazo de nicotina como terapias de primera línea para ayudar a dejar de fumar. La clonidina y la nortriptilina son terapias de segunda línea recomendadas.
Control del tabaco
Si bien en la mayoría de los países se identificaron y prohibieron los carcinógenos industriales y domésticos, el tabaquismo aún está muy extendido. Eliminar el tabaquismo es un objetivo principal en la prevención del cáncer de pulmón, y dejar de fumar es una herramienta preventiva importante en este proceso.
Las intervenciones políticas para disminuir el tabaquismo pasivo en áreas públicas como restaurantes y lugares de trabajo se han vuelto más comunes en muchos países occidentales. Bután ha prohibido la venta de tabaco desde 2004, mientras que India introdujo una prohibición de fumar en público en octubre de 2008. La Organización Mundial de la Salud ha pedido a los gobiernos que instituyan una prohibición total de la publicidad del tabaco para evitar que los jóvenes empiecen a fumar. Evalúa que tales prohibiciones han reducido el consumo de tabaco en un 16% donde se instituyeron.
Dieta y estilo de vida
Varios alimentos y suplementos dietéticos se han asociado con el riesgo de cáncer de pulmón. El alto consumo de algunos productos animales (carne roja (pero no otras carnes o pescados), grasas saturadas, así como nitrosodimetilaminas y nitritos (que se encuentran en las carnes saladas y ahumadas) está asociado con un mayor riesgo de desarrollar cáncer de pulmón. Por el contrario, el alto consumo de frutas y verduras se asocia con un menor riesgo de cáncer de pulmón, en particular el consumo de verduras crucíferas y frutas y verduras crudas. Sobre la base de los efectos beneficiosos de las frutas y verduras, se ha estudiado la suplementación de varias vitaminas individuales. La suplementación con vitamina A o betacaroteno no tuvo ningún efecto sobre el cáncer de pulmón y, en cambio, aumentó ligeramente la mortalidad. La suplementación dietética con vitamina E o retinoides tampoco tuvo efecto. El uso a largo plazo de suplementos de vitamina A, vitaminas B, vitamina D o vitamina E no reduce el riesgo de cáncer de pulmón. Algunos estudios han encontrado que las vitaminas A, B y E pueden aumentar el riesgo de cáncer de pulmón en aquellos que tienen antecedentes de tabaquismo. El consumo de grasas poliinsaturadas, té, bebidas alcohólicas y café están asociados con un menor riesgo de desarrollar cáncer de pulmón.
Además de la dieta, el peso corporal y los hábitos de ejercicio también están asociados con el riesgo de cáncer de pulmón. Tener sobrepeso se asocia con un menor riesgo de desarrollar cáncer de pulmón, posiblemente debido a la tendencia de quienes fuman cigarrillos a tener un peso corporal más bajo. Del mismo modo, tener bajo peso se asocia con un riesgo reducido de cáncer de pulmón. Algunos estudios han demostrado que las personas que hacen ejercicio regularmente o tienen una mejor condición cardiovascular tienen un menor riesgo de desarrollar cáncer de pulmón.
Epidemiología
A nivel mundial, el cáncer de pulmón es el tipo de cáncer más diagnosticado y la principal causa de muerte por cáncer. En 2020, se diagnosticaron 2,2 millones de nuevos casos y 1,8 millones de personas fallecieron por cáncer de pulmón, lo que representa el 18 % de todas las muertes por cáncer. Se espera que las muertes por cáncer de pulmón aumenten a nivel mundial a casi 3 millones de muertes anuales para 2035, debido a las altas tasas de consumo de tabaco y el envejecimiento de la población. El cáncer de pulmón es raro en personas menores de 40 años; a partir de ahí, las tasas de cáncer aumentan con la edad, estabilizándose alrededor de los 80 años. La mediana de edad de una persona diagnosticada con cáncer de pulmón es de 70 años; la edad media de muerte es 72.
La incidencia del cáncer de pulmón varía drásticamente según la geografía y el sexo, con las tasas más altas en Micronesia, Polinesia, Europa, Asia y América del Norte; y las tasas más bajas en África y América Central. A nivel mundial, alrededor del 8 % de los hombres y el 6 % de las mujeres desarrollan cáncer de pulmón a lo largo de su vida. Sin embargo, la proporción de casos de cáncer de pulmón en hombres y mujeres varía drásticamente según la geografía, hasta casi 12:1 en Bielorrusia y 1:1 en Brasil, probablemente debido a las diferencias en los patrones de tabaquismo. En los Estados Unidos, el cáncer de pulmón sigue siendo la causa más común de muerte por cáncer, a pesar de una disminución de casi el 50 % en la tasa de mortalidad desde su punto máximo en 1990. El cáncer de pulmón es el tercer cáncer más común en el Reino Unido (47 968 personas fueron diagnosticadas con la enfermedad en 2017), y es la causa más común de muerte relacionada con el cáncer (unas 34.600 personas fallecieron en 2018).
En los EE. UU., hay alrededor de 350 muertes por cáncer de pulmón todos los días. Las tasas de cáncer de pulmón varían según el grupo racial y étnico, con las tasas más altas en afroamericanos y las tasas más bajas en hispanos, nativos americanos y asiáticos americanos. También en los EE. UU., los veteranos militares tienen una tasa de cáncer de pulmón entre un 25% y un 50% más alta, principalmente debido a las tasas más altas de tabaquismo. Durante la Segunda Guerra Mundial y la Guerra de Corea, el asbesto también jugó un papel, y el Agente Naranja pudo haber causado algunos problemas durante la Guerra de Vietnam.
El riesgo de cáncer de pulmón está muy influenciado por la exposición ambiental, es decir, el tabaquismo, así como los riesgos laborales en la minería, la construcción naval, la refinación de petróleo y las ocupaciones que involucran la exposición al asbesto. Entre el 85 y el 90 % de los casos de cáncer de pulmón se dan en personas que han fumado cigarrillos, y el 15 % de los fumadores desarrollan cáncer de pulmón. Las personas que tienen un largo historial de tabaquismo tienen el mayor riesgo de desarrollar cáncer de pulmón, y el riesgo aumenta con la duración del tabaquismo. La incidencia en los hombres aumentó hasta mediados de la década de 1980 y ha disminuido desde entonces. En las mujeres, la incidencia aumentó hasta finales de la década de 1990 y desde entonces se ha mantenido estable. No fumadores' el riesgo de desarrollar cáncer de pulmón también está influenciado por el tabaquismo; el humo de segunda mano (es decir, estar cerca del humo del tabaco) aumenta el riesgo de desarrollar cáncer de pulmón en alrededor del 30 %, y el riesgo se correlaciona con la duración de la exposición.
Por cada 3-4 millones de cigarrillos fumados, puede ocurrir una muerte por cáncer de pulmón. La influencia de "Big Tobacco" juega un papel importante en el tabaquismo. Los jóvenes no fumadores que ven anuncios de tabaco tienen más probabilidades de fumar. El papel del tabaquismo pasivo se reconoce cada vez más como un factor de riesgo para el cáncer de pulmón, lo que resulta en intervenciones políticas para disminuir la exposición no deseada de los no fumadores a los demás. humo de tabaco.
Desde la década de 1960, las tasas de adenocarcinoma de pulmón comenzaron a aumentar en relación con otros tipos de cáncer de pulmón, en parte debido a la introducción de los cigarrillos con filtro. El uso de filtros elimina las partículas más grandes del humo del tabaco, lo que reduce la deposición en las vías respiratorias más grandes. Sin embargo, el fumador tiene que inhalar más profundamente para recibir la misma cantidad de nicotina, aumentando la deposición de partículas en las vías respiratorias pequeñas donde tiende a surgir el adenocarcinoma. Las tasas de adenocarcinoma de pulmón siguen aumentando.
Historia
El cáncer de pulmón era poco común antes de la llegada del tabaquismo; ni siquiera se reconoció como una enfermedad distinta hasta 1761. Los diferentes aspectos del cáncer de pulmón se describieron con más detalle en 1810. Los tumores pulmonares malignos constituían solo el 1% de todos los cánceres observados en la autopsia en 1878, pero habían aumentado al 10-15% en el principios de 1900. Los informes de casos en la literatura médica sumaban solo 374 en todo el mundo en 1912, pero una revisión de las autopsias mostró que la incidencia de cáncer de pulmón había aumentado del 0,3 % en 1852 al 5,66 % en 1952. En Alemania, en 1929, el médico Fritz Lickint reconoció el vínculo entre fumar y cáncer de pulmón, lo que condujo a una agresiva campaña contra el tabaquismo. Los médicos británicos' El estudio, publicado en la década de 1950, fue la primera evidencia epidemiológica sólida del vínculo entre el cáncer de pulmón y el tabaquismo. Como resultado, en 1964, el Cirujano General de los Estados Unidos recomendó a los fumadores que dejaran de fumar.
La conexión con el gas radón se reconoció por primera vez entre los mineros de los Montes Metálicos cerca de Schneeberg, Sajonia. La plata se ha extraído allí desde 1470, y estas minas son ricas en uranio, con el radio y el gas radón que lo acompañan. Los mineros desarrollaron una cantidad desproporcionada de enfermedad pulmonar, que finalmente se reconoció como cáncer de pulmón en la década de 1870. A pesar de este descubrimiento, la minería continuó hasta la década de 1950, debido a la demanda de uranio de la URSS. El radón se confirmó como una causa de cáncer de pulmón en la década de 1960.
La primera neumonectomía exitosa para el cáncer de pulmón se realizó en 1933. La radioterapia paliativa se ha utilizado desde la década de 1940. La radioterapia radical, utilizada inicialmente en la década de 1950, fue un intento de utilizar dosis de radiación más altas en pacientes con cáncer de pulmón en etapa relativamente temprana, pero que por lo demás no eran aptos para la cirugía. En 1997, CHART se consideró una mejora con respecto a la radioterapia radical convencional. Con SCLC, los intentos iniciales en la década de 1960 de resección quirúrgica y radioterapia radical no tuvieron éxito. En la década de 1970, se desarrollaron regímenes de quimioterapia exitosos.
Buscar direcciones
Los ensayos clínicos que involucran radioterapia, cirugía, inhibidores de EGFR, inhibidores de microtúbulos e inmunoterapia están en curso a partir de 2021.
Para los casos de cáncer de pulmón que desarrollan resistencia al receptor del factor de crecimiento epidérmico (EGFR) y los inhibidores de la tirosina quinasa del linfoma anaplásico (ALK), se están desarrollando nuevos medicamentos. Los inhibidores de EGFR incluyen erlotinib, gefitinib, afatinib e icotinib (el último solo está disponible en China). Una vía de señalización alternativa, c-Met, puede ser inhibida por tivantinib y onartuzumab. Los nuevos inhibidores de ALK incluyen crizotinib y ceritinib. Si la vía MAPK/ERK está involucrada, el inhibidor de la quinasa BRAF dabrafenib y el inhibidor de MAPK/MEK trametinib pueden ser beneficiosos.
Las células madre del cáncer de pulmón suelen ser resistentes a la quimioterapia y la radioterapia convencionales. Esto puede conducir a una recaída después del tratamiento. Los nuevos enfoques apuntan a marcadores de proteínas o glicoproteínas que son específicos de las células madre. Dichos marcadores incluyen CD133, CD90, ALDH1A1, CD44 y ABCG2. Las vías de señalización como Hedgehog, Wnt y Notch a menudo están implicadas en la autorrenovación de las líneas de células madre. Por lo tanto, los tratamientos dirigidos a estas vías pueden ayudar a prevenir la recaída.
La radiómica combinada con la inteligencia artificial se puede utilizar en imágenes PET y CT para ayudar a diagnosticar (o excluir) el cáncer de pulmón.
Contenido relacionado
Sustancia negra
Provirus
Cirugía abdominal