Cancer de prostata
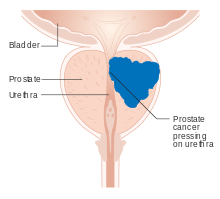
El cáncer de próstata es el cáncer de próstata. El cáncer de próstata es el segundo tumor canceroso más común en todo el mundo y es la quinta causa principal de mortalidad relacionada con el cáncer entre los hombres. La próstata es una glándula del aparato reproductor masculino que rodea la uretra justo debajo de la vejiga. Se encuentra en la región hipogástrica del abdomen. Para dar una idea de dónde se encuentra, la vejiga está superior a la glándula prostática como se muestra en la imagen. El recto está posterior en perspectiva a la glándula prostática y la tuberosidad isquiática del hueso pélvico está inferior. Solo los hombres son propensos a padecer cáncer de próstata debido a la presencia de órganos reproductores masculinos. La mayoría de los cánceres de próstata son de crecimiento lento. Las células cancerosas pueden diseminarse a otras áreas del cuerpo, particularmente a los huesos y los ganglios linfáticos. Inicialmente puede no causar síntomas. En etapas posteriores, los síntomas incluyen dolor o dificultad para orinar, sangre en la orina o dolor en la pelvis o la espalda. La hiperplasia prostática benigna puede producir síntomas similares. Otros síntomas tardíos incluyen fatiga, debido a los bajos niveles de glóbulos rojos.
Los factores que aumentan el riesgo de cáncer de próstata incluyen la edad avanzada, los antecedentes familiares y la raza. Alrededor del 99% de los casos ocurren después de los 50 años. Un familiar de primer grado con la enfermedad aumenta el riesgo dos o tres veces. Otros factores incluyen una dieta rica en carne procesada y carne roja, mientras que el riesgo de una ingesta elevada de productos lácteos no es concluyente. Se ha encontrado una asociación con la gonorrea, aunque no se ha identificado ninguna razón para esta relación. Un mayor riesgo está asociado con las mutaciones BRCA. El diagnóstico es por biopsia. Se pueden realizar imágenes médicas para evaluar si hay metástasis.
La detección del cáncer de próstata, incluida la prueba del antígeno prostático específico (PSA), aumenta la detección del cáncer, pero es controvertido si mejora los resultados. Se recomienda la toma de decisiones informadas para personas de 55 a 69 años. Las pruebas, si se realizan, son más apropiadas para aquellos con una esperanza de vida más larga. Aunque los inhibidores de la 5α-reductasa parecen disminuir el riesgo de cáncer de bajo grado, no afectan el riesgo de cáncer de alto grado y no se recomiendan para la prevención. La suplementación con vitaminas o minerales no parece afectar el riesgo.
Muchos casos se manejan con vigilancia activa o espera vigilante. Otros tratamientos pueden incluir una combinación de cirugía, radioterapia, terapia hormonal o quimioterapia. Los tumores limitados a la próstata pueden ser curables. Los medicamentos para el dolor, los bisfosfonatos y la terapia dirigida, entre otros, pueden ser útiles. Los resultados dependen de la edad, el estado de salud y la agresividad y extensión del cáncer. La mayoría de los hombres con cáncer de próstata no mueren a causa de él. La tasa de supervivencia a cinco años en los Estados Unidos es del 98%.
A nivel mundial, es el segundo cáncer más común. Es la quinta causa principal de muerte relacionada con el cáncer en los hombres. En 2018 se diagnosticó en 1,2 millones y provocó 359.000 muertes. Era el cáncer más común en hombres en 84 países, y se presentaba con mayor frecuencia en el mundo desarrollado. Las tasas han ido en aumento en el mundo en desarrollo. La detección aumentó significativamente en las décadas de 1980 y 1990 en muchas áreas debido al aumento de las pruebas de PSA. Un estudio informó cáncer de próstata en 30% a 70% de los hombres rusos y japoneses mayores de 60 años que habían muerto por causas no relacionadas.
Signos y síntomas
El cáncer de próstata temprano generalmente no tiene síntomas claros. Cuando aparecen, suelen ser similares a los de la hiperplasia prostática benigna. Estos incluyen micción frecuente, nicturia (aumento de la micción nocturna), dificultad para iniciar y mantener un flujo constante de orina, hematuria (sangre en la orina), disuria (micción dolorosa), así como fatiga debido a la anemia y dolor de huesos. Un estudio encontró que alrededor de un tercio de los pacientes diagnosticados tenían uno o más de estos síntomas.
El cáncer de próstata se asocia con disfunción urinaria ya que la glándula prostática rodea la uretra prostática. Los cambios dentro de la glándula afectan directamente la función urinaria. Debido a que el conducto deferente deposita líquido seminal en la uretra prostática y las secreciones de la próstata se incluyen en el contenido del semen, el cáncer de próstata también puede causar problemas con la función y el rendimiento sexual, como dificultad para lograr la erección o dolor en la eyaculación.
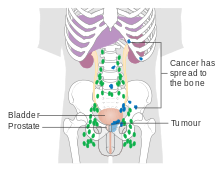
El cáncer de próstata metastásico puede causar síntomas adicionales. El síntoma más común es el dolor de huesos, a menudo en las vértebras (huesos de la columna), la pelvis o las costillas. La diseminación del cáncer a otros huesos, como el fémur, generalmente ocurre en la parte del hueso más cercana a la próstata. El cáncer de próstata en la columna vertebral puede comprimir la médula espinal, causando hormigueo, debilidad en las piernas e incontinencia urinaria y fecal.
Factores de riesgo
Los principales factores de riesgo son la obesidad, la edad y los antecedentes familiares. Se ha descubierto que los hombres obesos tienen una tasa de mortalidad por cáncer de próstata un 34 % mayor que los que tienen un peso normal. El cáncer de próstata es poco común en hombres menores de 45 años, pero se vuelve más común con la edad avanzada. La edad promedio en el momento del diagnóstico es de 70 años. Los estudios de autopsia de hombres chinos, alemanes, israelíes, jamaicanos, suecos y ugandeses que murieron por otras causas encontraron cáncer de próstata en el 30 % de los hombres de 50 años y en el 80 % de los hombres en sus 70 años.
Los hombres con presión arterial alta tienen más probabilidades de desarrollar cáncer de próstata. Un pequeño aumento en el riesgo está asociado con la falta de ejercicio. Los niveles elevados de testosterona en sangre pueden aumentar el riesgo.
Genética
La genética puede afectar el riesgo, como lo sugieren las asociaciones con la raza, la familia y variantes genéticas específicas. Los hombres que tienen un familiar de primer grado (padre o hermano) con cáncer de próstata tienen el doble de riesgo de desarrollar cáncer de próstata, y aquellos con dos familiares de primer grado afectados tienen un riesgo cinco veces mayor en comparación con los hombres sin antecedentes familiares. Este riesgo parece ser mayor para los hombres con un hermano afectado que para aquellos con un padre afectado. En los Estados Unidos, el cáncer de próstata afecta más comúnmente a los hombres negros que a los hombres blancos o hispanos, y también es más letal en los hombres negros. Por el contrario, las tasas de incidencia y mortalidad de los hombres hispanos son un tercio más bajas que las de los blancos no hispanos. Los estudios de gemelos en Escandinavia sugieren que el 58% del riesgo de cáncer de próstata puede explicarse por factores hereditarios.
Muchos genes están involucrados en el riesgo hereditario de cáncer de próstata. El primer gen relacionado con el cáncer de próstata hereditario en las familias fue el gen 1 del cáncer de próstata hereditario (HPC1). Las mutaciones dentro del gen HOXB13 también pueden conllevar un fuerte riesgo de cáncer de próstata. La variación genética heredada del locus del cromosoma 8q24, que se observa de manera destacada a través del estudio de asociación del genoma completo (GWAS) del cáncer de próstata tanto familiar como esporádico, puede conllevar un riesgo casi mendeliano (hasta 20 veces) de cáncer de próstata. Esta región abarca elementos reguladores, genes no codificantes y el gen POU5F1B relacionado con células madre. Aproximadamente el 4 % de las familias en las que varios hombres se ven afectados por el cáncer de próstata tienen mutaciones en HOXB13 y otro 4 % tienen mutaciones en 8q24. También se han implicado mutaciones en BRCA1 y BRCA2 (importantes factores de riesgo de cáncer de ovario y cáncer de mama en mujeres).
Dos GWAS grandes descubrieron polimorfismos de un solo nucleótido (SNP) comunes de bajo riesgo que están asociados con el cáncer de próstata en 2008. Estos estudios identificaron varios SNP relevantes. Por ejemplo, se informó que los individuos con el par de alelos TT en el SNP rs10993994 tenían un riesgo 1,6 veces mayor que aquellos con el par de alelos CC. Este SNP explica parte del mayor riesgo que enfrentan los afroamericanos. El alelo C es mucho más frecuente en el último; este SNP se encuentra en la región promotora del gen MSMB, por lo que afecta la cantidad de proteína MSMB sintetizada y secretada por las células epiteliales de la próstata.
Si bien se han realizado menos estudios para evaluar el riesgo de ser diagnosticado con cáncer de próstata agresivo, un GWAS de 12 518 casos de cáncer de próstata identificó dos loci asociados con una puntuación alta de la suma de Gleason, el SNP rs78943174 más cercano al gen NAALADL2 y SNP rs35148638 más cercano a RASA1.
También se han definido varias mutaciones somáticas (adquiridas en lugar de heredadas) en los tumores de próstata que impulsan su crecimiento. La fusión de la familia de genes TMPRSS2-ETS, específicamente TMPRSS2-ERG o TMPRSS2-ETV1/4 promueve el crecimiento de células cancerosas. Estas fusiones pueden surgir a través de cadenas de reordenamiento complejas llamadas cromoplejía.
Dietética
(feminine)Las dietas basadas en plantas están asociadas con un menor riesgo de cáncer de próstata. Cambiar a una dieta basada en plantas muestra resultados favorables para los resultados del cáncer en hombres con cáncer de próstata. Especialmente las dietas veganas muestran constantemente asociaciones favorables con el riesgo y los resultados del cáncer de próstata.
Se ha descubierto que el consumo de frutas y verduras tiene pocos beneficios preventivos. Algunos estudios informan que un mayor consumo de carne se asoció con un mayor riesgo.
El consumo de leche puede estar relacionado con el cáncer de próstata. Una revisión sistemática de 2020 encontró que los resultados sobre el consumo de leche y el cáncer de próstata no son concluyentes, pero afirmó que las personas con mayor riesgo pueden reducir o eliminar la leche. Una descripción general de 2019 indicó que la evidencia que vinculaba la leche con tasas más altas de cáncer de próstata era inconsistente y no concluyente. Un estudio de 2021 de Japón que analizó a 26 464 hombres descubrió que el consumo de leche aumentaba el riesgo de cáncer de próstata en un 37 %.
Los niveles sanguíneos más bajos de vitamina D pueden aumentar los riesgos. Un estudio no encontró ningún efecto de los suplementos de ácido fólico sobre el riesgo.
Exposición a medicamentos
Se han establecido algunos vínculos entre el cáncer de próstata y los medicamentos, los procedimientos médicos y las condiciones médicas. Las estatinas también pueden disminuir el riesgo.
Infección
La prostatitis (infección o inflamación) puede aumentar el riesgo. En particular, la infección por infecciones de transmisión sexual clamidia, gonorrea o sífilis parece aumentar el riesgo.
Se ha propuesto que el virus del papiloma tiene un papel potencial, pero a partir de 2015, la evidencia no era concluyente; a partir de 2018, se debatió el aumento del riesgo.
Medio ambiente
Los veteranos de guerra de EE. UU. que habían estado expuestos al agente naranja tenían un 48 % más de riesgo de recurrencia del cáncer de próstata después de la cirugía.
Sexo
Aunque algunas pruebas de estudios prospectivos de cohortes indican que la eyaculación frecuente puede reducir el riesgo de cáncer de próstata, ningún ensayo controlado aleatorio informó este beneficio. Se encontró una asociación entre la vasectomía y el cáncer de próstata, pero no se ha establecido la causalidad.
Fisiopatología
La próstata es parte del sistema reproductivo masculino que ayuda a producir y almacenar líquido seminal. En los hombres adultos, una próstata típica mide unos 3 cm de largo y pesa unos 20 g. Se encuentra en la pelvis, debajo de la vejiga urinaria y delante del recto. La próstata rodea parte de la uretra, el conducto que transporta la orina desde la vejiga durante la micción y el semen durante la eyaculación. La próstata contiene muchas glándulas pequeñas, que producen alrededor del 20% del líquido que constituye el semen.
Superiormente, la base de la próstata es contigua a la salida de la vejiga. Inferiormente, el vértice de la próstata se dirige en dirección al diafragma urogenital, que apunta anteroinferiormente. La próstata se puede dividir en cuatro espacios anatómicos: estroma fibromuscular periférico, central, de transición y anterior. El espacio periférico contiene las porciones posterior y lateral de la próstata, así como las porciones inferiores de la próstata. El espacio central contiene la porción superior de la próstata, incluidos los aspectos más proximales de la uretra y el cuello de la vejiga. El espacio de transición está ubicado justo por delante del espacio central e incluye la uretra distal a la uretra de la glándula central. Los haces neurovasculares discurren a lo largo de la superficie posterolateral de la próstata y allí también penetran en la cápsula prostática.
La mayor parte del tejido glandular se encuentra en las zonas periférica y central (zona periférica: 70-80 % de tejido glandular; zona central: 20 % de tejido glandular). Algo se encuentra en el espacio de transición (5% del tejido glandular). Por tanto, la mayoría de los cánceres que se desarrollan a partir del tejido glandular se encuentran en los espacios periférico y central, mientras que alrededor del 5% se encuentra en el espacio de transición. Ninguno se encuentra en el estroma fibromuscular anterior ya que no hay glándulas en ese espacio anatómico.
Las glándulas prostáticas requieren hormonas masculinas, conocidas como andrógenos, para funcionar correctamente. Los andrógenos incluyen testosterona, que se produce en los testículos; dehidroepiandrosterona, que se produce en las glándulas suprarrenales; y dihidrotestosterona, que se convierte de testosterona dentro de la próstata misma. Los andrógenos también son responsables de las características sexuales secundarias, como el vello facial y el aumento de la masa muscular.
Debido a la ubicación de la próstata, las enfermedades de la próstata a menudo afectan la micción, la eyaculación y, en raras ocasiones, la defecación. En el cáncer de próstata, las células de estas glándulas mutan en células cancerosas.
La mayoría de los cánceres de próstata se clasifican como adenocarcinomas, o cánceres glandulares, que comienzan cuando las células de las glándulas secretoras de semen mutan en células cancerosas. La región de la glándula prostática donde el adenocarcinoma es más común es la zona periférica. Inicialmente, pequeños grupos de células cancerosas permanecen dentro de las glándulas prostáticas normales, una condición conocida como carcinoma in situ o neoplasia intraepitelial prostática (PIN). Aunque ninguna prueba establece que el PIN sea un precursor del cáncer, está estrechamente relacionado con el cáncer. Con el tiempo, estas células se multiplican y se diseminan al tejido prostático circundante (el estroma) formando un tumor.
Con el tiempo, el tumor puede crecer lo suficiente como para invadir órganos cercanos, como las vesículas seminales o el recto, o las células tumorales pueden desarrollar la capacidad de viajar por el torrente sanguíneo y el sistema linfático.
El cáncer de próstata se considera un tumor maligno porque puede invadir otras áreas del cuerpo. Esta invasión se llama metástasis. El cáncer de próstata suele hacer metástasis en los huesos y los ganglios linfáticos, y puede invadir el recto, la vejiga y los uréteres inferiores después de la progresión local. Se cree que la ruta de metástasis al hueso es venosa, ya que el plexo venoso prostático que drena la próstata se conecta con las venas vertebrales.
La próstata es un órgano productor de citrato que acumula zinc. La proteína de transporte ZIP1 es responsable del transporte de zinc a las células de la próstata. Una de las funciones importantes del zinc es cambiar el metabolismo de las células para producir citrato, un componente importante del semen. El proceso de acumulación de zinc, alteración del metabolismo y producción de citrato es energéticamente ineficiente y las células de la próstata requieren enormes cantidades de energía (ATP) para realizar esta tarea. Las células de cáncer de próstata generalmente carecen de zinc. Las células de cáncer de próstata ahorran energía al no producir citrato y utilizan la energía conservada para crecer, reproducirse y propagarse.
Se cree que la ausencia de zinc se debe al silenciamiento del gen que produce ZIP1. Se llama producto del gen supresor de tumores para el gen SLC39A1. Se desconoce la causa del silenciamiento epigenético. Las estrategias que transportan zinc a las células prostáticas transformadas eliminan eficazmente estas células en los animales. El zinc inhibe las vías de NF-κB, es antiproliferativo e induce la apoptosis en células anormales. Desafortunadamente, la ingestión oral de zinc es ineficaz ya que altas concentraciones de zinc en las células de la próstata no son posibles sin ZIP1.
La pérdida de genes supresores del cáncer, en las primeras etapas de la carcinogénesis prostática, se ha localizado en los cromosomas 8p, 10q, 13q e 16q. Las mutaciones de P53 en el cáncer de próstata primario son relativamente bajas y se observan con mayor frecuencia en entornos metastásicos, por lo tanto, las mutaciones de p53 son un evento tardío en la patología. Otros genes supresores de tumores que se cree que juegan un papel incluyen PTEN y KAI1. "Hasta el 70 por ciento de los hombres con cáncer de próstata han perdido una copia del gen PTEN en el momento del diagnóstico". También se ha observado una frecuencia relativa de pérdida de E-cadherina y CD44. La pérdida de la proteína del retinoblastoma (RB) induce la desregulación del receptor de andrógenos en el cáncer de próstata resistente a la castración al desregular la expresión de 'E2F1.
Los factores que impulsan la progresión de la enfermedad y el pronóstico clínico aún se conocen solo en parte, pero se ha identificado una variedad de determinantes moleculares que parecen estar involucrados. El más importante de estos podría ser la tirosina fosfatasa ACP1, cuya expresión podría superar el sistema de clasificación de Gleason para predecir el curso de la enfermedad. Otras moléculas identificadas incluyen el factor de transcripción RUNX2 que puede evitar que las células cancerosas sufran apoptosis, la cascada de señalización PI3k/Akt junto con la cascada de señalización del factor de crecimiento transformante beta/SMAD que también protege contra la apoptosis. Pim-1 está regulado al alza en el cáncer de próstata. Se supone que el inhibidor de la apoptosis ligado al cromosoma X (XIAP) promueve la supervivencia y el crecimiento de las células cancerosas, la citoquina inhibidora de macrófagos-1 (MIC-1) que estimula la vía de señalización de la quinasa de adhesión focal (FAK). No obstante, es justo decir que los factores moleculares que determinan por qué algunos pacientes tienen una enfermedad inactiva mientras que otros muestran un pronóstico siguen siendo en gran medida oscuros.
El receptor de andrógenos ayuda a las células cancerosas a sobrevivir. El antígeno de membrana específico de la próstata (PSMA) estimula el desarrollo del cáncer al aumentar los niveles de folato, lo que ayuda a las células cancerosas a sobrevivir y crecer; aumenta los folatos disponibles para su uso mediante la hidrolización de folatos glutamados.
Diagnóstico
La posición de la Sociedad Estadounidense del Cáncer con respecto a la detección temprana mediante pruebas de PSA es:
La investigación todavía no ha demostrado que los beneficios potenciales de las pruebas superen los daños de las pruebas y el tratamiento. La Sociedad Americana del Cáncer cree que los hombres no deben ser probados sin aprender sobre lo que sabemos y no saben sobre los riesgos y posibles beneficios de las pruebas y el tratamiento. A partir de los 50 años, (45 si afroamericano o hermano o padre sufría de enfermedad antes de los 65 años) hable con su médico sobre los pros y contras de las pruebas para que pueda decidir si las pruebas son la opción correcta para usted".
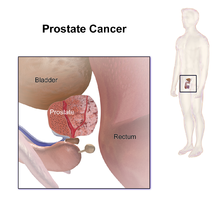
Se pueden usar varias otras pruebas para recopilar información sobre la próstata y las vías urinarias. El examen rectal digital puede permitirle al médico detectar anomalías en la próstata. La cistoscopia muestra el tracto urinario desde el interior de la vejiga, utilizando un tubo de cámara delgado y flexible que se inserta en la uretra. La ecografía transrectal crea una imagen de la próstata usando ondas de sonido de una sonda en el recto, pero la única prueba que puede confirmar completamente el diagnóstico de cáncer de próstata es una biopsia, la extracción de pequeñas piezas de la próstata para su examen microscópico.
Imágenes
La ecografía y la resonancia magnética nuclear (RMN) son los dos principales métodos de imagen utilizados para la detección del cáncer de próstata.
IRM
Aspecto de la próstata en la resonancia magnética
En la resonancia magnética, las zonas central y de transición tienen una señal T2 más baja que la zona periférica. Dado que las zonas central y de transición no se pueden distinguir entre sí, pueden describirse mejor como la glándula central en la resonancia magnética. Por lo tanto, la glándula periférica tiene una señal más alta en T2WI que la glándula central. En la glándula periférica, el cáncer de próstata se presenta como una lesión de baja intensidad. Sin embargo, en la glándula central, las lesiones de baja intensidad no se pueden distinguir de las de la glándula central de baja intensidad. La restricción de la difusión es fundamental para identificar y caracterizar las lesiones de las glándulas centrales. Se pueden utilizar imágenes combinadas de difusión ponderada (DW) y resonancia magnética dinámica con contraste para distinguir las lesiones de próstata malignas de las benignas. Las imágenes combinadas, de DW y MRI con realce de contraste dinámico, pueden visualizar áreas con baja intensidad de señal y efecto de lavado rápido, característico de los carcinomas. La linfadenopatía se puede ver mejor en T1 con supresión de grasa poscontraste. En la RM se pueden describir otras regiones. El estroma fibromuscular anterior y la cápsula prostática a lo largo de la próstata posterior y lateral tienen una señal T2WI baja, en contraste con la señal brillante de la zona periférica. Puede observarse extensión extraprostática con alteración de la integridad de la cápsula.
IRM para la detección del cáncer de próstata
A partir de 2011, la IRM se usó para identificar objetivos para la biopsia de próstata mediante IRM de fusión con ultrasonido (EE. UU.) o guía de IRM sola. Una resonancia magnética por sí sola identificará correctamente al 91 % de los hombres con cáncer de próstata clínicamente significativo, pero clasificará erróneamente al 63 % de los hombres en riesgo de cáncer de próstata como si tuvieran cáncer de próstata clínicamente significativo. Una biopsia dirigida por IRM identificará correctamente al 80 % de los hombres con cáncer de próstata. Sin embargo, clasificará al 6 % de los hombres en riesgo de cáncer de próstata con cáncer de próstata clínicamente significativo. Se ha demostrado que la detección de cáncer clínicamente insignificante disminuye cuando la biopsia dirigida por MRI se combina con una biopsia estándar para hombres con resultados positivos en MRI, en comparación con un método de biopsia estándar.
Después de una resonancia magnética, las regiones de interés dentro de la exploración que pueden ser cáncer a menudo se clasifican en una escala de probabilidad entre 1 y 5. Una de esas escalas es la escala del sistema de datos e informes de imágenes de la próstata (PI-RADS) que define los estándares de servicio clínico para resonancia magnética multiparamétrica (mpMRI), incluida la creación y generación de informes de imágenes. La puntuación de la versión 2 de PI-RADS ha mostrado una especificidad y una sensibilidad del 73 % y del 95 %, respectivamente, para la detección del cáncer de próstata.
Cuando se utiliza una resonancia magnética para decidir si se debe realizar una biopsia en hombres que se han sometido a una biopsia anterior, hay un 5 % más de probabilidades de hacer un diagnóstico correcto que una biopsia estándar y un 12 % más de probabilidades de que sea correcta para los hombres que pueden o no haber tenido una biopsia previa. En los hombres que han tenido una biopsia negativa, esta combinación tiene un 44 % más de probabilidades de conducir a un diagnóstico correcto.
Otros usos de la resonancia magnética
La resonancia magnética de la próstata también se usa para la planificación quirúrgica de la prostatectomía robótica. Ayuda a los cirujanos a decidir si resecar o conservar el haz neurovascular, determinar el retorno a la continencia urinaria y ayudar a evaluar la dificultad quirúrgica. La resonancia magnética se utiliza en otros tipos de planificación del tratamiento, tanto para la terapia focal como para la radioterapia. La resonancia magnética también se puede utilizar para identificar áreas para el muestreo de investigación en biobancos.
Base biológica para la visibilidad del cáncer de próstata en la resonancia magnética
Las propiedades biológicas que determinan si un tumor es visible o no en la resonancia magnética son poco conocidas. Una teoría es que las células tumorales sufren varios cambios genéticos durante la transformación que alteran la tasa de crecimiento celular y la formación de nuevos vasos sanguíneos, lo que da lugar a tumores con patrones histológicos más agresivos, regiones hipóxicas y mayor densidad celular, entre otras características. Tener tumores más grandes y densos con cambios en las distribuciones de los vasos sanguíneos puede alterar la señal en la resonancia magnética a través de la restricción del movimiento de agua y/o fluidos.
Algunos estudios han relacionado la presencia de patrones histológicos raros dentro del tumor, como el patrón cribiforme. Aunque investigaciones recientes sugieren que hay una serie de características histopatológicas que pueden influir en la detección de tumores por resonancia magnética. A nivel genético, la visibilidad del cáncer de próstata en la resonancia magnética parece estar relacionada con las características genéticas de la enfermedad agresiva, incluidos procesos como la proliferación celular, la hipoxia tumoral y el daño del ADN. Los cambios genéticos observados consistentemente en los tumores visibles por IRM incluyen la pérdida del supresor tumoral PTEN, el aumento de la expresión de los genes asociados a la proliferación CENPF, AGR2 y el factor de crecimiento GDF15, así como una serie de otros genes. Los cambios en estas vías y genes pueden facilitar un mayor crecimiento del tumor, cambios en la vasculatura y la densidad que finalmente cambian la señal en la resonancia magnética.
Ultrasonido
Las imágenes por ultrasonido se pueden obtener por vía transrectal y se utilizan durante las biopsias de próstata. El cáncer de próstata puede verse como una lesión hipoecoica en el 60% de los casos. El otro 40% de las lesiones cancerosas son hiperecoicas o isoecoicas. En Doppler color, las lesiones aparecen hipervascularizadas.
MASCOTA
Una exploración de PSMA es una técnica de imagen de tomografía por emisión de positrones (PET) que se enfoca en la sobreexpresión de PSMA en el tejido del cáncer de próstata. Se ha desarrollado una gama de radiofármacos, y hay más en investigación activa. El galio-68 (68Ga) PSMA-11 y el flúor-18 (18F) PSMA-DCFPyL recibieron la aprobación de la FDA para las imágenes PET-CT en el cáncer de próstata en 2021. tiene un papel en la evaluación de pacientes con cáncer de próstata, especialmente pacientes que pueden recibir terapia con radioligando PSMA con lutecio-177 (177Lu).
Biopsia
Si se sospecha cáncer, se ofrece una biopsia de manera oportuna. Durante una biopsia, un urólogo o radiólogo obtiene muestras de tejido de la próstata a través del recto o del perineo. Una pistola de biopsia inserta y extrae agujas especiales de núcleo hueco (generalmente de tres a seis a cada lado de la próstata) en menos de un segundo. Las biopsias de próstata se realizan de forma rutinaria de forma ambulatoria y rara vez requieren hospitalización. Las biopsias sistemáticas identifican correctamente al 63 % de los hombres con cáncer de próstata clínicamente significativo, pero no detectan el resto. Para los hombres con riesgo de cáncer de próstata, la biopsia no clasificará erróneamente a ninguno de los hombres con cáncer de próstata clínicamente significativo.
Se deben usar antibióticos para prevenir complicaciones como fiebre, infecciones del tracto urinario y sepsis, incluso si no se ha definido el curso o la dosis más apropiados. Alrededor del 55% de los hombres reportan molestias durante la biopsia de próstata.
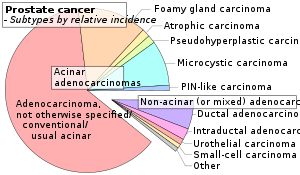
Diagnóstico histopatológico
Un diagnóstico histopatológico incluye principalmente la evaluación de si existe un cáncer, así como cualquier subdiagnóstico, si es posible. El subdiagnóstico histopatológico tiene implicaciones para la posibilidad y la metodología de la puntuación de Gleason. El subdiagnóstico histopatológico más frecuente es el adenocarcinoma acinar, constituyendo el 93% de los diagnósticos. La forma más común de adenocarcinoma acinar, a su vez, es el "adenocarcinoma, no especificado de otro modo", también denominado adenocarcinoma acinar convencional o habitual.
Diagnóstico bioquímico
La fosfatasa alcalina está más elevada en las células metastásicas que en las no metastásicas. Los altos niveles de fosfatasa alcalina se asocian con una disminución significativa en la supervivencia.
Puntuación de Gleason
El sistema de clasificación de Gleason se usa para ayudar a evaluar el pronóstico y ayuda a guiar la terapia. Una puntuación de Gleason se basa en la apariencia del tumor. Los cánceres con una puntuación de Gleason más alta son más agresivos y tienen un peor pronóstico. Los puntajes patológicos varían de 2 a 10, y un número más alto indica mayores riesgos y una mayor mortalidad.
Puntuación ISUP
En 2014, la Sociedad Internacional de Patología Urológica (ISUP, por sus siglas en inglés) proporcionó un nuevo sistema de clasificación del cáncer de próstata denominado puntuaciones ISUP.
| Grupo de riesgo | ISUP Grade Group | Gleason Score |
|---|---|---|
| Baja | Grupo de grado 1 | Gleason |
| Intermediatamente favorable | Grupo de grado 2 | Gleason 7 (3+4) |
| Intermedio Desfavorable | Grupo de grado 3 | Gleason 7 (4+3) |
| Alto | Grupo de grado 4 | Gleason 8 |
| Grupo de grado 5 | Gleason 9-10 |
Marcadores tumorales
Las muestras de tejido se pueden teñir para determinar la presencia de PSA y otros marcadores tumorales a fin de determinar el origen de las células malignas que han hecho metástasis.
El carcinoma de células pequeñas es un tipo raro (1 %) que no se puede diagnosticar mediante el PSA. A partir de 2009, los investigadores estaban investigando formas de detectar este tipo, porque hace metástasis rápidamente.
La oncoproteína BCL-2 está asociada con el desarrollo de cáncer de próstata andrógeno-independiente, debido a sus altos niveles de expresión en tumores andrógeno-independientes en estadios avanzados. La regulación positiva de BCL-2 después de la ablación de andrógenos en líneas celulares de carcinoma de próstata y en un modelo de rata macho castrada estableció aún más una conexión entre la expresión de BCL-2 y la progresión del cáncer de próstata.
Puesta en escena
Una parte importante de la evaluación del cáncer de próstata es determinar la etapa o el grado de propagación. Conocer el estadio ayuda a definir el pronóstico y es útil a la hora de seleccionar terapias. El sistema más común es el sistema TNM de cuatro etapas (abreviado de tumor/nódulos/metástasis). Sus componentes incluyen el tamaño del tumor, el número de ganglios linfáticos afectados y la presencia de cualquier otra metástasis. En el Reino Unido se utiliza el Cambridge Prognostic Group (CPG) para categorizar el cáncer de próstata en 5 grupos de riesgo (CPG1 a CPG5).
La distinción más importante que hace cualquier sistema de estadificación es si el cáncer está confinado a la próstata. En el sistema TNM, los cánceres clínicos T1 y T2 se encuentran solo en la próstata, mientras que los cánceres T3 y T4 han hecho metástasis. Se pueden usar varias pruebas para buscar evidencia de propagación. Las organizaciones profesionales de especialidades médicas desaconsejan el uso de tomografías por emisión de positrones, tomografías computarizadas o gammagrafías óseas cuando un médico estadifica el cáncer de próstata temprano con bajo riesgo de metástasis. Esas pruebas serían apropiadas en casos como cuando una tomografía computarizada evalúa la diseminación dentro de la pelvis, una gammagrafía ósea busca la diseminación a los huesos y la resonancia magnética con bobina endorrectal evalúa la cápsula prostática y las vesículas seminales. Las gammagrafías óseas deben revelar una apariencia osteoblástica debido al aumento de la densidad ósea en las áreas de metástasis ósea, lo contrario de lo que se encuentra en muchos otros cánceres metastásicos. Agentes de diagnóstico radiofarmacéuticos aprobados utilizados en PET: fluciclovina (2016), Ga 68 PSMA-11 (2020), piflufolastat (2021).
Después de una biopsia, un patólogo examina las muestras bajo un microscopio. Si hay cáncer presente, el patólogo informa el grado del tumor. El grado indica cuánto difiere el tejido tumoral del tejido prostático normal y sugiere qué tan rápido es probable que crezca el tumor. El patólogo asigna un número de Gleason del 1 al 5 para el patrón más común observado bajo el microscopio, luego hace lo mismo para el segundo patrón más común. La suma de estos dos números es la puntuación de Gleason. La etapa de Whitmore-Jewett es otro método.
En hombres con cáncer de próstata localizado de alto riesgo, la estadificación con PSMA PET/CT puede ser adecuada para detectar la diseminación metastásica a distancia oa los ganglios. En 2020, un ensayo aleatorizado de fase 3 comparó la PET/TC con PSMA con galio-68 con imágenes estándar (TC y gammagrafía ósea). Informó una precisión superior de la PET/TC con galio-68 PSMA-11 (92 % frente a 65 %), un mayor cambio significativo en el tratamiento (28 % frente a 15 %), menos hallazgos de imágenes equívocos/inciertos (7 % frente a 23 %) y menor exposición a la radiación (10 msV frente a 19 mSv). El estudio concluyó que PSMA PET/CT es un reemplazo adecuado para las imágenes convencionales.
Prevención
Dieta y estilo de vida
Los datos sobre la relación entre la dieta y el cáncer de próstata son escasos. Sin embargo, la tasa de cáncer de próstata está ligada al consumo de la dieta occidental. Poca o ninguna evidencia asocia la ingesta de grasas trans, grasas saturadas y carbohidratos con el cáncer de próstata. La evidencia no respalda el papel de los ácidos grasos omega-3 en la prevención del cáncer de próstata. Los suplementos vitamínicos parecen no tener efecto y algunos pueden aumentar el riesgo. El alto consumo de calcio suplementario se ha relacionado con el cáncer de próstata avanzado.
El pescado puede reducir las muertes por cáncer de próstata, pero no parece afectar la ocurrencia. Cierta evidencia apoya tasas más bajas de cáncer de próstata con una dieta vegetariana, licopeno, vegetales crucíferos con selenio, soya, frijoles y/u otras legumbres.
El ejercicio regular puede reducir ligeramente el riesgo, especialmente la actividad vigorosa.
Medicamentos
En aquellos que se someten a exámenes de detección con regularidad, los inhibidores de la 5-alfa-reductasa (finasterida y dutasterida) reducen el riesgo general de cáncer de próstata. Los datos son insuficientes para determinar si afectan el riesgo de muerte y pueden aumentar la posibilidad de casos más graves.
Proyección
La detección del cáncer de próstata busca cánceres en personas que no presentan síntomas. Las opciones incluyen el examen rectal digital y el análisis de sangre PSA. Tal detección es controvertida y, para muchos, puede conducir a una interrupción innecesaria y posiblemente a consecuencias dañinas. Los daños de las pruebas de detección basadas en la población, principalmente debido al sobrediagnóstico (la detección de cánceres latentes que de otro modo no se habrían descubierto) pueden superar los beneficios. Otros recomiendan la toma de decisiones compartida, un enfoque en el que la detección puede realizarse después de una consulta médica.
El Grupo de Trabajo de Servicios Preventivos de los Estados Unidos (USPSTF, por sus siglas en inglés) sugiere que la decisión de someterse a una prueba de PSA se base en una consulta con un médico para hombres de 55 a 69 años de edad. USPSTF recomienda no realizar pruebas de PSA después de los 70 años. Los Centros para el Control y la Prevención de Enfermedades respaldaron la conclusión de USPSTF. La Sociedad Estadounidense de Oncología Clínica y el Colegio Estadounidense de Médicos desaconsejan la detección para aquellos que se espera que vivan menos de 10 a 15 años, mientras que aquellos con una mayor expectativa de vida deben tomar una decisión que sopese individualmente los riesgos y beneficios potenciales. En general, concluyeron, "no está claro si los beneficios asociados con la prueba de PSA para la detección del cáncer de próstata compensan los daños asociados con la detección y el tratamiento innecesario posterior".
Las pautas de la American Urological Association (AUA 2013) exigen sopesar los beneficios inciertos de las pruebas de detección frente a los daños conocidos asociados con las pruebas de diagnóstico y el tratamiento. La AUA recomienda que la toma de decisiones compartida controle la evaluación para las personas de 55 a 69 años, y que la evaluación no se realice con más frecuencia que cada dos años. En el Reino Unido a partir de 2018, no existía ningún programa para detectar el cáncer de próstata.
Administración
La primera decisión es si se necesita tratamiento. Las formas de bajo grado que se encuentran en hombres mayores a menudo crecen tan lentamente que no se requiere tratamiento. El tratamiento puede ser inapropiado si una persona tiene otros problemas de salud graves o si no se espera que viva lo suficiente como para que aparezcan los síntomas. Los enfoques en los que se pospone el tratamiento se denominan "manejo expectante". El manejo expectante se divide en dos enfoques: espera vigilante, que tiene una intención paliativa (tiene como objetivo tratar solo los síntomas) y vigilancia activa, que tiene una intención curativa (tiene como objetivo evitar que el cáncer avance).
La mejor opción depende del estadio de la enfermedad, la puntuación de Gleason y el nivel de PSA. Otros factores importantes son la edad, el estado de salud general y la opinión de la persona sobre los posibles tratamientos y sus posibles efectos secundarios. Debido a que la mayoría de los tratamientos pueden tener efectos secundarios significativos, como la disfunción eréctil y la incontinencia urinaria, las discusiones sobre el tratamiento a menudo se centran en equilibrar los objetivos de la terapia con los riesgos de las alteraciones del estilo de vida. Una revisión de 2017 encontró que se necesita más investigación centrada en los resultados centrados en la persona para guiar a los pacientes. A menudo se recomienda una combinación de opciones de tratamiento.
Las pautas para situaciones clínicas específicas requieren una estimación de la esperanza de vida. A medida que aumenta la expectativa de vida promedio debido a los avances en el tratamiento de otras enfermedades, más pacientes vivirán lo suficiente para que su cáncer de próstata exprese síntomas. Se propuso un cuestionario de 18 ítems para saber si los pacientes tienen el conocimiento y la comprensión adecuados de sus opciones de tratamiento. En un estudio de 2015, la mayoría de los recién diagnosticados respondieron correctamente menos de la mitad de las preguntas.
El uso generalizado de la prueba de PSA en los EE. UU. ha dado como resultado un diagnóstico a una edad y una etapa del cáncer más tempranas, pero casi todos los casos aún se diagnostican después de los 65 años, mientras que alrededor del 25 % se diagnostican después de los 75 años. Aunque la Red Nacional Integral del Cáncer de EE. UU. Las guías recomiendan usar la expectativa de vida para ayudar a tomar decisiones de tratamiento; en la práctica, a muchos pacientes de edad avanzada no se les ofrecen opciones de tratamiento curativo como la prostatectomía radical o la radioterapia y, en cambio, se les trata con terapia hormonal o espera vigilante.
Vigilancia
Muchos hombres diagnosticados con cáncer de próstata de bajo riesgo son elegibles para vigilancia activa. El tumor se observa detenidamente a lo largo del tiempo, con la intención de iniciar tratamiento si aparecen signos de progresión. La vigilancia activa no es sinónimo de espera vigilante, un término que implica ningún tratamiento o programa específico de seguimiento, con el supuesto de que solo se usaría el tratamiento paliativo si se desarrolla una enfermedad sintomática avanzada.
La vigilancia activa consiste en controlar el crecimiento del tumor o los síntomas que desencadenan el tratamiento. El proceso de monitoreo puede incluir pruebas de PSA, examen rectal digital o biopsias repetidas cada pocos meses. El objetivo de la vigilancia activa es posponer el tratamiento y evitar el tratamiento excesivo y sus efectos secundarios, dado un tumor de crecimiento lento o autolimitado que en la mayoría de las personas es poco probable que cause problemas. Este enfoque no se usa para los cánceres agresivos y puede causar ansiedad a las personas que creen erróneamente que todos los cánceres son mortales o que su afección pone en peligro la vida. Entre el 50 y el 75% de los pacientes fallecen por otras causas sin presentar síntomas prostáticos. En la enfermedad localizada, con base en el seguimiento a largo plazo, la prostatectomía radical produce resultados oncológicos significativamente mejores en comparación con la conducta expectante. La prostatectomía se asocia con mayores tasas de incontinencia urinaria y disfunción eréctil, pero estos hallazgos se basan principalmente en hombres diagnosticados antes de la detección generalizada de PSA y no pueden generalizarse mucho. Cuando se compara con el seguimiento/vigilancia activa, en el seguimiento a diez años, la prostatectomía radical probablemente tenga resultados similares para la supervivencia específica de la enfermedad y probablemente reduzca el riesgo de progresión y propagación de la enfermedad. La función urinaria y sexual probablemente estén disminuidas en pacientes tratados con prostatectomía radical.
Tratamiento activo
Hay tratamientos quirúrgicos y no quirúrgicos disponibles, pero el tratamiento puede ser difícil y se pueden usar combinaciones. El tratamiento con radioterapia de haz externo, braquiterapia, criocirugía, ultrasonido focalizado de alta intensidad y prostatectomía se ofrece, en general, a los hombres cuyo cáncer permanece dentro de la próstata. La terapia hormonal y la quimioterapia a menudo se reservan para la enfermedad metastásica. Las excepciones incluyen la terapia local o dirigida a la metástasis con radiación que se puede usar para tumores avanzados con metástasis limitada. La terapia hormonal se usa para algunos tumores en etapa temprana. Se puede ofrecer crioterapia (el proceso de congelación del tumor), terapia hormonal y quimioterapia si el tratamiento inicial falla y el cáncer progresa. Se informó que sipuleucel-T, una vacuna contra el cáncer, ofrecía un aumento de cuatro meses en la supervivencia en el cáncer de próstata metastásico, pero la autorización de comercialización se retiró el 19 de mayo de 2015.
Si la radioterapia falla, la prostatectomía radical puede ser una opción, aunque es una cirugía técnicamente desafiante. Sin embargo, la radioterapia después del fracaso quirúrgico puede tener muchas complicaciones. Se asocia con un pequeño aumento de cáncer de vejiga y colon. La radioterapia y la cirugía parecen tener resultados similares con respecto a la función intestinal, eréctil y urinaria después de cinco años.
Tratamiento no quirúrgico
El tratamiento no quirúrgico puede incluir radioterapia, quimioterapia, terapia hormonal, radioterapia de haz externo y terapia con partículas, ultrasonido enfocado de alta intensidad o alguna combinación.
El cáncer de próstata que persiste cuando la terapia hormonal reduce los niveles de testosterona se denomina cáncer de próstata resistente a la castración (CPRC). Muchos cánceres en etapa temprana necesitan niveles normales de testosterona para crecer, pero el CRPC no. Anteriormente considerado "cáncer de próstata refractario a las hormonas" o "cáncer de próstata independiente de andrógenos", el término CRPC surgió porque estos cánceres muestran una dependencia de las hormonas, particularmente la testosterona, para la activación del receptor de andrógenos.
El docetaxel quimioterapéutico contra el cáncer se ha utilizado como tratamiento para el CPRC con un beneficio de supervivencia promedio de 2 a 3 meses. Un tratamiento de quimioterapia de segunda línea es cabazitaxel. Una combinación de bevacizumab, docetaxel, talidomida y prednisona parece eficaz en el tratamiento del CPRC.
El tratamiento de inmunoterapia con sipuleucel-T en CRPC pareció aumentar la supervivencia en cuatro meses. Sin embargo, la autorización de comercialización de sipuleucel-T se retiró el 19 de mayo de 2015. La terapia hormonal de segunda línea, abiraterona, aumenta la supervivencia en aproximadamente 4,6 meses. La enzalutamida es otro agente hormonal de segunda línea con una ventaja de supervivencia de cinco meses. Tanto la abiraterona como la enzalutamida se encuentran actualmente en ensayos clínicos en personas con CRPC que no han recibido quimioterapia anteriormente.
No todos los pacientes responden a los fármacos bloqueadores de la señalización de andrógenos. Ciertas células con características que se asemejan a las células madre no se ven afectadas. Por lo tanto, el deseo de mejorar los resultados del CRPC resultó en dosis crecientes o terapia combinada con agentes bloqueadores de la señalización de andrógenos sinérgicos. Pero incluso esta combinación no afectará a las células madre que no exhiben señalización de andrógenos.
Para los pacientes con cáncer de próstata metastásico que se ha diseminado a los huesos, los médicos usan una variedad de agentes modificadores de los huesos para prevenir complicaciones esqueléticas y apoyar la formación de nueva masa ósea. El ácido zoledrónico (un bifosfonato) y el denosumab (un inhibidor del ligando de RANK) parecen ser agentes efectivos, pero están asociados con eventos adversos más frecuentes y graves.
Cirugía
La prostatectomía radical se considera el pilar del tratamiento quirúrgico del cáncer de próstata, donde el cirujano extirpa la próstata, las vesículas seminales y los ganglios linfáticos circundantes. Se puede realizar mediante una técnica abierta (una incisión en la piel en la parte inferior del abdomen) o por vía laparoscópica. La prostatectomía radical retropúbica es la técnica quirúrgica abierta más utilizada. La prostatectomía asistida por robot se ha vuelto común. Los hombres con cáncer de próstata localizado, sometidos a prostatectomía radical laparoscópica o prostatectomía radical asistida por robot, pueden tener estadías más cortas en el hospital y recibir menos transfusiones de sangre que los hombres sometidos a prostatectomía radical abierta. Se desconoce cómo se comparan estos tratamientos con respecto a la supervivencia general o la supervivencia libre de recurrencia.
La resección transuretral de la próstata es el tratamiento quirúrgico estándar para el agrandamiento benigno de la próstata. En el cáncer de próstata, este procedimiento se puede usar para aliviar los síntomas de retención urinaria causados por un tumor de próstata grande, pero no se usa para tratar el cáncer en sí. El procedimiento se realiza bajo anestesia espinal, se inserta un resectoscopio dentro del pene y se corta el tejido prostático adicional para despejar el paso de la orina.
Complicaciones
Las dos principales complicaciones encontradas después de la prostatectomía y la radioterapia prostática son la disfunción eréctil y la incontinencia urinaria, principalmente de tipo estrés. La mayoría de los hombres recuperan la continencia dentro de los 6 a 12 meses posteriores a la operación, por lo que los médicos suelen esperar al menos un año antes de recurrir a tratamientos invasivos.
La incontinencia urinaria de esfuerzo generalmente ocurre después de la cirugía de próstata o la radioterapia debido a factores que incluyen daño al esfínter uretral o al tejido y los nervios circundantes. La próstata rodea la uretra, un tubo muscular que cierra la vejiga urinaria. Cualquiera de las razones mencionadas puede conducir a un cierre incompetente de la uretra y, por lo tanto, a la incontinencia. La terapia inicial incluye entrenamiento de la vejiga, cambios en el estilo de vida, ejercicios de Kegel y el uso de compresas para la incontinencia. El tratamiento quirúrgico más invasivo puede incluir la inserción de un cabestrillo uretral o un esfínter urinario artificial, que es un dispositivo mecánico que imita la función del esfínter uretral y que el paciente activa manualmente a través de un interruptor implantado en el escroto. Este último se considera el estándar de oro en pacientes con incontinencia urinaria de esfuerzo moderada o grave.
La disfunción eréctil ocurre en diferentes grados en casi todos los hombres que se someten a un tratamiento para el cáncer de próstata, incluida la radioterapia o la cirugía; sin embargo, dentro de un año, la mayoría de ellos notará una mejoría. Si se dañaron los nervios, este progreso puede no tener lugar. El tratamiento farmacológico incluye inhibidores de la PDE-5 como viagra o cialis, o fármacos inyectables intracavernosos inyectados directamente en el pene (prostaglandina E1 y mezclas de fármacos vasoactivos). Otra terapia no farmacológica incluye dispositivos de constricción por vacío e implantes de pene.
Psicológico
Se recomiendan intervenciones psicológicas como la psicoeducación, la terapia cognitiva conductual (TCC) y la atención plena para el manejo de las complicaciones mentales y emocionales de los síntomas de la enfermedad y aquellas asociadas con el tratamiento activo. Debido a la investigación limitada y al rigor metodológico inadecuado de la literatura publicada, no se pueden hacer recomendaciones sólidas sobre la efectividad de la atención plena en hombres con cáncer de próstata.
Pronóstico
Muchos cánceres de próstata no están destinados a ser letales y, en última instancia, la mayoría de los hombres no morirán como resultado de la enfermedad. La mortalidad varía ampliamente según la geografía y otros elementos. En los Estados Unidos, las tasas de supervivencia a cinco años oscilan entre el 29 % (metástasis a distancia) y el 100 % (tumores locales o regionales). En Japón, la tasa de mortalidad aumentó a 8,6/100.000 en 2000. En India, en la década de 1990, la mitad de las personas diagnosticadas con cáncer local morían en 19 años. Un estudio informó que los afroamericanos tienen entre 50 y 60 veces más muertes que las que se encuentran en Shanghái, China. En Nigeria, el 2 % de los hombres desarrollan cáncer de próstata y el 64 % de ellos muere después de 2 años. La mayoría de los hombres nigerianos presentan enfermedad metastásica con una supervivencia típica de 40 meses.
En los pacientes que se someten a tratamiento, los indicadores de pronóstico clínico más importantes del resultado de la enfermedad son el estadio, el nivel de PSA previo al tratamiento y la puntuación de Gleason. Cuanto mayor sea el grado y la etapa, peor será el pronóstico. Los nomogramas se pueden utilizar para calcular el riesgo estimado del paciente individual. Las predicciones se basan en la experiencia de grandes grupos de pacientes. Un factor de complicación es que la mayoría de los pacientes tienen múltiples focos tumorales independientes en el momento del diagnóstico, y estos focos tienen cambios genéticos y características moleculares independientes. Debido a esta gran heterogeneidad interfocal, existe el riesgo de que el pronóstico se establezca en base al foco tumoral equivocado.
Un aspecto importante de la toma de decisiones sobre el valor del tratamiento es cómo equilibrar el pronóstico del cáncer de próstata con otras causas de mortalidad y morbilidad del tratamiento. El algoritmo PREDICT Prostate (https://prostate.predict.nhs.uk) es un modelo de pronóstico multivariable que proporciona estimaciones individualizadas de supervivencia global y específica del cáncer a largo plazo en pacientes con CaP no metastásico en etapa temprana. Además del uso de variables clínico-patológicas preoperatorias disponibles de forma rutinaria, como el PSA, la puntuación de Gleason de la biopsia (grupo de grado ISUP) y el estadio T clínico, la herramienta PREDICT Prostate también incluye el impacto de las características del paciente (edad y estado de comorbilidad) y tratamiento radical (prostatectomía radical o radioterapia) sobre la supervivencia. La herramienta proporciona a los pacientes tasas de supervivencia estimadas después del tratamiento en el contexto de la tasa de mortalidad absoluta, lo que les permite tomar una decisión informada sobre el valor del tratamiento y sus posibles efectos secundarios. Thurtle et al. realizó una validación externa de su modelo de próstata PREDICT previamente publicado. La herramienta superó a otros modelos ampliamente utilizados y se demostró que tiene índices c altos para todas las causas y mortalidad específica del CaP, y la calibración del modelo fue buena y se mantuvo precisa dentro de los subgrupos de tratamiento. El trabajo reciente también ha demostrado que altera significativamente las recomendaciones de tratamiento de los médicos y mejora la confianza de los pacientes en la toma de decisiones y en su comprensión de los riesgos de mortalidad de un nuevo diagnóstico de cáncer de próstata. para la salud y la excelencia en la atención
La terapia de ablación con andrógenos provoca la remisión en el 80-90 % de los pacientes que se someten a la terapia, lo que resulta en una mediana de supervivencia libre de progresión de 12 a 33 meses. Después de la remisión, típicamente surge un fenotipo independiente de andrógenos, en el que la mediana de supervivencia general es de 23 a 37 meses desde el momento del inicio de la terapia de ablación de andrógenos. No está claro cómo se establece la independencia de los andrógenos y cómo restablece la progresión.
Sistemas de clasificación
Hay varias herramientas disponibles para ayudar a predecir los resultados, como el estadio patológico y la recurrencia después de la cirugía o la radioterapia. La mayoría combina el estadio, el grado y el nivel de PSA, y algunos incluyen el número o el porcentaje de núcleos de biopsia positivos, la edad y/u otra información.
- La clasificación D'Amico estratifica a los hombres por bajo, intermedio o alto riesgo basado en estadio, grado y PSA. Se utiliza ampliamente en la práctica clínica y la configuración de investigación. La desventaja principal del sistema de tres niveles es que no cuenta con múltiples parámetros adversos (por ejemplo, puntuación de Gleason alta y PSA alto en pacientes estratificadores.
- Las tablas Partin predicen los resultados patológicos (Estado de inicio, extensión extraprostática y invasión de vesículas seminal) basados en las mismas tres variables y se publican como cuadros de búsqueda.
- Los nomogramas Kattan predicen la recurrencia después de la cirugía y/o radioterapia, sobre la base de datos disponibles en el momento del diagnóstico o después de la cirugía. La puntuación de Kattan representa la probabilidad de permanecer libre de enfermedad en un intervalo de tiempo dado después del tratamiento.
- La puntuación del Cáncer UCSF de la Evaluación del Riesgo de próstata (CAPRA) predice tanto el estado patológico como la recurrencia después de la cirugía. Ofrece precisión comparable al nomograma preoperatorio de Kattan y se puede calcular sin tablas o una calculadora. Los puntos se asignan sobre la base de PSA, grado, etapa, edad y porcentaje de núcleos positivos; la suma produce una puntuación de 0 a 10, con cada dos puntos que representan aproximadamente una duplicación del riesgo de recurrencia. La puntuación de CAPRA se deriva de datos basados en la comunidad en la base de datos CaPSURE. Se ha validado entre más de 10.000 pacientes de prostatectomía, incluyendo pacientes de CaPSURE; el registro SEARCH, representando datos de varios Veteranos Administración de Salud y centros médicos militares; una cohorte multiinstitucional en Alemania; y la cohorte de prostatectomía en la Universidad Johns Hopkins. Más recientemente, se ha demostrado que predice metástasis y mortalidad tras la prostatectomía, radioterapia, espera vigilante o terapia de privación de andrógeno.
- Las directrices del UK National Institute for Health and Care Excellence recomiendan el uso del modelo de 5 niveles de Cambridge Prognostic Groups (CPG) al determinar las opciones de tratamiento. La justificación del cambio relacionado con las pruebas recientes, lo que sugiere que el modelo de estratificación de riesgo de 5 niveles era mejor para predecir la mortalidad específica del cáncer de próstata que los modelos de 3 niveles más antiguos El modelo CPG ha sido probado y validado en estudios que incluyen √80,000 hombres El modelo y las recomendaciones de tratamiento del CPG NICE pueden consultarse en el sitio web de la directriz NICE.
Esperanza de vida
Las proyecciones de esperanza de vida son promedios para toda una población masculina, y muchos factores médicos y de estilo de vida modifican estos números. Por ejemplo, los estudios han demostrado que un hombre de 40 años perderá 3,1 años de vida si tiene sobrepeso (IMC 25-29) y 5,8 años de vida si es obeso (IMC 30 o más), en comparación con los hombres de peso normal. Si tiene sobrepeso y fuma, perderá 6,7 años, y si es obeso y fumador, perderá 13,7 años.
Ninguna evidencia muestra que la cirugía o la radiación de haz tengan una ventaja sobre la otra en este sentido. Las tasas de mortalidad más bajas informadas con la cirugía parecen ocurrir porque es más probable que la cirugía se ofrezca a hombres más jóvenes con cánceres menos graves. No se dispone de información suficiente para determinar si la radiación de semillas prolonga la vida más fácilmente que los otros tratamientos, pero los datos hasta el momento no sugieren que lo haga.
Es poco probable que los hombres con enfermedad de bajo grado (Gleason 2–4) mueran de cáncer de próstata dentro de los 15 años posteriores al diagnóstico. Los hombres mayores (de 70 a 75 años) con enfermedad de bajo grado tuvieron una supervivencia general de aproximadamente el 20 % a los 15 años debido a las muertes por causas contrapuestas. Los hombres con enfermedad de alto grado (Gleason 8-10) experimentaron una alta mortalidad dentro de los 15 años posteriores al diagnóstico, independientemente de su edad.
Epidemiología
A partir de 2012, el cáncer de próstata es el segundo cáncer diagnosticado con más frecuencia (el 15 % de todos los cánceres masculinos) y la sexta causa principal de muerte por cáncer en hombres en todo el mundo. En 2010, el cáncer de próstata resultó en 256 000 muertes, frente a las 156 000 muertes en 1990. Las tasas de cáncer de próstata varían ampliamente. Las tarifas varían mucho entre países. Es menos común en el sur y este de Asia, y más común en Europa, América del Norte, Australia y Nueva Zelanda. El cáncer de próstata es menos común entre los hombres asiáticos y más común entre los hombres negros, con los hombres blancos en el medio.
La tasa de incidencia anual promedio de cáncer de próstata entre 1988 y 1992 entre los hombres chinos en los Estados Unidos fue 15 veces mayor que la de sus contrapartes que viven en Shanghái y Tianjin, pero estas altas tasas pueden verse afectadas por tasas más altas de detección. Muchos sugieren que el cáncer de próstata puede estar subestimado, pero la incidencia de hiperplasia prostática benigna en China y Japón es similar a las tasas en los países occidentales.
Más del 80 % de los hombres desarrollan cáncer de próstata a los 80 años.
Estados Unidos
El cáncer de próstata es la tercera causa principal de muerte por cáncer en los hombres, superada por el cáncer de pulmón y el cáncer colorrectal. Representa el 19% de todos los cánceres masculinos y el 9% de las muertes relacionadas con el cáncer masculino.
Los casos oscilaron entre un estimado de 230 000 en 2005 y un estimado de 164 690 en 2018.
Las muertes se mantuvieron estables alrededor de 30 000 en 2005 y 29 430 en 2018.
Las tasas de incidencia ajustadas por edad aumentaron constantemente desde 1975 hasta 1992, con aumentos particularmente dramáticos asociados con la difusión de las pruebas de detección del PSA a fines de la década de 1980, seguidas más tarde por una caída en la incidencia. Una disminución en las tasas de incidencia en etapa temprana de 2011 a 2012 (19 %) en hombres de 50 años o más persistió hasta 2013 (6 %).
Las disminuciones en las tasas de mortalidad en ciertas jurisdicciones pueden reflejar la interacción de la prueba de PSA y la mejora del tratamiento. El riesgo de por vida estimado es de alrededor del 14,0 % y el riesgo de mortalidad de por vida es del 2,6 %.
Entre 2005 y 2011, la proporción de enfermedad diagnosticada en un estadio locorregional fue del 93 % para los blancos y del 92 % para los afroamericanos; la proporción de enfermedad diagnosticada en una etapa tardía fue del 4 % para los estadounidenses de origen europeo y del 5 % para los estadounidenses de origen africano.
El cáncer de próstata es más común en la población afroamericana que en la población europea americana. Un estudio de autopsias de hombres blancos y asiáticos también encontró un aumento en el cáncer de próstata oculto con la edad, alcanzando casi el 60 % en hombres mayores de 80 años. Más del 50 % de los cánceres en hombres asiáticos y el 25 % de los cánceres en hombres blancos tenían una puntuación de Gleason de 7 o más, lo que sugiere que la puntuación de Gleason puede ser un indicador impreciso de casos clínicamente insignificantes.
Canadá
El cáncer de próstata es el tercer tipo de cáncer en los hombres canadienses. En 2016, alrededor de 4000 murieron y 21 600 hombres fueron diagnosticados con cáncer de próstata.
Europa
En Europa en 2012, fue el tercer cáncer más diagnosticado después de los cánceres de mama y colorrectal con 417 000 casos.
En el Reino Unido, es la segunda causa más común de muerte por cáncer después del cáncer de pulmón, donde cada año se diagnostican alrededor de 35 000 casos, de los cuales alrededor de 10 000 son mortales.
Historia
La próstata fue descrita por primera vez por el anatomista veneciano Niccolò Massa en 1536 e ilustrada por el anatomista flamenco Andreas Vesalius en 1538. El cáncer de próstata se identificó en 1853. Inicialmente se consideró una enfermedad rara, probablemente debido a una esperanza de vida más corta y a una detección más deficiente. Métodos en el siglo XIX. Los primeros tratamientos fueron cirugías para aliviar la obstrucción urinaria.
La extirpación de la glándula se describió por primera vez en 1851, y la prostatectomía radical perineal fue realizada por primera vez en 1904 por Hugh H. Young en el Hospital Johns Hopkins.
La extirpación quirúrgica de los testículos (orquiectomía) para tratar el cáncer de próstata se realizó por primera vez en la década de 1890, con un éxito limitado. La resección transuretral de la próstata (RTUP) reemplazó a la prostatectomía radical para el alivio sintomático de la obstrucción a mediados del siglo XX porque podía preservar mejor la función eréctil del pene. La prostatectomía retropúbica radical fue desarrollada en 1983 por Patrick Walsh. Este enfoque quirúrgico permitió la extirpación de la próstata y los ganglios linfáticos manteniendo la función del pene.
En 1941, Charles B. Huggins publicó estudios en los que utilizó estrógeno para oponerse a la producción de testosterona en hombres con cáncer de próstata metastásico. Este descubrimiento de la "castración química" le ganó a Huggins el Premio Nobel de Fisiología o Medicina en 1966. El papel de la hormona liberadora de gonadotropina (GnRH) en la reproducción fue determinado por Andrzej W. Schally y Roger Guillemin, quienes compartieron el Premio Nobel de Fisiología o Medicina de 1977 por este trabajo. Los agonistas de los receptores de GnRH, como la leuprorelina y la goserelina, se desarrollaron y utilizaron posteriormente para tratar el cáncer de próstata.
La radioterapia para el cáncer de próstata se desarrolló por primera vez a principios del siglo XX e inicialmente consistía en implantes de radio intraprostática. La radioterapia de haz externo se hizo más popular a medida que se disponía de fuentes de radiación [de rayos X] más potentes a mediados del siglo XX. La braquiterapia con semillas implantadas (para el cáncer de próstata) se describió por primera vez en 1983.
La quimioterapia sistémica para el cáncer de próstata se estudió por primera vez en la década de 1970. Al régimen inicial de ciclofosfamida y 5-fluorouracilo se unieron rápidamente otros regímenes que utilizaban otros fármacos quimioterápicos sistémicos.
La enzalutamida obtuvo la aprobación de la FDA en 2012 para el tratamiento del cáncer de próstata resistente a la castración (CPRC). Alpharadin obtuvo la aprobación de la FDA en 2013, bajo el programa de revisión prioritaria.
En 2006, un retrovirus previamente desconocido, el virus relacionado con Xenotropic MuLV (XMRV), se asoció con tumores de próstata humanos, pero PLOS Pathogens se retractó del artículo en 2012.
Sociedad y cultura
Los hombres con cáncer de próstata generalmente encuentran disparidades significativas en la concientización, la financiación, la cobertura de los medios y la investigación (y, por lo tanto, un tratamiento inferior y peores resultados) en comparación con otros tipos de cáncer de igual prevalencia. En 2001, The Guardian señaló que Gran Bretaña tenía 3000 enfermeras especializadas en cáncer de mama, en comparación con una sola enfermera para el cáncer de próstata. El tiempo de espera entre la derivación y el diagnóstico fue de dos semanas para el cáncer de mama, pero de tres meses para el cáncer de próstata.
Un informe de 2007 de la Coalición Nacional contra el Cáncer de Próstata, con sede en EE. UU., indicó que los medicamentos contra el cáncer de mama superaban siete a uno los medicamentos contra el cáncer de próstata. The Times también señaló un "sesgo anti-masculino en la financiación del cáncer" con una discrepancia de cuatro a uno en el Reino Unido tanto por parte del gobierno como de organizaciones benéficas contra el cáncer como Cancer Research UK. Los críticos citan tales cifras cuando afirman que se favorece la salud de la mujer sobre la salud del hombre.
Las disparidades se extienden a la detección, ya que los gobiernos no financian ni ordenan la detección del cáncer de próstata mientras apoyan plenamente los programas de cáncer de mama. Por ejemplo, un informe de 2007 encontró que 49 estados de EE. UU. exigen cobertura de seguro para las pruebas de detección de cáncer de mama de rutina, en comparación con 28 para el cáncer de próstata.
El cáncer de próstata experimenta una cobertura mediática significativamente menor que otros cánceres igualmente prevalentes, superado 2,6:1 por el cáncer de mama.
El mes de concientización sobre el cáncer de próstata se lleva a cabo en septiembre en varios países. Se utiliza una cinta azul claro para promover la causa.
Investigación
Cáncer de próstata resistente a la castración
El cáncer de próstata resistente a la castración es el cáncer de próstata que progresa a pesar de la terapia de depleción de andrógenos.
La enzalutamida es un antiandrógeno no esteroideo (NSAA). Se ha utilizado con abiraterona en estudios de secuenciación del genoma completo que han demostrado cómo los receptores de andrógenos adquieren resistencia a los mismos, lo que determina el uso de nuevas terapias contra esta patología como degradadores de la proteína o del dominio N-terminal de este receptor. Esto se ha visto gracias a la secuenciación del ADN tumoral circulante en pacientes.
Alpharadin utiliza isótopos de radio-223 dirigidos a los huesos para eliminar las células cancerosas mediante radiación alfa.
El inhibidor de PARP olaparib es un fármaco aprobado para el cáncer de mama/ovario que se encuentra en ensayos clínicos. También se encuentran en ensayos para el CRPC: el inhibidor del punto de control ipilimumab, el inhibidor de CYP17 galeterona (TOK-001) y la inmunoterapia PROSTVAC.
Todos los medicamentos para CRPC bloquean la señalización del receptor de andrógenos (AR) a través de la orientación directa o indirecta del dominio de unión al ligando AR (LBD). AR pertenece a la familia de receptores nucleares de esteroides. El desarrollo de la próstata depende de la señalización de andrógenos mediada por AR, y AR también es importante para la progresión de la enfermedad. Han surgido moléculas que podrían dirigirse con éxito a dominios alternativos. Tales terapias podrían brindar una ventaja; particularmente en el tratamiento de cánceres de próstata que son resistentes a las terapias actuales.
Evolución
Las técnicas de secuenciación, además de reflejar los mecanismos de resistencia al tratamiento, a través del ADN tumoral circulante, distinguen entre la historia evolutiva de este cáncer cuando hace metástasis y la dinámica subclonal temporal, determinando cómo se encuentra el tumor cuando se diagnostica.
Preclínico
Se ha identificado que la araquidonato 5-lipoxigenasa desempeña un papel importante en la supervivencia de las células del cáncer de próstata. Se están desarrollando medicamentos que se dirigen a esta enzima. En particular, los inhibidores de la araquidonato 5-lipoxigenasa producen una muerte celular programada masiva y rápida en las células de cáncer de próstata.
La galectina-3 es otro objetivo potencial. Se han descrito perfiles de glicanos aberrantes en el cáncer de próstata, y los estudios han encontrado vínculos específicos entre la firma galectina y el cáncer de próstata.
La familia de quinasas PIM es otro objetivo potencial para la inhibición selectiva. Se están desarrollando varios medicamentos relacionados. Se ha sugerido que el enfoque más prometedor puede ser co-objetivo de esta familia con otras vías, incluida la PI3K.
Modelos de cáncer
Los científicos han establecido líneas celulares de cáncer de próstata para investigar la progresión de la enfermedad. LNCaP, PC-3 (PC3) y DU-145 (DU145) son líneas celulares de cáncer de próstata comúnmente utilizadas. La línea celular de cáncer LNCaP se estableció a partir de una lesión metastásica de adenocarcinoma prostático en un ganglio linfático humano. Se establecieron células PC-3 y DU-145 a partir de adenocarcinoma prostático humano metastásico al hueso y al cerebro, respectivamente. Las células LNCaP expresan AR, pero las células PC-3 y DU-145 expresan muy poco o nada de AR.
La proliferación de las células LNCaP depende de los andrógenos, pero la proliferación de las células PC-3 y DU-145 no es sensible a los andrógenos. La elevación de la expresión de AR a menudo se observa en pacientes con tumores de próstata avanzados. Se han desarrollado algunas sublíneas LNCaP independientes de andrógenos a partir de células LNCaP dependientes de andrógenos de la ATCC después de la privación de andrógenos para el estudio de la progresión del cáncer de próstata. Estas células LNCaP independientes de andrógenos tienen una expresión AR elevada y expresan antígeno prostático específico tras el tratamiento con andrógenos. Paradójicamente, los andrógenos inhiben la proliferación de estas células de cáncer de próstata independientes de andrógenos.
Diagnóstico
Un área de investigación activa y las investigaciones aplicadas no clínicamente involucran métodos no invasivos de detección de tumores. Se está investigando una prueba molecular que detecta la presencia de ARNm de PCA3 asociado a células en el líquido obtenido de la próstata y la muestra de orina de la primera evacuación. El ARNm de PCA3 se expresa casi exclusivamente en las células de próstata y se ha demostrado que se sobreexpresa en gran medida en las células de cáncer de próstata. El resultado de la prueba se informa actualmente como una proporción de muestras de ARNm de PCA3 a ARNm de PSA.
La prueba PCA3 intenta ayudar a decidir si, en hombres con sospecha de cáncer de próstata (especialmente si una biopsia inicial no logra explicar el PSA sérico elevado), se necesita una biopsia/rebiopsia. Cuanto mayor sea la expresión de PCA3 en la muestra, mayor será la probabilidad de una biopsia positiva. El Grupo de Trabajo de Evaluación de Aplicaciones Genómicas en la Práctica y Prevención de los CDC desaconseja el uso clínico.
Contenido relacionado
Ribozima
Magnus Hirschfeld
Infecciones del torrente sanguíneo