Cáncer de cuello uterino
El cáncer de cuello uterino es un cáncer que se origina en el cuello uterino. Se debe al crecimiento anormal de células que tienen la capacidad de invadir o propagarse a otras partes del cuerpo. Al principio, por lo general no se observan síntomas. Los síntomas posteriores pueden incluir sangrado vaginal anormal, dolor pélvico o dolor durante las relaciones sexuales. Si bien el sangrado después del sexo puede no ser grave, también puede indicar la presencia de cáncer de cuello uterino.
La infección por el virus del papiloma humano (VPH) causa más del 90 % de los casos; Sin embargo, la mayoría de las mujeres que han tenido infecciones por VPH no desarrollan cáncer de cuello uterino. Las cepas de VPH 16 y 18 son responsables de casi el 50 % de los precánceres de cuello uterino de alto grado. Otros factores de riesgo incluyen fumar, un sistema inmunitario débil, píldoras anticonceptivas, comenzar a tener relaciones sexuales a una edad temprana y tener muchas parejas sexuales, pero estos son menos importantes. Los factores genéticos también contribuyen al riesgo de cáncer de cuello uterino. El cáncer de cuello uterino generalmente se desarrolla a partir de cambios precancerosos durante 10 a 20 años. Alrededor del 90 % de los casos de cáncer de cuello uterino son carcinomas de células escamosas, el 10 % son adenocarcinomas y una pequeña cantidad son de otros tipos. El diagnóstico generalmente se realiza mediante un examen cervical seguido de una biopsia. Luego se realizan imágenes médicas para determinar si el cáncer se ha propagado o no.
Las vacunas contra el VPH protegen contra dos a siete cepas de alto riesgo de esta familia de virus y pueden prevenir hasta el 90 % de los cánceres de cuello uterino. Como todavía existe el riesgo de cáncer, las pautas recomiendan continuar con las pruebas de Papanicolaou regulares. Otros métodos de prevención incluyen tener pocas o ninguna pareja sexual y el uso de condones. La detección del cáncer de cuello uterino mediante la prueba de Papanicolaou o el ácido acético puede identificar cambios precancerosos que, cuando se tratan, pueden prevenir el desarrollo del cáncer. El tratamiento puede consistir en alguna combinación de cirugía, quimioterapia y radioterapia. Las tasas de supervivencia a cinco años en los Estados Unidos son del 68%. Sin embargo, los resultados dependen mucho de qué tan temprano se detecte el cáncer.
A nivel mundial, el cáncer de cuello uterino es el cuarto tipo de cáncer más común y la cuarta causa más común de muerte por cáncer en las mujeres. En 2012, se produjeron aproximadamente 528 000 casos de cáncer de cuello uterino, con 266 000 muertes. Esto es alrededor del 8% del total de casos y del total de muertes por cáncer. Alrededor del 70% de los cánceres de cuello uterino y el 90% de las muertes ocurren en países en desarrollo. En los países de bajos ingresos, es una de las causas más comunes de muerte por cáncer. En los países desarrollados, el uso generalizado de los programas de detección del cuello uterino ha reducido drásticamente las tasas de cáncer de cuello uterino. Se han revisado los escenarios esperados para la reducción de la mortalidad por cáncer de cuello uterino en todo el mundo (y especialmente en los países de bajos ingresos), dados los supuestos con respecto al logro de los objetivos de prevención recomendados utilizando estrategias de triple intervención definidas por la OMS. En la investigación médica, la línea celular inmortalizada más famosa, conocida como HeLa, se desarrolló a partir de células de cáncer de cuello uterino de una mujer llamada Henrietta Lacks.
Signos y síntomas
Las primeras etapas del cáncer de cuello uterino pueden estar completamente libres de síntomas. El sangrado vaginal, el sangrado por contacto (una de las formas más comunes es el sangrado después de las relaciones sexuales) o (rara vez) una masa vaginal pueden indicar la presencia de una neoplasia maligna. Además, el dolor moderado durante las relaciones sexuales y el flujo vaginal son síntomas de cáncer de cuello uterino. En la enfermedad avanzada, las metástasis pueden estar presentes en el abdomen, los pulmones o en otros lugares.
Los síntomas del cáncer de cuello uterino avanzado pueden incluir: pérdida de apetito, pérdida de peso, fatiga, dolor pélvico, dolor de espalda, dolor en las piernas, piernas hinchadas, sangrado vaginal abundante, fracturas óseas y (rara vez) pérdida de orina o heces del vagina. El sangrado después de una ducha vaginal o después de un examen pélvico es un síntoma común del cáncer de cuello uterino.
Causas
La infección por algunos tipos de VPH es el mayor factor de riesgo de cáncer de cuello uterino, seguido del tabaquismo. La infección por el VIH también es un factor de riesgo. Sin embargo, no se conocen todas las causas del cáncer de cuello uterino y se han implicado varios otros factores contribuyentes.
Virus del papiloma humano
Los tipos de VPH 16 y 18 son la causa del 75 % de los casos de cáncer de cuello uterino en todo el mundo, mientras que el 31 y el 45 son la causa de otro 10 %.
Las mujeres que tienen relaciones sexuales con hombres que tienen muchas otras parejas sexuales o las mujeres que tienen muchas parejas sexuales tienen un mayor riesgo.
De los 150 a 200 tipos de VPH conocidos, 15 se clasifican como tipos de alto riesgo (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73, y 82), tres de probable alto riesgo (26, 53 y 66) y 12 de bajo riesgo (6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81 y CP6108).
Las verrugas genitales, que son una forma de tumor benigno de las células epiteliales, también son causadas por varias cepas del VPH. Sin embargo, estos serotipos generalmente no están relacionados con el cáncer de cuello uterino. Tener varias cepas al mismo tiempo es común, incluidas las que pueden causar cáncer de cuello uterino junto con las que causan verrugas. En general, se cree que la infección por el VPH es necesaria para que se produzca el cáncer de cuello uterino.
Fumar
Fumar cigarrillos, tanto de forma activa como pasiva, aumenta el riesgo de cáncer de cuello uterino. Entre las mujeres infectadas con VPH, las fumadoras actuales y anteriores tienen aproximadamente dos o tres veces más incidencia de cáncer invasivo. El tabaquismo pasivo también se asocia con un mayor riesgo, pero en menor medida. Fumar también se ha relacionado con el desarrollo de muchos tipos de cáncer y otras enfermedades, no solo el cáncer de cuello uterino. Fumar se ha encontrado la causa del cáncer de pulmón, cáncer de mama, cáncer de próstata y muchos más.
Fumar también se ha relacionado con el desarrollo de cáncer de cuello uterino. Fumar puede aumentar el riesgo en las mujeres de diferentes maneras, que pueden ser métodos directos e indirectos de inducir el cáncer de cuello uterino. Una forma directa de contraer este cáncer es que un fumador tiene una mayor probabilidad de que ocurra una neoplasia intraepitelial cervical (CIN3), que tiene el potencial de formar cáncer de cuello uterino. Cuando las lesiones CIN3 conducen al cáncer, la mayoría de ellas cuentan con la asistencia del virus HPV, pero no siempre es así, por lo que se puede considerar un vínculo directo con el cáncer de cuello uterino. El tabaquismo empedernido y el tabaquismo a largo plazo parecen tener más riesgo de contraer lesiones CIN3 que el tabaquismo ligero o no fumar en absoluto. Aunque fumar se ha relacionado con el cáncer de cuello uterino, ayuda en el desarrollo del VPH, que es la principal causa de este tipo de cáncer. Además, no solo ayuda en el desarrollo del VPH, sino que también si la mujer ya es VPH positiva, tiene una probabilidad aún mayor de contraer cáncer de cuello uterino.
Anticonceptivos orales
El uso a largo plazo de anticonceptivos orales se asocia con un mayor riesgo de cáncer de cuello uterino en mujeres que han tenido VPH. Las mujeres que han usado anticonceptivos orales durante 5 a 9 años tienen una incidencia tres veces mayor de cáncer invasivo, y las que los han usado durante 10 años o más tienen un riesgo cuatro veces mayor.
Embarazos múltiples
Tener muchos embarazos se asocia con un mayor riesgo de cáncer de cuello uterino. Entre las mujeres infectadas por el VPH, las que han tenido siete o más embarazos a término tienen alrededor de cuatro veces más riesgo de cáncer en comparación con las mujeres sin embarazos, y de dos a tres veces el riesgo de las mujeres que han tenido uno o dos embarazos a término. embarazos
Diagnóstico
Biopsia
La prueba de Papanicolaou se puede utilizar como prueba de detección, pero produce un falso negativo hasta en el 50 % de los casos de cáncer de cuello uterino. Otra preocupación es el costo de las pruebas de Papanicolaou, que las hace inasequibles en muchas partes del mundo.
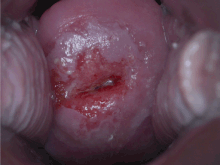
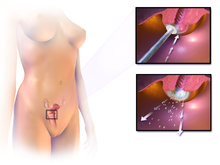
La confirmación del diagnóstico de cáncer o precáncer de cuello uterino requiere una biopsia del cuello uterino. Esto a menudo se realiza a través de una colposcopia, una inspección visual ampliada del cuello uterino con la ayuda del uso de una solución diluida de ácido acético (por ejemplo, vinagre) para resaltar las células anormales en la superficie del cuello uterino, con contraste visual proporcionado por la tinción de los tejidos normales de un marrón caoba con Yodo de Lugol. Los dispositivos médicos utilizados para la biopsia del cuello uterino incluyen fórceps perforadores. La impresión colposcópica, la estimación de la gravedad de la enfermedad basada en la inspección visual, forma parte del diagnóstico. Otros procedimientos de diagnóstico y tratamiento son el procedimiento de escisión eléctrica con asa y la conización cervical, en los que se extrae el revestimiento interno del cuello uterino para examinarlo patológicamente. Se realizan si la biopsia confirma una neoplasia intraepitelial cervical grave.
A menudo, antes de la biopsia, el médico pide imágenes médicas para descartar otras causas de los síntomas de la mujer. Se han utilizado modalidades de imagen como ultrasonido, tomografía computarizada y resonancia magnética para buscar enfermedad alternante, diseminación del tumor y efecto en las estructuras adyacentes. Por lo general, aparecen como una masa heterogénea en el cuello uterino.
Intervenciones como reproducir música durante el procedimiento y ver el procedimiento en un monitor pueden reducir la ansiedad asociada con el examen.
Lesiones precancerosas
La neoplasia intraepitelial cervical, el precursor potencial del cáncer de cuello uterino, a menudo se diagnostica mediante el examen de biopsias cervicales por parte de un patólogo. Para cambios displásicos premalignos, se utiliza la clasificación de neoplasia intraepitelial cervical.
La denominación y la clasificación histológica de las lesiones precursoras del carcinoma de cuello uterino ha cambiado muchas veces durante el siglo XX. El sistema de clasificación de la Organización Mundial de la Salud fue descriptivo de las lesiones, nombrándolas displasia leve, moderada o severa o carcinoma in situ (CIS). El término neoplasia intraepitelial cervical (NIC) se desarrolló para enfatizar el espectro de anomalías en estas lesiones y ayudar a estandarizar el tratamiento. Clasifica la displasia leve como CIN1, la displasia moderada como CIN2 y la displasia grave y el CIS como CIN3. Más recientemente, CIN2 y CIN3 se combinaron en CIN2/3. Estos resultados son los que un patólogo podría informar de una biopsia.
Estos no deben confundirse con los términos del sistema Bethesda para los resultados de la prueba de Papanicolaou (citopatología). Entre los resultados de Bethesda: lesión intraepitelial escamosa de bajo grado (LSIL) y lesión intraepitelial escamosa de alto grado (HSIL). Un Papanicolaou LSIL puede corresponder a CIN1, y HSIL puede corresponder a CIN2 y CIN3, pero son resultados de pruebas diferentes, y los resultados de la prueba de Papanicolaou no necesitan coincidir con los hallazgos histológicos.
Subtipos de cáncer
Los subtipos histológicos del carcinoma de cuello uterino invasivo incluyen:
- Carcinoma de células escamosas (alrededor del 80-85%)
- adenocarcinoma (alrededor del 15% de los cánceres cervicales en el Reino Unido)
- Carcinoma adenosquamous
- Carcinoma de células pequeñas
- tumor neuroendocrino
- Carcinoma de células cristalinas
- Adenocarcinoma Villoglandular
Aunque el carcinoma de células escamosas es el cáncer de cuello uterino con mayor incidencia, la incidencia del adenocarcinoma de cuello uterino ha ido en aumento en las últimas décadas. El adenocarcinoma endocervical representa el 20-25% de los tipos histológicos de carcinoma de cuello uterino. El adenocarcinoma mucinoso de cuello uterino de tipo gástrico es un tipo raro de cáncer con comportamiento agresivo. Este tipo de malignidad no está relacionado con el virus del papiloma humano (VPH) de alto riesgo. Las neoplasias malignas no cancerosas que rara vez pueden ocurrir en el cuello uterino incluyen el melanoma y el linfoma. La etapa de la Federación Internacional de Ginecología y Obstetricia (FIGO) no incorpora la participación de los ganglios linfáticos en contraste con la estadificación TNM para la mayoría de los otros cánceres. Para los casos tratados quirúrgicamente, la información obtenida del patólogo se puede utilizar para asignar un estadio patológico separado, pero no reemplaza el estadio clínico original.
Puesta en escena
El cáncer de cuello uterino se clasifica por etapas mediante el sistema FIGO, que se basa en el examen clínico en lugar de los hallazgos quirúrgicos. Antes de las revisiones de 2018 de la estadificación FIGO, el sistema permitía que solo se usaran estas pruebas de diagnóstico para determinar la etapa: palpación, inspección, colposcopia, legrado endocervical, histeroscopia, cistoscopia, proctoscopia, urografía intravenosa y examen de rayos X de los pulmones. y esqueleto, y conización cervical. Sin embargo, el sistema actual permite el uso de cualquier método patológico o de imagen para la estadificación.
Prevención
Proyección
La comprobación de las células del cuello uterino con la prueba de Papanicolaou (prueba de Papanicolaou) en busca de precáncer de cuello uterino ha reducido drásticamente la cantidad de casos y la mortalidad por cáncer de cuello uterino. La citología de base líquida puede reducir el número de muestras inadecuadas. La prueba de Papanicolaou cada tres a cinco años con un seguimiento adecuado puede reducir la incidencia de cáncer de cuello uterino hasta en un 80%. Los resultados anormales pueden sugerir la presencia de cambios precancerosos, lo que permite un examen y un posible tratamiento preventivo, conocido como colposcopia. El tratamiento de las lesiones de bajo grado puede afectar negativamente a la fertilidad y el embarazo posteriores. Las invitaciones personales que alientan a las mujeres a hacerse la prueba son efectivas para aumentar la probabilidad de que lo hagan. Los materiales educativos también ayudan a aumentar la probabilidad de que las mujeres se hagan la prueba, pero no son tan efectivos como las invitaciones.
Según las guías europeas de 2010, la edad de inicio del cribado oscila entre los 20 y los 30 años, pero preferentemente no antes de los 25 o 30 años, y depende de la carga de la enfermedad en la población y de los recursos disponibles.
En los Estados Unidos, se recomienda que las pruebas de detección comiencen a los 21 años, independientemente de la edad en que la mujer comenzó a tener relaciones sexuales u otros factores de riesgo. Las pruebas de Papanicolaou se deben realizar cada tres años entre las edades de 21 y 65 años. En mujeres mayores de 65 años, la prueba de detección puede suspenderse si no se observaron resultados de prueba anormales en los 10 años anteriores y no existe un historial de CIN2 o superior. El estado de vacunación contra el VPH no cambia las tasas de detección.
Existen varias opciones recomendadas para la detección de mujeres de 30 a 65 años. Esto incluye la citología cervical cada 3 años, la prueba del VPH cada 5 años o la prueba del VPH junto con la citología cada 5 años. La detección no es beneficiosa antes de los 25 años, ya que la tasa de enfermedad es baja. La detección no es beneficiosa en mujeres mayores de 60 años si tienen antecedentes de resultados negativos. La guía de la Sociedad Estadounidense de Oncología Clínica tiene recomendaciones para diferentes niveles de disponibilidad de recursos.
Las pruebas de Papanicolaou no han sido tan efectivas en los países en desarrollo. Esto se debe en parte a que muchos de estos países tienen una infraestructura de atención médica deficiente, muy pocos profesionales capacitados y capacitados para obtener e interpretar pruebas de Papanicolaou, mujeres desinformadas que se pierden durante el seguimiento y un tiempo de respuesta prolongado para obtener resultados. Se han probado la inspección visual con ácido acético y la prueba de ADN del VPH, aunque con éxito mixto.
Protección de barrera
La protección de barrera o el uso de gel espermicida durante las relaciones sexuales disminuye, pero no elimina el riesgo de transmisión de la infección, aunque los condones pueden proteger contra las verrugas genitales. También brindan protección contra otras infecciones de transmisión sexual, como el VIH y la clamidia, que están asociadas con mayores riesgos de desarrollar cáncer de cuello uterino.
Vacunación
Tres vacunas contra el VPH (Gardasil, Gardasil 9 y Cervarix) reducen el riesgo de cambios cancerosos o precancerosos del cuello uterino y el perineo en aproximadamente un 93 % y un 62 %, respectivamente. Las vacunas tienen entre un 92 % y un 100 % de eficacia contra el VPH 16 y 18 hasta al menos 8 años.
Las vacunas contra el VPH generalmente se administran entre los 9 y los 26 años, ya que la vacuna es más efectiva si se administra antes de que ocurra la infección. Se desconoce la duración de la eficacia y si se necesitará un refuerzo. El alto costo de esta vacuna ha sido motivo de preocupación. Varios países han considerado (o están considerando) programas para financiar la vacunación contra el VPH. La guía de la Sociedad Estadounidense de Oncología Clínica tiene recomendaciones para diferentes niveles de disponibilidad de recursos.
Desde 2010, las mujeres jóvenes en Japón han sido elegibles para recibir la vacuna contra el cáncer de cuello uterino de forma gratuita. En junio de 2013, el Ministerio de Salud, Trabajo y Bienestar de Japón ordenó que, antes de administrar la vacuna, las instituciones médicas deben informar a las mujeres que el ministerio no la recomienda. Sin embargo, la vacuna todavía está disponible sin costo alguno para las mujeres japonesas que decidan aceptar la vacunación.
Nutrición
La vitamina A se asocia con un menor riesgo al igual que la vitamina B12, la vitamina C, la vitamina E y el betacaroteno.
Tratamiento
El tratamiento del cáncer de cuello uterino varía en todo el mundo, en gran parte debido al acceso a cirujanos expertos en cirugía pélvica radical y al surgimiento de la terapia de preservación de la fertilidad en los países desarrollados. Las etapas menos avanzadas del cáncer de cuello uterino suelen tener opciones de tratamiento que permiten mantener la fertilidad, si la paciente lo desea. Debido a que los cánceres de cuello uterino son radiosensibles, la radiación se puede usar en todas las etapas donde no existen opciones quirúrgicas. La intervención quirúrgica puede tener mejores resultados que los enfoques radiológicos. Además, la quimioterapia se puede usar para tratar el cáncer de cuello uterino y se ha descubierto que es más eficaz que la radiación sola. La evidencia sugiere que la quimiorradioterapia puede aumentar la supervivencia general y reducir el riesgo de recurrencia de la enfermedad en comparación con la radioterapia sola. Hay evidencia de certeza baja de que los enfoques de atención perioperatoria, como la 'cirugía acelerada' o 'programas de recuperación mejorada' puede reducir el estrés quirúrgico y mejorar la recuperación después de la cirugía de cáncer ginecológico.
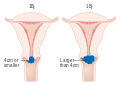
El cáncer microinvasivo (etapa IA) se puede tratar con histerectomía (extirpación de todo el útero, incluida parte de la vagina). Para el estadio IA2, también se extirpan los ganglios linfáticos. Las alternativas incluyen procedimientos quirúrgicos locales, como un procedimiento de escisión eléctrica con asa o una biopsia de cono. Una revisión sistemática concluyó que se necesita más evidencia para informar las decisiones sobre diferentes técnicas quirúrgicas para mujeres con cáncer de cuello uterino en estadio IA2.
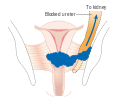
Si una biopsia de cono no produce márgenes claros (resultados de la biopsia que muestran que el tumor está rodeado de tejido libre de cáncer, lo que sugiere que se extirpa todo el tumor), otra opción de tratamiento posible para las mujeres que desean preservar su fertilidad es una traquelectomía. Esto intenta extirpar quirúrgicamente el cáncer mientras se preservan los ovarios y el útero, proporcionando una operación más conservadora que una histerectomía. Es una opción viable para aquellas en cáncer de cuello uterino en etapa I que no se ha propagado; sin embargo, aún no se considera un estándar de atención, ya que pocos médicos están capacitados en este procedimiento. Incluso el cirujano más experimentado no puede prometer que se pueda realizar una traquelectomía hasta después del examen microscópico quirúrgico, ya que se desconoce el alcance de la propagación del cáncer. Si el cirujano no puede confirmar microscópicamente márgenes claros de tejido cervical una vez que la mujer está bajo anestesia general en el quirófano, aún puede ser necesaria una histerectomía. Esto solo se puede hacer durante la misma operación si la mujer ha dado su consentimiento previo. Debido al posible riesgo de propagación del cáncer a los ganglios linfáticos en los cánceres en etapa 1B y algunos cánceres en etapa 1A, es posible que el cirujano también deba extirpar algunos ganglios linfáticos que se encuentran alrededor del útero para realizar una evaluación patológica.
Una traquelectomía radical se puede realizar por vía abdominal o vaginal y las opiniones son contradictorias sobre cuál es mejor. Una traquelectomía abdominal radical con linfadenectomía generalmente solo requiere una estadía en el hospital de dos a tres días, y la mayoría de las mujeres se recuperan muy rápidamente (alrededor de seis semanas). Las complicaciones son poco comunes, aunque las mujeres que pueden concebir después de la cirugía son susceptibles de tener un parto prematuro y un posible aborto espontáneo tardío. Por lo general, se recomienda esperar al menos un año antes de intentar quedar embarazada después de la cirugía. La recurrencia en el cuello uterino residual es muy rara si el cáncer se eliminó con la traquelectomía. Sin embargo, se recomienda a las mujeres que practiquen una prevención vigilante y atención de seguimiento, incluidas pruebas de Papanicolaou/colposcopia, con biopsias del segmento uterino inferior restante según sea necesario (cada 3 o 4 meses durante al menos 5 años) para monitorear cualquier recurrencia además de minimizar cualquier nueva exposición al VPH a través de prácticas sexuales seguras hasta que uno esté tratando activamente de concebir.
Las etapas tempranas (IB1 y IIA de menos de 4 cm) se pueden tratar con histerectomía radical con extirpación de los ganglios linfáticos o radioterapia. La radioterapia se administra como radioterapia de haz externo en la pelvis y braquiterapia (radiación interna). Las mujeres tratadas con cirugía que tienen características de alto riesgo encontradas en el examen patológico reciben radioterapia con o sin quimioterapia para reducir el riesgo de recaída. Una revisión Cochrane encontró evidencia de certeza moderada de que la radiación reduce el riesgo de progresión de la enfermedad en pacientes con cáncer de cuello uterino en estadio IB, en comparación con ningún tratamiento adicional. Sin embargo, se encontró poca evidencia sobre sus efectos en la supervivencia general.
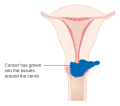
Los tumores más grandes en etapa temprana (IB2 y IIA de más de 4 cm) se pueden tratar con radioterapia y quimioterapia basada en cisplatino, histerectomía (que generalmente requiere radioterapia adyuvante) o quimioterapia con cisplatino seguida de histerectomía. Cuando el cisplatino está presente, se cree que es el agente individual más activo en las enfermedades periódicas. Tal adición de quimioterapia basada en platino a la quimiorradiación parece no solo mejorar la supervivencia, sino que también reduce el riesgo de recurrencia en mujeres con cáncer de cuello uterino en estadio temprano (IA2–IIA). Una revisión Cochrane encontró una falta de evidencia sobre los beneficios y daños de la histerectomía primaria en comparación con la quimiorradioterapia primaria para el cáncer de cuello uterino en estadio IB2.
Los tumores en etapa avanzada (IIB-IVA) se tratan con radioterapia y quimioterapia basada en cisplatino. El 15 de junio de 2006, la Administración de Drogas y Alimentos de EE. UU. aprobó el uso de una combinación de dos medicamentos de quimioterapia, hicamtina y cisplatino, para mujeres con tratamiento de cáncer de cuello uterino en etapa tardía (IVB). El tratamiento combinado tiene un riesgo significativo de efectos secundarios de neutropenia, anemia y trombocitopenia.
No hay pruebas suficientes de si los medicamentos contra el cáncer después de la atención estándar ayudan a las mujeres con cáncer de cuello uterino localmente avanzado a vivir más tiempo.
Para que la cirugía sea curativa, se debe extirpar todo el cáncer sin que se encuentre cáncer en los márgenes del tejido extirpado al examinarlo con un microscopio. Este procedimiento se conoce como exenteración.
No hay evidencia disponible que sugiera que cualquier forma de enfoque de seguimiento sea mejor o peor en términos de prolongar la supervivencia, mejorar la calidad de vida o guiar el manejo de los problemas que pueden surgir debido al tratamiento y que, en el caso de tratamiento de radioterapia empeoran con el tiempo. Una revisión de 2019 no encontró ensayos controlados sobre la eficacia y la seguridad de las intervenciones para el sangrado vaginal en mujeres con cáncer de cuello uterino avanzado.
Tisotumab vedotin (Tivdak) fue aprobado para uso médico en los Estados Unidos en septiembre de 2021.
Pronóstico
Escenario
El pronóstico depende de la etapa del cáncer. Para las neoplasias cervicales intraepiteliales el pronóstico es bueno. Con tratamiento, la tasa de supervivencia relativa a cinco años para la etapa más temprana del cáncer de cuello uterino invasivo es del 92 %, y la tasa de supervivencia general (todas las etapas combinadas) a los cinco años es de alrededor del 66 %. Estas estadísticas pueden mejorar cuando se aplican a mujeres recién diagnosticadas, teniendo en cuenta que estos resultados pueden basarse en parte en el estado del tratamiento hace cinco años cuando las mujeres estudiadas fueron diagnosticadas por primera vez.
Con tratamiento, del 80 al 90 % de las mujeres con cáncer en etapa I y del 60 al 75 % de las que tienen cáncer en etapa II están vivas 5 años después del diagnóstico. Las tasas de supervivencia disminuyen al 58 % para las mujeres con cáncer en etapa III y al 17 % o menos de aquellas con cáncer en etapa IV cinco años después del diagnóstico. El cáncer de cuello uterino recurrente detectado en sus primeras etapas podría tratarse con éxito con cirugía, radiación, quimioterapia o una combinación de los tres. Alrededor del 35% de las mujeres con cáncer de cuello uterino invasivo tienen enfermedad persistente o recurrente después del tratamiento.
Por país
La supervivencia a cinco años en los Estados Unidos para las mujeres blancas es del 69 % y para las mujeres negras es del 57 %.
Las pruebas de detección regulares han significado que los cambios precancerosos y los cánceres de cuello uterino en etapa temprana se han detectado y tratado a tiempo. Las cifras sugieren que la detección del cuello uterino está salvando 5000 vidas cada año en el Reino Unido al prevenir el cáncer de cuello uterino. Alrededor de 1000 mujeres al año mueren de cáncer de cuello uterino en el Reino Unido. Todos los países nórdicos cuentan con programas de detección del cáncer de cuello uterino. La prueba de Papanicolaou se integró en la práctica clínica en los países nórdicos en la década de 1960.
En África, los resultados suelen ser peores, ya que el diagnóstico se realiza con frecuencia en una última etapa de la enfermedad. En una revisión de alcance de los planes de prevención y control del cáncer de cuello uterino disponibles públicamente en países africanos, los planes tendieron a enfatizar la supervivencia en lugar del diagnóstico y la prevención tempranos del VPH.
Epidemiología
A nivel mundial, el cáncer de cuello uterino es la cuarta causa más común de cáncer y de muerte por cáncer en las mujeres. En 2018, se estima que ocurrieron 570 000 casos de cáncer de cuello uterino, con más de 300 000 muertes. Es la segunda causa más común de cáncer específico de la mujer después del cáncer de mama y representa alrededor del 8 % del total de casos de cáncer y del total de muertes por cáncer en mujeres. Alrededor del 80% de los cánceres de cuello uterino ocurren en países en desarrollo. Es el cáncer más frecuentemente detectado durante el embarazo, con una incidencia de 1,5 a 12 por cada 100.000 embarazos.
Australia
Australia tuvo 734 casos de cáncer de cuello uterino en 2005. La cantidad de mujeres diagnosticadas con cáncer de cuello uterino ha disminuido en promedio un 4,5 % cada año desde que comenzaron las pruebas de detección organizadas en 1991 (1991–2005). Las pruebas de Papanicolaou regulares dos veces al año pueden reducir la incidencia de cáncer de cuello uterino hasta en un 90 % en Australia y evitar que 1200 mujeres australianas mueran a causa de la enfermedad cada año. Se prevé que, debido al éxito del programa de pruebas primarias de VPH, habrá menos de cuatro casos nuevos por cada 100 000 mujeres anualmente para 2028.
Canadá
En Canadá, se estima que 1300 mujeres habrán sido diagnosticadas con cáncer de cuello uterino en 2008 y 380 habrán muerto.
India
En la India, el número de personas con cáncer de cuello uterino está aumentando, pero en general las tasas ajustadas por edad están disminuyendo. El uso de preservativos en la población femenina ha mejorado la supervivencia de las mujeres con cáncer de cuello uterino.
Unión Europea
En la Unión Europea, en 2004 ocurrieron alrededor de 34 000 casos nuevos por año y más de 16 000 muertes por cáncer de cuello uterino.
Reino Unido
El cáncer de cuello uterino es el duodécimo cáncer más común entre las mujeres en el Reino Unido (alrededor de 3100 mujeres fueron diagnosticadas con la enfermedad en 2011) y representa el 1 % de las muertes por cáncer (alrededor de 920 fallecieron en 2012). Con una reducción del 42 % de 1988 a 1997, el programa de detección implementado por el NHS ha tenido mucho éxito, examinando al grupo de edad de mayor riesgo (25 a 49 años) cada 3 años, y a las personas de 50 a 64 años cada 5 años.
Estados Unidos
Se estima que en 2019 se producirán 13 170 nuevos casos de cáncer de cuello uterino y 4250 muertes por cáncer de cuello uterino en los Estados Unidos. La edad promedio en el momento del diagnóstico es de 50 años. Las tasas de casos nuevos en los Estados Unidos fueron de 7,3 por cada 100 000 mujeres, según 2012 a 2016. Las muertes por cáncer de cuello uterino disminuyeron aproximadamente un 74 % en los últimos 50 años, en gran parte debido a la detección generalizada de la prueba de Papanicolaou. El costo médico directo anual de la prevención y el tratamiento del cáncer de cuello uterino antes de la introducción de la vacuna contra el VPH se estimó en $ 6 000 millones.
Historia
- 400 BCE: Hippocrates señaló que el cáncer cervical era incurable.
- 1925: Hinselmann inventó el colposcopio.
- 1928: Papanicolaou desarrolló la técnica Papanicolaou.
- 1941: Papanicolaou y Traut: La prueba de Papanicolaou comenzó.
- 1946: Aylesbury espátula fue desarrollada para raspar el cuello uterino, recolectando la muestra para la prueba de Papanicolaou.
- 1951: Primera línea celular in vitro exitosa, HeLa, derivada de la biopsia del cáncer cervical de Henrietta Lacks.
- 1976: Harald zur Hausen y Gisam encontraron ADN del VPH en cáncer cervical y verrugas genitales; Hausen ganó más tarde el Premio Nobel de su trabajo.
- 1988: Bethesda System for reporting Pap results was developed.
- 2006: La primera vacuna contra el VPH fue aprobada por la FDA.
- 2015: VPH La vacuna muestra proteger contra la infección en múltiples sitios del cuerpo.
- 2018: Evidencia para la protección de dosis única con vacuna contra el VPH.
Los epidemiólogos que trabajaban a principios del siglo XX notaron que el cáncer de cuello uterino se comportaba como una enfermedad de transmisión sexual. En resumen:
- Se observó que el cáncer de cuello uterino era común en las trabajadoras sexuales femeninas.
- Era raro en monjas, excepto para aquellos que habían estado sexualmente activos antes de entrar en el convento (Rigoni en 1841).
- Era más común en las segundas esposas de hombres cuyas primeras esposas habían muerto por cáncer cervical.
- Era raro en mujeres judías.
- En 1935 Syverton y Berry descubrieron una relación entre el VPH (Rabbit Papillomavirus) y el cáncer de piel en conejos (El VPH es específico para especies y por lo tanto no se puede transmitir a los conejos).
Estas observaciones históricas sugirieron que el cáncer de cuello uterino podría ser causado por un agente de transmisión sexual. Las investigaciones iniciales en las décadas de 1940 y 1950 atribuyeron el cáncer de cuello uterino al esmegma (p. ej., Heins et al. 1958). Durante las décadas de 1960 y 1970 se sospechó que la infección por el virus del herpes simple era la causa de la enfermedad. En resumen, se consideró que el VHS era una causa probable porque se sabe que sobrevive en el aparato reproductor femenino y se transmite sexualmente de manera compatible con los factores de riesgo conocidos, como la promiscuidad y el nivel socioeconómico bajo. Los virus del herpes también estuvieron implicados en otras enfermedades malignas, como el linfoma de Burkitt, el carcinoma nasofaríngeo, la enfermedad de Marek y el adenocarcinoma renal de Lucké. Se recuperó HSV de células tumorales cervicales.
En 1949 se proporcionó una descripción del virus del papiloma humano (VPH) por microscopía electrónica y en 1963 se identificó el ADN del VPH. No fue hasta la década de 1980 que se identificó el VPH en el tejido del cáncer de cuello uterino. Desde entonces se ha demostrado que el VPH está implicado en prácticamente todos los cánceres de cuello uterino. Los subtipos virales específicos implicados son HPV 16, 18, 31, 45 y otros.
En un trabajo que se inició a mediados de la década de 1980, investigadores del Centro Médico de la Universidad de Georgetown, la Universidad de Rochester, la Universidad de Queensland en Australia y el Instituto Nacional del Cáncer de EE. UU. desarrollaron la vacuna contra el VPH en paralelo. En 2006, la Administración de Drogas y Alimentos de los Estados Unidos (FDA) aprobó la primera vacuna preventiva contra el VPH, comercializada por Merck & Co. bajo el nombre comercial Gardasil.
En noviembre de 2020, la Organización Mundial de la Salud, con el respaldo de la Asamblea Mundial de la Salud, estableció una estrategia para eliminar el cáncer de cuello uterino para 2050. La estrategia implica vacunar al 90 % de las niñas antes de los 15 años y realizar pruebas de detección al 70 % de las mujeres. a la edad de 35 años y nuevamente a la edad de 45, y tratando al 90% de las mujeres identificadas con enfermedad cervical.
Sociedad y cultura
Australia
En Australia, las mujeres aborígenes tienen más de cinco veces más probabilidades de morir de cáncer de cuello uterino que las mujeres no aborígenes, lo que sugiere que las mujeres aborígenes tienen menos probabilidades de hacerse pruebas de Papanicolaou con regularidad. Hay varios factores que pueden limitar la participación de las mujeres indígenas en las prácticas regulares de detección del cuello uterino, incluida la sensibilidad al discutir el tema en las comunidades aborígenes, la vergüenza, la ansiedad y el miedo sobre el procedimiento. La dificultad para acceder a los servicios de detección (por ejemplo, dificultades de transporte) y la falta de médicos de cabecera, proveedores de pruebas de Papanicolaou capacitados y trabajadoras de la salud aborígenes capacitadas también son problemas.
La Australian Cervical Cancer Foundation (ACCF), fundada en 2008, promueve la 'salud de la mujer' al eliminar el cáncer de cuello uterino y permitir el tratamiento para mujeres con cáncer de cuello uterino y problemas de salud relacionados, en Australia y en países en desarrollo.' Ian Frazer, uno de los desarrolladores de la vacuna contra el cáncer de cuello uterino Gardasil, es el asesor científico de ACCF. Janette Howard, esposa del entonces primer ministro de Australia, John Howard, fue diagnosticada con cáncer de cuello uterino en 1996 y habló públicamente por primera vez sobre la enfermedad en 2006.
Estados Unidos
Una encuesta de 2007 entre mujeres estadounidenses encontró que el 40 % había oído hablar de la infección por VPH y menos de la mitad sabía que causa cáncer de cuello uterino. En un estudio longitudinal de 1975 a 2000, se encontró que las personas de los niveles socioeconómicos más bajos del censo tenían tasas más altas de diagnóstico de cáncer en etapa tardía y tasas de morbilidad más altas. Después de controlar por etapa, todavía existían diferencias en las tasas de supervivencia.
Contenido relacionado
Botulismo
Imagen de resonancia magnética
Movimiento rápido del ojo




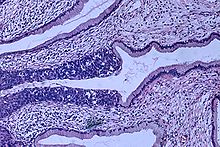
![Invasive squamous cell carcinoma of the cervix is characterized by infiltration as irregular anastomosing nests or single cells.[62] This case is poorly differentiated. H&E stain.](https://upload.wikimedia.org/wikipedia/commons/thumb/4/43/Histopathology_of_squamous_cell_carcinoma_of_the_cervix.png/380px-Histopathology_of_squamous_cell_carcinoma_of_the_cervix.png)