Canal iónico activado por ligando

- Receptor interconectado por canales iónicos
- Iones
- Ligand (como acetylcholine)
Canales iónicos activados por ligando (LIC, LGIC), también conocidos comúnmente como receptores ionotrópicos, son un grupo de proteínas de canales iónicos transmembrana que se abren para permitir que iones como Na+, K+, Ca2+ y/o Cl- pasen a través de la membrana en respuesta a la unión de un mensajero químico (es decir, un ligando), como un neurotransmisor.
Cuando una neurona presináptica se excita, libera un neurotransmisor de las vesículas hacia la hendidura sináptica. Luego, el neurotransmisor se une a los receptores ubicados en la neurona postsináptica. Si estos receptores son canales iónicos activados por ligando, un cambio conformacional resultante abre los canales iónicos, lo que conduce a un flujo de iones a través de la membrana celular. Esto, a su vez, da como resultado una despolarización, para una respuesta del receptor excitador, o una hiperpolarización, para una respuesta inhibidora.
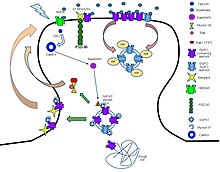
Estas proteínas receptoras suelen estar compuestas por al menos dos dominios diferentes: un dominio transmembrana que incluye el poro iónico y un dominio extracelular que incluye la ubicación de unión del ligando (un sitio de unión alostérico). Esta modularidad ha permitido una estrategia de "divide y vencerás". enfoque para encontrar la estructura de las proteínas (cristalizando cada dominio por separado). La función de estos receptores ubicados en las sinapsis es convertir la señal química del neurotransmisor liberado presinápticamente directa y muy rápidamente en una señal eléctrica postsináptica. Muchos LIC están además modulados por ligandos alostéricos, bloqueadores de canales, iones o el potencial de membrana. Los LIC se clasifican en tres superfamilias que carecen de relación evolutiva: receptores cys-loop, receptores ionotrópicos de glutamato y canales activados por ATP.
Receptores de bucle Cys

Los receptores cys-loop reciben su nombre de un bucle característico formado por un enlace disulfuro entre dos residuos de cisteína en el dominio extracelular N terminal. Son parte de una familia más grande de canales iónicos activados por ligando pentamericano que generalmente carecen de este enlace disulfuro, de ahí el nombre provisional de "receptores Pro-loop". Un sitio de unión en el dominio de unión al ligando N-terminal extracelular les otorga especificidad de receptor para (1) acetilcolina (AcCh), (2) serotonina, (3) glicina, (4) glutamato y (5) ácido γ-aminobutírico (GABA). ) en vertebrados. Los receptores se subdividen con respecto al tipo de ion que conducen (aniónico o catiónico) y además en familias definidas por el ligando endógeno. Por lo general, son pentaméricos y cada subunidad contiene 4 hélices transmembrana que constituyen el dominio transmembrana y un dominio de unión a ligando extracelular, N terminal, tipo sándwich de hoja beta. Algunos también contienen un dominio intracelular como se muestra en la imagen.
El canal iónico regulado por ligando prototípico es el receptor nicotínico de acetilcolina. Consiste en un pentámero de subunidades proteicas (típicamente ααβγδ), con dos sitios de unión para acetilcolina (uno en la interfaz de cada subunidad alfa). Cuando la acetilcolina se une, altera la configuración del receptor (tuerce las hélices T2 que mueven los residuos de leucina, que bloquean el poro, fuera de la vía del canal) y hace que la constricción en el poro de aproximadamente 3 angstroms se ensanche a aproximadamente 8 angstroms para que los iones puedan pasar. Este poro permite que los iones Na+ fluyan a favor de su gradiente electroquímico hacia el interior de la célula. Cuando se abre un número suficiente de canales a la vez, el flujo interno de cargas positivas transportadas por los iones Na+ despolariza la membrana postsináptica lo suficiente como para iniciar un potencial de acción.
Se ha identificado un homólogo bacteriano de un LIC, del que se supone que actúa, no obstante, como quimiorreceptor. Esta variante procariótica de nAChR se conoce como receptor GLIC, en honor a la especie en la que se identificó; II activado por Lligando de Gloeobacter en canal.
Estructura
Los receptores Cys-loop tienen elementos estructurales que están bien conservados, con un gran dominio extracelular (ECD) que alberga una hélice alfa y 10 cadenas beta. Después del ECD, cuatro segmentos transmembrana (TMS) están conectados por estructuras de bucle intracelular y extracelular. Excepto el bucle TMS 3-4, sus longitudes son sólo de 7 a 14 residuos. El bucle TMS 3-4 forma la parte más grande del dominio intracelular (ICD) y exhibe la región más variable entre todos estos receptores homólogos. El ICD está definido por el bucle TMS 3-4 junto con el bucle TMS 1-2 que precede al poro del canal iónico. La cristalización ha revelado estructuras para algunos miembros de la familia, pero para permitir la cristalización, el bucle intracelular generalmente se reemplazaba por un conector corto presente en los receptores de bucle cis procarióticos, por lo que se desconocen sus estructuras. Sin embargo, este bucle intracelular parece funcionar en la desensibilización, la modulación de la fisiología del canal por sustancias farmacológicas y las modificaciones postraduccionales. Allí se encuentran motivos importantes para el tráfico y el ICD interactúa con proteínas de andamio que permiten la formación de sinapsis inhibidoras.
Receptores catiónicos cys-loop
| Tipo | Clase | IUPHAR-recommended nombre de la proteína | Gene | Nombres anteriores |
|---|---|---|---|---|
| Serotonin (5-HT) | 5-HT3 | 5-HT3A 5-HT3B 5-HT3C 5-HT3D 5-HT3E | HTR3A HTR3B HTR3C HTR3D HTR3E | 5-HT3A 5-HT3B 5-HT3C 5-HT3D 5-HT3E |
| Nicotinic acetylcholine (nAChR) | alfa | α1 α2 α3 α4 α5 α6 α7 α9 α10 | CHRNA1 CHRNA2 CHRNA3 CHRNA4 CHRNA5 CHRNA6 CHRNA7 CHRNA9 CHRNA10 | ACHRA, ACHRD, CHRNA, CMS2A, FCCMS, SCCMS |
| beta | β1 β2 β3 β4 | CHRNB1 CHRNB2 CHRNB3 CHRNB4 | CMS2A, SCCMS, ACHRB, CHRNB, CMS1D EFNL3, nAChRB2 | |
| gamma | γ | CHRNG | ACHRG | |
| delta | δ | CHRND | ACHRD, CMS2A, FCCMS, SCCMS | |
| epsilon | ε | CHRNE | ACHRE, CMS1D, CMS1E, CMS2A, FCCMS, SCCMS | |
| Canal de iones activado por zinc (ZAC) | ZAC | ZACN | ZAC1, L2m LICZ, LICZ1 |
Receptores aniónicos cys-loop
| Tipo | Clase | IUPHAR-recommended nombre de la proteína | Gene | Nombres anteriores |
|---|---|---|---|---|
| GABAA | alfa | α1 α2 α3 α4 α5 α6 | GABRA1 GABRA2 GABRA3 GABRA4 GABRA5 GABRA6 | EJM, ECA4 |
| beta | β1 β2 β3 | GABRB1 GABRB2 GABRB3 | CEPA5 | |
| gamma | γ1 γ2 γ3 | GABRG1 GABRG2 GABRG3 | CAE2, ECA2, GEFSP3 | |
| delta | δ | GABRD | ||
| epsilon | ε | GABRE | ||
| pi | π | GABRP | ||
| theta | Silencio | GABRQ | ||
| rho | ρ1 ρ2 ρ3 | GABRR1 GABRR2 GABRR3 | GABAC | |
| Glycine (GlyR) | alfa | α1 α2 α3 α4 | GLRA1 GLRA2 GLRA3 GLRA4 | STHE |
| beta | β | GLRB |
Receptores ionotrópicos de glutamato
Los receptores ionotrópicos de glutamato se unen al neurotransmisor glutamato. Forman tetrámeros, y cada subunidad consta de un dominio amino terminal extracelular (ATD, que participa en el ensamblaje del tetrámero), un dominio de unión al ligando extracelular (LBD, que se une al glutamato) y un dominio transmembrana (TMD, que forma el canal iónico). . El dominio transmembrana de cada subunidad contiene tres hélices transmembrana, así como una media hélice de membrana con un bucle reentrante. La estructura de la proteína comienza con el ATD en el extremo N seguido de la primera mitad del LBD que es interrumpido por las hélices 1,2 y 3 del TMD antes de continuar con la mitad final del LBD y luego terminar con la hélice 4 de el TMD en el extremo C. Esto significa que hay tres vínculos entre el TMD y los dominios extracelulares. Cada subunidad del tetrámero tiene un sitio de unión para el glutamato formado por las dos secciones de LBD que forman una forma similar a una concha. Sólo es necesario ocupar dos de estos sitios en el tetrámero para abrir el canal iónico. El poro está formado principalmente por la media hélice 2 de forma que se asemeja a un canal de potasio invertido.

| Tipo | Clase | IUPHAR-recommended nombre de la proteína | Gene | Nombres anteriores |
|---|---|---|---|---|
| AMPA | GluA | GluA1 GluA2 GluA3 GluA4 | GRIA1 GRIA2 GRIA3 GRIA4 | GLUA1, GluR1, GluRA, GluR-A, GluR-K1, HBGR1 GLUA2, GluR2, GluRB, GluR-B, GluR-K2, HBGR2 GLUA3, GluR3, GluRC, GluR-C, GluR-K3 GLUA4, GluR4, GluRD, GluR-D |
| Kainate | GluK | GluK1 GluK2 GluK3 GluK4 GluK5 | GRIK1 GRIK2 GRIK3 GRIK4 GRIK5 | GLUK5, GluR5, GluR-5, EAA3 GLUK6, GluR6, GluR-6, EAA4 GLUK7, GluR7, GluR-7, EAA5 GLUK1, KA1, KA-1, EAA1 GLUK2, KA2, KA-2, EAA2 |
| NMDA | GluN | GluN1 NRL1A NRL1B | GRIN1 GRINL1A GRINL1B | GLUN1, NMDA-R1, NR1, GluR•1 |
| GluN2A GluN2B GluN2C GluN2D | GRIN2A GRIN2B GRIN2C GRIN2D | GLUN2A, NMDA-R2A, NR2A, GluRε1 GLUN2B, NMDA-R2B, NR2B, hNR3, GluRε2 GLUN2C, NMDA-R2C, NR2C, GluRε3 GLUN2D, NMDA-R2D, NR2D, GluRε4 | ||
| GluN3A GluN3B | GRIN3A GRIN3B | GLUN3A, NMDA-R3A, NMDAR-L, chi-1 GLU3B, NMDA-R3B | ||
| Huérfano ’ | (GluD) | GluD1 GluD2 | GRID1 GRID2 | GluRδ1 GluRδ2 |
Receptor AMPA
El receptor del ácido α-amino-3-hidroxi-5-metil-4-isoxazolpropiónico (también conocido como receptor AMPA o receptor de quiscualato b>) es un receptor transmembrana ionotrópico de tipo no NMDA para glutamato que media la transmisión sináptica rápida en el sistema nervioso central (SNC). Su nombre se deriva de su capacidad de ser activado por el análogo artificial del glutamato AMPA. El receptor se denominó por primera vez "receptor de quiscualato" por Watkins y colegas después de un quiscualato agonista natural y sólo más tarde se le dio la etiqueta de "receptor AMPA" en honor al agonista selectivo desarrollado por Tage Honore y sus colegas en la Escuela Real Danesa de Farmacia en Copenhague. Los AMPAR se encuentran en muchas partes del cerebro y son el receptor que se encuentra con mayor frecuencia en el sistema nervioso. El tetrámero del receptor AMPA GluA2 (GluR2) fue el primer canal iónico del receptor de glutamato que cristalizó. Los ligandos incluyen:
- Agonistas: Glutamate, AMPA, 5-Fluorowillardiine, ácido domoico, ácido quisqualico, etc.
- Antagonistas: CNQX, ácido Kynurenic, NBQX, Perampanel, Piracetam, etc.
- Moduladores alostericos positivos: Aniracetam, Cyclothiazide, CX-516, CX-614, etc.
- Moduladores alostericos negativos: Etanol, Perampanel, Talampanel, GYKI-52,466, etc.
Receptores NMDA

El receptor de N-metil-D-aspartato (receptor NMDA), un tipo de receptor ionotrópico de glutamato, es un canal iónico activado por ligando que se activa mediante la unión simultánea de glutamato y un coagonista (es decir, D -serina o glicina). Los estudios muestran que el receptor NMDA participa en la regulación de la plasticidad sináptica y la memoria.
El nombre "receptor NMDA" Se deriva del ligando N-metil-D-aspartato (NMDA), que actúa como agonista selectivo en estos receptores. Cuando el receptor NMDA se activa mediante la unión de dos coagonistas, el canal catiónico se abre, permitiendo que Na+ y Ca2+ fluyan hacia el interior de la célula, lo que a su vez eleva El potencial eléctrico de la célula. Por tanto, el receptor NMDA es un receptor excitador. En potenciales de reposo, la unión de Mg2+ o Zn2+ en sus sitios de unión extracelulares en el receptor bloquea el flujo de iones a través del canal del receptor NMDA. "Sin embargo, cuando las neuronas se despolarizan, por ejemplo, mediante una activación intensa de los receptores AMPA postsinápticos colocalizados, el bloqueo dependiente del voltaje por parte del Mg2+ se alivia parcialmente, permitiendo la entrada de iones a través de los receptores NMDA activados. . La entrada de Ca2+ resultante puede desencadenar una variedad de cascadas de señalización intracelular, que en última instancia pueden cambiar la función neuronal mediante la activación de varias quinasas y fosfatasas". Los ligandos incluyen:
- Co-agonistas endógenos primarios: glutamato y ya sea D-serina o glicina
- Otros agonistas: aminociclopropanecarboxílico ácido; D-cicloserina; L-aspartate; quinolinate, etc.
- Agonistas parciales: ácido aspartico N-metil-D (NMDA); NRX-1074; 3,5-dibromo-L-phenylalanina, etc.
- Antagonistas: ketamina, PCP, dextropropoxyphene, ketobemidone, tramadol, ácido kynurenico (endogenoso), etc.
Canales activados por ATP

Los canales activados por ATP se abren en respuesta a la unión del nucleótido ATP. Forman trímeros con dos hélices transmembrana por subunidad y los extremos C y N en el lado intracelular.
| Tipo | Clase | IUPHAR-recommended nombre de la proteína | Gene | Nombres anteriores |
|---|---|---|---|---|
| P2X | N/A | P2X1 P2X2 P2X3 P2X4 P2X5 P2X6 P2X7 | P2RX1 P2RX2 P2RX3 P2RX4 P2RX5 P2RX6 P2RX7 | P2X1 P2X2 P2X3 P2X4 P2X5 P2X6 P2X7 |
Relevancia clínica
Es probable que loscanales iónicos activados por ligandos sean el principal sitio en el que los agentes anestésicos y el etanol tienen sus efectos, aunque aún no se ha establecido evidencia inequívoca de esto. En particular, los receptores GABA y NMDA se ven afectados por agentes anestésicos en concentraciones similares a las utilizadas en anestesia clínica.
Al comprender el mecanismo y explorar el componente químico/biológico/físico que podría funcionar en esos receptores, cada vez se prueban más aplicaciones clínicas mediante experimentos preliminares o la FDA. La memantina está aprobada por la FDA de EE. UU. y la Agencia Europea de Medicamentos para el tratamiento de la enfermedad de Alzheimer de moderada a grave, y ahora ha recibido una recomendación limitada del Instituto Nacional para la Excelencia en la Salud y la Atención de los pacientes del Reino Unido. que fracasan en otras opciones de tratamiento. La agomelatina, es un tipo de fármaco que actúa sobre una vía dual melatonérgica-serotonérgica, los cuales han demostrado su eficacia en el tratamiento de la depresión ansiosa durante ensayos clínicos, estudio también sugiere la eficacia en el tratamiento de la depresión atípica y melancólica.