Caenorhabditis elegans
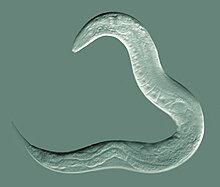
Caenorhabditis elegans () es un nematodo transparente de vida libre de aproximadamente 1 mm de longitud que vive en ambientes de suelos templados. Es la especie tipo de su género. El nombre es una mezcla del griego caeno- (reciente), rhabditis (similar a una varilla) y el latín elegans (elegante). En 1900, Maupas inicialmente lo llamó Rhabditides elegans. Osche lo colocó en el subgénero Caenorhabditis en 1952, y en 1955, Dougherty elevó Caenorhabditis al estatus de género.
C. elegans es un pseudocelomado no segmentado y carece de sistema respiratorio o circulatorio. La mayoría de estos nematodos son hermafroditas y unos pocos son machos. Los machos tienen colas especializadas para el apareamiento que incluyen espículas.
En 1963, Sydney Brenner propuso investigar C. elegans, principalmente en el área del desarrollo neuronal. En 1974, comenzó a investigar la biología molecular y del desarrollo de C. elegans, que desde entonces se ha utilizado ampliamente como organismo modelo. Fue el primer organismo multicelular en el que se secuenció todo su genoma y, a partir de 2019, es el único organismo en el que se completó su conectoma ('diagrama de cableado' neuronal).
Anatomía
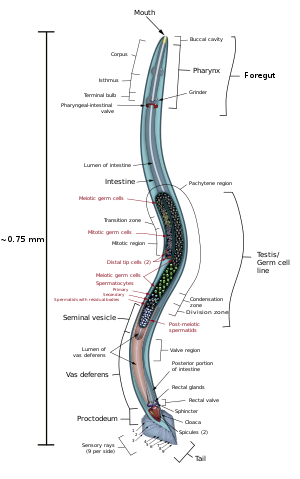
C. elegans no está segmentado, es vermiforme y tiene simetría bilateral. Tiene una cutícula (una cubierta exterior resistente, como un exoesqueleto), cuatro cordones epidérmicos principales y un pseudoceloma (cavidad corporal) lleno de líquido. También tiene algunos de los mismos sistemas de órganos que los animales más grandes. Aproximadamente uno de cada mil individuos es hombre y el resto son hermafroditas. La anatomía básica de C. elegans incluye boca, faringe, intestino, gónada y cutícula colágena. Como todos los nematodos, no tienen sistema circulatorio ni respiratorio. Las cuatro bandas de músculos que corren a lo largo del cuerpo están conectadas a un sistema neural que permite que los músculos muevan el cuerpo del animal solo como flexión dorsal o flexión ventral, pero no hacia la izquierda o hacia la derecha, a excepción de la cabeza. donde los cuatro cuadrantes musculares están cableados independientemente uno del otro. Cuando una ola de contracciones musculares dorsales/ventrales avanza desde la parte posterior hacia la parte delantera del animal, el animal es impulsado hacia atrás. Cuando una ola de contracciones se inicia en la parte delantera y avanza hacia atrás a lo largo del cuerpo, el animal es impulsado hacia adelante. Debido a este sesgo dorsal/ventral en las curvas del cuerpo, cualquier individuo vivo y en movimiento tiende a recostarse sobre su lado izquierdo o derecho cuando se lo observa cruzando una superficie horizontal. Se cree que un conjunto de crestas en los lados laterales de la cutícula del cuerpo, las alas, le dan al animal tracción adicional durante estos movimientos de flexión.
En relación con el metabolismo de los lípidos, C. elegans no tiene tejidos adiposos especializados, páncreas, hígado o incluso sangre para suministrar nutrientes en comparación con los mamíferos. En cambio, los lípidos neutros se almacenan en el intestino, la epidermis y los embriones. La epidermis corresponde a los adipocitos de los mamíferos por ser el principal depósito de triglicéridos.
La faringe es una bomba de alimento muscular en la cabeza de C. elegans, que es triangular en sección transversal. Esto muele la comida y la transporta directamente al intestino. Un conjunto de "celdas de válvula" conecta la faringe con el intestino, pero no se comprende cómo funciona esta válvula. Después de la digestión, el contenido del intestino se libera a través del recto, como ocurre con todos los demás nematodos. No existe una conexión directa entre la faringe y el canal excretor, que funciona en la liberación de orina líquida.
Los machos tienen una gónada de un solo lóbulo, un conducto deferente y una cola especializada para el apareamiento, que incorpora espículas. Los hermafroditas tienen dos ovarios, oviductos y espermateca, y un solo útero.
C. elegans las neuronas contienen dendritas que se extienden desde la célula para recibir neurotransmisores, y un proceso que se extiende hasta el anillo nervioso (el 'cerebro') para una conexión sináptica entre las neuronas. La mayor diferencia es que C. elegans tiene neuronas motoras excitatorias e inhibitorias, conocidas como neuronas colinérgicas y gabaérgicas, que simplemente actúan como regulación adicional para la diminuta criatura. No tienen ninguna influencia sobre el sistema nervioso además de regular los impulsos neuronales.
Gránulos de tripa
Numerosos gránulos intestinales están presentes en el intestino de C. elegans, cuyas funciones aún no se conocen del todo, al igual que muchos otros aspectos de este nematodo, a pesar de los muchos años que lleva estudiándose. Estos gránulos intestinales se encuentran en todos los órdenes Rhabditida. Son muy similares a los lisosomas en que presentan un interior ácido y capacidad de endocitosis, pero son considerablemente más grandes, lo que refuerza la idea de que son orgánulos de almacenamiento. Una característica notable de los gránulos es que cuando se observan bajo luz ultravioleta, reaccionan emitiendo una intensa fluorescencia azul. Otro fenómeno observado se denomina "fluorescencia de la muerte". A medida que los gusanos mueren, se emite un espectacular estallido de fluorescencia azul. Esta fluorescencia de muerte normalmente tiene lugar en una onda de anterior a posterior que se mueve a lo largo del intestino, y se observa tanto en gusanos jóvenes como viejos, ya sea que hayan sufrido lesiones letales o mueran pacíficamente de vejez.
Se han postulado muchas teorías sobre las funciones de los gránulos intestinales, y las anteriores han sido eliminadas por hallazgos posteriores. Se cree que almacenan zinc como una de sus funciones. Análisis químicos recientes han identificado el material azul fluorescente que contienen como una forma glicosilada de ácido antranílico (AA). Se cuestiona la necesidad de las grandes cantidades de AA que contienen muchos gránulos intestinales. Una posibilidad es que el AA sea antibacteriano y se use en defensa contra patógenos invasores. Otra posibilidad es que los gránulos proporcionen fotoprotección; los estallidos de fluorescencia AA implican la conversión de la dañina luz ultravioleta en luz visible relativamente inofensiva. Esto se ve como un posible vínculo con los melanosomas que contienen melanina.
Reproducción
El gusano hermafrodita se considera una forma especializada de hembra autofértil, ya que su soma es femenino. La línea germinal hermafrodita produce gametos masculinos primero y pone huevos a través de su útero después de la fertilización interna. Los hermafroditas producen todos sus espermatozoides en la etapa L4 (150 espermatozoides por brazo gonadal) y luego producen solo ovocitos. La gónada hermafrodita actúa como un ovotestis con espermatozoides almacenados en la misma área de la gónada que los ovocitos hasta que el primer ovocito empuja el esperma hacia la espermateca (una cámara en la que los ovocitos son fertilizados por el esperma).
El macho puede inseminar a la hermafrodita, que utilizará preferentemente semen masculino (ambos tipos de esperma se almacenan en la espermateca).
El esperma de C. elegans es ameboide, carece de flagelos y acrosomas. Cuando se autoinsemina, el gusano de tipo salvaje pone alrededor de 300 huevos. Cuando es inseminada por un macho, el número de descendientes puede exceder los 1.000. Los hermafroditas no suelen aparearse con otros hermafroditas. A 20 °C, la tensión de laboratorio de C. elegans (N2) tiene una vida útil promedio de 2 a 3 semanas y un tiempo de generación de 3 a 4 días.
C. elegans tiene cinco pares de autosomas y un par de cromosomas sexuales. Sexo en C. elegans se basa en un sistema de determinación del sexo X0. Hermafroditas de C. elegans tienen un par coincidente de cromosomas sexuales (XX); los raros machos tienen un solo cromosoma sexual (X0).
Determinación del sexo
C. elegans son en su mayoría organismos hermafroditas, que producen tanto espermatozoides como ovocitos. Los machos se encuentran en la población en una tasa de aproximadamente 1 en 200 hermafroditas, pero los dos sexos están muy diferenciados. Los machos se diferencian de sus contrapartes hermafroditas en que son más pequeños y pueden identificarse por la forma de su cola. C.elegans se reproduce a través de un proceso llamado androdioecia. Esto significa que pueden reproducirse de dos maneras: ya sea a través de la autofecundación en hermafroditas o a través de la cría de hermafroditas con machos. Los machos se producen a través de la no disyunción de los cromosomas X durante la meiosis. Los gusanos que se reproducen a través de la autofertilización corren el riesgo de sufrir un alto desequilibrio de ligamiento, lo que conduce a una menor diversidad genética en las poblaciones y un aumento en la acumulación de alelos nocivos. En C. elegans, la determinación del sexo somático se atribuye al gen tra-1. El tra-1 es un gen dentro de la vía de determinación del sexo del factor de transcripción TRA-1 que se regula postranscripcionalmente y funciona al promover el desarrollo femenino. En hermafroditas (XX), hay altos niveles de actividad tra-1, que produce el sistema reproductivo femenino e inhibe el desarrollo masculino. En un momento determinado de su ciclo de vida, un día antes de la edad adulta, los hermafroditas pueden identificarse mediante la adición de una vulva cerca de su cola. En los machos (XO), hay niveles bajos de actividad tra-1, lo que da como resultado un sistema reproductivo masculino. Investigaciones recientes han demostrado que hay otros tres genes, fem-1, fem-2 y fem-3, que regulan negativamente la vía TRA-1 y actúan como determinante final del sexo en C. elegante.
Evolución
El sistema de determinación del sexo en C. elegans es un tema que ha sido de interés para los científicos durante años. Dado que se utilizan como organismo modelo, cualquier información descubierta sobre la forma en que podría haber evolucionado su sistema de determinación del sexo podría promover la misma investigación de biología evolutiva en otros organismos. Después de casi 30 años de investigación, los científicos han comenzado a juntar las piezas de la evolución de dicho sistema. Lo que han descubierto es que hay una vía compleja involucrada que tiene varias capas de regulación. El organismo estrechamente relacionado Caenorhabditis briggsae se ha estudiado ampliamente y la secuencia de su genoma completo ha ayudado a juntar las piezas faltantes en la evolución de C. elegans determinación del sexo. Se ha descubierto que dos genes se han asimilado, dando lugar a que las proteínas XOL-1 y MIX-1 tengan un efecto sobre la determinación del sexo en C. elegans también. Las mutaciones en la vía XOL-1 conducen a la feminización en C. elegans. Se sabe que el gen mix-1 hipoactiva el cromosoma X y regula la morfología de la cola del macho en C. elegans. Mirando al nematodo como un todo, el sexo masculino y el hermafrodita probablemente evolucionaron a partir de una evolución paralela. La evolución paralela se define como rasgos similares que evolucionan de un ancestro en condiciones similares; En pocas palabras, las dos especies evolucionan de manera similar a lo largo del tiempo. Un ejemplo de esto serían los mamíferos marsupiales y placentarios. Los científicos también han planteado la hipótesis de que la reproducción asexual hermafrodita, o "autofecundación", podría haber evolucionado de forma convergente al estudiar especies similares a C. elegans Otros estudios sobre la evolución de la determinación del sexo sugieren que los genes relacionados con los espermatozoides evolucionan a un ritmo más rápido que los genes femeninos. Sin embargo, los genes de los espermatozoides en el cromosoma X tienen tasas de evolución reducidas. Los genes espermáticos tienen secuencias de codificación cortas, alto sesgo de codones y una representación desproporcionada entre los genes huérfanos. Estas características de los genes de los espermatozoides pueden ser la razón de sus altas tasas de evolución y también pueden sugerir cómo evolucionaron los genes de los espermatozoides a partir de los gusanos hermafroditas. En general, los científicos tienen una idea general de la vía de determinación del sexo en C. elegans, sin embargo, la evolución de cómo surgió esta vía aún no está bien definida.
Desarrollo
Desarrollo embrionario
El cigoto fertilizado sufre una escisión holoblástica rotacional.
La entrada del esperma en el ovocito inicia la formación de un eje anteroposterior. El centro organizador de los microtúbulos espermáticos dirige el movimiento del pronúcleo espermático hacia el futuro polo posterior del embrión, al mismo tiempo que incita el movimiento de las proteínas PAR, un grupo de factores de determinación citoplasmáticos, hacia sus respectivas ubicaciones adecuadas. Como resultado de la diferencia en la distribución de la proteína PAR, la primera división celular es muy asimétrica. C. elegans la embriogénesis es uno de los ejemplos mejor entendidos de división celular asimétrica.
Todas las células de la línea germinal surgen de una única célula germinal primordial, llamada célula P4, establecida en las primeras etapas de la embriogénesis. Esta célula primordial se divide para generar dos precursores de la línea germinal que no se dividen más hasta después de la eclosión.
Formación del eje
Las células hijas resultantes de la primera división celular se denominan célula AB (que contiene PAR-6 y PAR-3) y célula P1 (que contiene PAR-1 y PAR-2). Una segunda división celular produce las células ABp y ABa de la célula AB, y las células EMS y P2 de la célula P1. Esta división establece el eje dorsal-ventral, con la célula ABp formando el lado dorsal y la célula EMS marcando el lado ventral. A través de la señalización Wnt, la célula P2 le indica a la célula EMS que se divida a lo largo del eje anterior-posterior. A través de la señalización de Notch, la célula P2 especifica diferencialmente las células ABp y ABa, lo que define aún más el eje dorsal-ventral. El eje izquierda-derecha también se hace evidente temprano en la embriogénesis, aunque no está claro exactamente cuándo se determina específicamente el eje. Sin embargo, la mayoría de las teorías del desarrollo del eje L-R involucran algún tipo de diferencias en las células derivadas de la célula AB.
Gastrulación
La gastrulación ocurre después de que el embrión alcanza la etapa de 24 células. C. elegans es una especie de protostomes, por lo que el blastoporo eventualmente forma la boca. La involución hacia el blastoporo comienza con el movimiento de las células del endodermo y la subsiguiente formación del intestino, seguido por el precursor de la línea germinal P4 y, finalmente, las células del mesodermo, incluidas las células que finalmente forman la faringe. La gastrulación termina cuando la epibolia de los hipoblastos cierra el blastoporo.
Desarrollo postembrionario
En condiciones ambientales favorables para la reproducción, las larvas eclosionadas se desarrollan a través de cuatro etapas larvarias (L1, L2, L3 y L4) en solo 3 días a 20 °C. Cuando las condiciones son estresantes, como en la insuficiencia de alimentos, densidad de población excesiva o temperatura alta, C. elegans puede entrar en un tercer estadio larvario alternativo, L2d, llamado estadio dauer (Dauer en alemán significa permanente). Una feromona dauer específica regula la entrada en el estado dauer. Esta feromona está compuesta por derivados similares del azúcar 3,6-didesoxi, la ascarilosa. Los ascarósidos, llamados así por la base de la ascarilosa, están involucrados en muchos comportamientos sociales y específicos del sexo. De esta manera, constituyen un lenguaje químico que C. elegans utiliza para modular varios fenotipos. Las larvas de Dauer son resistentes al estrés; son delgados y sus bocas están selladas con una cutícula dauer característica y no pueden comer. Pueden permanecer en esta etapa durante algunos meses. La etapa termina cuando las condiciones mejoran y favorecen un mayor crecimiento de la larva, que ahora muda a la etapa L4, aunque el desarrollo de las gónadas se detiene en la etapa L2.
Cada transición de etapa está marcada por una muda de la cutícula transparente del gusano. Las transiciones a través de estas etapas están controladas por genes de la vía heterocrónica, un conjunto de factores reguladores conservados evolutivamente. Muchos genes heterocrónicos codifican microARN, que reprimen la expresión de factores de transcripción heterocrónicos y otros miARN heterocrónicos. Los miARN se descubrieron originalmente en C. elegans. Los eventos de desarrollo importantes controlados por genes heterocrónicos incluyen la división y eventual fusión sincitial de las células de la costura hipodérmica, y su posterior secreción de las alas en adultos jóvenes. Se cree que la vía heterocrónica representa un predecesor conservado evolutivamente de los relojes circadianos.
Algunos nematodos tienen un número fijo de células determinado genéticamente, un fenómeno conocido como eutely. El adulto C. elegans hermafrodita tiene 959 células somáticas y el macho tiene 1033 células, aunque se ha sugerido que el número de sus células intestinales puede aumentar de uno a tres en respuesta a los microbios intestinales experimentados por las madres. Gran parte de la literatura describe el número de células en los machos como 1031, pero el descubrimiento de un par de neuronas MCM izquierda y derecha aumentó el número en dos en 2015. El número de células no cambia después de que cesa la división celular al final de la larva. período, y el crecimiento posterior se debe únicamente a un aumento en el tamaño de las células individuales.
Ecología
Las diferentes especies de Caenorhabditis ocupan varios ambientes ricos en nutrientes y bacterias. Se alimentan de las bacterias que se desarrollan en la materia orgánica en descomposición (microbivory). El suelo carece de suficiente materia orgánica para sustentar poblaciones autosuficientes. C. elegans puede sobrevivir con una dieta de una variedad de bacterias, pero su ecología silvestre es en gran parte desconocida. La mayoría de las cepas de laboratorio se tomaron de entornos artificiales como jardines y pilas de compost. Más recientemente, C. elegans se ha encontrado prosperando en otros tipos de materia orgánica, particularmente en fruta podrida.
C. elegans también puede utilizar diferentes especies de levaduras, incluidas Cryptococcus laurentii y C. kuetzingii, como única fuente de alimento. Aunque es un bacterivoro, C. elegans puede ser eliminado por una serie de bacterias patógenas, incluidos patógenos humanos como Staphylococcus aureus, Pseudomonas aeruginosa, Salmonella enterica o Enterococcus faecalis. Las bacterias patógenas también pueden formar biopelículas, cuya matriz de exopolímero pegajoso podría impedir la C. elegans motility and cloaks bacteria quorum sensing quimioatrayentes de la detección de depredadores.
Los invertebrados como los milpiés, los insectos, los isópodos y los gasterópodos pueden transportar las larvas de dauer a varios lugares adecuados. También se ha visto que las larvas se alimentan de sus huéspedes cuando mueren.
Los nematodos pueden sobrevivir a la desecación y en C. elegans, se ha demostrado que el mecanismo de esta capacidad son proteínas abundantes en la embriogénesis tardía.
C. elegans, como otros nematodos, puede ser consumido por nematodos depredadores y otros omnívoros, incluidos algunos insectos.
El virus de Orsay es un virus que afecta a C. elegans, así como el virus Caenorhabditis elegans Cer1 y el virus Caenorhabditis elegans Cer13.
- Interacciones con hongos
Aislados silvestres de Caenorhabditis elegans se encuentran regularmente con infecciones por hongos Microsporidia. Una de esas especies, Nematocida parisii, se replica en los intestinos de C. elegante.
Arthrobotrys oligospora es el organismo modelo para las interacciones entre hongos y nematodos. Es el hongo capturador de nematodos más común y extendido.
Utilizar como organismo modelo
En 1963, Sydney Brenner propuso usar C. elegans como organismo modelo para la investigación principalmente del desarrollo neuronal en animales. Es uno de los organismos más simples con un sistema nervioso. Las neuronas no disparan potenciales de acción y no expresan ningún canal de sodio dependiente de voltaje. En el hermafrodita, este sistema comprende 302 neuronas cuyo patrón se ha mapeado exhaustivamente, en lo que se conoce como conectoma, y se muestra como una red de mundo pequeño.
La investigación ha explorado los mecanismos neuronales y moleculares que controlan varios comportamientos de C. elegans, incluyendo quimiotaxis, termotaxis, mecanotransducción, aprendizaje, memoria y comportamiento de apareamiento. En 2019 se publicó el conectoma del macho utilizando una técnica distinta a la utilizada para el hermafrodita. El mismo artículo utilizó la nueva técnica para rehacer el conectoma hermafrodita, encontrando 1.500 nuevas sinapsis.
Se ha utilizado como organismo modelo para estudiar mecanismos moleculares en enfermedades metabólicas. Brenner también lo eligió porque es fácil de cultivar en grandes poblaciones y conveniente para el análisis genético. Es un organismo eucariota multicelular, pero lo suficientemente simple como para ser estudiado en gran detalle. La transparencia de C. elegans facilita el estudio de la diferenciación celular y otros procesos de desarrollo en el organismo intacto. Las espículas del macho distinguen claramente a los machos de las hembras. Las cepas son baratas de criar y se pueden congelar. Cuando se descongelan posteriormente, siguen siendo viables, lo que permite el almacenamiento a largo plazo. El mantenimiento es fácil en comparación con otros organismos modelo multicelulares. Se pueden mantener unos cientos de nematodos en una sola placa de agar y un medio de crecimiento adecuado. Brenner describió el uso de un mutante de E. coli – OP50. OP50 es un organismo que requiere uracilo y su deficiencia en la placa evita el crecimiento excesivo de bacterias que ocultarían a los gusanos. El uso de OP50 no exige medidas de seguridad de laboratorio importantes, ya que no es patógeno y se cultiva fácilmente en medios Luria-Bertani (LB) durante la noche.
Mapeo de linaje celular
Se mapeó el destino del desarrollo de cada célula somática (959 en el hermafrodita adulto; 1031 en el macho adulto). Estos patrones de linaje celular son en gran medida invariantes entre los individuos, mientras que en los mamíferos, el desarrollo celular depende más de las señales celulares del embrión.
Como se mencionó anteriormente, las primeras divisiones celulares de la embriogénesis temprana en C. elegans se encuentran entre los ejemplos mejor entendidos de divisiones celulares asimétricas, y el gusano es un sistema modelo muy popular para estudiar la biología del desarrollo.
Muerte celular programada
La muerte celular programada (apoptosis) elimina muchas células adicionales (131 en el hermafrodita, la mayoría de las cuales de otro modo se convertirían en neuronas); esta "previsibilidad apoptótica" ha contribuido a la elucidación de algunos genes apoptóticos. Se han identificado genes que promueven la muerte celular y un único inhibidor de la muerte celular.
Interferencia de ARN y silenciamiento de genes
La interferencia de ARN (ARNi) es un método relativamente sencillo para interrumpir la función de genes específicos. A veces, silenciar la función de un gen puede permitir a un investigador inferir su posible función. El nematodo puede empaparse, inyectarse o alimentarse con bacterias transformadas genéticamente que expresan el ARN de doble cadena de interés, cuya secuencia complementa la secuencia del gen que el investigador desea desactivar. RNAi se ha convertido en una poderosa herramienta en el estudio de la genómica funcional. C. elegans se ha utilizado para analizar las funciones de los genes y reclamar la promesa de futuros hallazgos en las interacciones genéticas sistemáticas.
La captación de ARNi ambiental es mucho peor en otras especies de gusanos del género Caenorhabditis. Aunque la inyección de ARN en la cavidad corporal del animal induce el silenciamiento génico en la mayoría de las especies, sólo C. elegans y algunos otros nematodos lejanamente relacionados pueden tomar ARN de las bacterias que comen para ARNi. Esta capacidad se ha asignado a un solo gen, sid-2, que, cuando se inserta como un transgén en otras especies, les permite tomar ARN para ARNi como C. elegans sí.
División celular y ciclo celular
La investigación sobre la meiosis se ha simplificado considerablemente, ya que cada núcleo de la célula germinal se encuentra en la misma posición dada a medida que desciende por la gónada, por lo que se encuentra en la misma etapa de la meiosis. En una fase temprana de la meiosis, los ovocitos se vuelven extremadamente resistentes a la radiación y esta resistencia depende de la expresión de los genes rad51 y atm que tienen funciones clave en la reparación recombinante. El gen mre-11 también juega un papel crucial en la reparación recombinante del daño del ADN durante la meiosis. Un estudio de la frecuencia de cruzamiento en poblaciones naturales mostró que la autofecundación es el modo de reproducción predominante en C. elegans, pero que los eventos cruzados poco frecuentes ocurren a una tasa de alrededor del 1%. Es poco probable que las meiosis que dan como resultado la autofecundación contribuyan significativamente a la variabilidad genética beneficiosa, pero estas meiosis pueden proporcionar el beneficio adaptativo de la reparación recombinacional de los daños en el ADN que surgen, especialmente en condiciones de estrés.
Abuso de drogas y adicción
La dependencia de la nicotina también se puede estudiar usando C. elegans porque exhibe respuestas de comportamiento a la nicotina que son paralelas a las de los mamíferos. Estas respuestas incluyen respuesta aguda, tolerancia, abstinencia y sensibilización.
Bases de datos biológicas
En cuanto a la mayoría de los organismos modelo, los científicos que trabajan en el campo seleccionan una base de datos en línea dedicada y WormBase es para C. elegante. WormBase intenta recopilar toda la información publicada en C. elegans y otros nematodos relacionados. Su sitio web ha anunciado una recompensa de $ 4000 para el buscador de una nueva especie de nematodo estrechamente relacionado. Tal descubrimiento ampliaría las oportunidades de investigación con el gusano.
Envejecimiento
C. elegans ha sido un organismo modelo para la investigación del envejecimiento; por ejemplo, se ha demostrado que la inhibición de una vía de señalización del factor de crecimiento similar a la insulina triplica la vida adulta; mientras que la alimentación con glucosa promueve el estrés oxidativo y reduce la vida adulta a la mitad. De manera similar, la degradación inducida de un receptor de insulina/IGF-1 en una etapa tardía de la vida prolongó dramáticamente la esperanza de vida de los gusanos. Mutantes de larga vida de C. elegans demostraron ser resistentes al estrés oxidativo y a la luz ultravioleta. Estos mutantes de larga vida tenían una mayor capacidad de reparación del ADN que el C de tipo salvaje. elegante. La eliminación del gen de reparación por escisión de nucleótidos Xpa-1 aumentó la sensibilidad a los rayos UV y redujo la vida útil de los mutantes de larga duración. Estos hallazgos indican que la capacidad de reparación del ADN es la base de la longevidad.
La capacidad de reparar el daño del ADN mediante el proceso de reparación por escisión de nucleótidos disminuye con la edad.
C. elegans expuesta a cloruro de litio (LiCl) 5 mM mostró una vida más prolongada. Cuando se expuso a LiCl 10 μM, se observó una mortalidad reducida, pero no con 1 μM.
C. elegans ha sido fundamental en la identificación de las funciones de los genes implicados en la enfermedad de Alzheimer, como la presenilina. Además, una extensa investigación sobre C. elegans ha identificado las proteínas de unión al ARN como factores esenciales durante la línea germinal y el desarrollo embrionario temprano.
Los telómeros, cuya longitud se ha demostrado que se correlaciona con una mayor esperanza de vida y un retraso en el inicio de la senescencia en una multitud de organismos, de C. elegans a humanos, muestran un comportamiento interesante en C. elegans. Mientras que C. elegans mantiene sus telómeros de forma canónica similar a otros eucariotas, en contraste Drosophila melanogaster es notable en su uso de retrotransposones para mantener sus telómeros, durante la desactivación de la subunidad catalítica del telomerasa (trt-1) C. elegans puede obtener la capacidad de alargamiento alternativo de los telómeros (ALT). C. elegans fue el primer eucariota en obtener la funcionalidad ALT después de la eliminación de la vía canónica de la telomerasa. La ALT también se observa en alrededor del 10-15% de todos los cánceres clínicos. Así C. elegans es un candidato principal para la investigación de ALT. Bayat et al. mostró el acortamiento paradójico de los telómeros durante la sobreexpresión de trt-1 que condujo a una esterilidad cercana, mientras que los gusanos incluso exhibieron un ligero aumento en la vida útil, a pesar de los telómeros acortados.
Dormir
C. elegans es notable en los estudios del sueño en animales como el organismo más primitivo que muestra estados similares al sueño. En C. elegans, se produce una fase de letargo poco antes de cada muda. C. elegans también se ha demostrado que duerme después de la exposición al estrés físico, incluido el golpe de calor, la radiación ultravioleta y las toxinas bacterianas.
Biología sensorial
Si bien el gusano no tiene ojos, se ha descubierto que es sensible a la luz debido a un tercer tipo de proteína fotorreceptora animal sensible a la luz, LITE-1, que es de 10 a 100 veces más eficiente para absorber luz que el otro dos tipos de fotopigmentos (opsinas y criptocromos) que se encuentran en el reino animal.
C. elegans es notablemente experto en tolerar la aceleración. Puede soportar 400.000 g's, según genetistas de la Universidad de São Paulo en Brasil. En un experimento, el 96% de ellos seguían vivos sin efectos adversos después de una hora en una ultracentrífuga.
Investigación de vuelos espaciales
C. elegans fue noticia cuando se descubrió que los especímenes sobrevivieron al desastre del transbordador espacial Columbia en febrero de 2003. Más tarde, en enero de 2009, muestras vivas de C. elegans de la Universidad de Nottingham se anunció que pasaría dos semanas en la Estación Espacial Internacional en octubre, en un proyecto de investigación espacial para explorar los efectos de la gravedad cero en el desarrollo muscular y la fisiología. La investigación se centró principalmente en la base genética de la atrofia muscular, que se relaciona con los vuelos espaciales o estar postrado en cama, ser geriátrico o diabético. Los descendientes de los gusanos a bordo del Columbia en 2003 fueron lanzados al espacio en el Endeavour para la misión STS-134. A partir de diciembre de 2018, se llevarán a cabo experimentos adicionales sobre la distrofia muscular durante los vuelos espaciales a bordo de la ISS.
Genética
Genoma
C. elegans fue el primer organismo multicelular en tener su genoma completo secuenciado. La secuencia se publicó en 1998, aunque presentaba algunas pequeñas lagunas; la última brecha se terminó en octubre de 2002. En el período previo al genoma completo, el C. elegans Consorcio de Secuenciación/C. elegans Genome Project publicó varios escaneos parciales, incluidos Wilson et al. 1994.
Tamaño y contenido genético
El C. elegans el genoma tiene una longitud de unos 100 millones de pares de bases y consiste en seis pares de cromosomas en los hermafroditas o cinco pares de autosomas con el cromosoma XO en los machos C. elegans y un genoma mitocondrial. Su densidad génica es de aproximadamente un gen por cada cinco kilopares de bases. Los intrones constituyen el 26% y las regiones intergénicas el 47% del genoma. Muchos genes están dispuestos en grupos y no está claro cuántos de ellos son operones. C. elegans y otros nematodos se encuentran entre los pocos eucariotas que actualmente se sabe que tienen operones; estos incluyen tripanosomas, platelmintos (en particular, el trematodo Schistosoma mansoni) y un tunicado cordado primitivo Oikopleura dioica. Es probable que se demuestre que muchos más organismos tienen estos operones.
El genoma contiene aproximadamente 20 470 genes que codifican proteínas. Alrededor del 35% de C. elegans genes tienen homólogos humanos. Sorprendentemente, se ha demostrado repetidamente que los genes humanos reemplazan su C. elegans homólogos cuando se introducen en C. elegante. Por el contrario, muchos C. elegans pueden funcionar de manera similar a los genes de los mamíferos.
La cantidad de genes de ARN conocidos en el genoma ha aumentado considerablemente debido al descubrimiento en 2006 de una nueva clase llamada genes 21U-ARN, y ahora se cree que el genoma contiene más de 16 000 genes de ARN., frente a tan solo 1.300 en 2005.
Los curadores científicos continúan evaluando el conjunto de genes conocidos; se siguen agregando nuevos modelos genéticos y se modifican o eliminan los incorrectos.
La referencia C. la secuencia del genoma de elegans continúa cambiando a medida que nuevas evidencias revelan errores en la secuenciación original. La mayoría de los cambios son menores, agregando o eliminando solo unos pocos pares de bases de ADN. Por ejemplo, la versión WS202 de WormBase (abril de 2009) agregó dos pares de bases a la secuencia del genoma. A veces, se realizan cambios más extensos, como se indica en la publicación WS197 de diciembre de 2008, que agregó una región de más de 4300 pb a la secuencia.
El C. elegans Proyecto Genoma Wilson et al. 1994 encontró CelVav y un dominio del factor A de von Willebrand y con Wilson et al. 1998 proporciona la primera evidencia creíble de un homólogo del receptor de arilo de hidrocarburos (AHR) fuera de los vertebrados. 2
Genomas relacionados
En 2003, la secuencia del genoma del nematodo relacionado C. briggsae también se determinó, lo que permitió a los investigadores estudiar la genómica comparativa de estos dos organismos. Las secuencias del genoma de más nematodos del mismo género, por ejemplo, C. remanei, C. japonica y C. brenneri (llamado así por Brenner), también se han estudiado utilizando la técnica de secuenciación de escopeta. Estas secuencias ahora se han completado.
Otros estudios genéticos
A partir de 2014, C. elegans es la especie más basal de la familia 'Elegans' grupo (10 especies) de los 'Elegans' supergrupo (17 especies) en estudios filogenéticos. Forma una rama propia distinta a cualquier otra especie del grupo.
El transposónTc1 es un transposón de ADN activo en C. elegante.
Comunidad científica
En 2002, el Premio Nobel de Fisiología o Medicina fue otorgado a Sydney Brenner, H. Robert Horvitz y John Sulston por su trabajo sobre la genética del desarrollo de órganos y la muerte celular programada en C. elegante. El Premio Nobel de Fisiología o Medicina de 2006 fue otorgado a Andrew Fire y Craig C. Mello por su descubrimiento de la interferencia del ARN en C. elegante. En 2008, Martin Chalfie compartió el Premio Nobel de Química por su trabajo sobre la proteína fluorescente verde; parte de la investigación involucró el uso de C. elegante.
Muchos científicos que investigan C. elegans conecta estrechamente con Sydney Brenner, con quien casi todas las investigaciones en este campo comenzaron en la década de 1970; han trabajado como investigadores posdoctorales o posgraduados en el laboratorio de Brenner o en el laboratorio de alguien que trabajó anteriormente con Brenner. La mayoría de los que trabajaron en su laboratorio más tarde establecieron sus propios laboratorios de investigación de gusanos, creando así un "linaje" bastante bien documentado. de C. elegans científicos, que se registró en la base de datos WormBase con cierto detalle en la Reunión Internacional de Gusanos de 2003.
Contenido relacionado
Alineación de secuencia
Thomas Henry Huxley
Cuagga