Bromuro de oro (III)
El bromuro de oro (III) es un sólido cristalino de color rojo oscuro a negro. Tiene la fórmula empírica AuBr3, pero existe como un dímero con la fórmula molecular Au2Br6 en la que dos átomos de oro están unidos por dos átomos de bromo. Se lo conoce comúnmente como bromuro de oro (III), tribromuro de oro y, en raras ocasiones, pero tradicionalmente, como bromuro áurico, y a veces como hexabromuro de oro. Los tribromuros análogos de cobre o plata no existen.
Historia
La primera mención de cualquier investigación o estudio sobre los haluros de oro se remonta a principios y mediados del siglo XIX, y hay tres investigadores principales asociados con la extensa investigación de esta área particular de la química: Thomsen, Schottländer y Krüss.
Estructura
El bromuro de oro (III) adopta estructuras que se observan en otros compuestos diméricos de trihaluro de oro (III), como el cloruro. Los centros de oro presentan una coordinación plana cuadrada con ángulos de enlace de aproximadamente 90 grados.
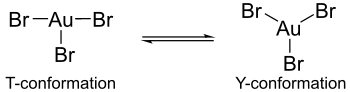
Los cálculos indican que en las formas monoméricas hipotéticas de los trihaluros de oro, el efecto Jahn-Teller hace que surjan diferencias en las estructuras de los complejos de haluro de oro. Por ejemplo, el bromuro de oro (III) contiene un enlace oro-bromo largo y dos cortos, mientras que el cloruro de oro (III) y el fluoruro de oro (III) constan de dos enlaces oro-halógeno largos y uno corto. Además, el tribromuro de oro no exhibe la misma coordinación alrededor del átomo central de oro que el tricloruro de oro o el trifluoruro de oro. En estos últimos complejos, la coordinación exhibe una conformación T, pero en el tribromuro de oro la coordinación existe como un equilibrio más dinámico entre una conformación Y y una conformación T. Esta diferencia de coordinación se puede atribuir al efecto Jahn-Teller, pero más aún a la disminución del enlace π-back de los átomos de oro con los ligandos de bromo en comparación con el enlace π-back encontrado con los ligandos de flúor y cloro. También es esta disminución del enlace π-posterior lo que explica por qué el tribromuro de oro es menos estable que sus contrapartes trifluoruro y tricloruro.
Preparación
El método de síntesis más común del bromuro de oro (III) consiste en calentar el oro y el exceso de bromo líquido a 140 °C:
- 2 Au + 3 Br2 → Au2Br6
Alternativamente, la reacción de intercambio de haluro de cloruro de oro (III) con ácido bromhídrico también ha demostrado ser exitosa en la síntesis de bromuro de oro (III):
- Au2Cl6 + 6 HBr → 6 HCl + Au2Br6
Propiedades químicas
Gold(III) muestra una geometría de coordinación plana cuadrada.
Los trihaluros de oro (III) forman una variedad de aductos de cuatro coordenadas. Un ejemplo es el hidrato AuBr3·H2O. Otro aducto bien conocido es el que se forma con tetrahidrotiofeno. El tetrabromuro también se conoce como:
- HBr + AuBr3 → H+[AuBr4]−
Usos
Química catalítica
El bromuro de oro (III) cataliza una variedad de reacciones. En un ejemplo, cataliza la reacción de Diels-Alder de una unidad enina y un carbonilo.
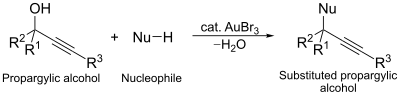
Otro uso catalítico del tribromuro de oro es en la reacción de sustitución nucleofílica de alcoholes propargílicos. En esta reacción, el complejo de oro actúa como un agente activador del alcohol para facilitar la sustitución.
Detección de ketaminas
El bromuro de oro (III) se puede utilizar como reactivo para detectar la presencia de ketamina.
Se prepara una solución de NaOH 0,25 % de AuBr3 0,1 M para obtener una solución de color amarillo parduzco. Se añaden dos gotas de esta solución a una placa de análisis y se añade una pequeña cantidad de ketamina. La mezcla adquiere un color violeta intenso en aproximadamente un minuto, que se transforma en un color violeta negruzco oscuro en aproximadamente dos minutos.
El paracetamol, el ácido ascórbico, la heroína, la lactosa, el manitol, la morfina y la sacarosa provocan un cambio de color instantáneo a púrpura, al igual que otros compuestos con grupos fenol e hidroxilo.
Nada de lo que se encuentra comúnmente en combinación con ketamina produjo el mismo cambio de color en el mismo tiempo.
"El color púrpura inicial puede deberse a la formación de un complejo entre el oro y la ketamina. Se desconoce la causa del cambio de color de púrpura a púrpura negruzco oscuro; sin embargo, puede deberse a una reacción redox que produce una pequeña cantidad de oro coloidal."
Referencias
- ^ "Gold(III) bromide 99.999% trace metals". Sigma Aldrich. Retrieved 27 de mayo 2021.
- ^ "Gold tribromide". pubchem.ncbi.nlm.nih.gov.
- ^ a b Macintyre, J. E. (ed.) Diccionario de compuestos inorgánicos; Chapman " Hall: London, 1992; vol. 1, págs. 121
- ^ a b c Greenwood, N.N.; Earnshaw, A. Química de los elementos; Butterworth-Heineman: Oxford,1997; pp. 1183-1185
- ^ a b c d Cotton, F.A.; Wilkinson, G.; Murillo, C.A.; Bochmann, M. Química Inorgánica Avanzada; John Wiley ' Sons: New York, 1999; pp. 1101-1102
- ^ a b c d Schulz, A.; Hargittai, M. Chem. Eur. J. 2001, vol. 7, págs. 3657 a 3670
- ^ Schwerdtfeger, P. J. Am. Chem. Soc. 1989, vol. 111, pp. 7261-7262
- ^ Lengefield, F. J. Am. Chem. Soc. 1901, vol. 26, págs. 324
- ^ Thomsen, J. J. Prakt. Chem. 1876, vol. 13, págs. 337
- ^ Schottländer, Justus Liebigs Ann., vol. 217, págs. 312
- ^ Krüss, G. Ber Dtsch. Cielos. 1887, vol. 20, págs. 2634
- ^ Dell'Amico, D.B.; Calderazzo, F.; Morvillo, A.; Pelizzi, G; Robino, P. J. Chem. Soc., Dalton Trans. 1991 pp. 3009-3016
- ^ Nottingham, Chris; Barber, Verity; Lloyd-Jonesjournal=Organic Syntheses, Guy C. (2019). "Gold-Catalyzed Oxidative Coupling of Arenes y Arylsilanes". Org. Synth. 96: 150–178. doi:10.15227/orgsyn.096.0150.
- ^ Asao, N.; Aikawa, H.; Yamamoto, Y. J. Am. Chem. Soc. 2004, vol. 126, págs. 7458 a 7459
- ^ Georgy, M.; Boucard, V.; Campagne, J. J. Am. Chem. Soc. 2005, vol. 127, pp. 14180-14181
- ^ a b Sarwar, Mohammad. "Una nueva prueba de color altamente específica para la ketamina". El Micrograma. Administración de Fiscalización de Drogas. Archivado desde el original en 2010-10-17. Retrieved 2012-01-26.