Bromuro
Un ion bromuro es la forma cargada negativamente (Br-) del elemento bromo, un miembro del grupo de los halógenos en la tabla periódica. mesa. La mayoría de los bromuros son incoloros. Los bromuros tienen muchas funciones prácticas y se encuentran en anticonvulsivos, materiales retardantes de llama y colorantes celulares. Aunque es poco común, la toxicidad crónica del bromuro puede provocar bromismo, un síndrome con múltiples síntomas neurológicos. La toxicidad del bromuro también puede causar un tipo de erupción cutánea, consulte bromuro de potasio. El ion bromuro tiene un radio iónico de 196 pm.
Ocurrencia natural
El bromuro está presente en el agua de mar típica (35 PSU) con una concentración de alrededor de 65 mg/L, que es aproximadamente el 0,2 % de todas las sales disueltas. Los mariscos y las plantas de aguas profundas generalmente tienen niveles más altos que los alimentos de origen terrestre. La bromargirita (bromuro de plata natural y cristalino) es el mineral de bromuro más común conocido, pero sigue siendo muy raro. Además de la plata, el bromo también se encuentra en minerales combinados con mercurio y cobre.
Formación y reacciones del bromuro
Disociación de sales de bromuro
Las sales de bromuro de metales alcalinos, alcalinotérreos y muchos otros metales se disuelven en agua (e incluso en algunos alcoholes y algunos éteres) para dar iones bromuro. El caso clásico es el bromuro de sodio, que se disocia completamente en agua:
- NaBr → Na+ + Br−
El bromuro de hidrógeno, que es una molécula diatómica, adquiere propiedades similares a las de la sal al entrar en contacto con el agua para dar una solución iónica llamada ácido bromhídrico. El proceso a menudo se describe de manera simplista como que implica la formación de la sal hidronio de bromuro:
- HBr + H2O → H3O+ + Br−
Hidrólisis del bromo
El bromo reacciona fácilmente con el agua, es decir, sufre hidrólisis:
- Br2 + H2O → HOBr + HBr
Esto forma ácido hipobromoso (HOBr) y ácido bromhídrico (HBr en agua). La solución se llama "agua con bromo". La hidrólisis del bromo es más favorable en presencia de una base, por ejemplo hidróxido de sodio:
- Br2 + NaOH → NaOBr + NaBr
Esta reacción es análoga a la producción de lejía, donde el cloro se disuelve en presencia de hidróxido de sodio.
Oxidación del bromuro
Se puede probar la presencia de un ion bromuro agregando un oxidante. Un método utiliza HNO3 diluido.
El método de Balard y Löwig se puede utilizar para extraer bromo del agua de mar y de determinadas salmueras. Para muestras que prueban una concentración suficiente de bromuro, la adición de cloro produce bromo (Br2):
- Cl2 + 2 Br− → 2 Cl− + Br2
Aplicaciones
El principal valor comercial del bromuro es su uso en la producción de compuestos organobromados, que en sí mismos son bastante especializados. Los compuestos organobromados se utilizan comúnmente como retardantes de llama bromados. Algunos retardantes de llama bromados fueron identificados como persistentes, bioacumulativos y tóxicos tanto para los humanos como para el medio ambiente y se sospechaba que causaban efectos neuroconductuales y alteraciones endocrinas.
Se producen comercialmente muchos bromuros metálicos, incluidos LiBr, NaBr, NH4Br, CuBr, ZnBr2 y AlBr3. AgBr se utiliza para el proceso fotográfico de gelatina de plata, en gran parte obsoleto.
Usos medicinales y veterinarios
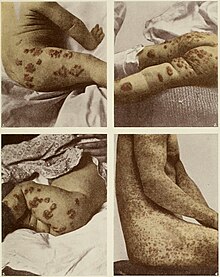
Medicina popular y pasada de moda
El bromuro de litio se utilizó como sedante a principios del siglo XX. Sin embargo, cayó en desgracia en la década de 1940 debido a la creciente popularidad de sedantes más seguros y eficaces (específicamente, barbitúricos) y cuando algunos pacientes cardíacos murieron después de usar un sustituto de la sal (ver cloruro de litio). Al igual que el carbonato de litio y el cloruro de litio, se utilizó como tratamiento para el trastorno bipolar.
De 1954 a 1977, el bioquímico australiano Shirley Andrews estaba investigando formas seguras de utilizar litio para el tratamiento de enfermedades depresivas maníacas mientras trabajaba en el Hospital Psiquiátrico del Parque Real de Victoria. Al realizar esta investigación descubrió que el bromuro causaba síntomas de enfermedad mental, lo que condujo a una reducción importante en su uso.
Los compuestos de bromuro, especialmente el bromuro de potasio, se utilizaron con frecuencia como sedantes en el siglo XIX y principios del XX. Su uso en sedantes y remedios para el dolor de cabeza de venta libre (como Bromo-Seltzer) en los Estados Unidos se extendió hasta 1975, cuando los bromuros fueron retirados como ingredientes debido a su toxicidad crónica. Este uso dio lugar a la palabra "bromuro" su connotación coloquial de cliché reconfortante.
Se ha dicho que durante la Primera Guerra Mundial, a los soldados británicos se les dio bromuro para frenar sus impulsos sexuales. Lord Dunsany menciona a un soldado al que le dieron bromuro como sedante para el agotamiento nervioso y el exceso de trabajo en su obra Fame and the Poet (1919).
Las sales de bromuro se utilizan en jacuzzis como agentes germicidas suaves para generar hipobromito in situ.
El ion bromuro es antiepiléptico y, como sal de bromuro, se utiliza en medicina veterinaria en los EE. UU. Los riñones excretan iones bromuro. La vida media del bromuro en el cuerpo humano (12 días) es larga en comparación con la de muchos productos farmacéuticos, lo que hace que sea difícil ajustar la dosis. (Una nueva dosis puede requerir varios meses para alcanzar el equilibrio). Las concentraciones de iones bromuro en el líquido cefalorraquídeo son aproximadamente el 30% de las de la sangre y están fuertemente influenciadas por la ingesta de cloruro y el metabolismo del cuerpo.
Dado que el bromuro todavía se utiliza en la medicina veterinaria en los Estados Unidos, los laboratorios de diagnóstico veterinario pueden medir de forma rutinaria los niveles de bromuro en sangre. Sin embargo, esta no es una prueba convencional en medicina humana en los EE. UU., ya que no existen usos aprobados por la FDA para el bromuro. Los niveles terapéuticos de bromuro se miden en países europeos como Alemania, donde el bromuro todavía se utiliza terapéuticamente en la epilepsia humana.
Bioquímica
El bromuro rara vez se menciona en el contexto bioquímico. Algunas enzimas utilizan bromuro como sustrato o cofactor.
Sustrato
Las enzimas bromoperoxidasa utilizan bromuro (normalmente en agua de mar) para generar agentes bromadores electrófilos. Este proceso genera cientos de compuestos organobromados. Un ejemplo notable es el bromoformo, del cual se producen miles de toneladas anualmente de esta manera. El tinte histórico púrpura de Tiro se produce mediante reacciones enzimáticas similares.
Cofactor
En un informe especializado, el bromuro es un cofactor esencial en la catálisis peroxidante de los enlaces cruzados de sulfonimina en el colágeno IV. Esta modificación postraduccional ocurre en todos los animales y el bromo es un oligoelemento esencial para el ser humano.
Los eosinófilos necesitan bromuro para combatir los parásitos multicelulares. El hipobromito se produce mediante la peroxidasa de eosinófilos, una enzima que puede utilizar cloruro pero preferentemente utiliza bromuro.
La concentración promedio de bromuro en la sangre humana en Queensland, Australia, es 5,3±1,4 mg/L y varía según la edad y el sexo. Niveles mucho más altos pueden indicar exposición a sustancias químicas bromadas. También se encuentra en los mariscos.