BRCA1
Proteína de susceptibilidad al cáncer de mama tipo 1 es una proteína que en los humanos está codificada por el gen BRCA1 (). Los ortólogos son comunes en otras especies de vertebrados, mientras que los genomas de invertebrados pueden codificar un gen relacionado más lejanamente. BRCA1 es un gen supresor de tumores humanos (también conocido como gen cuidador) y es responsable de reparar el ADN.
BRCA1 y BRCA2 son proteínas no relacionadas, pero ambas normalmente se expresan en las células de la mama y otros tejidos, donde ayudan a reparar el ADN dañado o a destruir las células si el ADN no se puede reparar. Están implicados en la reparación de daños cromosómicos y desempeñan un papel importante en la reparación sin errores de roturas de doble cadena del ADN. Si el BRCA1 o el BRCA2 se dañan por una mutación de BRCA, el ADN dañado no se repara adecuadamente y esto aumenta el riesgo de cáncer de mama. BRCA1 y BRCA2 se han descrito como "genes de susceptibilidad al cáncer de mama" y "proteínas de susceptibilidad al cáncer de mama". El alelo predominante tiene una función supresora de tumores normal, mientras que las mutaciones de alta penetrancia en estos genes provocan una pérdida de la función supresora de tumores que se correlaciona con un mayor riesgo de cáncer de mama.
BRCA1 se combina con otros supresores de tumores, sensores de daños en el ADN y transductores de señales para formar un gran complejo proteico de múltiples subunidades conocido como complejo de vigilancia del genoma asociado a BRCA1 (BASC).). La proteína BRCA1 se asocia con la ARN polimerasa II y, a través del dominio C-terminal, también interactúa con complejos de histona desacetilasa. Por lo tanto, esta proteína desempeña un papel en la transcripción y la reparación del ADN de doble hebra rompe la ubiquitinación, la regulación transcripcional y otras funciones.
Los métodos para evaluar la probabilidad de que un paciente con mutaciones en BRCA1 y BRCA2 desarrollen cáncer estaban cubiertos por patentes propiedad de Myriad Genetics o controladas por ella. El modelo de negocio de Myriad de ofrecer la prueba de diagnóstico exclusivamente llevó de que Myriad fuera una startup en 1994 a ser una empresa que cotiza en bolsa con 1200 empleados y alrededor de 500 millones de dólares en ingresos anuales en 2012; también generó controversia sobre los altos precios y la imposibilidad de obtener segundas opiniones de otros laboratorios de diagnóstico, lo que a su vez condujo a la histórica demanda Association for Molecular Pathology v. Myriad Genetics.
Descubrimiento
La primera evidencia de la existencia de un gen que codifica una enzima reparadora del ADN implicada en la susceptibilidad al cáncer de mama fue proporcionada por el laboratorio de Mary-Claire King en UC Berkeley en 1990. Cuatro años más tarde, después de una carrera internacional para encontrar El gen fue clonado en 1994 por científicos de la Universidad de Utah, el Instituto Nacional de Ciencias de la Salud Ambiental (NIEHS) y Myriad Genetics.
Ubicación del gen
El gen BRCA1 humano está ubicado en el brazo largo (q) del cromosoma 17 en la región 2, banda 1, desde el par de bases 41.196.312 hasta el par de bases 41.277.500 (compilación GRCh37/hg19) (mapa). Se han identificado ortólogos de BRCA1 en la mayoría de los vertebrados para los que se dispone de datos genómicos completos.
Estructura de las proteínas
La proteína BRCA1 contiene los siguientes dominios:
- Dedo Zinc, tipo C3HC4 (Dedo RING)
- BRCA1 C Terminus (BRCT) dominio
Esta proteína también contiene señales de localización nuclear y motivos de señales de exportación nuclear.
La proteína BRCA1 humana consta de cuatro dominios proteicos principales; el dominio Znf C3HC4-RING, el dominio de serina BRCA1 y dos dominios BRCT. Estos dominios codifican aproximadamente el 27% de la proteína BRCA1. Hay seis isoformas conocidas de BRCA1, y las isoformas 1 y 2 comprenden 1863 aminoácidos cada una.
BRCA1 no está relacionado con BRCA2, es decir, no son homólogos ni parálogos.

Dominio anular de zinc
El motivo RING, un dedo de Zn que se encuentra en péptidos eucariotas, tiene entre 40 y 60 aminoácidos de longitud y consta de ocho residuos de unión a metales conservados, dos cuartetos de residuos de cisteína o histidina que coordinan dos átomos de zinc. Este motivo contiene una hoja beta antiparalela corta, dos bucles de unión de zinc y una hélice alfa central en un dominio pequeño. Este dominio RING interactúa con proteínas asociadas, incluida BARD1, que también contiene un motivo RING, para formar un heterodímero. El motivo BRCA1 RING está flanqueado por hélices alfa formadas por los residuos 8–22 y 81–96 de la proteína BRCA1. Interactúa con una región homóloga en BARD1 que también consta de un dedo ANILLO flanqueado por dos hélices alfa formadas a partir de los residuos 36–48 y 101–116. Estas cuatro hélices se combinan para formar una interfaz de heterodimerización y estabilizar el complejo heterodímero BRCA1-BARD1. Se logra una estabilización adicional mediante interacciones entre residuos adyacentes en la región flanqueante e interacciones hidrofóbicas. La interacción BARD1/BRCA1 se ve interrumpida por sustituciones de aminoácidos tumorigénicos en BRCA1, lo que implica que la formación de un complejo estable entre estas proteínas puede ser un aspecto esencial de la supresión del tumor BRCA1.
El dominio del anillo es un elemento importante de las ligasas de ubiquitina E3, que catalizan la ubiquitinación de proteínas. La ubiquitina es una pequeña proteína reguladora que se encuentra en todos los tejidos y que dirige las proteínas a compartimentos dentro de la célula. Los polipéptidos BRCA1, en particular las cadenas de poliubiquitina unidas a Lys-48, están dispersas por todo el núcleo celular en reposo, pero al comienzo de la replicación del ADN, se reúnen en grupos restringidos que también contienen BRCA2 y BARD1. Se cree que BARD1 participa en el reconocimiento y la unión de proteínas dianas para la ubiquitinación. Se adhiere a las proteínas y las etiqueta para su destrucción. La ubiquitinación se produce a través de la proteína de fusión BRCA1 y se suprime mediante la quelación del zinc. La actividad enzimática de la proteína de fusión depende del plegamiento adecuado del dominio del anillo.
Dominio del clúster de serina
El dominio del grupo de serina (SCD) BRCA1 abarca los aminoácidos 1280-1524. Una parte del dominio se encuentra en los exones 11 a 13. Se producen altas tasas de mutación en los exones 11 a 13. Los sitios de fosforilación informados de BRCA1 se concentran en la SCD, donde son fosforilados por quinasas ATM/ATR tanto in vitro como in vivo. ATM/ATR son quinasas activadas por daño al ADN. La mutación de los residuos de serina puede afectar la localización de BRCA1 en los sitios de daño del ADN y la función de respuesta al daño del ADN.
Dominios BRCT
El dominio BRCT de doble repetición de la proteína BRCA1 es una estructura alargada de aproximadamente 70 Å de largo y de 30 a 35 Å de ancho. Los dominios de 85 a 95 aminoácidos en BRCT se pueden encontrar como módulos individuales o como múltiples repeticiones en tándem que contienen dos dominios. Ambas posibilidades pueden ocurrir en una sola proteína en una variedad de conformaciones diferentes. La región BRCT C-terminal de la proteína BRCA1 es esencial para la reparación del ADN, la regulación de la transcripción y la función supresora de tumores. En BRCA1, los dominios BRCT repetidos en tándem duales están dispuestos de cabeza a cola en la estructura tridimensional, enterrando 1600 Å de área de superficie hidrófoba y accesible a solventes en la interfaz. Todo esto contribuye a la estructura de perilla en orificio apretada que compone la interfaz. Estos dominios homólogos interactúan para controlar las respuestas celulares al daño del ADN. Una mutación sin sentido en la interfaz de estas dos proteínas puede perturbar el ciclo celular, lo que resulta en un mayor riesgo de desarrollar cáncer.
Función y mecanismo
BRCA1 es parte de un complejo que repara las roturas de doble hebra del ADN. Las hebras de la doble hélice del ADN se rompen continuamente a medida que se dañan. A veces sólo se rompe una hebra, a veces ambas hebras se rompen simultáneamente. Los agentes de entrecruzamiento del ADN son una fuente importante de daño a los cromosomas/ADN. Las roturas de doble cadena se producen como intermediarios después de que se eliminan los enlaces cruzados y, de hecho, se ha identificado que las mutaciones bialélicas en BRCA1 son responsables de la anemia de Fanconi, grupo de complementación S (FA-S), una enfermedad genética asociada con hipersensibilidad a los agentes reticulantes del ADN. BRCA1 es parte de un complejo proteico que repara el ADN cuando ambas cadenas se rompen. Cuando esto sucede, es difícil para el mecanismo de reparación "saber" qué está sucediendo. cómo reemplazar la secuencia de ADN correcta y existen múltiples formas de intentar la reparación. El mecanismo de reparación de doble hebra en el que participa BRCA1 es la reparación dirigida por homología, donde las proteínas reparadoras copian la secuencia idéntica de la cromátida hermana intacta. FA-S es casi siempre una condición letal en el útero; Solo se han informado en la literatura unos pocos casos de mutaciones bialélicas de BRCA1 a pesar de las altas frecuencias de portadores en los Ashkenazim, y ninguno desde 2013.
En el núcleo de muchos tipos de células normales, la proteína BRCA1 interactúa con RAD51 durante la reparación de las roturas de la doble cadena del ADN. Estas rupturas pueden ser causadas por radiación natural u otras exposiciones, pero también ocurren cuando los cromosomas intercambian material genético (recombinación homóloga, por ejemplo, "entrecruzamiento" durante la meiosis). La proteína BRCA2, que tiene una función similar a la de BRCA1, también interactúa con la proteína RAD51. Al influir en la reparación del daño del ADN, estas tres proteínas desempeñan un papel en el mantenimiento de la estabilidad del genoma humano.
BRCA1 también participa en otro tipo de reparación del ADN, denominada reparación de errores de coincidencia. BRCA1 interactúa con la proteína reparadora de errores de coincidencia del ADN MSH2. Se informa que MSH2, MSH6, PARP y algunas otras proteínas involucradas en la reparación de una sola hebra están elevadas en tumores mamarios con deficiencia de BRCA1.
Una proteína llamada proteína que contiene valosina (VCP, también conocida como p97) desempeña un papel en el reclutamiento de BRCA1 en los sitios dañados del ADN. Después de la radiación ionizante, la VCP se recluta en las lesiones del ADN y coopera con la ubiquitina ligasa RNF8 para orquestar el ensamblaje de complejos de señalización para una reparación eficiente de la DSB. BRCA1 interactúa con VCP. BRCA1 también interactúa con c-Myc y otras proteínas que son fundamentales para mantener la estabilidad del genoma.
BRCA1 se une directamente al ADN, con mayor afinidad por las estructuras de ADN ramificadas. Esta capacidad de unirse al ADN contribuye a su capacidad para inhibir la actividad nucleasa del complejo MRN, así como la actividad nucleasa de Mre11 solo. Esto puede explicar el papel de BRCA1 para promover la reparación del ADN de menor fidelidad mediante la unión de extremos no homólogos (NHEJ). BRCA1 también se colocaliza con γ-H2AX (histona H2AX fosforilada en serina-139) en focos de reparación de roturas de doble cadena de ADN, lo que indica que puede desempeñar un papel en el reclutamiento de factores de reparación.
El formaldehído y el acetaldehído son fuentes ambientales comunes de enlaces cruzados de ADN que a menudo requieren reparaciones mediadas por vías que contienen BRCA1.
Esta función de reparación del ADN es esencial; los ratones con mutaciones de pérdida de función en ambos alelos BRCA1 no son viables y, en 2015, solo se sabía que dos adultos tenían mutaciones de pérdida de función en ambos alelos (que conducen a FA-S); ambos tenían problemas congénitos o de desarrollo y ambos tenían cáncer. Se suponía que uno de ellos había sobrevivido hasta la edad adulta porque una de las mutaciones de BRCA1 era hipomórfica.
Transcripción
Se demostró que BRCA1 se copurifica con la holoenzima ARN polimerasa II humana en extractos de HeLa, lo que implica que es un componente de la holoenzima. Sin embargo, investigaciones posteriores contradijeron esta suposición y mostraron en cambio que el complejo predominante que incluye BRCA1 en las células HeLa es un complejo de 2 megadaltones que contiene SWI/SNF. SWI/SNF es un complejo remodelador de la cromatina. Se demostró que la unión artificial de BRCA1 a la cromatina descondensa la heterocromatina, aunque el dominio de interacción SWI/SNF no era necesario para esta función. BRCA1 interactúa con la subunidad NELF-B (COBRA1) del complejo NELF.
Mutaciones y riesgo de cáncer
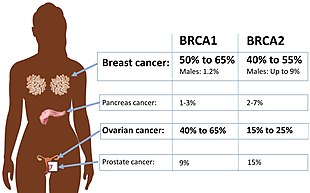
Ciertas variaciones del gen BRCA1 conducen a un mayor riesgo de cáncer de mama como parte de un síndrome de cáncer de mama-ovario hereditario. Los investigadores han identificado cientos de mutaciones en el gen BRCA1, muchas de las cuales están asociadas con un mayor riesgo de cáncer. Las mujeres con un gen BRCA1 o BRCA2 anormal tienen hasta un 80% de riesgo de desarrollar cáncer de mama a los 90 años; El mayor riesgo de desarrollar cáncer de ovario es aproximadamente del 55 % para las mujeres con mutaciones en BRCA1 y aproximadamente del 25 % para las mujeres con mutaciones en BRCA2.
Estas mutaciones pueden ser cambios en uno o un pequeño número de pares de bases de ADN (los componentes básicos del ADN) y pueden identificarse mediante PCR y secuenciación de ADN.
En algunos casos, se reorganizan grandes segmentos de ADN. Esos segmentos grandes, también llamados grandes reordenamientos, pueden ser una deleción o una duplicación de uno o varios exones del gen. Los métodos clásicos de detección de mutaciones (secuenciación) no pueden revelar este tipo de mutaciones. Se han propuesto otros métodos: PCR cuantitativa tradicional, amplificación de sonda dependiente de ligadura múltiple (MLPA) y PCR múltiple cuantitativa de fragmentos fluorescentes cortos (QMPSF). También se han propuesto recientemente métodos más nuevos: análisis de heterodúplex (HDA) mediante electroforesis multicapilar o también una matriz de oligonucleótidos dedicada basada en la hibridación genómica comparativa (array-CGH).
Algunos resultados sugieren que la hipermetilación del promotor BRCA1, que se ha informado en algunos cánceres, podría considerarse como un mecanismo inactivador de la expresión de BRCA1.
Un gen BRCA1 mutado generalmente produce una proteína que no funciona correctamente. Los investigadores creen que la proteína BRCA1 defectuosa no puede ayudar a reparar el daño del ADN que provoca mutaciones en otros genes. Estas mutaciones pueden acumularse y permitir que las células crezcan y se dividan sin control para formar un tumor. Por tanto, las mutaciones que inactivan BRCA1 conducen a una predisposición al cáncer.
ARNm BRCA1 3' La UTR puede estar unida por un miARN, el microARN Mir-17. Se ha sugerido que variaciones en este miARN junto con el microARN Mir-30 podrían conferir susceptibilidad al cáncer de mama.
Además del cáncer de mama, las mutaciones en el gen BRCA1 también aumentan el riesgo de cáncer de ovario y de próstata. Además, las lesiones precancerosas (displasia) dentro de las trompas de Falopio se han relacionado con mutaciones en el gen BRCA1. Las mutaciones patógenas en cualquier parte de una vía modelo que contenga BRCA1 y BRCA2 aumentan en gran medida los riesgos de un subconjunto de leucemias y linfomas.
Las mujeres que han heredado un gen BRCA1 o BRCA2 defectuoso tienen un riesgo muy elevado de desarrollar cáncer de mama y de ovario. Su riesgo de desarrollar cáncer de mama y/o de ovario es tan alto, y tan específico de esos cánceres, que muchas portadoras de mutaciones optan por someterse a una cirugía profiláctica. Ha habido muchas conjeturas para explicar esta especificidad tisular aparentemente sorprendente. Los principales determinantes de dónde se producen los cánceres hereditarios BRCA1/2 están relacionados con la especificidad tisular del patógeno del cáncer, el agente que causa la inflamación crónica o el carcinógeno. El tejido diana puede tener receptores para el patógeno, puede quedar expuesto selectivamente a un proceso inflamatorio o a un carcinógeno. Un déficit genómico innato en un gen supresor de tumores altera las respuestas normales y exacerba la susceptibilidad a enfermedades en órganos diana. Esta teoría también se ajusta a los datos de varios supresores de tumores más allá de BRCA1 o BRCA2. Una ventaja importante de este modelo es que sugiere que puede haber algunas opciones además de la cirugía profiláctica.
Como se mencionó anteriormente, la herencia bialélica y homocigótica del gen BRCA1 conduce a FA-S, que casi siempre es una condición embrionaria letal.
Baja expresión de BRCA1 en cánceres de mama y ovario
La expresión de BRCA1 está reducida o es indetectable en la mayoría de los cánceres de mama ductales de alto grado. Durante mucho tiempo se ha observado que la pérdida de la actividad de BRCA1, ya sea por mutaciones de la línea germinal o por una regulación negativa de la expresión genética, conduce a la formación de tumores en tejidos diana específicos. En particular, la disminución de la expresión de BRCA1 contribuye a la progresión del tumor de mama tanto esporádico como hereditario. La expresión reducida de BRCA1 es tumorigénica porque desempeña un papel importante en la reparación de daños en el ADN, especialmente roturas de doble hebra, mediante la vía potencialmente libre de errores de recombinación homóloga. Dado que las células que carecen de la proteína BRCA1 tienden a reparar los daños en el ADN mediante mecanismos alternativos más propensos a errores, la reducción o el silenciamiento de esta proteína genera mutaciones y reordenamientos cromosómicos graves que pueden conducir a la progresión al cáncer de mama.
De manera similar, la expresión de BRCA1 es baja en la mayoría (55%) de los cánceres de ovario epiteliales (COE) esporádicos, donde los COE son el tipo más común de cáncer de ovario y representan aproximadamente el 90% de los cánceres de ovario. En los carcinomas serosos de ovario, una subcategoría que constituye aproximadamente 2/3 de los COE, se produce una expresión baja de BRCA1 en más del 50% de los casos. Bowtell revisó la literatura que indica que la reparación deficiente de la recombinación homóloga causada por la deficiencia de BRCA1 es tumorigénica. En particular, esta deficiencia inicia una cascada de eventos moleculares que esculpen la evolución del cáncer de ovario seroso de alto grado y dictan su respuesta a la terapia. Se destacó especialmente que la deficiencia de BRCA1 podría ser la causa de la tumorigénesis, ya sea debido a una mutación de BRCA1 o cualquier otro evento que cause una deficiencia de la expresión de BRCA1.
Mutación de BRCA1 en cáncer de mama y ovario
Solo alrededor del 3 % al 8 % de todas las mujeres con cáncer de mama son portadoras de una mutación en BRCA1 o BRCA2. De manera similar, las mutaciones BRCA1 solo se observan en aproximadamente el 18 % de los cánceres de ovario (13 % mutaciones de la línea germinal y 5 % mutaciones somáticas).
Por lo tanto, si bien la expresión de BRCA1 es baja en la mayoría de estos cánceres, la mutación BRCA1 no es una causa importante de expresión reducida. Ciertos virus latentes, que se detectan con frecuencia en los tumores de cáncer de mama, pueden disminuir la expresión del gen BRCA1 y provocar el desarrollo de tumores de mama.
Hipermetilación del promotor BRCA1 en cáncer de mama y ovario
La hipermetilación del promotorBRCA1 estuvo presente en solo el 13% de los carcinomas de mama primarios no seleccionados. De manera similar, la hipermetilación del promotor BRCA1 estuvo presente en solo entre el 5% y el 15% de los casos de COE.
Por lo tanto, si bien la expresión de BRCA1 es baja en estos cánceres, la metilación del promotor BRCA1 es solo una causa menor de expresión reducida.
Represión de microARN de BRCA1 en cánceres de mama
Existe una serie de microARN específicos, cuando se sobreexpresan, que reducen directamente la expresión de proteínas reparadoras del ADN específicas (consulte la sección MicroARN Reparación del ADN y cáncer). En el caso del cáncer de mama, el microARN-182 (miR-182) se dirige específicamente al BRCA1.. Los cánceres de mama se pueden clasificar según el estado del receptor o la histología, con cáncer de mama triple negativo (15%-25% de los cánceres de mama), HER2+ (15%-30% de los cánceres de mama), ER+/PR+ (alrededor del 70% de los cánceres de mama). cánceres) y carcinoma lobulillar invasivo (alrededor del 5% al 10% del cáncer de mama invasivo). Se descubrió que los cuatro tipos de cáncer de mama tenían un aumento promedio de aproximadamente 100 veces en miR-182, en comparación con el tejido mamario normal. En líneas celulares de cáncer de mama, existe una correlación inversa entre los niveles de proteína BRCA1 y la expresión de miR-182. Por lo tanto, parece que gran parte de la reducción o ausencia de BRCA1 en los cánceres de mama ductales de alto grado puede deberse a una sobreexpresación de miR-182.
Además de miR-182, un par de microARN casi idénticos, miR-146a y miR-146b-5p, también reprimen la expresión de BRCA1. Estos dos microARN están sobreexpresados en tumores triple negativos y su sobreexpresión da como resultado la inactivación de BRCA1. Por lo tanto, miR-146a y/o miR-146b-5p también pueden contribuir a una expresión reducida de BRCA1 en estos cánceres de mama triple negativos.
Represión de microARN de BRCA1 en cánceres de ovario
Tanto en el carcinoma intraepitelial tubárico seroso (la lesión precursora del carcinoma de ovario seroso de alto grado (HG-SOC)) como en el propio HG-SOC, miR-182 se sobreexpresa en aproximadamente el 70 % de los casos. En las células con miR-182 sobreexpresado, BRCA1 permaneció bajo, incluso después de la exposición a radiación ionizante (que normalmente aumenta la expresión de BRCA1). Por lo tanto, gran parte del BRCA1 reducido o ausente en HG-SOC puede deberse a miR-182 sobreexpresado.
Otro microARN conocido por reducir la expresión de BRCA1 en células de cáncer de ovario es el miR-9. Entre 58 tumores de pacientes con cánceres de ovario serosos en estadio IIIC o IV (HG-SOG), se encontró una correlación inversa entre las expresiones de miR-9 y BRCA1, por lo que el aumento de miR-9 también puede contribuir a la expresión reducida de BRCA1 en estos cánceres de ovario.
La deficiencia de la expresión de BRCA1 es probablemente tumorigénica
El daño al ADN parece ser la principal causa subyacente del cáncer, y las deficiencias en la reparación del ADN parecen ser la base de muchas formas de cáncer. Si la reparación del ADN es deficiente, el daño del ADN tiende a acumularse. Tal daño excesivo en el ADN puede aumentar los errores mutacionales durante la replicación del ADN debido a la síntesis de translesiones propensa a errores. El exceso de daño en el ADN también puede aumentar las alteraciones epigenéticas debido a errores durante la reparación del ADN. Estas mutaciones y alteraciones epigenéticas pueden dar lugar al cáncer. La frecuente deficiencia de BRCA1 inducida por microARN en los cánceres de mama y de ovario probablemente contribuya a la progresión de esos cánceres.
Mutaciones de la línea germinal y efecto fundador
Todas las mutaciones de la línea germinal BRCA1 identificadas hasta la fecha se han heredado, lo que sugiere la posibilidad de que haya un gran "fundador" Efecto en el que una determinada mutación es común a un grupo de población bien definido y, en teoría, puede remontarse a un ancestro común. Dada la complejidad de la detección de mutaciones de BRCA1, estas mutaciones comunes pueden simplificar los métodos necesarios para la detección de mutaciones en determinadas poblaciones. El análisis de mutaciones que se producen con alta frecuencia también permite estudiar su expresión clínica. Se observan ejemplos de manifestaciones del efecto fundador entre los judíos asquenazíes. Se ha informado que tres mutaciones en BRCA1 representan la mayoría de los pacientes judíos asquenazíes con cáncer de mama y/o de ovario heredado relacionado con BRCA1: 185delAG, 188del11 y 5382insC en el gen BRCA1. De hecho, se ha demostrado que si una mujer judía no porta una mutación fundadora BRCA1 185delAG, BRCA1 5382insC, es muy poco probable que se encuentre una mutación BRCA1 diferente. En la Tabla 1 se dan ejemplos adicionales de mutaciones fundadoras en BRCA1 (principalmente derivados de).
| Población o subgrupo | BRCA1 mutation(s) | Referencias |
|---|---|---|
| Afroamericanos | 943ins10, M1775R | |
| Afrikaners | E881X, 1374delC | |
| Ashkenazi Judío | 185delAG, 188del11, 5382insC | |
| Austrianos | 2795delA, C61G, 5382insC, Q1806stop | |
| Belga | 2804delAA, IVS5+3A título G | |
| Dutch | Exon 2 eliminación, exon 13 eliminación, 2804delAA | |
| Finns | 3745delT, IVS11-2A título G | |
| Francés | 3600del11, G1710X | |
| Francés canadienses | C4446T | |
| Germans | 5382insC, 4184del4 | |
| Griegos | 5382insC | |
| Húngaros | 300T títuloG, 5382insC, 185delAG | |
| Italianos | 5083del19 | |
| japonés | L63X, Q934X | |
| Norteamericanos nativos | 1510insG, 1506A confianza G | |
| Northern Irish | 2800delAA | |
| Noruegos | 816delGT, 1135insA, 1675delA, 3347delAG | |
| Pakistanis | 2080insA, 3889delAG, 4184del4, 4284delAG, IVS14-1A confiar G | |
| Poles | 300T títuloG, 5382insC, C61G, 4153delA | |
| Rusos | 5382insC, 4153delA | |
| Scots | 2800delAA | |
| Españoles | R71G | |
| Suecos | Q563X, 3171ins5, 1201del11, 2594delC |
Fertilidad femenina
A medida que las mujeres envejecen, el rendimiento reproductivo disminuye, lo que lleva a la menopausia. Esta disminución está ligada a una reducción en el número de folículos ováricos. Aunque alrededor de 1 millón de ovocitos están presentes al nacer en el ovario humano, sólo alrededor de 500 (alrededor del 0,05%) de ellos ovulan. La disminución de la reserva ovárica parece ocurrir a un ritmo que aumenta constantemente con la edad y conduce a un agotamiento casi completo de la reserva alrededor de los 52 años. A medida que la reserva ovárica y la fertilidad disminuyen con la edad, también hay un aumento paralelo en los fracasos del embarazo y la meiótica. errores, que resultan en concepciones cromosómicamente anormales.
Las mujeres con una mutación BRCA1 en la línea germinal parecen tener una reserva de ovocitos disminuida y una menor fertilidad en comparación con las mujeres que envejecen normalmente. Además, las mujeres con una mutación BRCA1 heredada experimentan la menopausia prematuramente. Dado que BRCA1 es una proteína clave para la reparación del ADN, estos hallazgos sugieren que los daños naturales en el ADN de los ovocitos se reparan de manera menos eficiente en mujeres con un defecto BRCA1, y que esta ineficiencia en la reparación conduce a una falla reproductiva temprana.
Como se señaló anteriormente, la proteína BRCA1 desempeña un papel clave en la reparación recombinacional homóloga. Este es el único proceso celular conocido que puede reparar con precisión las roturas de la doble cadena del ADN. Las roturas de la doble cadena del ADN se acumulan con la edad en humanos y ratones en los folículos primordiales. Los folículos primordiales contienen ovocitos que se encuentran en una etapa intermedia (profase I) de la meiosis. La meiosis es el proceso general en los organismos eucariotas mediante el cual se forman las células germinales, y probablemente sea una adaptación para eliminar daños en el ADN, especialmente roturas de doble cadena, del ADN de la línea germinal. (Ver también artículo Meiosis). La reparación recombinante homóloga que emplea BRCA1 se promueve especialmente durante la meiosis. Se descubrió que la expresión de cuatro genes clave necesarios para la reparación recombinacional homóloga de roturas de doble cadena del ADN (BRCA1, MRE11, RAD51 y ATM) disminuye con la edad en los ovocitos de humanos y ratones, lo que lleva a la hipótesis de que la reparación de roturas de doble cadena del ADN es necesaria para el mantenimiento de la reserva de ovocitos y que una disminución en la eficiencia de la reparación con la edad desempeña un papel en el envejecimiento ovárico.
Quimioterapia contra el cáncer
El cáncer de pulmón de células no pequeñas (CPCNP) es la principal causa de muerte por cáncer en todo el mundo. En el momento del diagnóstico, casi el 70% de las personas con NSCLC tienen enfermedad localmente avanzada o metastásica. Las personas con NSCLC suelen ser tratadas con compuestos terapéuticos de platino (por ejemplo, cisplatino, carboplatino u oxaliplatino) que provocan enlaces cruzados entre cadenas en el ADN. Entre las personas con NSCLC, la baja expresión de BRCA1 en el tumor primario se correlacionó con una mejor supervivencia después de la quimioterapia con platino. Esta correlación implica que un nivel bajo de BRCA1 en el cáncer, y el consiguiente bajo nivel de reparación del ADN, provoca la vulnerabilidad del cáncer al tratamiento con agentes de entrecruzamiento del ADN. Un nivel alto de BRCA1 puede proteger las células cancerosas al actuar en una vía que elimina los daños en el ADN introducidos por los medicamentos que contienen platino. Por tanto, el nivel de expresión de BRCA1 es una herramienta potencialmente importante para adaptar la quimioterapia en el tratamiento del cáncer de pulmón.
El nivel de expresión de BRCA1 también es relevante para el tratamiento del cáncer de ovario. Las pacientes con cáncer de ovario esporádico que fueron tratadas con medicamentos que contienen platino tuvieron una mediana de supervivencia más larga si su expresión de BRCA1 era baja en comparación con las pacientes con una expresión de BRCA1 más alta (46 en comparación con 33 meses)..
Patentes, observancia, litigios y controversias
La Universidad de Utah, el Instituto Nacional de Ciencias de la Salud Ambiental (NIEHS) y Myriad presentaron una solicitud de patente para el gen BRCA1 aislado y las mutaciones promotoras del cáncer mencionadas anteriormente, así como métodos para diagnosticar la probabilidad de contraer cáncer de mama. Genética en 1994; Durante el año siguiente, Myriad (en colaboración con investigadores de Endo Recherche, Inc., HSC Research & Development Limited Partnership y la Universidad de Pensilvania), aisló y secuenció el gen BRCA2 e identificó mutaciones clave, y se obtuvo la primera patente de BRCA2. presentada en los EE. UU. por Myriad y otras instituciones en 1995. Myriad es el licenciatario exclusivo de estas patentes y las ha aplicado en los EE. UU. frente a los laboratorios de diagnóstico clínico. Este modelo de negocio llevó de que Myriad fuera una startup en 1994 a ser una empresa que cotiza en bolsa con 1200 empleados y alrededor de 500 millones de dólares en ingresos anuales en 2012; también generó controversia sobre los altos precios y la imposibilidad de obtener segundas opiniones de otros laboratorios de diagnóstico, lo que a su vez llevó a la histórica demanda Association for Molecular Pathology v. Myriad Genetics. Las patentes comenzaron a caducar en 2014.
Según un artículo publicado en la revista Genetic Medicine, en 2010, "La historia de las patentes fuera de los Estados Unidos es más complicada... Por ejemplo, se han obtenido patentes pero las patentes están siendo ignoradas por los sistemas de salud provinciales de Canadá. En Australia y el Reino Unido, el licenciatario de Myriad permitió su uso en los sistemas sanitarios, pero anunció un cambio de planes en agosto de 2008. Sólo se ha patentado una mutación en la única patente europea de Myriad, aunque algunas patentes siguen vigentes. bajo revisión de un procedimiento de oposición. De hecho, Estados Unidos es la única jurisdicción donde la sólida posición de patentes de Myriad le ha conferido el estatus de proveedor único. Peter Meldrum, director ejecutivo de Myriad Genetics, ha reconocido que Myriad tiene "otras ventajas competitivas que pueden hacer que dicha aplicación [de patentes] sea innecesaria" en Europa.
Como ocurre con cualquier gen, encontrar una variación en BRCA1 no es difícil. El valor real proviene de comprender cuáles son las consecuencias clínicas de cualquier variante en particular. Myriad tiene una gran base de datos patentada de tales correlaciones genotipo-fenotipo. En respuesta, se están desarrollando bases de datos paralelas de código abierto.
Las decisiones legales relacionadas con las patentes BRCA1 y BRCA2 afectarán el campo de las pruebas genéticas en general. Un artículo de junio de 2013, en Association for Molecular Pathology v. Myriad Genetics (No. 12-398), citó el fallo unánime de la Corte Suprema de EE. UU. de que "un ADN de origen natural "El segmento es un producto de la naturaleza y no puede ser patentado simplemente porque ha sido aislado", dijo. invalidando las patentes de Myriad sobre los genes BRCA1 y BRCA2. Sin embargo, el Tribunal también sostuvo que la manipulación de un gen para crear algo que no se encuentra en la naturaleza aún podría ser elegible para protección por patente. El Tribunal Federal de Australia llegó a la conclusión opuesta, confirmando la validez de una patente australiana de Myriad Genetics sobre el gen BRCA1 en febrero de 2013. El Tribunal Federal también rechazó una apelación en septiembre de 2014. Yvonne D'Arcy ganó su caso contra EE.UU. Myriad Genetics, empresa de biotecnología con sede en el Tribunal Superior de Australia. En su decisión unánime del 7 de octubre de 2015, el "tribunal superior determinó que un ácido nucleico aislado, que codifica una proteína BRCA1, con variaciones específicas de la norma que son indicativas de susceptibilidad al cáncer de mama y de ovario no era un 'invención patentable.'"
Interacciones
Se ha demostrado que BRCA1 interactúa con las siguientes proteínas:
- ABL1
- AKT1
- AR
- ATR
- ATM
- ATF1
- BACH1
- BARD1
- BRCA2
- BRCC3
- BRE
- BRIP1
- C-jun
- CHEK2
- CLSPN
- COBRA1
- CREBBP
- CSNK2B
- CSTF2
- CDK2
- DHX9
- ELK4
- EP300
- ESR1
- FANCA
- FANCD2
- FHL2
- H2AFX
- JUNB
- JunD
- LMO4
- MAP3K3
- MED1
- MED17
- MED21
- MED24
- MRE11A
- MSH2
- MSH3
- MSH6
- Myc
- NBN
- NMI
- NPM1
- NCOA2
- NUFIP1
- P53
- PALB2
- POLR2A
- PPP1CA
- Rad50
- RAD51
- RBBP4
- RBBP7
- RBBP8
- RELA
- RB1
- RBL1
- RBL2
- RPL31
- SMARCA4
- SMARCB1
- STAT1
- TOPBP1
- UBE2D1
- USF2
- VCP
- XIST
- ZNF350
Contenido relacionado
Misti
Alianza Quíntuple
Una carta abierta a los aficionados