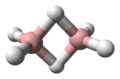Boranes
Boranos es el nombre que reciben los compuestos de fórmula BxHy y los aniones relacionados. Se conocen muchos de estos boranos. Los más comunes son los que tienen de 1 a 12 átomos de boro. Aunque tienen pocas aplicaciones prácticas, los boranos exhiben estructuras y enlaces que difieren mucho de los patrones observados en los hidrocarburos. Híbridos de boranos e hidrocarburos, los carboranos también están bien desarrollados.
Historia
El desarrollo de la química de los boranos dio lugar a innovaciones en los métodos sintéticos, así como en la estructura y la unión. Primero, se requerían nuevas técnicas sintéticas para manejar el diborano y muchos de sus derivados, que son tanto pirofóricos como volátiles. Alfred Stock inventó la línea de vacío de vidrio para este propósito.
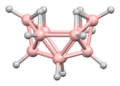
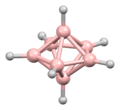
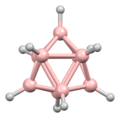
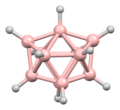
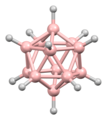
La estructura del diborano se predijo correctamente en 1943, muchos años después de su descubrimiento. Las estructuras de los grupos de hidruro de boro se determinaron a partir de 1948 con la caracterización del decaborano. William Lipscomb recibió el premio Nobel de Química en 1976 por esta y muchas investigaciones cristalográficas posteriores. Estas investigaciones revelaron la prevalencia de estructuras deltaédricas, es decir, redes de matrices triangulares de centros BH.
La unión de los grupos marcó el comienzo de la teoría del par de electrones del esqueleto poliédrico y las reglas de Wade, que se pueden usar para predecir las estructuras de los boranos. Se encontró que estas reglas describen estructuras de muchos compuestos de grupos.
El interés en los boranos aumentó durante la Segunda Guerra Mundial debido al potencial del borohidruro de uranio para enriquecer los isótopos de uranio y como fuente de hidrógeno para inflar globos meteorológicos. En EE. UU., un equipo dirigido por Schlesinger desarrolló la química básica de los hidruros de boro aniónicos y los hidruros de aluminio relacionados. El trabajo de Schlesinger sentó las bases para una gran cantidad de reactivos de hidruro de boro para la síntesis orgánica, la mayoría de los cuales fueron desarrollados por su alumno Herbert C. Brown. Los reactivos a base de borano ahora se usan ampliamente en síntesis orgánica. Brown recibió el premio Nobel de Química en 1979 por este trabajo.
Fórmula química y convenciones de nomenclatura
Los grupos de borano se clasifican de la siguiente manera, donde n es el número de átomos de boro en un solo grupo:
| Tipo de grupo | Fórmula química | Ejemplo | Notas |
|---|---|---|---|
| hipercloso- | BnHn | Inestable; derivados son conocidos | |
| closo- | BnHn2 - 2 | Caesium dodecaborate | |
| Nido- | BnHn+4 | pentaborane(9) | |
| arachno- | BnHn+6 | pentaborane(11) | |
| hypho- | BnHn+8 | Sólo se encuentra en los adductos |
Las normas de la Unión Internacional de Química Pura y Aplicada para la denominación sistemática se basan en un prefijo que indica una clase de compuesto, seguido del número de átomos de boro y, finalmente, el número de átomos de hidrógeno entre paréntesis. Se pueden omitir varios detalles si no hay ambigüedad sobre el significado, por ejemplo, si solo es posible un tipo estructural. A continuación se muestran algunos ejemplos de las estructuras.
La denominación de los aniones se ilustra mediante
- octahidridopentaborate, B5H8−
Primero se especifica el recuento de hidrógeno, seguido del recuento de boro. El sufijo -ate se aplica con aniones. El valor de la carga iónica se incluye en la fórmula química pero no como parte del nombre sistemático.
Enlace en boranos
Los boranos son compuestos con enlaces no clásicos, es decir, no hay suficientes electrones para formar enlaces de dos centros y dos electrones entre todos los pares de átomos adyacentes en la molécula. William Lipscomb formuló una descripción del enlace en los boranos más grandes. Involucró:
- Puentes de hidrógeno B-H-B de 3-centro
- Bonos B-B-B 3-centro 2-electron
- Bonos 2-centro 2-electronos (en B-B, B-H y BH2)
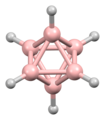
La metodología de Lipscomb ha sido reemplazada en gran medida por un enfoque de orbitales moleculares. Esto permite ampliar el concepto de unión multicéntrica. Por ejemplo, en el ion icosaédrico [B12H12]2-, el totalmente simétrico (Ag simetría) el orbital molecular se distribuye por igual entre los 12 átomos de boro. Las reglas de Wade proporcionan un método poderoso que se puede utilizar para racionalizar las estructuras en términos del número de átomos y la conectividad entre ellos.
Boranos multirracimo
Aunque son relativamente raros, se han caracterizado varios boranos de múltiples grupos. Por ejemplo, la reacción de un grupo de borano con B2H6 (como fuente de BH3) puede conducir a la formación de un conjuncto-especies de borano en las que las subunidades del grupo de borano se unen compartiendo átomos de boro.
- B6H10 + (BH3) → B7H11 + H2
- B7H11 + B6H10 → B13H19 + H2
Otros conjuncto-boranos, en los que las subunidades están unidas por un enlace B-B, pueden fabricarse mediante irradiación ultravioleta de nido-boranos. Algunos conjuntos-boranos acoplados B-B se pueden producir usando PtBr2 como catalizador.
Al igual que las Reglas de Wade, se ha desarrollado un esquema de conteo de electrones para predecir o racionalizar boranos multicluster.
| Prefijo | Significado | Ejemplo |
|---|---|---|
| klado- | clusters ramificados | |
| conjuncto- | grupos unidos | |
| megalo- | múltiples grupos unidos |
Reactividad de los boranos
El borano más bajo, BH3 existe solo de forma transitoria, dimerizándose instantáneamente para formar diborano, B2H6. Sus aductos BH3·THF y BH3·DMSO son suficientemente estables para ser utilizados en reacciones de hidroboración. Con reminiscencias del comportamiento del diborano, algunos boranos inferiores reaccionan con el aire de forma muy exotérmica, incluso explosiva. Por el contrario, muchos grupos closo-borano, como B12H122−, no reaccionan con aire.
Los grupos de hidruro de boro son tan diversos que no es posible hacer generalizaciones sobre sus reacciones.
Comportamiento ácido/base de Lewis
algunos funcionan como donantes de electrones debido al carácter básico relativo de los grupos terminales B-H. Los boranos pueden funcionar como ligandos en compuestos de coordinación. Se han encontrado hapticidades de η1 a η6, con donación de electrones que involucra átomos H puente o donación de enlaces B-B. Por ejemplo, nido-B6H10 puede reemplazar al eteno en la sal de Zeise para producir Fe(η2-B6H10)(CO)4.
También pueden actuar como ácidos de Lewis, con apertura concomitante del racimo. Un ejemplo que involucra trimetilfosfina:
- B5H9 + 2 PMe3 → B5H9(PMe3)2
Comportamiento ácido/base de Brønsted
Algunos boranos superiores, especialmente aquellos con átomos de hidrógeno puente, se pueden desprotonar con una base fuerte. Un ejemplo:
- B5H9 + NaH → Na(B)5H8) + H2
La acidez aumenta con el tamaño del borano. B10H14 tiene un valor pK de 2,7.
- B5H9 b6H10 b10H14 b16H20 b18H22
Reacciones de Aufbau
Para el químico del hidruro de boro, una de las reacciones más importantes es el proceso de formación mediante el cual los grupos de hidruro de boro más pequeños agregan borano para formar grupos más grandes. Este enfoque también se aplica a la síntesis de metallaboranos,
Hidroboración
Al igual que el comportamiento del diborano y sus aductos, los boranos superiores participan en la hidroboración. Cuando los hidruros de boro agregan un alquino, el carbono se incorpora al grupo, produciendo carboranos, p. C2B10H12.
Aplicaciones
El diborano y sus aductos monoméricos borano-tetrahidrofurano o borano-dimetilsulfuro son reactivos útiles. A menudo se utilizan para hidroboración en síntesis orgánica. Algunos boranos superiores, incluido el anti-B18H22, han demostrado propiedades luminiscentes. Se han comercializado algunos derivados de cobalto de carboranos para secuestrar 137C de desechos radiactivos.
Usos aspiracionales
Debido a que los grupos de hidruro de boro absorben fácilmente los neutrones, sus derivados a menudo se han investigado para aplicaciones en la terapia de captura de neutrones del cáncer. Un compuesto favorito es el Na2[B12H11(SH)]. Aprovecha el hecho de que 10B tiene una sección transversal de captura de neutrones muy alta, por lo que la irradiación de neutrones es altamente selectiva para la región donde reside el compuesto.
- 10B + 1n →11B*) → 4Él + 7Li + γ (2.4 Mev)
Los boranos tienen una alta energía específica de combustión en comparación con los hidrocarburos, lo que los hace potencialmente atractivos como combustibles. En la década de 1950 se llevó a cabo una intensa investigación sobre su uso como aditivos de combustible para aviones, pero el esfuerzo no condujo a resultados prácticos.
Contenido relacionado
Cetona de poliéter éter
Hielo XII
Pisco