Bomba de sodio-potasio
La bomba de sodio-potasio (adenosina trifosfatasa de sodio-potasio, también conocida como Na⁺/K⁺-ATPasa, bomba de Na⁺/K⁺, o Sodio-Potasio ATPasa) es una enzima (una ATPasa transmembrana electrogénica) que se encuentra en la membrana de todas las células animales. Realiza varias funciones en la fisiología celular.
La enzima Na⁺/K⁺-ATPasa está activa (es decir, utiliza energía del ATP). Por cada molécula de ATP que utiliza la bomba, se exportan tres iones de sodio y se importan dos iones de potasio. Por lo tanto, hay una exportación neta de una sola carga positiva por ciclo de bombeo.
La bomba de sodio-potasio fue descubierta en 1957 por el científico danés Jens Christian Skou, quien recibió el Premio Nobel por su trabajo en 1997. Su descubrimiento marcó un importante paso adelante en la comprensión de cómo los iones entran y salen de y tiene un significado particular para las células excitables, como las células nerviosas, que dependen de esta bomba para responder a los estímulos y transmitir impulsos.
Todos los mamíferos tienen cuatro subtipos o isoformas diferentes de bombas de sodio. Cada uno tiene propiedades y patrones de expresión tisular únicos. Esta enzima pertenece a la familia de las ATPasas de tipo P.
Función
La Na⁺/K⁺-ATPasa ayuda a mantener el potencial de reposo, afecta el transporte y regula el volumen celular. También funciona como un transductor/integrador de señales para regular la vía MAPK, las especies reactivas de oxígeno (ROS), así como el calcio intracelular. De hecho, todas las células gastan una gran fracción del ATP que producen (típicamente 30% y hasta 70% en células nerviosas) para mantener su Na y K citosólico requeridos concentraciones Para las neuronas, la Na⁺/K⁺-ATPasa puede ser responsable de hasta 3/4 del gasto de energía de la célula. En muchos tipos de tejido, el consumo de ATP por parte de las Na⁺/K⁺-ATPasas se ha relacionado con la glucólisis. Esto se descubrió por primera vez en los glóbulos rojos (Schrier, 1966), pero luego se evidenció en las células renales, los músculos lisos que rodean los vasos sanguíneos y las células de Purkinje cardíacas. Recientemente, también se ha demostrado que la glucólisis es de particular importancia para las Na⁺/K⁺-ATPasas en los músculos esqueléticos, donde la inhibición de la descomposición del glucógeno (un sustrato para la glucólisis) conduce a una reducción de la actividad de la Na⁺/K⁺-ATPasa y a una menor producción de fuerza..
Potencial de reposo
Para mantener el potencial de la membrana celular, las células mantienen una baja concentración de iones de sodio y altos niveles de iones de potasio dentro de la célula (intracelular). El mecanismo de bomba de sodio-potasio saca 3 iones de sodio y mueve 2 iones de potasio, por lo tanto, en total, elimina un portador de carga positiva del espacio intracelular (ver Mecanismo para más detalles). Además, hay un canal de cortocircuito (es decir, un canal de iones altamente permeable al K) para el potasio en la membrana, por lo que el voltaje a través de la membrana plasmática está cerca del potencial de Nernst del potasio.
Potencial de inversión
Incluso si los iones K⁺ y Na⁺ tienen la misma carga, aún pueden tener potenciales de equilibrio muy diferentes para las concentraciones externas e internas. La bomba de sodio-potasio se mueve hacia un estado de no equilibrio con las concentraciones relativas de Na⁺ y K⁺ tanto dentro como fuera de la célula. Por ejemplo, la concentración de K⁺ en el citosol es de 100 mM, mientras que la concentración de Na⁺ es de 10 mM. Por otro lado, en el espacio extracelular, la concentración de K⁺ es de 5 mM, mientras que la concentración de Na⁺ es de 150 mM.
Transporte
La exportación de iones de sodio desde la célula proporciona la fuerza motriz para varios transportadores activos secundarios, como las proteínas transportadoras de membrana, que importan glucosa, aminoácidos y otros nutrientes a la célula mediante el uso del gradiente de iones de sodio.
Otra tarea importante de la bomba de Na⁺-K⁺ es proporcionar un gradiente de Na⁺ que es utilizado por ciertos procesos portadores. En el intestino, por ejemplo, el sodio se transporta fuera de la célula de reabsorción en el lado de la sangre (líquido intersticial) a través de la bomba de Na⁺-K⁺, mientras que en el lado de reabsorción (luminal), el simportador de Na⁺-glucosa usa el creó un gradiente de Na⁺ como fuente de energía para importar tanto Na⁺ como glucosa, que es mucho más eficiente que la simple difusión. Procesos similares se localizan en el sistema tubular renal.
Control del volumen de la celda
La falla de las bombas de Na⁺-K⁺ puede provocar la inflamación de la célula. La osmolaridad de una célula es la suma de las concentraciones de varias especies de iones y muchas proteínas y otros compuestos orgánicos dentro de la célula. Cuando esto es más alto que la osmolaridad fuera de la celda, el agua fluye hacia la celda a través de la ósmosis. Esto puede hacer que la célula se hinche y se lice. La bomba de Na⁺-K⁺ ayuda a mantener las concentraciones adecuadas de iones. Además, cuando la célula comienza a hincharse, esto activa automáticamente la bomba de Na⁺-K⁺ porque cambia las concentraciones internas de Na⁺-K⁺ a las que la bomba es sensible.
Funcionando como transductor de señal
Durante la última década, muchos laboratorios independientes han demostrado que, además del transporte de iones clásico, esta proteína de membrana también puede transmitir señales extracelulares de unión de uabaína a la célula a través de la regulación de la fosforilación de proteína tirosina. Por ejemplo, un estudio investigó la función de Na+/K+ ATPasa en el músculo del pie y el hepatopáncreas en el caracol terrestre O.Lactea comparando la estados activos y estivales. Llegaron a la conclusión de que la fosforilación reversible puede controlar los mismos medios de coordinación del uso de ATP por esta bomba de iones con las tasas de generación de ATP por vías catabólicas en la estivación de O. Láctea. Las señales aguas abajo a través de los eventos de fosforilación de proteínas desencadenados por ouabaína incluyen la activación de las cascadas de señales de la proteína quinasa activada por mitógenos (MAPK), la producción de especies reactivas de oxígeno (ROS) mitocondriales, así como la activación de la fosfolipasa C (PLC) y trifosfato de inositol (IP3) receptor (IP3R) en diferentes compartimentos intracelulares.
Las interacciones proteína-proteína juegan un papel muy importante en la transducción de señales mediada por la bomba de Na⁺-K⁺. Por ejemplo, la bomba Na⁺-K⁺ interactúa directamente con Src, una tirosina quinasa no receptora, para formar un complejo receptor de señalización. Src es inicialmente inhibido por la bomba de Na⁺-K⁺. Sin embargo, tras la unión subsiguiente de ouabaína, el dominio de la quinasa Src se libera y luego se activa. En base a este escenario, NaKtide, un inhibidor peptídico de Src derivado de la bomba Na⁺-K⁺, se desarrolló como una transducción de señal mediada por la bomba funcional de ouabaína-Na⁺-K⁺. La bomba Na⁺-K⁺ también interactúa con ankyrin, IP3R, PI3K, PLCgamma1 y cofilin.
Control de estados de actividad neuronal
Se ha demostrado que la bomba de Na⁺-K⁺ controla y establece el modo de actividad intrínseco de las neuronas de Purkinje del cerebelo, las células accesorias del bulbo olfatorio mitral y probablemente otros tipos de neuronas. Esto sugiere que la bomba podría no ser simplemente un sistema homeostático de "limpieza" molécula para gradientes iónicos, pero podría ser un elemento de cálculo en el cerebelo y el cerebro. De hecho, una mutación en la bomba Na⁺-K⁺ provoca distonía-parkinsonismo de inicio rápido, que tiene síntomas que indican que es una patología de la computación cerebelosa. Además, un bloque de ouabaína de las bombas de Na⁺-K⁺ en el cerebelo de un ratón vivo hace que presente ataxia y distonía. El alcohol inhibe las bombas de sodio y potasio en el cerebelo y es probable que así corrompa la computación cerebelosa y la coordinación corporal. Se ha demostrado que la distribución de la bomba de Na⁺-K⁺ en los axones mielinizados en el cerebro humano está a lo largo del axolema internodal, y no dentro del axolema nodal como se pensaba anteriormente. La disfunción de la bomba de Na⁺-K⁺ se ha relacionado con varias enfermedades, incluidas la epilepsia y las malformaciones cerebrales.
Mecanismo
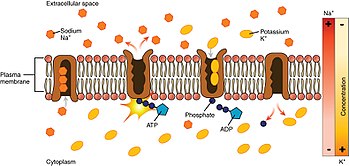
Mirando el proceso a partir del interior de la célula:
- La bomba tiene una afinidad superior para iones Na+ que iones K+, por lo tanto después de la unión ATP, se une 3 iones intracelulares Na+.
- ATP es hidrolizado, lo que conduce a la fosforilación de la bomba en un residuo aspartado altamente conservado y posterior liberación de ADP. Este proceso conduce a un cambio conformacional en la bomba.
- El cambio conformacional expone los iones Na+ a la región extracelular. La forma fosforilada de la bomba tiene una baja afinidad para los iones Na+, por lo que son liberados; por contraste tiene alta afinidad para los iones K+.
- La bomba une 2 iones extracelulares K+, que induce desfosforilación de la bomba, revertiéndola a su estado conformacional anterior, liberando así los iones K+ en la célula.
- La forma unfosforilada de la bomba tiene una afinidad superior para iones Na+. ATP se une, y el proceso comienza de nuevo.
Regulación
Endógeno
La Na⁺/K⁺-ATPasa está regulada al alza por el AMPc. Por lo tanto, las sustancias que causan un aumento en cAMP regulan al alza la Na⁺/K⁺-ATPasa. Estos incluyen los ligandos de los GPCR acoplados a Gs. Por el contrario, las sustancias que causan una disminución de cAMP regulan a la baja la Na⁺/K⁺-ATPasa. Estos incluyen los ligandos de los GPCR acoplados a Gi. Nota: Los primeros estudios indicaron el efecto opuesto, pero luego se descubrió que eran inexactos debido a factores de complicación adicionales.
La Na⁺/K⁺-ATPasa está regulada negativamente de forma endógena por el pirofosfato de inositol 5-InsP7, una molécula de señalización intracelular generada por IP6K1, que alivia un dominio autoinhibidor de PI3K p85α para impulsar la endocitosis y la degradación.
La Na⁺/K⁺-ATPasa también está regulada por fosforilación reversible. La investigación ha demostrado que en animales en estivación, la Na⁺/K⁺-ATPasa está en forma fosforilada y de baja actividad. La desfosforilación de Na⁺/K⁺-ATPasa puede recuperarla a la forma de alta actividad.
Exógena
(feminine)La Na⁺/K⁺-ATPasa se puede modificar farmacológicamente mediante la administración de fármacos de forma exógena. Su expresión también se puede modificar a través de hormonas como la triyodotironina, una hormona tiroidea.
Por ejemplo, la Na⁺/K⁺-ATPasa que se encuentra en la membrana de las células cardíacas es un objetivo importante de los glucósidos cardíacos (por ejemplo, la digoxina y la uabaína), fármacos inotrópicos que se utilizan para mejorar el rendimiento cardíaco aumentando su fuerza de contracción.
La contracción muscular depende de una concentración de Ca²⁺ intracelular de 100 a 10 000 veces mayor que en reposo, que es causada por la liberación de Ca²⁺ de las células musculares' retículo sarcoplásmico. Inmediatamente después de la contracción muscular, el Ca²⁺ intracelular vuelve rápidamente a su concentración normal mediante una enzima transportadora en la membrana plasmática y una bomba de calcio en el retículo sarcoplásmico, lo que hace que el músculo se relaje.
Según la hipótesis de Blaustein, esta enzima portadora (intercambiador Na⁺/Ca²⁺, NCX) utiliza el gradiente de Na generado por la bomba Na⁺-K⁺ para eliminar el Ca²⁺ del espacio intracelular, lo que ralentiza el Na La bomba ⁺-K⁺ da como resultado un nivel de Ca²⁺ permanentemente elevado en el músculo, lo que puede ser el mecanismo del efecto inotrópico a largo plazo de los glucósidos cardíacos como la digoxina. El problema con esta hipótesis es que a concentraciones farmacológicas de digitálicos, menos del 5 % de las moléculas de Na/K-ATPasa, específicamente la isoforma α2 en el corazón y el músculo liso arterial (Kd = 32 nM) -- se inhiben, no lo suficiente como para afectar la concentración intracelular de Na⁺. Sin embargo, además de la población de Na/K-ATPasa en la membrana plasmática —responsable del transporte de iones—, existe otra población en las caveolas que actúa como receptor digitálico y estimula el receptor EGF.
Regulación farmacológica
En ciertas condiciones, como en el caso de una enfermedad cardíaca, es posible que sea necesario inhibir la Na⁺/K⁺-ATPasa por medios farmacológicos. Un inhibidor comúnmente utilizado en el tratamiento de enfermedades cardíacas sería la digoxina, que esencialmente se une "a la parte extracelular de la enzima, es decir, que se une al potasio, cuando está en un estado fosforilado, para transferir potasio dentro de la célula". Después de que ocurre esta unión esencial, ocurre una desfosforilación de la subunidad alfa que reduce el efecto de la enfermedad cardíaca. Es a través de la inhibición de la Na⁺/K⁺-ATPasa que los niveles de sodio comenzarán a aumentar dentro de la célula, lo que finalmente aumenta la concentración de calcio intracelular a través del intercambiador de sodio-calcio. Esta mayor presencia de calcio es lo que permite aumentar la fuerza de contracción. En el caso de pacientes en los que el corazón no está bombeando lo suficientemente fuerte para proporcionar lo que necesita el cuerpo, este enfoque permite superar temporalmente este problema.
Descubrimiento
La Na⁺/K⁺-ATPasa fue descubierta por Jens Christian Skou en 1957 mientras trabajaba como profesor asistente en el Departamento de Fisiología de la Universidad de Aarhus, Dinamarca. Publicó su obra ese año.
En 1997, recibió la mitad del Premio Nobel de Química "por el primer descubrimiento de una enzima transportadora de iones, Na⁺,K⁺-ATPasa."
Genes
- Alpha: ATP1A1ATP1A1, ATP1A2ATP1A2, ATP1A3ATP1A3, ATP1A4ATP1A4. #1 predomina en el riñón. #2 también se conoce como "alpha(+)"
- Beta: ATP1B1ATP1B1, ATP1B2, ATP1B3ATP1B3, ATP1B4
En insectos
Los estudios de mutagénesis realizados por Susanne Dobler han identificado las horquillas M3-M4 y M5-M6 conservadas. En la posición 312, los insectos que se alimentaban de especies Apocynum diferían de la Na⁺/K⁺-ATPasa de mamíferos a través del cambio de ácido glutámico a ácido aspártico. Por lo tanto, se encontró que los insectos tenían un mayor grado de conservación en el terminal C del bolsillo de unión de la ouabaína. Dobler et al. encontró una identidad de aminoácidos del 87% entre las secuencias de insectos, lo que muestra un alto nivel de convergencia molecular entre cuatro órdenes de insectos herbívoros. Por lo tanto, algunas sustituciones brindan resistencia a cardenólidos como una adaptación incluso a través de ramas filogenéticas.
Contenido relacionado
Aeronáutica británica
Temperatura termodinámica
Satélite de observación de la tierra


