Óxido de sodio (Na₂O)
El óxido de sodio es un compuesto químico de fórmula Na 2 O. Se utiliza en cerámica y vidrios. Es un sólido blanco pero el compuesto rara vez se... (leer más)
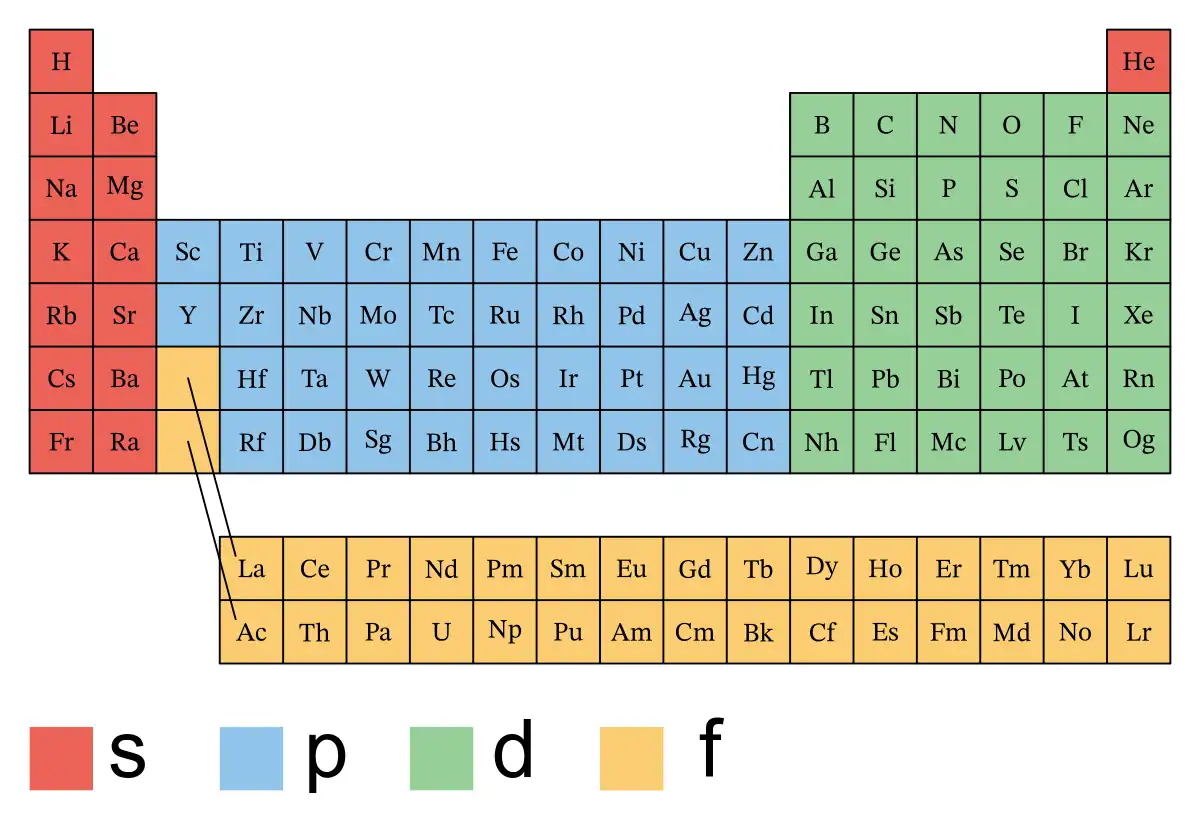
Un bloque de la tabla periódica es un grupo de elementos químicos con la misma configuración de orbitales atómicos de los electrones de valencia. En otras palabras, se agrupan de acuerdo a los electrones que pueden formar enlaces químicos. El término fue utilizado por primera vez en la obra del químico francés Charles Janet.
La tabla periódica se divide en cuatro bloques: s, p, d y f.
Cada bloque tiene características y propiedades distintivas que definen el comportamiento químico de los elementos que lo componen. El bloque s incluye los elementos más simples, con electrones de valencia en orbitales s. Por otro lado, el bloque p abarca elementos con electrones de valencia en orbitales p, y es notable por incluir una gran variedad de elementos con distintas propiedades. Los elementos de transición se encuentran en el bloque d, caracterizados por tener electrones de valencia en orbitales d. Finalmente, el bloque f comprende a los lantánidos y actínidos, elementos con electrones en orbitales f.
Los nombres de los bloques (s, p, d y f) se derivan de la notación espectroscópica en inglés para el valor del número cuántico azimutal de un electrón: sharp (0), principal (1), diffuse (2) o fundamental (3). Teóricamente podrían haber más bloques, aunque todavía no se han encontrado los elementos con diferentes características.
Los bloques, permiten a los científicos entender las relaciones y las tendencias químicas a lo largo de la tabla periódica. Conocer a qué bloque pertenece un elemento ayuda a deducir cómo interactuará con otros elementos, facilitando así el desarrollo de nuevas sustancias y la exploración de la química de materiales.
HSD
La división en bloques se justifica por su carácter distintivo: s se caracteriza, excepto en H y He, por metales altamente electropositivos; p por una gama de metales y no metales muy distintivos, muchos de ellos esenciales para la vida; d por metales con múltiples estados de oxidación; f por metales tan similares que su separación es problemática. Se pueden hacer declaraciones útiles sobre los elementos sobre la base del bloque al que pertenecen y su posición en él, por ejemplo, el estado de oxidación más alto, la densidad, el punto de fusión... La electronegatividad se distribuye de manera bastante sistemática a través y entre los bloques.
PJ Stewarten Fundamentos de Química, 2017
hay un aproximadocorrespondencia entre esta nomenclatura de bloques, basada en la configuración electrónica, y conjuntos de elementos basados en propiedades químicas. El bloque s y el bloque p juntos generalmente se consideran elementos del grupo principal, el bloque d corresponde a los metales de transición y el bloque f abarca casi todos los lantánidos (como el lantano) y los actínidos (como el actinio). No todo el mundo está de acuerdo en la composición exacta de cada conjunto de elementos. Por ejemplo, los elementos del grupo 12 zinc, cadmio y mercurio a menudo se consideran un grupo principal, en lugar de un grupo de transición, porque son química y físicamente más similares a los elementos del bloque p que a los otros elementos del bloque d. Los elementos del grupo 3 a veces se consideran elementos del grupo principal debido a sus similitudes con los elementos del bloque s.
El helio es un elemento del bloque s, con sus electrones exteriores (y únicos) en el orbital atómico 1s, aunque sus propiedades químicas son más similares a las de los gases nobles del bloque p en el grupo 18 debido a su capa completa.
…Na, K, Mg y Ca son esenciales en los sistemas biológicos. Algunos... otros elementos del bloque s se usan en medicina (por ejemplo, Li y Ba) y/o se presentan como contaminantes menores pero útiles en biominerales de Ca, por ejemplo, Sr... Estos metales muestran solo un estado de oxidación estable [+1 o +2]. Esto permite que [sus]... iones se muevan por la célula sin... peligro de oxidación o reducción.
Wilkins RG y Wilkins PC (2003)El papel del calcio y cationes comparables en el comportamiento animal, RSC, Cambridge, p. 1
El bloque s, con la s de "aguda" y número cuántico azimutal 0, está en el lado izquierdo de la tabla periódica convencional y está compuesto por elementos de las dos primeras columnas más un elemento en la columna más a la derecha, los no metales hidrógeno y helio y los metales alcalinos (en el grupo 1) y metales alcalinotérreos (grupo 2). Su configuración de valencia general es n s. El helio es un elemento s, pero casi siempre encuentra su lugar en el extremo derecho del grupo 18, por encima del elemento p neón. Cada fila de la tabla tiene dos elementos s.
Los metales del bloque s (desde el segundo período en adelante) son en su mayoría blandos y generalmente tienen puntos de fusión y ebullición bajos. La mayoría imparte color a una llama.
Químicamente, todos los elementos S excepto el helio son altamente reactivos. Los metales del bloque s son altamente electropositivos y, a menudo, forman compuestos esencialmente iónicos con los no metales, especialmente con los no metales halógenos altamente electronegativos.
El bloque p, donde la p representa el número cuántico "principal" y azimutal 1, está en el lado derecho de la tabla periódica estándar y abarca elementos en los grupos 13 a 18. Su configuración electrónica general es n s n p. El helio, aunque es el primer elemento del grupo 18, no está incluido en el bloque p. Cada fila de la tabla tiene un lugar para seis elementos p excepto la primera fila (que no tiene ninguno).
Este bloque es el único que tiene los tres tipos de elementos: metales, no metales y metaloides. Los elementos del bloque p pueden describirse grupo por grupo como: grupo 13, los icoságenos; 14, los cristalógenos; 15, los pnictógenos; 16, los calcógenos; 17, los halógenos; y 18, el grupo del helio, compuesto por los gases nobles (excluido el helio) y el oganesón. Alternativamente, el bloque p puede describirse como que contiene metales posteriores a la transición; metaloides; no metales reactivos, incluidos los halógenos; y gases nobles (excepto helio).
Los elementos del bloque p están unificados por el hecho de que sus electrones de valencia (más externos) están en el orbital p. El orbital p consta de seis formas lobuladas que provienen de un punto central en ángulos espaciados uniformemente. El orbital p puede contener un máximo de seis electrones, por lo que hay seis columnas en el bloque p. Los elementos de la columna 13, la primera columna del bloque p, tienen un electrón orbital p. Los elementos de la columna 14, la segunda columna del bloque p, tienen dos electrones orbitales p. La tendencia continúa así hasta la columna 18, que tiene seis electrones en el orbital p.
El bloque es un baluarte de la regla del octeto en su primera fila, pero los elementos de las filas posteriores a menudo muestran hipervalencia. Los elementos del bloque p muestran estados de oxidación variables que generalmente difieren en múltiplos de dos. La reactividad de los elementos en un grupo generalmente disminuye hacia abajo. (El helio rompe esta tendencia en el grupo 18 al ser más reactivo que el neón, pero dado que el helio es en realidad un elemento del bloque s, la porción del bloque p de la tendencia permanece intacta).
El oxígeno y los halógenos tienden a formar más compuestos iónicos con los metales; los no metales reactivos restantes tienden a formar más compuestos covalentes, aunque la ionicidad es posible cuando la diferencia de electronegatividad es lo suficientemente alta (por ejemplo, Li 3 N). Los metaloides tienden a formar compuestos covalentes o aleaciones con metales.
Los... elementos muestran una similitud horizontal en sus propiedades físicas y químicas, así como la relación vertical habitual. Esta similitud horizontal es tan marcada que la química de la primera... serie... a menudo se discute por separado de la de la segunda y tercera serie, que son más similares entre sí que con la primera serie.
Kneen WR, Rogers MJW y Simpson P 1972Química: hechos, patrones y principios, Addison-Wesley, Londres, págs. 487-489
El bloque d, con la d de "difuso" y número cuántico azimutal 2, está en el medio de la tabla periódica y abarca elementos de los grupos 3 a 12; comienza en el cuarto período. Los períodos del cuarto en adelante tienen un espacio para diez elementos del bloque d. La mayoría o todos estos elementos también se conocen como metales de transición porque ocupan una zona de transición en propiedades, entre los metales fuertemente electropositivos de los grupos 1 y 2, y los metales débilmente electropositivos de los grupos 13 a 16. Grupo 3 o grupo 12, mientras que todavía se cuentan como metales del bloque d, a veces no se cuentan como metales de transición porque no muestran las propiedades químicas características de los metales de transición, por ejemplo, múltiples estados de oxidación y compuestos coloreados.
Los elementos del bloque d son todos metales y la mayoría tiene uno o más electrones orbitales d químicamente activos. Debido a que existe una diferencia relativamente pequeña en la energía de los diferentes electrones del orbital d, la cantidad de electrones que participan en el enlace químico puede variar. Los elementos del bloque d tienen tendencia a exhibir dos o más estados de oxidación, que difieren en múltiplos de uno. Los estados de oxidación más comunes son +2 y +3. El cromo, el hierro, el molibdeno, el rutenio, el tungsteno y el osmio pueden tener números de oxidación formales tan bajos como −4; el iridio tiene la singular distinción de ser capaz de alcanzar un estado de oxidación de +9.
Los orbitales d (cuatro con forma de trébol de cuatro hojas y el quinto como una pesa con un anillo alrededor) pueden contener hasta cinco pares de electrones.
Debido a su compleja estructura electrónica, los significativos efectos de correlación de electrones y las grandes contribuciones relativistas, los elementos del bloque f son probablemente el grupo de elementos más desafiante para la teoría de la estructura electrónica.
Dolg M 2015 (ed.)Métodos computacionales en química de lantánidos y actínidos, John Wiley & Sons, Chichester, p. xvii
El bloque f, con la f de "fundamental" y número cuántico azimutal 3, aparece como una nota al pie en una tabla estándar de 18 columnas, pero está ubicado en el centro-izquierda de una tabla de ancho completo de 32 columnas. Los períodos del sexto en adelante tienen lugar para catorce elementos del bloque f. Si bien estos elementos generalmente no se consideran parte de ningún grupo, algunos autores los consideran parte del grupo 3. A veces se les llama metales de transición interna porque proporcionan una transición entre el bloque s y el bloque d en la 6.ª y 7.ª fila. (punto), de la misma manera que los metales de transición del bloque d proporcionan un puente de transición entre el bloque s y el bloque p en las filas 4 y 5.
Los elementos del bloque f vienen en dos series, en los períodos 6 y 7. Todos son metales. Los electrones del orbital f son menos activos en la química de los elementos del bloque f del período 6, aunque hacen alguna contribución: son bastante similares entre sí. Son más activos en los elementos del bloque 7f del período temprano, donde las energías de las capas 5f, 7s y 6d son bastante similares; en consecuencia, estos elementos tienden a mostrar tanta variabilidad química como sus análogos de metales de transición. Los últimos elementos del bloque f se comportan más como sus contrapartes del período 6.
Los elementos del bloque f están unificados al tener principalmente uno o más electrones en un orbital f interno. De los orbitales f, seis tienen seis lóbulos cada uno, y el séptimo parece una mancuerna con una rosquilla con dos anillos. Pueden contener hasta siete pares de electrones, por lo que el bloque ocupa catorce columnas en la tabla periódica. No se les asignan números de grupo, ya que las tendencias periódicas verticales no se pueden discernir en un "grupo" de dos elementos.
Las dos filas de 14 miembros de los elementos del bloque f a veces se confunden con los lantánidos y los actínidos, que son nombres para conjuntos de elementos basados en propiedades químicas más que en configuraciones electrónicas. Los lantánidos son los 15 elementos que van desde el lantano (La) hasta el lutecio (Lu); los actínidos son los 15 elementos que van desde el actinio (Ac) hasta el laurencio (Lr).
Se predice que un bloque g, con el número cuántico azimutal 4, comenzará en la vecindad del elemento 121. Aunque no se espera que los orbitales g comiencen a llenarse en el estado fundamental hasta alrededor del elemento 124-126 (consulte la tabla periódica extendida), es probable que ya tengan una energía lo suficientemente baja como para comenzar a participar químicamente en el elemento 121, similar a la situación de los orbitales 4f y 5f.
Si la tendencia de las filas anteriores continuara, entonces el bloque g tendría dieciocho elementos. Sin embargo, los cálculos predicen una gran confusión de la periodicidad en el octavo período, hasta el punto de que los bloques individuales se vuelven difíciles de delinear. Es probable que el octavo período no siga la tendencia de las filas anteriores.
El óxido de sodio es un compuesto químico de fórmula Na 2 O. Se utiliza en cerámica y vidrios. Es un sólido blanco pero el compuesto rara vez se... (leer más)
Un elemento sintético es uno de los 24 elementos químicos conocidos que no existen de forma natural en la Tierra: han sido creados por la manipulación... (leer más)
La Fuerza nuclear débil en física nuclear y de partículas es una de las cuatro interacciones fundamentales. Las otras son el electromagnetismo, la fuerza... (leer más)