Bloqueador del receptor de angiotensina II
Bloqueadores de los receptores de angiotensina II (BRA), formalmente antagonistas del receptor de angiotensina II tipo 1 (AT1), también conocidos como bloqueadores de los receptores de angiotensina, antagonistas de los receptores de angiotensina II o antagonistas de los receptores AT1, son un grupo de productos farmacéuticos que se unen e inhiben el receptor de angiotensina II tipo 1 (AT1) y, por lo tanto, bloquean los efectos de la contracción arteriolar y la retención de sodio del sistema renina-angiotensina.
Sus principales usos son en el tratamiento de la hipertensión (presión arterial alta), la nefropatía diabética (daño renal debido a la diabetes) y la insuficiencia cardíaca congestiva. Bloquean selectivamente la activación del receptor AT1, impidiendo la unión de la angiotensina II en comparación con los inhibidores de la ECA.
Los BRA y los inhibidores de la ECA de atribuciones similares están indicados como antihipertensivos de primera línea en pacientes que desarrollan hipertensión junto con insuficiencia cardíaca izquierda. Sin embargo, los BRA parecen producir menos efectos adversos en comparación con los inhibidores de la ECA.
Usos médicos
Los bloqueadores de los receptores de angiotensina II se utilizan principalmente para el tratamiento de la hipertensión cuando el paciente es intolerante a la terapia con inhibidores de la ECA principalmente debido a tos persistente y/o seca. No inhiben la degradación de bradicinina u otras cininas y, por lo tanto, rara vez se asocian con tos seca persistente y/o angioedema que limitan el tratamiento con inhibidores de la ECA. Más recientemente, se han utilizado para el tratamiento de la insuficiencia cardíaca en pacientes que no toleran el tratamiento con inhibidores de la ECA, en particular candesartán. Irbesartán y losartán tienen datos de ensayos que muestran beneficios en pacientes hipertensos con diabetes tipo 2 y pueden retrasar la progresión de la nefropatía diabética. Un estudio doble ciego de 1998 encontró que "el lisinopril mejoraba la sensibilidad a la insulina, mientras que losartán no la afectaba". Candesartán se utiliza de forma experimental en el tratamiento preventivo de la migraña. Se ha descubierto que lisinopril es menos eficaz que candesartán para prevenir la migraña.
Los bloqueadores de los receptores de angiotensina II tienen diferentes potencias en relación con el control de la presión arterial, con efectos estadísticamente diferentes en las dosis máximas. Cuando se utiliza en la práctica clínica, el agente particular utilizado puede variar según el grado de respuesta requerido.
Algunos de estos medicamentos tienen un efecto uricosúrico.
En un estudio, después de 10 semanas de tratamiento con un BRA llamado losartán (Cozaar), el 88 % de los hombres hipertensos con disfunción sexual informaron una mejoría en al menos un área de la sexualidad, y la satisfacción sexual general mejoró del 7,3 al 58,5 %. En un estudio que comparó el betabloqueante carvedilol con valsartán, el bloqueador del receptor de angiotensina II no sólo no tuvo ningún efecto perjudicial sobre la función sexual, sino que en realidad la mejoró. Otros BRA incluyen candesartán (Atacand), telmisartán (Micardis) y valsartán (Diovan), fimasartán (Kanarb).
La angiotensina II, a través de la estimulación del receptor AT1, es una importante hormona del estrés y, debido a que los BRA bloquean estos receptores, además de sus efectos antihipertensivos, se puede considerar para el tratamiento de los trastornos relacionados con el estrés.
En 2008, se informó que tenían una asociación negativa notable con la enfermedad de Alzheimer (EA). Un análisis retrospectivo de cinco millones de registros de pacientes con el sistema del Departamento de Asuntos de Veteranos de EE. UU. encontró que diferentes tipos de medicamentos antihipertensivos de uso común tenían resultados de EA muy diferentes. Los pacientes que tomaban bloqueadores de los receptores de angiotensina (BRA) tenían entre un 35 y un 40 por ciento menos de probabilidades de desarrollar EA que aquellos que usaban otros antihipertensivos.
Un estudio retrospectivo de 1968 pacientes con accidente cerebrovascular reveló que el tratamiento con BRA antes del accidente cerebrovascular puede estar asociado con una reducción de la gravedad del accidente cerebrovascular y mejores resultados. Este hallazgo concuerda con datos experimentales que sugieren que los BRA ejercen un efecto protector cerebral.
Efectos adversos
Esta clase de fármacos suele ser bien tolerado. Las reacciones adversas a los medicamentos (RAM) comunes incluyen: mareos, dolor de cabeza y/o hiperpotasemia. Las reacciones adversas poco frecuentes asociadas con el tratamiento incluyen: hipotensión ortostática de primera dosis, erupción cutánea, diarrea, dispepsia, función hepática anormal, calambres musculares, mialgia, dolor de espalda, insomnio, disminución de los niveles de hemoglobina, insuficiencia renal, faringitis y/o congestión nasal. Una revisión sistemática Cochrane de 2014 basada en ensayos controlados aleatorios informó que al comparar pacientes que tomaban inhibidores de la ECA con pacientes que tomaban BRA, menos pacientes con BRA se retiraron del estudio debido a eventos adversos en comparación con los pacientes con inhibidores de la ECA.
Si bien una de las principales razones para el uso de esta clase es evitar la tos seca persistente y/o el angioedema asociados con la terapia con inhibidores de la ECA, en raras ocasiones aún pueden ocurrir. Además, también existe un pequeño riesgo de reactividad cruzada en pacientes que han experimentado angioedema con la terapia con inhibidores de la ECA.
Infarto de miocardio
Actualmente se está investigando la cuestión de si los antagonistas de los receptores de angiotensina II aumentan ligeramente el riesgo de infarto de miocardio (IM o ataque cardíaco). Algunos estudios sugieren que los BRA pueden aumentar el riesgo de infarto de miocardio. Sin embargo, otros estudios han encontrado que los BRA no aumentan el riesgo de infarto de miocardio. Hasta la fecha, al no haber consenso sobre si los BRA tienen tendencia a aumentar el riesgo de infarto de miocardio, se están realizando más investigaciones.
De hecho, como consecuencia del bloqueo AT1, los BRA aumentan los niveles de angiotensina II varias veces por encima del valor inicial al desacoplar un circuito de retroalimentación negativa. Los niveles elevados de angiotensina II circulante dan como resultado una estimulación sin oposición de los receptores AT2, que, además, están regulados positivamente. Sin embargo, datos recientes sugieren que la estimulación del receptor AT2 puede ser menos beneficiosa que lo propuesto previamente, e incluso puede ser dañina bajo ciertas circunstancias a través de la mediación de la promoción del crecimiento, la fibrosis y la hipertrofia, además de provocar estímulos proaterogénicos y proinflamatorios. efectos.
Cáncer
Un estudio publicado en 2010 determinó que "...el metanálisis de ensayos controlados aleatorios sugiere que los BRA se asocian con un riesgo modestamente mayor de un nuevo diagnóstico de cáncer". Dada la escasez de datos, no es posible sacar conclusiones sobre el riesgo exacto de cáncer asociado con cada medicamento en particular. Estos hallazgos justifican una mayor investigación." Un metaanálisis posterior realizado por la Administración de Alimentos y Medicamentos de los EE. UU. (FDA) de 31 ensayos controlados aleatorios que compararon los BRA con otros tratamientos no encontró evidencia de un mayor riesgo de cáncer incidente (nuevo), muerte relacionada con el cáncer, cáncer de mama, cáncer de pulmón, o cáncer de próstata en pacientes que reciben BRA. En 2013, una investigación de efectividad comparativa del Departamento de Asuntos de Veteranos de los Estados Unidos sobre la experiencia de más de un millón de veteranos no encontró mayores riesgos de cáncer de pulmón o de próstata. Los investigadores concluyeron: "En esta gran cohorte nacional de veteranos de los Estados Unidos, no encontramos evidencia que respalde ninguna preocupación sobre un mayor riesgo de cáncer de pulmón entre los nuevos usuarios de BRA en comparación con los no usuarios". Nuestros hallazgos fueron consistentes con un efecto protector de los BRA."
En mayo de 2013, un regulador senior de Food & El líder del equipo médico de la Administración de Medicamentos de Estados Unidos, Thomas A. Marciniak, reveló públicamente que, contrariamente a la conclusión oficial de la FDA de que no había un mayor riesgo de cáncer, después de un examen paciente por paciente de los datos disponibles de la FDA, había llegado a la conclusión de que Hubo un aumento del riesgo de cáncer de pulmón de alrededor del 24% en los pacientes con BRA, en comparación con los pacientes que tomaban un placebo u otros medicamentos. Una de las críticas que hizo Marciniak fue que el metanálisis anterior de la FDA no contaba los carcinomas de pulmón como cánceres. En diez de los once estudios que examinó, Marciniak dijo que había más casos de cáncer de pulmón en el grupo de BRA que en el grupo de control. Ellis Unger, jefe de la división de evaluación de medicamentos que incluye a Marciniak, fue citado calificando las quejas como una "desviación", según el informe. y decir en una entrevista: "No tenemos ninguna razón para decirle al público nada nuevo". En un artículo sobre la disputa, el Wall Street Journal entrevistó a otros tres médicos para conocer sus opiniones; uno tenía "sin duda" Los BRA aumentaron el riesgo de cáncer, uno estaba preocupado y quería ver más datos, y el tercero pensó que no había relación o que era una relación de baja frecuencia difícil de detectar.
Un metanálisis de 2016 que incluyó a 148,334 pacientes no encontró diferencias significativas en la incidencia de cáncer asociada con el uso de BRA.
Insuficiencia renal
Aunque los BRA tienen efectos protectores contra el desarrollo de enfermedades renales en pacientes con diabetes e hipertensión previa sin la administración de BRA, los BRA pueden empeorar las funciones renales, como la reducción de la tasa de filtración glomerular asociada con un aumento de la creatinina sérica en pacientes con proteinuria preexistente. estenosis de la arteria renal, nefroesclerosis hipertensiva, insuficiencia cardíaca, enfermedad poliquística del riñón, enfermedad renal crónica, fibrosis intersticial, glomeruloesclerosis focal y segmentaria o cualquier afección como la hipertensión tratada con BRA pero aún clínicamente presente que provoca un estrechamiento anormal de los vasos sanguíneos que van al riñón que interrumpe el suministro de oxígeno y nutrientes al órgano.
Historia
Estructura
Losartán, irbesartán, olmesartán, candesartán, valsartán y fimasartán incluyen el grupo tetrazol (un anillo con cuatro nitrógenos y un carbono). Losartán, irbesartán, olmesartán, candesartán y telmisartán incluyen uno o dos grupos imidazol.
Mecanismo de acción
Estas sustancias son antagonistas del receptor AT1; es decir, bloquean la activación de los receptores AT1 de angiotensina II. Los receptores AT1 se encuentran en las células del músculo liso de los vasos, en las células corticales de la glándula suprarrenal y en las sinapsis de los nervios adrenérgicos. El bloqueo de los receptores AT1 provoca directamente vasodilatación, reduce la secreción de vasopresina y reduce la producción y secreción de aldosterona, entre otras acciones. El efecto combinado reduce la presión arterial.
La eficacia específica de cada BRA dentro de esta clase depende de una combinación de tres parámetros farmacodinámicos (PD) y farmacocinéticos (PK). La eficacia requiere tres áreas clave de PD/PK a un nivel efectivo; los parámetros de las tres características deberán compilarse en una tabla similar a la siguiente, eliminando duplicaciones y llegando a valores de consenso; estos últimos están en desacuerdo ahora.
Inhibición presora
Inhibición del presor a nivel valle: se relaciona con el grado de bloqueo o inhibición del efecto de aumento de la presión arterial ("presor") de la angiotensina II. Sin embargo, la inhibición presora no es una medida de la eficacia de la reducción de la presión arterial (PA) per se. Las tasas que figuran en los prospectos (PI) de la Administración de Alimentos y Medicamentos de los EE. UU. (FDA) para la inhibición de este efecto a las 24 horas para los BRA son las siguientes:
- Valsartan – 30% a 80 mg
- Telmisartan – 40% a 80 mg
- Losartan – 25–40% a 100 mg
- Irbesartán – 40% a 150 mg; 60% 300 mg
- Azilsartan – 60% a 32 mg
- Olmesartán – 61% a 20 mg; 74% a 40 mg
Afinidad AT1 frente a AT2
Las proporciones de AT1 a AT2 en las afinidades de unión de los BRA específicos se muestran a continuación. Sin embargo, la afinidad AT1 frente a AT2 no es un indicador significativo de la respuesta de la presión arterial.
- Losartan – 1000 veces
- Telmisartan – 3000 veces
- Irbesartan – 8500 veces
- Candesartan – más de 10000 veces
- Olmesartan – 12500 veces
- Valsartan – 30000 veces
- ¿Saprisartan?
Afinidades vinculantes Ki
Componente
Casi todos los BRA contienen una fracción de bifeniltetrazol, excepto telmisartán y eprosartán.
Agente activo
Losartán lleva un imidazol heterociclo, mientras que valsartán lleva un aminoácido acilado no plano.
Comparación farmacocinética
| Drogas | Nombre comercial | Vida media biológica [hrs] | Concentración de pico [Tmax] | Protein binding [%] | Biodisponibilidad [%] | Limpieza renal/hepática [%] | Efectos alimentarios | Dosis diaria [mg] | Metabolismo/transportador |
|---|---|---|---|---|---|---|---|---|---|
| Losartan | Cozaar | 2 h | 1 hr | 98,7% | 33% | 10/90% | Minimal | 50 a 100 | Sustratos sensibles: CYP2C9 y CYP3A4 |
| EXP 3174 metabolito activo de los | - | 6 a 9 horas | 3 a 4 horas después de la administración oral del losartan | 99,8% | – | 50/50% | – | – | AUC reducido por fenitoína y rifampina en 63% y 40% respectivamente; específicas isozimas CYP450 son desconocidas |
| Candesartan | Atacand | 9 | 3 a 4 horas | √99% | 15% | 60/40% | No | 4 a 32 | Sustrato sensible moderado: CYP2C9 |
| Valsartan | Diovan | 6 | 2 a 4 horas | 95% | 25% | 30/70% | Sí. | 80–320 | Substrates: MRP2 and OATP1B1/SLCO1B1 |
| Irbesartan | Avapro | 11 a 15 | 1.5 a 2 horas | 90-95% | 70% | 20/80% | No | 150–300 | Sustratos menores de CYP2C9 |
| Telmisartan | Micardis | 24 | 0,5 a 1 hr | √99% | 42-58% | 1/99% | No | 40–80 | Ninguno conocido; √97% por excreción biliar |
| Eprosartan | Teveten | 5 | 1–2 horas | 98% | 13% | 30/70% | No | 400 a 800 | Ninguno conocido; √90% a través de la excreción renal y biliar |
| Olmesartan | Benicar/Olmetec | 14 a 16 | 1–2 horas | √99% | 29% | 40/60% | No | 10 a 40 | Substrates of OATP1B1/SLCO1B1 |
| Azilsartan | Edarbi | 11 | 1.5 a 3 horas | √99% | 60% | 55/42% | No | 40–80 | Sustratos menores de CYP2C9 |
| Fimasartan | Kanarb | 7 a 11 | 0,5 a 3 horas después de la dosificación. | ▪97% | 30-40% | – | – | 30–120 | Ninguna conocida; principalmente excreción biliar |
| Drogas | Nombre comercial | Vida media biológica [hrs] | Concentración de pico [Tmax] | Protein binding [%] | Biodisponibilidad [%] | Limpieza renal/hepática [%] | Efectos alimentarios | Dosis diaria [mg] | Metabolismo/transportador |
Investigación
Longevidad
La desactivación del gen Agtr1a que codifica AT1 da como resultado una marcada prolongación de la vida útil de los ratones, en un 26 % en comparación con los controles. El mecanismo probable es la reducción del daño oxidativo (especialmente en las mitocondrias) y la sobreexpresión de genes de supervivencia renal. Los BRA parecen tener el mismo efecto.
Regresión de la fibrosis
Se ha demostrado que los BRA, como losartán, frenan o reducen la fibrosis muscular, hepática, cardíaca y renal.
Regresión de la raíz aórtica dilatada
Un estudio de 2003 que utilizó candesartán y valsartán demostró la capacidad de hacer retroceder el tamaño de la raíz aórtica dilatada.
Impurezas
Nitrosaminas
En 2018 y 2019, la Administración de Alimentos y Medicamentos de EE. UU. (FDA) encontró rastros de impurezas de NDMA y NDEA en los medicamentos bloqueadores de los receptores de angiotensina II (BRA), valsartán, losartán e irbesartán. La FDA declaró: “En junio de 2018, se informó a la FDA de la presencia de una impureza, identificada como N-nitrosodimetilamina (NDMA), de un productor de API. Desde entonces, la FDA ha determinado que otros tipos de compuestos de nitrosamina, por ejemplo, N-nitrosodietilamina (NDEA), están presentes en niveles inaceptables en los API de múltiples productores de API de valsartán y otros medicamentos de la clase ARB. En 2018, la FDA emitió una guía para la industria sobre cómo evaluar y controlar las impurezas.
En agosto de 2020, la Agencia Europea de Medicamentos (EMA) brindó orientación a los titulares de autorizaciones de comercialización sobre cómo evitar la presencia de impurezas de nitrosaminas en los medicamentos humanos y les pidió que revisaran todos los medicamentos humanos químicos y biológicos para detectar la posible presencia de nitrosaminas y para probar los productos en riesgo.
En noviembre de 2020, el Comité de Medicamentos de Uso Humano (CHMP) de la EMA alineó las recomendaciones para limitar las impurezas de nitrosamina en los medicamentos sartán con las recomendaciones que emitió para otras clases de medicamentos. El principal cambio se refiere a los límites para las nitrosaminas, que antes se aplicaban a los ingredientes activos pero ahora se aplican a los productos terminados (por ejemplo, tabletas). Estos límites, basados en estándares acordados internacionalmente (ICH M7(R1)), deberían garantizar que el exceso de riesgo de cáncer debido a las nitrosaminas en cualquier medicamento sartán sea inferior a 1 entre 100.000 para una persona que toma el medicamento como tratamiento de por vida.
Estos medicamentos sartán tienen una estructura de anillo específica (tetrazol) cuya síntesis podría conducir potencialmente a la formación de impurezas de nitrosamina. Otros medicamentos sartán que no tienen este anillo, como azilsartán, eprosartán y telmisartán, no se incluyeron en esta revisión, pero están cubiertos en la revisión posterior de otros medicamentos.
Azidas
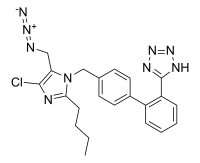
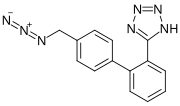
En abril de 2021, la Dirección Europea de Calidad de los Medicamentos (EDQM) advirtió del riesgo de contaminación con impurezas distintas de las nitrosaminas (en concreto, compuestos de azido) en los sartanes que contienen tetrazol. En septiembre de 2021, el EDQM anunció que las investigaciones habían revelado un nuevo contaminante azido que se encuentra solo en losartán (azida de losartán o impureza de azido de losartán) y que resultó ser mutagénico en las pruebas de Ames.
Más adelante, en 2021 y 2022, se detectaron varios casos de contaminación con impurezas de azido en losartán, irbesartán y valsartán, lo que provocó respuestas regulatorias que abarcaron desde investigaciones hasta retiros del mercado y retiros preventivos del mercado en Australia, Brasil y Europa (incluida Suiza).
Teva Pharmaceuticals anunció que cambiaría su proceso de fabricación de losartán para evitar una futura contaminación con estas impurezas, y el fabricante indio de API, IOL Chemicals and Pharmaceuticals, solicitó una patente para una nueva síntesis de losartán diseñada para estar libre de contaminantes azido.