Biogénesis de los ribosomas
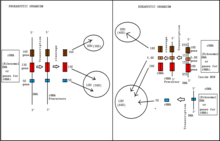
La biogénesis de los ribosomas es el proceso de formación de ribosomas. En los procariotas, este proceso tiene lugar en el citoplasma con la transcripción de muchos operones de genes de ribosomas. En los eucariotas, tiene lugar tanto en el citoplasma como en el nucléolo. Implica la función coordinada de más de 200 proteínas en la síntesis y procesamiento de los tres ARNr procariotas o cuatro eucariotas, así como el ensamblaje de esos ARNr con las proteínas ribosómicas. La mayoría de las proteínas ribosómicas pertenecen a varias familias de enzimas que consumen energía, incluidas las helicasas de ARN dependientes de ATP, las AAA-ATPasas, las GTPasas y las quinasas. Aproximadamente el 60% de la energía de una célula se gasta en la producción y el mantenimiento de ribosomas.
La biogénesis de los ribosomas es un proceso muy regulado y está estrechamente vinculado a otras actividades celulares como el crecimiento y la división.
Algunos han especulado que en el origen de la vida, la biogénesis de los ribosomas es anterior a las células y que los genes y las células evolucionaron para mejorar la capacidad reproductiva de los ribosomas.
Ribosomas
Los ribosomas son las máquinas macromoleculares responsables de la traducción del ARNm en proteínas. El ribosoma eucariota, también llamado ribosoma 80S, está formado por dos subunidades: la subunidad grande 60S (que contiene el ARNr 25S [en plantas] o 28S [en mamíferos], 5.8S y 5S y 46 proteínas ribosómicas) y una subunidad pequeña 40S (que contiene el ARNr 18S y 33 proteínas ribosómicas). Las proteínas ribosómicas están codificadas por genes ribosómicos.
| Tipo | Tamaño | Subunidad grande (LSU rRNA) | Subunidad pequeña (SSU rRNA) |
| prokaryotic | 70S | 50S (5S: 120 nt, 23S: 2906 nt) | 30S (16S: 1542 nt) |
| eukaryotic | 80S | 60S (5S: 121 nt, 5.8S: 156 nt, 28S: 5070 nt) | 40S (18S: 1869 nt) |
Prokaryotes
Existen 52 genes que codifican las proteínas ribosómicas y se pueden encontrar en 20 operones dentro del ADN procariota. La regulación de la síntesis de ribosomas depende de la regulación del propio ARNr.
En primer lugar, una reducción de aminoacil-ARNt hará que la célula procariota responda disminuyendo la transcripción y la traducción. Esto ocurre a través de una serie de pasos, comenzando con la unión de factores estrictos a los ribosomas y catalizando la reacción:
GTP + ATP --> pppGpp + AMP
Luego se elimina el fosfato gamma y la ppGpp se une a la ARN polimerasa y la inhibe. Esta unión provoca una reducción en la transcripción del ARNr. Una cantidad reducida de ARNr significa que las proteínas ribosómicas (proteínas r) se traducirán pero no tendrán un ARNr al que unirse. En cambio, se retroalimentarán negativamente y se unirán a su propio ARNm, reprimiendo la síntesis de la proteína r. Nótese que las proteínas r se unen preferentemente a su ARNr complementario si está presente, en lugar de al ARNm.
Los operones ribosómicos también incluyen los genes de la ARN polimerasa y los factores de elongación (utilizados en la traducción del ARN). La regulación de todos estos genes a la vez ilustra el acoplamiento entre la transcripción y la traducción en los procariotas.
Eukaryotes
La síntesis de proteínas ribosómicas en eucariotas es una actividad metabólica importante. Se produce, como la mayoría de las síntesis de proteínas, en el citoplasma, justo fuera del núcleo. Las proteínas ribosómicas individuales se sintetizan e importan al núcleo a través de poros nucleares. Consulte la importación nuclear para obtener más información sobre el movimiento de las proteínas ribosómicas hacia el núcleo.
El ADN se transcribe a gran velocidad en el nucléolo, que contiene todos los genes del ARNr 45S. La única excepción es el ARNr 5S, que se transcribe fuera del nucléolo. Después de la transcripción, los ARNr se asocian con las proteínas ribosómicas y forman los dos tipos de subunidades ribosómicas (grandes y pequeñas). Estas se ensamblarán más tarde en el citosol para formar un ribosoma funcional. Consulte la exportación nuclear para obtener más información sobre el movimiento de las subunidades ribosómicas fuera del núcleo.
Procesamiento
Las células eucariotas co-transcriben tres de las especies maduras de ARNr a través de una serie de pasos. El proceso de maduración de los ARNr y el proceso de reclutamiento de las proteínas r ocurren en partículas ribosómicas precursoras, a veces llamadas preribosomas, y tienen lugar en el nucléolo, el nucleoplasma y el citoplasma. La levadura, S. cerevisiae es el organismo modelo eucariota para el estudio de la biogénesis de los ribosomas. La biogénesis de los ribosomas comienza en el nucléolo. Allí, el pre-ARN 35S se transcribe a partir de los genes ribosómicos como una transcripción policistrónica por la ARN polimerasa I y se procesa en las subunidades 18S, 5.8S y 25S del ARNr.
La transcripción de la polimerasa I comienza con un complejo de iniciación Pol I que se une al promotor del ADNr. La formación de este complejo requiere la ayuda de un factor activador ascendente o UAF que se asocia con la proteína de unión a la caja TATA y el factor central (CF). Juntos, los dos factores de transcripción permiten que el complejo pol I del ARN se una al factor de iniciación de la polimerasa I, Rrn3. A medida que se produce la transcripción de pol I, aproximadamente 75 ribonucleopartículas nucleolares pequeñas (snoRNP) facilitan las modificaciones covalentes cotranscripcionales de >100 residuos de ARNr. Estas snoRNP controlan la metilación de nucleótidos por 2'-O-ribosa y también ayudan en la creación de pseudouridinas. En el extremo 5' de las transcripciones de ARNr, las proteínas ribosómicas de subunidades pequeñas (Rps) y los factores no ribosómicos se ensamblan con las transcripciones de pre-ARN para crear protuberancias con forma de bola. Estos nódulos son las primeras partículas preribosómicas en la vía de la subunidad ribosómica pequeña (40S). La transcripción del ARNr se escinde en el sitio A2, y esto separa el preribosoma 40S inicial del pre-ARNr restante que se combinará con las proteínas ribosómicas de la subunidad grande (Rpl) y otros factores no ribosómicos para crear las partículas ribosómicas pre-60S.
40S subunidad
El ensamblaje transcripcional del precursor de la subunidad 40S, a veces denominado procesoma de subunidad pequeña (SSU) o partícula 90S, ocurre de manera jerárquica: esencialmente una incorporación gradual de los subcomplejos UTP-A, UTP-B y UTP-C. Estos subcomplejos están formados por más de 30 factores proteicos no ribosómicos, la partícula snoRNP U3, algunas proteínas Rps y el pre-ARNr 35S. Sin embargo, no se ha descubierto su función exacta. La composición de la partícula pre-40S cambia drásticamente una vez que se realiza la escisión en los sitios dependientes de snoRNPA U3 (sitios A0, A1 y A2). Este evento de escisión crea el pre-ARNr 20S y hace que los factores ribosómicos se disocien de la partícula pre-40S. U3 es desplazado del 40S naciente por la helicasa Dhr1. En este punto del proceso de biogénesis del ribosoma, el preribosoma 40S ya muestra las estructuras de “cabeza” y “cuerpo” de la subunidad 40S madura. El preribosoma 40S es transportado fuera del nucléolo hacia el citoplasma. El preribosoma 40S citoplasmático ahora contiene proteínas ribosómicas, el ARNr 20s y algunos factores no ribosómicos. La formación final de la estructura de “pico” de la subunidad 40S ocurre después de un evento de fosforilación y desfosforilación que involucra al complejo Enp1-Ltv1-Rps3 y la quinasa Hrr25. La escisión del preribosoma 20S en el sitio D crea el ARNr 18s maduro. Este evento de escisión depende de varios factores no ribosómicos como Nob1, Rio1, Rio2, Tsr1 y Fap7.
60S subunit
La maduración de la subunidad pre-60S en una subunidad 60S madura requiere muchos factores de biogénesis que se asocian y disocian. Además, algunos factores de ensamblaje se asocian con la subunidad 60S mientras que otros solo interactúan con ella transitoriamente. Como tendencia general, la maduración de la subunidad pre-60S está marcada por una disminución gradual de la complejidad. La subunidad madura a medida que se mueve desde el nucléolo hasta el citoplasma y gradualmente se reduce el número de factores que actúan en trans. La maduración de la subunidad 60S requiere la ayuda de unos 80 factores. Ocho de estos factores están directamente involucrados en el procesamiento del pre-ARNr 27S A3, que en realidad completa la formación del extremo 5' maduro del ARNr 5.8S. Los factores A3 se unen a sitios distantes en el pre-ARN, así como entre sí. Posteriormente, acercan áreas de ARNr y promueven el procesamiento del pre-ARNr y el reclutamiento de proteínas ribosómicas. Tres ATPasas de tipo AAA trabajan para eliminar los factores del preribosoma 60S en maduración. Una de las ATPasas es una proteína similar a la dineína Rea1 compuesta por 6 dominios ATPasa diferentes que forman una estructura de anillo. La estructura de anillo está unida a una cola flexible que tiene una punta MIDAS (sitio de adhesión dependiente de iones metálicos). La Rea1 interactúa con el preribosoma 60S a través de su anillo, mientras que dos sustratos, Ytm1 y Rsa1, interactúan con Rea1 a través de su punta MIDAS. El papel de estos sustratos aún no se ha definido. Sin embargo, ambos, junto con sus interacciones, se eliminan en el proceso de maduración del preribosoma 60S. Las otras dos ATPasas, Rix7 y Drg1, también funcionan para eliminar los factores de ensamblaje de la subunidad 60S en maduración. Las helicasas y las GTPasas también participan en la eliminación de los factores de ensamblaje y la reorganización del ARN para formar la subunidad 60S completa. Una vez en el citoplasma (ver exportación nuclear), la subunidad 60S sufre un procesamiento adicional para ser funcional. El resto de las partículas ribosómicas de la subunidad grande se asocian con la unidad 60S y los factores de ensamblaje no ribosómicos restantes se disocian. La liberación de los factores de biogénesis está mediada principalmente por GTPasas como Lsg1 y ATPasas como Drg1. La secuencia precisa de estos eventos sigue sin estar clara. La vía de maduración citoplasmática de 60S sigue siendo incompleta en lo que respecta al conocimiento actual.
Exportación nuclear
Para que las unidades prerribosomales maduren por completo, deben ser exportadas al citoplasma. Para moverse eficazmente desde el nucléolo al citoplasma, los prerribosomas interactúan con receptores de exportación para moverse a través del canal central hidrofóbico del complejo de poros nucleares. La carioferina Crm1 es el receptor para ambas subunidades ribosomales y media la exportación de una manera dependiente de Ran-GTP. Reconoce moléculas que tienen señales de exportación nuclear ricas en leucina. La Crm1 es atraída hacia la subunidad grande 60S con la ayuda de una proteína adaptadora llamada Nmd3. La proteína adaptadora para la unidad 40S es desconocida. Además de Crm1, otros factores juegan un papel en la exportación nuclear de prerribosomas. Un receptor general de exportación de ARNm, llamado Mex67, así como una proteína que contiene repeticiones HEAT, Rrp12, facilitan la exportación de ambas subunidades. Estos factores son proteínas no esenciales y ayudan a optimizar la exportación de los preribosomas ya que son moléculas de gran tamaño.
Control de calidad
Debido a que los ribosomas son tan complejos, una cierta cantidad de ribosomas se ensamblan incorrectamente y podrían potencialmente desperdiciar energía y recursos celulares al sintetizar proteínas no funcionales. Para evitar esto, las células tienen un sistema de vigilancia activo para reconocer los ribosomas dañados o defectuosos y dirigirlos hacia su degradación. El mecanismo de vigilancia está en funcionamiento para detectar preribosomas no funcionales, así como ribosomas maduros no funcionales. Además, el sistema de vigilancia trae el equipo de degradación necesario y realmente degrada los ribosomas no funcionales. Los preribosomas que se acumulan en el núcleo son destruidos por el exosoma, que es un complejo de múltiples subunidades con actividad exonucleasa. Si las subunidades ribosómicas defectuosas logran salir del nucléolo y entrar en el citoplasma, existe un segundo sistema de vigilancia para dirigir los ribosomas defectuosos en el citoplasma para su degradación. Ciertas mutaciones en los residuos de la subunidad grande del ribosoma realmente darán como resultado la descomposición del ARN y, por lo tanto, la degradación de la unidad. Debido a que la cantidad de defectos que son posibles en el ensamblaje de ribosomas es tan amplia, aún se desconoce cómo el sistema de vigilancia detecta todos los defectos, pero se ha postulado que, en lugar de centrarse en defectos específicos, el sistema de vigilancia reconoce las consecuencias de esos defectos, como los retrasos en el ensamblaje. Es decir, si hay una interrupción en el ensamblaje o la maduración de un ribosoma maduro, el sistema de vigilancia actuará como si la subunidad fuera defectuosa.
Enfermedades humanas
Las mutaciones en la biogénesis de los ribosomas están relacionadas con varias enfermedades genéticas humanas llamadas ribosomopatías, entre ellas los síndromes hereditarios de insuficiencia de la médula ósea, que se caracterizan por una predisposición al cáncer y una cantidad reducida de células sanguíneas. La desregulación de los ribosomas también puede desempeñar un papel en el deterioro muscular.
Véase también
- Polimerasa de ARN
Referencias
- ^ a b c d e f g Kressler, Dieter; Hurt, Ed; Babler, Jochen (2009). "Conducir montaje riboso" (PDF). Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1803 (6): 673–683. doi:10.1016/j.bbamcr.2009.10.009. PMID 19879902.
- ^ Krista Conger (26 de junio de 2017). "Nuevo proceso identificado de retos de regulación de genes aceptado la ciencia, dicen los investigadores". Dentro de Stanford MedicineVol. 9, no. Universidad de Stanford.
- ^ a b c d e f g h Thomson, Emma; Ferreira-Cerca, Sebastien; Hurt, Ed (2013). "Eukaryotic ribosome biogenesis a un vistazo". Journal of Cell Science. 126 (21): 4815–4821. doi:10.1242/jcs.111948. PMID 24172536.
- ^ Lu T, Stroot PG, Oerther DB (2009). "La transcripción reversa de 16S rRNA para monitorear poblaciones bacterianas bilioso-sintetizadoras en el medio ambiente". Microbiología aplicada y ambiental. 75 (13): 4589–4598. Código:2009ApEnM..75.4589L. doi:10.1128/AEM.02970-08. PMC 2704851. PMID 19395563.
- ^ Root-Bernstein, Meredith; Root-Bernstein, Robert (21 de febrero de 2015). "El riboso como un vínculo perdido en la evolución de la vida". Journal of Theoretical Biology. 367: 130–158. doi:10.1016/j.jtbi.2014.11.025. PMID 25500179.
- ^ Thomson, E.; Ferreira-Cerca, S.; Hurt, E. (2013). "Eukaryotic ribosome biogenesis a un vistazo". Journal of Cell Science. 126 (21): 4815–4821. doi:10.1242/jcs.111948. PMID 24172536.
- ^ "Homo sapiens 5S ribosomal RNA". 2018-05-24.
{{cite journal}}: Cite journal requires|journal=(Ayuda) - ^ "Homo sapiens 5.8S ribosomal RNA". 2017-02-10.
{{cite journal}}: Cite journal requires|journal=(Ayuda) - ^ "Homo sapiens 28S ribosomal RNA". 2017-02-04.
{{cite journal}}: Cite journal requires|journal=(Ayuda) - ^ "Homo sapiens 18S ribosomal RNA". 2017-02-04.
{{cite journal}}: Cite journal requires|journal=(Ayuda) - ^ Lafontaine, Denis L.J. (2010). "Un 'garbage can' para ribosomas: cómo los eucariotas degradan sus ribosomas". Tendencias Biochem Sci. 35 (5): 267–77. doi:10.1016/j.tibs.2009.12.006. PMID 20097077.
- ^ Sardana, R; Liu, X; Granneman, S; Zhu, J; Gill, M; Papoulas, O; Marcotte, EM; Tollervey, D; Correll, CC; Johnson, AW (febrero de 2015). "El buzón de DEAH Dhr1 disocia U3 del prerRNA para promover la formación del pseudoknot central". PLOS Biología. 13 (2): e1002083. doi:10.1371/journal.pbio.1002083. PMC 4340053. PMID 25710520.
- ^ Connolly, Martin (2017). "miR-424-5p reduce el ARN ribosomal y la síntesis de proteínas en el desperdicio muscular". Journal of Cachexia, Sarcopenia and Muscle. 9 (2): 400-416. doi:10.1002/jcsm.12266. PMC 5879973. PMID 29215200.