Batería de flujo
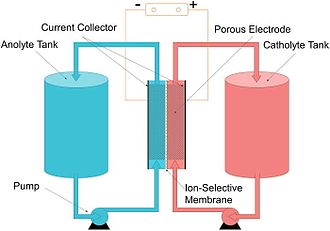
Una batería de flujo, o batería de flujo redox (después de reducción-oxidación), es un tipo de celda electroquímica donde la energía química es proporcionada por dos componentes químicos disueltos en líquidos. que se bombean a través del sistema en lados separados y en dirección opuesta a una membrana. La transferencia de iones dentro de la celda (acompañada del flujo de corriente eléctrica a través de un circuito externo) se produce a través de la membrana mientras ambos líquidos circulan en su respectivo espacio. El voltaje de la celda está determinado químicamente por la ecuación de Nernst y varía, en aplicaciones prácticas, de 1,0 a 2,43 voltios. La capacidad energética es función del volumen del electrolito y la potencia es función del área de superficie de los electrodos.
Se han demostrado varios tipos de baterías de flujo, incluidas baterías de flujo inorgánico y baterías de flujo orgánico. En cada categoría, el diseño de la batería de flujo se puede clasificar en baterías de flujo completo, baterías de semiflujo y baterías de flujo sin membrana. La diferencia fundamental entre las baterías convencionales y las de flujo es que en las baterías convencionales la energía se almacena en el material del electrodo, mientras que en las baterías de flujo se almacena en el electrolito. Las clasificaciones de patentes para baterías de flujo no se han desarrollado completamente a partir de 2021. La clasificación cooperativa de patentes considera los RFB como una subclase de pilas de combustible regenerativas (H01M8/18), aunque es más apropiado considerar las pilas de combustible como una subclase de baterías de flujo.
Una batería de flujo se puede usar como una celda de combustible (donde se agregan al sistema nuevo negolito cargado (también conocido como reductor o combustible) y posolito cargado (también conocido como oxidante)) o como una batería recargable (donde una fuente de energía eléctrica impulsa la regeneración del reductor y oxidante). Si bien las baterías de flujo presentan ciertas ventajas técnicas respecto de las baterías recargables convencionales con materiales electroactivos sólidos, como el escalado independiente de potencia (determinado por el tamaño de la pila) y de energía (determinado por el tamaño de los depósitos), ciclo y vida útil prolongados, y un costo total de propiedad potencialmente más bajo, todas las baterías de flujo sufren de eficiencia energética de ciclo bajo (50–80%). Esta eficiencia energética inferior surge de la necesidad de operar baterías de flujo a densidades de corriente altas (>= 100 mA/cm2) para reducir el efecto del cruce interno (a través de la membrana/separador dentro de cada celda) y reducir el costo de la energía. (tamaño de las pilas). Además, la mayoría de las baterías de flujo (Zn-Cl2, Zn-Br2 y H2-LiBrO3 son excepciones) tienen una energía específica más baja (más peso) en comparación con las baterías de iones de litio. El mayor peso se debe principalmente a la necesidad de utilizar un disolvente (normalmente agua) para mantener las especies redox activas en la fase líquida.
Historia

La batería de flujo de zinc-bromo (Zn-Br2) es la química de batería de flujo más antigua, con la patente US224404 de John Doyle presentada el 29 de septiembre de 1879. Las baterías de Zn-Br2 tienen una energía específica relativamente alta y fueron demostraron como fuentes de energía para automóviles eléctricos en la década de 1970.
Walther Kangro, un químico estonio que trabajaba en Alemania, fue el primero en demostrar en la década de 1950 baterías de flujo basadas completamente en iones de metales de transición disueltos: Ti-Fe y Cr-Fe. Después de algunas experimentaciones iniciales con Ti-Fe RFB, la NASA y algunos otros grupos en Japón y otros lugares seleccionaron la química del Cr-Fe para un mayor desarrollo. Para reducir el efecto de la concentración variable en el tiempo durante el ciclo de RFB, se utilizaron soluciones mixtas (es decir, que comprenden especies de cromo y hierro en el negolito y en el posolito). Entre las desventajas de la química Cr-Fe se encuentran: la isomería de hidratos (es decir, el equilibrio entre los clorocomplejos de Cr3+ electroquímicamente activos y el complejo hexa-aqua inactivo, que puede aliviarse agregando aminoligandos quelantes) y la evolución de hidrógeno en el negodo (que es mitigado añadiendo sales de Pb para aumentar la sobretensión de H2 y sales de Au para catalizar la reacción del electrodo de cromo).
A finales de la década de 1980, Sum, Rychcik y Skyllas-Kazacos de la Universidad de Nueva Gales del Sur (UNSW) en Australia demostraron las ventajas de la química de RFB totalmente de vanadio, como la existencia de cuatro estados de oxidación dentro de la ventana de voltaje electroquímico. de la interfaz grafito-ácido acuoso y, por tanto, la eliminación de la dilución de la mezcla, perjudicial en los RFB de Cr-Fe. La UNSW presentó varias patentes relacionadas con los VRFB, que luego fueron licenciadas a corporaciones japonesas, tailandesas y canadienses, que intentaron comercializar esta tecnología con éxito variable.
En 2022, Dalian, China, comenzó a operar una batería de flujo de vanadio de 400 MWh y 100 MW, entonces la más grande de su tipo.
Diseño
Una batería de flujo es una celda de combustible recargable en la que un electrolito que contiene uno o más elementos electroactivos disueltos fluye a través de una celda electroquímica que convierte de manera reversible la energía química directamente en electricidad. Los elementos electroactivos son "elementos en solución que pueden participar en una reacción de electrodo o que pueden adsorberse en el electrodo". El electrolito adicional se almacena externamente, generalmente en tanques, y normalmente se bombea a través de la celda (o celdas) del reactor, aunque también se conocen sistemas de alimentación por gravedad. Las baterías de flujo se pueden "recargar" rápidamente; reemplazando el líquido electrolítico (de manera similar a rellenar los tanques de combustible para motores de combustión interna) y al mismo tiempo recuperando el material gastado para recargarlo. Muchas baterías de flujo utilizan electrodos de fieltro de carbono debido a su bajo costo y conductividad eléctrica adecuada, aunque estos electrodos limitan en cierta medida la densidad de potencia debido a su baja actividad inherente hacia muchos pares redox.
En otras palabras, una batería de flujo es una celda electroquímica, con la propiedad de que la solución iónica (electrolito) se almacena fuera de la celda (en lugar de en la celda alrededor de los electrodos) y se puede alimentar a la celda para para generar electricidad. La cantidad total de electricidad que se puede generar depende del volumen de electrolito en los tanques.
Las baterías de flujo se rigen por los principios de diseño establecidos por la ingeniería electroquímica.
Las baterías de flujo redox y, en menor medida, las baterías de flujo híbrido, tienen las ventajas de:
- Escalada independiente de energía (tanques) y potencia (stack), que permite una optimización costo/peso/etc. para cada aplicación
- Vidas de ciclo largo y calendario (porque no hay transiciones de fase sólidas a sólidas, que causan degradación de iones de litio y baterías conexas)
- Tiempos de respuesta rápida
- No hay necesidad de "igualización" de carga (el sobrecarga de una batería para asegurar que todas las células tengan una carga igual)
- Ninguna emisión dañina
- Poco a ningún auto-descarga durante la parada
- Reciclaje completo de materiales electroactivos
Algunos tipos también ofrecen una fácil determinación del estado de carga (mediante la dependencia del voltaje en la carga), bajo mantenimiento y tolerancia a la sobrecarga/sobredescarga.
Son seguros porque normalmente no contienen electrolitos inflamables y los electrolitos se pueden almacenar lejos de la pila de energía.
Las baterías de flujo tienen tres desventajas principales en comparación con las baterías con materiales electroactivos sólidos
- Baja densidad de energía (necesita grandes tanques de electrolito para almacenar cantidades útiles de energía)
- Tasas de baja carga y descarga (en comparación con otros procesos de electrodo industrial). Esto significa que los electrodos y separadores de membrana necesitan ser grandes, lo que aumenta el costo de la energía.
- Las baterías de flujo tienen una menor eficiencia energética, porque operan en densidades de corriente más altas para minimizar los efectos de la recrucijada (auto-descarga interna) y reducir el costo de la energía.
Las baterías de flujo suelen tener una eficiencia energética mayor que las pilas de combustible, pero menor que las baterías de iones de litio.
Baterías de flujo tradicional
La celda redox (reducción-oxidación) es una celda reversible en la que las especies redox activas se encuentran en medios fluidos (líquidos o gaseosos). Las baterías de flujo redox son celdas recargables (secundarias). Debido a que emplean transferencia heterogénea de electrones en lugar de difusión o intercalación en estado sólido, son más similares a las pilas de combustible que a las baterías convencionales (como las de plomo-ácido o de iones de litio). La razón principal por la que las pilas de combustible no se consideran baterías es porque originalmente (en el siglo XIX) las pilas de combustible surgieron como un medio para producir electricidad directamente a partir de combustibles (y aire) mediante un proceso electroquímico sin combustión. Más tarde, particularmente en los años 1960 y 1990, las pilas de combustible recargables (es decir, H
2/O
2, como las pilas de combustible regenerativas unificadas de la NASA. #39;s Helios Prototype).
Ejemplos de baterías de flujo redox son la batería de flujo redox de vanadio, la batería de polisulfuro-bromuro (Regenesys), la batería de flujo redox de hierro (IRFB) y la batería de flujo redox de uranio. Las pilas de combustible redox son menos comunes comercialmente, aunque se han propuesto muchos sistemas.
Las baterías de flujo redox de vanadio son las baterías de flujo más comercializadas en la actualidad, debido a las ventajas que ofrecen sobre otras químicas, a pesar de sus limitadas densidades de energía y potencia. Como utilizan vanadio en ambos electrodos, no sufren contaminación cruzada. Sin embargo, la solubilidad limitada de las sales de vanadio contrarresta esta ventaja en la práctica. Lo más importante para el éxito comercial de los VRFB es en realidad una combinación casi perfecta de la ventana de voltaje de la interfaz carbono/ácido acuoso con el rango de voltaje de trabajo de los pares redox de vanadio. Esto asegura la durabilidad de los electrodos de carbono de bajo costo y el bajo impacto de las reacciones secundarias, como las evoluciones de H2 y O2, lo que da como resultado una vida útil récord (muchos años) y ciclos (15.000 a 20.000 ciclos), lo que a su vez da como resultado en un costo de energía nivelado récord bajo (LCOE, es decir, el costo del sistema dividido por la energía utilizable, el ciclo de vida y la eficiencia de ida y vuelta). La larga vida útil de las baterías de flujo permite amortizar su coste de capital relativamente elevado (debido al vanadio, fieltros de carbono, placas bipolares, membranas). El coste nivelado de la energía para los VRFB es del orden de unas pocas decenas de céntimos de dólar o céntimos de euro por kWh, mucho más bajo que el de las baterías de estado sólido y no muy lejos de los objetivos de 0,05 dólares y 0,05 euros, declarados por EE.UU. y la CE. agencias gubernamentales. Los principales desafíos para la implementación amplia incluyen: baja abundancia y altos costos del V2O5 (> $30/Kg), la materia prima para VRFB; reacciones de parásitos que incluyen desprendimiento de hidrógeno y oxígeno; y precipitación de V2O5 durante el ciclismo. Es la principal fuerza impulsora para desarrollar tecnologías de baterías de flujo alternativas.
La química de las baterías de flujo tradicionales tiene baja energía específica (lo que las hace demasiado pesadas para vehículos totalmente eléctricos) y baja potencia específica (lo que las hace demasiado caras para el almacenamiento de energía estacionario). Sin embargo, se demostró una alta potencia de 1,4 W/cm2 para las baterías de flujo de hidrógeno-bromo, y una alta energía específica (530 Wh/kg al nivel del tanque) para las baterías de flujo de hidrógeno-bromo.
Baterías de flujo híbrido
La batería de flujo híbrido utiliza uno o más componentes electroactivos depositados como una capa sólida. La principal desventaja es la pérdida de energía y potencia desacopladas, como se ve en las baterías de flujo completo, debido al uso de un electrodo de estado sólido. La celda contiene un electrodo de batería y un electrodo de celda de combustible. Este tipo tiene una energía limitada por el área de superficie del electrodo. Las baterías de flujo híbrido incluyen baterías de flujo de zinc-bromo, zinc-cerio, plomo-ácido soluble y hierro-sal. Weng et al. informaron una batería de flujo híbrida recargable de hidruro metálico de vanadio con un OCV experimental de 1,93 V y un voltaje de funcionamiento de 1,70 V, valores relativamente altos entre las baterías de flujo recargables con electrolitos acuosos. Esta batería híbrida consta de un electrodo positivo de fieltro de grafito que funciona en una solución mixta de VOSO
4 y H
2SO
4, y un electrodo negativo de hidruro metálico en solución acuosa de KOH. Los dos electrolitos de diferente pH están separados por una membrana bipolar. El sistema demostró buena reversibilidad y altas eficiencias en culombio (95%), energía (84%) y voltaje (88%). Informaron de mejoras adicionales de este par redox con logros de mayor densidad de corriente, inclusión de electrodos más grandes de 100 cm2 y el funcionamiento de 10 celdas grandes en serie. Los datos preliminares que utilizaron una entrada de energía simulada fluctuante probaron la viabilidad del almacenamiento a escala de kWh. En 2016, se propuso una batería de flujo híbrido Mn (VI) / Mn (VII) -Zn de alta densidad energética.
Un prototipo de batería de flujo de poliyoduro de zinc demostró una densidad de energía de 167 Wh/L (vatios-hora por litro). Las celdas de bromuro de zinc más antiguas alcanzan los 70 Wh/L. A modo de comparación, las baterías de fosfato de hierro y litio almacenan 233 Wh/L. Se afirma que la batería de poliyoduro de zinc es más segura que otras baterías de flujo dada su ausencia de electrolitos ácidos, su no inflamabilidad y su rango de funcionamiento de -4 a 122 °F (-20 a 50 °C) que no requiere circuitos de enfriamiento extensos, lo que añade peso y ocupa espacio. Un problema sin resolver es la acumulación de zinc en el electrodo negativo que puede permear la membrana y reducir la eficiencia. Debido a la formación de dendritas de Zn, las baterías de haluro de Zn no pueden funcionar con una densidad de corriente alta (> 20 mA/cm2) y, por lo tanto, tienen una densidad de potencia limitada. Agregar alcohol al electrolito de la batería ZnI puede ayudar con el problema. Los inconvenientes de las RFB de Zn/I radican en el alto coste de las sales de yoduro (>20 dólares/kg); capacidad de área limitada de deposición de Zn, perdiendo también la energía y potencia desacopladas; y formación de dendritas de Zn.
Cuando la batería está completamente descargada, ambos tanques contienen la misma solución electrolítica: una mezcla de iones de zinc cargados positivamente (Zn2+
>) y ion yoduro cargado negativamente, (I−
></span ). Cuando se carga, un tanque contiene otro ion negativo, poliyoduro, (I−
>3). La batería produce energía bombeando líquido desde tanques externos al área de pila de la batería donde se mezclan los líquidos. Dentro de la pila, los iones de zinc pasan a través de una membrana selectiva y se transforman en zinc metálico en el lado negativo de la pila. Para aumentar aún más la densidad de energía de la batería de flujo de yoduro de zinc, se utilizan iones de bromuro (Br
–) se utilizan como agente complejante para estabilizar el yodo libre, formando iones de bromuro de yodo (I
2 Br−
) como medio para liberar iones de yoduro para el almacenamiento de carga.
Las baterías de flujo de protones (PFB) integran un electrodo de almacenamiento de hidrato de metal en una célula de combustible de protones reversibles (PEM). Durante la carga, PFB combina iones de hidrógeno producidos a partir de agua dividida con electrones y partículas metálicas en un electrodo de una célula de combustible. La energía se almacena en forma de un hidrato de metal de estado sólido. La descarga produce electricidad y agua cuando el proceso se invierte y los protones se combinan con oxígeno ambiente. Los metales menos costosos que el litio se pueden utilizar y proporcionan mayor densidad de energía que las células de litio.
Tipos orgánicos
En comparación con las baterías de flujo redox que son inorgánicas, como las baterías de flujo redox de vanadio y las baterías de Zn-Br2, que se han desarrollado durante décadas, las baterías de flujo redox orgánicas surgieron en 2009. El principal atractivo de las baterías de flujo redox orgánicas radica en la Propiedades redox sintonizables de los componentes activos. A partir de 2021, los RFB orgánicos experimentan una baja durabilidad (es decir, calendario o ciclo de vida, o ambos). Por este motivo, sólo se han demostrado a escala comercial los RFB inorgánicos.
Las baterías de flujo redox orgánico se pueden clasificar en acuosas (AORFB) y no acuosas (NAORFB). Los AORFB utilizan agua como disolvente para materiales electrolíticos, mientras que los NAORFB emplean disolventes orgánicos. Los AORFB y NAORFB se pueden dividir en sistemas orgánicos totales e híbridos. Los primeros utilizan únicamente materiales de electrodos orgánicos, mientras que los segundos utilizan materiales inorgánicos para el ánodo o el cátodo. En el almacenamiento de energía a mayor escala, el menor costo de los solventes y la mayor conductividad brindan a los AORFB un mayor potencial comercial, además de ofrecer ventajas de seguridad respecto de los electrolitos a base de agua. En cambio, los NAORFB proporcionan una ventana de voltaje mucho mayor y ocupan menos espacio físico.
AORFB de PH neutro
Los AORFB de pH neutro funcionan en condiciones de pH 7, normalmente utilizando NaCl como electrolito de soporte. En condiciones de pH neutro, las moléculas orgánicas y organometálicas son más estables que en condiciones corrosivas ácidas y alcalinas. Por ejemplo, K4[Fe(CN)], un catolito común utilizado en AORFB, no es estable en soluciones alcalinas pero sí en condiciones de pH neutro.
Los AORFB utilizaron viológeno de metilo como anolito y 4-hidroxi-2,2,6,6-tetrametilpiperidin-1-oxilo como catolito en condiciones de pH neutro, además de NaCL y una membrana de intercambio aniónico de bajo costo. Este sistema MV/TEMPO tiene el voltaje de celda más alto, 1,25 V y, posiblemente, el costo de capital más bajo ($180/kWh) reportado para AORFB. Los electrolitos líquidos acuosos se diseñaron como un reemplazo directo de los sistemas actuales sin reemplazar la infraestructura existente. Una batería de prueba de 600 milivatios se mantuvo estable durante 100 ciclos con casi un 100 por ciento de eficiencia en densidades de corriente que oscilaban entre 20 y 100 mA/cm2, con un rendimiento óptimo clasificado entre 40 y 50 mA, en el que se retuvo aproximadamente el 70% del voltaje original de la batería. Los AORFB neutros pueden ser más respetuosos con el medio ambiente que los AORFB ácidos o alcalinos y, al mismo tiempo, muestran un rendimiento electroquímico comparable al de los RFB corrosivos. El MV/TEMPO AORFB tiene una densidad de energía de 8,4 Wh/L con la limitación en el lado TEMPO. Las baterías de flujo basadas en viológenos han sido desarrolladas principalmente por el grupo de Liu en la Universidad Estatal de Utah. En 2019, el grupo informó sobre un AORFB ultraligero de sulfonato-viológeno/ferrocianuro estable durante 1000 ciclos con una densidad de energía de 10 Wh/L, hasta ahora el AORFB más estable y denso en energía.
AORFB ácidos
Las quinonas y sus derivados son la base de muchos sistemas orgánicos redox. En un estudio, se emplearon como cátodos el ácido 1,2-dihidrobenzoquinona-3,5-disulfónico (BQDS) y el ácido 1,4-dihidrobenzoquinona-2-sulfónico (BQS), y el Pb/PbSO4 convencional fue el anolito en un ácido híbrido. AORFB. Las quinonas aceptan dos unidades de carga eléctrica, en comparación con una en el catolito convencional, lo que implica que una batería de este tipo podría almacenar el doble de energía en un volumen determinado.
Se ha evaluado otra quinona, el ácido 9,10-antraquinona-2,7-disulfónico (AQDS). AQDS sufre una reducción rápida y reversible de dos electrones/dos protones en un electrodo de carbón vítreo en ácido sulfúrico. Una batería de flujo acuoso con electrodos de carbono económicos, que combina el par quinona/hidroquinona con el Br
2/Br−
par redox, produce un pico galvánico densidad de potencia superior a 6.000 W/m2 a 13.000 A/m2. El ciclismo mostró> Retención del 99 % de la capacidad de almacenamiento por ciclo. La densidad de energía volumétrica superó los 20 Wh/L. El ácido antraquinona-2-sulfónico y el ácido antraquinona-2,6-disulfónico en el lado negativo y el ácido 1,2-dihidrobenzoquinona-3,5-disulfónico en el lado positivo evitan el uso de Br2 peligroso . Se afirmó que la batería duraba 1000 ciclos sin degradarse. Si bien este sistema parece robusto, tiene un voltaje de celda bajo (aproximadamente 0,55 V) y una densidad de energía baja (< 4 Blanco/L).
El ácido bromhídrico utilizado como electrolito se ha reemplazado por una solución alcalina menos tóxica (1 M KOH) y ferrocianuro. El pH más alto es menos corrosivo, lo que permite el uso de tanques de polímeros económicos. El aumento de la resistencia eléctrica en la membrana se compensó con un aumento de voltaje. El voltaje de la celda era de 1,2 V. La eficiencia de la celda superó el 99%, mientras que la eficiencia de ida y vuelta midió el 84%. La batería ofrecía una vida útil prevista de al menos 1.000 ciclos. Su densidad energética teórica era de 19 Wh/L. La estabilidad química del ferrocianuro en una solución de KOH con pH alto sin formar Fe(OH)2 o Fe(OH)3 debe verificarse antes del aumento de escala.
Se ha examinado la integración de anolito y catolito en la misma molécula. Estos analitos bifuncionales o moléculas combinadas permiten utilizar el mismo material en ambos tanques. En un tanque es donante de electrones, mientras que en el otro es receptor de electrones. Esto tiene ventajas relevantes como la de disminuir el efecto de cruce. Por lo tanto, las moléculas de quinona diaminoantraquinona y de índigo, así como las moléculas que combinan TEMPO/fenazina, son electrolitos potenciales para el desarrollo de baterías de flujo redox simétrico (SRFB).
Otro enfoque adoptó a un radical de Blatter como donante/receptor. Soportó 275 ciclos de carga y descarga en las pruebas, aunque no era soluble en agua.
Alcalina
(feminine)Las moléculas de quinona se han utilizado como anolitos en AROFB alcalinos. Otro candidato anolito es la fluorenona, rediseñada para aumentar su solubilidad en agua. Una celda de demostración de (des)hidrogenación de cetonas reversible funcionó continuamente durante 120 días durante 1111 ciclos de carga a temperatura ambiente sin catalizador, conservando el 97 % de su capacidad. La celda ofrece más del doble de densidad de energía que los sistemas basados en vanadio. El principal desafío para los AORFB alcalinos es la falta de un catolito estable, que mantenga sus densidades de energía por debajo de 5 Wh/L. Todos los AORFB alcalinos informados utilizan un exceso de católito de ferrocianuro de potasio debido al problema de estabilidad del ferrocianuro en soluciones alcalinas.
Las baterías de flujo metal-orgánico utilizan ligandos orgánicos para mejorar las propiedades de los metales con actividad redox. Los ligandos pueden ser quelatos como el EDTA y pueden permitir que el electrolito esté en condiciones neutras o alcalinas en las que, de otro modo, precipitarían los acucomplejos metálicos. Al bloquear la coordinación del agua con el metal, los ligandos orgánicos pueden inhibir las reacciones de división del agua catalizadas por metales, lo que da como resultado sistemas totalmente acuosos de mayor voltaje. Por ejemplo, el uso de cromo coordinado con 1,3-propanodiaminotetraacetato (PDTA) dio potenciales celulares de 1,62 V frente al ferrocianuro y un récord de 2,13 V frente al bromo. Las baterías de flujo organometálico pueden conocerse como baterías de flujo de química de coordinación, que representan la tecnología detrás de la tecnología Gridstar Flow de Lockheed Martin.
Oligómero
Se han propuesto RFB de especies redox de oligómeros para reducir el cruce de especies electroactivas, al tiempo que se utilizan membranas de bajo costo. Estos oligómeros activos redox se conocen como redoxímeros. Un sistema utiliza polímeros orgánicos y una solución salina con una membrana de celulosa. El prototipo se sometió a 10.000 ciclos de carga manteniendo una capacidad sustancial. La densidad de energía fue de 10 Wh/L. La densidad de corriente alcanzó los 100 miliamperios/cm2.
Otro oligómero RFB emplea viológeno y redoximeros TEMPO en combinación con membranas de diálisis de bajo costo. El material del electrodo activo son macromoléculas funcionalizadas (similares al vidrio acrílico o al poliestireno) disueltas en agua. La membrana nanoporosa de tamaño selectivo funciona como un filtro y se produce mucho más fácilmente y a menor costo que las membranas selectivas de iones convencionales. Retiene las grandes moléculas de polímero tipo "espagueti", al tiempo que permite el paso de pequeños contraiones. El concepto puede resolver el alto costo de la membrana Nafion tradicional, pero el diseño y la síntesis de un polímero activo redox con alta solubilidad en agua no es trivial. Hasta ahora, los RFB con especies redox de oligómeros no han demostrado poder competitivo en áreas específicas. No está claro si la baja densidad de corriente operativa es una característica intrínseca de las grandes moléculas redox o no.
Otros tipos
Otras baterías de flujo incluyen la batería de zinc-cerio, la batería de zinc-bromo y la batería de hidrógeno-bromo.
Sin membrana
Una batería sin membrana se basa en un flujo laminar en el que dos líquidos se bombean a través de un canal, donde experimentan reacciones electroquímicas para almacenar o liberar energía. Las soluciones fluyen en paralelo sin apenas mezclarse. El flujo separa los líquidos de forma natural, eliminando la necesidad de una membrana.
Las membranas son a menudo los componentes más costosos y menos confiables de las baterías, ya que pueden corroerse por la exposición repetida a ciertos reactivos. La ausencia de membrana permite el uso de una solución líquida de bromo e hidrógeno: esta combinación es problemática cuando se utilizan membranas, porque forman ácido bromhídrico que puede destruir la membrana. Ambos materiales están disponibles a bajo costo. El diseño utiliza un pequeño canal entre dos electrodos. El bromo líquido fluye a través del canal sobre un cátodo de grafito y el ácido bromhídrico fluye bajo un ánodo poroso. Al mismo tiempo, fluye gas hidrógeno a través del ánodo. La reacción química se puede revertir para recargar la batería, una novedad en cualquier diseño sin membrana. Una de estas baterías de flujo sin membrana publicada en agosto de 2013 produjo una densidad de potencia máxima de 0,795 mW/cm2, tres veces más energía que otros sistemas sin membrana y un orden de magnitud superior a las baterías de iones de litio.
En 2018, se demostró una batería de flujo redox sin membrana a macroescala capaz de recargar y recircular las mismas corrientes de electrolitos durante múltiples ciclos. La batería se basa en catolitos orgánicos inmiscibles y líquidos anolitos acuosos, que exhiben una alta retención de capacidad y eficiencia coulómbica durante el ciclo.
Basado en suspensión

El sistema de litio-azufre dispuesto en una red de nanopartículas elimina el requisito de que la carga entre y salga de las partículas que están en contacto directo con una placa conductora. En cambio, la red de nanopartículas permite que la electricidad fluya por todo el líquido. Esto permite extraer más energía.
En una batería de flujo semisólido, los electrodos positivo y negativo están compuestos de partículas suspendidas en un líquido portador. Las suspensiones positiva y negativa se almacenan en tanques separados y se bombean a través de tuberías separadas hacia una pila de cámaras de reacción adyacentes, donde están separadas por una barrera como una membrana delgada y porosa. El enfoque combina la estructura básica de las baterías de flujo acuoso, que utilizan material de electrodo suspendido en un electrolito líquido, con la química de las baterías de iones de litio tanto en suspensiones libres de carbono como en lodos con red de carbono conductora. La batería de flujo redox semisólida libre de carbono también se conoce a veces como batería de flujo redox de dispersión sólida. La disolución de un material cambia significativamente su comportamiento químico. Sin embargo, suspender trozos de material sólido preserva las características del sólido. El resultado es una suspensión viscosa que fluye como melaza.
En 2022, Influit Energy anunció un electrolito de batería de flujo que consiste en un óxido metálico suspendido en una solución acuosa.
Las baterías de flujo con sólidos redox (ROTS), también conocidas como impulsores de energía sólida (SEB), son otro desarrollo reciente. En estas baterías, ya sea posolito, negolito o ambos (también conocidos como fluidos redox), entran en contacto con uno o más materiales electroactivos sólidos, almacenados en tanques fuera de la pila de energía. Los fluidos redox comprenden uno o más pares redox, flanqueando potenciales redox el potencial redox del material electroactivo sólido. Estos RFB con potenciadores de energía sólida (SEB) combinan la alta ventaja energética específica de las baterías convencionales (como las de iones de litio) con la ventaja energía-potencia desacoplada de las baterías de flujo. Los RFB SEB (ROTS) tienen varias ventajas en comparación con los RFB semisólidos, como la ausencia de necesidad de bombear lodos viscosos, la ausencia de precipitación/obstrucción, una mayor potencia específica del área, una mayor durabilidad y un espacio de diseño químico más amplio. Sin embargo, debido a las dobles pérdidas de energía (una en la pila y otra en el tanque entre el SEB (ROTS) y un mediador), estas baterías adolecen de una baja eficiencia energética. A nivel de sistema, la energía específica práctica de las baterías de iones de litio tradicionales es mayor que la de las versiones de flujo SEB (ROTS) de las baterías de iones de litio.
Comparación
| Pareja | Tensión máxima (V) | Densidad media del electrodo (W/m)2) | Densidad media de la energía del fluido | Ciclos |
|---|---|---|---|---|
| Hidrogen-lithium bromate | 1.1 | 15.000 | 750 Wh/kg | |
| clorato de hidrógeno-litio | 1.4 | 10.000. | 1400 Wh/kg | |
| Hídrógeno-bromina | 1.07 | 7,950 | ||
| Iron-tin | 0,622 | b) 200 | ||
| Hierro-titanio | 0.43 | b) 200 | ||
| Hierro-cromo | 1.07 | b) 200 | ||
| Iron-iron | 1.21 | Identificada | 20 Wh/L | 10.000. |
| Orgánico (2013) | 0,8 | 13.000 | 21.4 Wh/L | 10 |
| Orgánico (2015) | 1.2 | 7.1 Wh/L | 100 | |
| MV-TEMPO | 1.25 | 8.4 Wh/L | 100 | |
| viológeno sulfonato (NH4)4[Fe(CN)6] | 0.9 | ■ 500 | 10 Wh/L | 1.000 |
| Metal-organic-ferrocyanide | 1.62 | 2.000 | 21.7 Wh/L | 75 |
| Metal-organic–bromine | 2.13 | 3.000 | 35 Wh/L | 10 |
| Vanadium–vanadium (sulfato) | 1.4 | ~800 | 25 Wh/L | |
| Vanadium–vanadium (bromuro) | 50 Wh/L | 2.000 | ||
| Polisulfido de sodio-bromuro | 1.54 | ~800 | ||
| Sodium-potassium | ||||
| Sulfur–oxygen-salt | ||||
| Zinc-bromine | 1.85 | ~1,000 | 75 Wh/kg | ■ 2.000 |
| Plomo-ácido (metanosulfonato) | 1.82 | ~1,000 | ||
| Zinc-cerium (metanosulfonato) | 2.43 | 1.200 a 2.500 | ||
| Zn-Mn(VI)/Mn(VII) | 1.2 | 60 Wh/L |
Aplicaciones
Los méritos técnicos hacen de las baterías de flujo redox una opción muy adecuada para el almacenamiento de energía a gran escala. Las baterías de flujo normalmente se consideran para aplicaciones estacionarias relativamente grandes (1 kWh – 10 MWh) con ciclos de carga y descarga de varias horas. Las baterías de flujo no son rentables para tiempos de carga/descarga más cortos. Algunos ejemplos de nichos de mercado de baterías de flujo son:
- Almacenamiento de energía a presión - almacenamiento de energía a corto y largo plazo para su uso por la red
- Equilibrio de carga – donde la batería está conectada a una red eléctrica para almacenar exceso de energía eléctrica durante horas fuera de pico y liberar energía eléctrica durante períodos de demanda máxima. El problema común que limita el uso de la mayoría de las farmacias de la batería de flujo en esta aplicación es su baja potencia areal (operando densidad actual) que se traduce en un alto costo de potencia.
- Cambio de energía de fuentes intermitentes como el viento o la energía solar para uso durante períodos de máxima demanda.
- Afeitado de pico, donde los picos de demanda se satisfacen por la batería.
- UPS, donde se utiliza la batería si la potencia principal no proporciona un suministro ininterrumpido.
- Conversión de potencia – Debido a que todas las células comparten el mismo electrolito, los electrolitos pueden ser cargados usando un número determinado de células y descargados con un número diferente. Como el voltaje de la batería es proporcional al número de células utilizadas, la batería puede actuar como un convertidor DC-DC muy potente. Además, si el número de células se cambia continuamente (en el lado de entrada y/o salida) la conversión de potencia también puede ser AC/DC, AC/AC o DC-AC con la frecuencia limitada por la del engranaje de conmutación.
- Vehículos eléctricos – Debido a que las baterías de flujo se pueden recargar rápidamente reemplazando el electrolito, se pueden utilizar para aplicaciones donde el vehículo necesita tomar energía tan rápido como un vehículo motorizado de combustión. Un problema común encontrado con la mayoría de las farmacias RFB en las aplicaciones EV es su baja densidad de energía que se tradujo en un corto rango de conducción. Las baterías y baterías de cloro de zinc con alatos altamente solubles son una excepción notable.
- Sistema de energía autónomo – Un ejemplo de esto es en las estaciones base de teléfonos celulares donde no hay energía de red disponible. La batería se puede utilizar junto con fuentes de energía solar o eólica para compensar sus niveles de energía fluctuantes y junto con un generador para hacer el uso más eficiente de ella para ahorrar combustible.