Barrera hematoencefálica
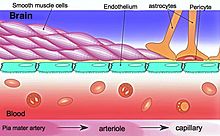
La barrera hematoencefálica (BBB) es un borde semipermeable altamente selectivo de células endoteliales que evita que los solutos en la sangre circulante no selectivamente i> cruzar al fluido extracelular del sistema nervioso central donde residen las neuronas. La barrera hematoencefálica está formada por células endoteliales de la pared capilar, pies terminales de astrocitos que envuelven el capilar y pericitos incrustados en la membrana basal del capilar. Este sistema permite el paso de algunas moléculas pequeñas por difusión pasiva, así como el transporte selectivo y activo de varios nutrientes, iones, aniones orgánicos y macromoléculas como glucosa y aminoácidos que son cruciales para la función neural.
La barrera hematoencefálica restringe el paso de patógenos, la difusión de solutos en la sangre y moléculas grandes o hidrofílicas en el líquido cefalorraquídeo, al tiempo que permite la difusión de moléculas hidrofóbicas (O2, CO2, hormonas) y pequeñas moléculas no polares. Las células de la barrera transportan activamente productos metabólicos como la glucosa a través de la barrera utilizando proteínas de transporte específicas. La barrera también restringe el paso de factores inmunitarios periféricos, como moléculas de señalización, anticuerpos y células inmunitarias, al SNC, aislando así al cerebro del daño debido a eventos inmunitarios periféricos.
Las estructuras cerebrales especializadas que participan en la integración sensorial y secretora dentro de los circuitos neurales del cerebro (los órganos circunventriculares y el plexo coroideo) tienen, en cambio, capilares muy permeables.
Estructura
La BBB resulta de la selectividad de las uniones estrechas entre las células endoteliales de los capilares cerebrales, restringiendo el paso de solutos. En la interfaz entre la sangre y el cerebro, las células endoteliales están unidas continuamente por estas uniones estrechas, que están compuestas por subunidades más pequeñas de proteínas transmembrana, como ocludina, claudinas (como Claudin-5), moléculas de adhesión de unión (como JAM- A). Cada una de estas proteínas de unión estrecha se estabiliza en la membrana de la célula endotelial mediante otro complejo proteico que incluye proteínas de andamiaje como la proteína de unión estrecha 1 (ZO1) y proteínas asociadas.
La BHE está compuesta por células endoteliales que restringen el paso de sustancias de la sangre de manera más selectiva que las células endoteliales de los capilares en otras partes del cuerpo. Las proyecciones de células de astrocitos llamadas pies astrocíticos (también conocidos como "glia limitans") rodean las células endoteliales de la BBB, brindando apoyo bioquímico a esas células. La BBB es distinta de la barrera sangre-líquido cefalorraquídeo bastante similar, que es una función de las células coroideas del plexo coroideo, y de la barrera sangre-retiniana, que puede considerarse parte del ámbito completo de tales barreras.
No todos los vasos del cerebro humano muestran propiedades BBB. Algunos ejemplos de esto incluyen los órganos circunventriculares, el techo de los ventrículos tercero y cuarto, los capilares en la glándula pineal en el techo del diencéfalo y la glándula pineal. La glándula pineal secreta la hormona melatonina 'directamente a la circulación sistémica', por lo que la melatonina no se ve afectada por la barrera hematoencefálica.
Desarrollo
La BBB parece ser funcional en el momento del nacimiento. La glicoproteína P, un transportador, ya existe en el endotelio embrionario.
La medición de la captación cerebral de varios solutos transportados por la sangre mostró que las células endoteliales de los recién nacidos eran funcionalmente similares a las de los adultos, lo que indica que una BHE selectiva está operativa al nacer.
En ratones, la pérdida de Claudin-5 durante el desarrollo es letal y da como resultado un aflojamiento selectivo del tamaño de la BBB.
Función
La barrera hematoencefálica actúa eficazmente para proteger el tejido cerebral de los patógenos circulantes y otras sustancias potencialmente tóxicas. En consecuencia, las infecciones del cerebro transmitidas por la sangre son raras. Las infecciones del cerebro que ocurren a menudo son difíciles de tratar. Los anticuerpos son demasiado grandes para cruzar la barrera hematoencefálica y solo ciertos antibióticos pueden pasar. En algunos casos, un fármaco debe administrarse directamente en el líquido cefalorraquídeo, donde puede ingresar al cerebro atravesando la barrera del líquido cefalorraquídeo.
Órganos circunventriculares
Los órganos circunventriculares (CVO) son estructuras individuales ubicadas adyacentes al cuarto ventrículo o al tercer ventrículo en el cerebro y se caracterizan por densos lechos capilares con células endoteliales permeables a diferencia de las de la barrera hematoencefálica. Entre los CVO que tienen capilares muy permeables se incluyen el área postrema, el órgano subfornical, el órgano vascular de la lámina terminal, la eminencia media, la glándula pineal y los tres lóbulos de la glándula pituitaria.
Los capilares permeables de los CVO sensoriales (área postrema, órgano subfornical, órgano vascular de la lámina terminal) permiten la detección rápida de señales circulantes en la sangre sistémica, mientras que los de los CVO secretores (eminencia media, glándula pineal, lóbulos pituitarios) facilitan transporte de señales derivadas del cerebro a la sangre circulante. En consecuencia, los capilares permeables CVO son el punto de comunicación bidireccional sangre-cerebro para la función neuroendocrina.
Zonas permeables especializadas
Las zonas fronterizas entre el tejido cerebral "detrás" la barrera hematoencefálica y las zonas "abiertas" a las señales sanguíneas en ciertos CVO contienen capilares híbridos especializados que tienen más fugas que los capilares cerebrales típicos, pero no tan permeables como los capilares CVO. Tales zonas existen en el borde del área postrema: núcleo del tracto solitario (NTS) y eminencia media: núcleo arqueado del hipotálamo. Estas zonas parecen funcionar como regiones de tránsito rápido para las estructuras cerebrales involucradas en diversos circuitos neuronales, como el NTS y el núcleo arqueado, para recibir señales sanguíneas que luego se transmiten a la salida neuronal. La zona capilar permeable compartida entre la eminencia mediana y el núcleo arqueado hipotalámico se ve aumentada por amplios espacios pericapilares, lo que facilita el flujo bidireccional de solutos entre las dos estructuras e indica que la eminencia mediana no es solo un órgano secretor, sino que también puede ser un órgano sensorial..
Investigación terapéutica
Como diana farmacológica
La barrera hematoencefálica está formada por el endotelio capilar cerebral y excluye del cerebro el 100 % de los neuroterapéuticos de molécula grande y más del 98 % de todos los fármacos de molécula pequeña. Superar la dificultad de administrar agentes terapéuticos en regiones específicas del cerebro presenta un gran desafío para el tratamiento de la mayoría de los trastornos cerebrales. En su función neuroprotectora, la barrera hematoencefálica funciona para dificultar el suministro al cerebro de muchos agentes diagnósticos y terapéuticos potencialmente importantes. Las moléculas terapéuticas y los anticuerpos que de otro modo podrían ser efectivos en el diagnóstico y la terapia no cruzan la BBB en cantidades adecuadas para ser clínicamente efectivos. La BBB representa un obstáculo para que algunos fármacos lleguen al cerebro, por lo que para superar esta barrera se han investigado ampliamente algunos péptidos capaces de cruzar la BHE de forma natural como sistema de administración de fármacos.
Los mecanismos para el direccionamiento de drogas en el cerebro implican pasar "a través de" o "detrás" el BBB. Las modalidades para la administración de fármacos al cerebro en dosis unitarias a través de la BBB implican su interrupción por medios osmóticos o bioquímicamente mediante el uso de sustancias vasoactivas, como la bradicinina, o incluso mediante exposición localizada a ultrasonido focalizado de alta intensidad (HIFU).
Otros métodos utilizados para atravesar la BBB pueden implicar el uso de sistemas de transporte endógenos, incluidos los transportadores mediados por transportadores, como los transportadores de glucosa y aminoácidos, la transcitosis mediada por receptores para la insulina o la transferrina, y el bloqueo de los transportadores de salida activos. como la glicoproteína p. Algunos estudios han demostrado que los vectores que se dirigen a los transportadores BBB, como el receptor de transferrina, permanecen atrapados en las células endoteliales del cerebro de los capilares, en lugar de ser transportados a través de la BBB hacia el área objetivo.
Nanopartículas
La nanotecnología está bajo investigación preliminar por su potencial para facilitar la transferencia de medicamentos a través del BBB. Las células endoteliales capilares y los pericitos asociados pueden ser anormales en los tumores y es posible que la barrera hematoencefálica no siempre esté intacta en los tumores cerebrales. Otros factores, como los astrocitos, pueden contribuir a la resistencia de los tumores cerebrales a la terapia con nanopartículas. Las moléculas solubles en grasa de menos de 400 daltons en masa pueden difundir libremente más allá de la BHE a través de la difusión pasiva mediada por lípidos.
Daño en lesiones y enfermedades
La barrera hematoencefálica puede dañarse en enfermedades neurológicas seleccionadas, como lo indican los estudios de neuroimagen de la enfermedad de Alzheimer, la esclerosis lateral amiotrófica, la epilepsia, el accidente cerebrovascular isquémico y el traumatismo cerebral, y en enfermedades sistémicas, como el hígado falla. Los efectos como el transporte deficiente de glucosa y la degeneración endotelial pueden conducir a una disfunción metabólica dentro del cerebro y a una mayor permeabilidad de la BHE a los factores proinflamatorios, lo que podría permitir que los antibióticos y los fagocitos se muevan a través de la BHE.
Predicción
Ha habido muchos intentos de correlacionar la permeabilidad experimental de la barrera hematoencefálica con las propiedades fisicoquímicas. El primer estudio QSAR de distribución cerebro-sangre se realizó en 1988, este estudio informó los valores in vivo en ratas para una gran cantidad de agonistas de histamina del receptor H2. Los primeros artículos que intentaron modelar la permeabilidad de la barrera hematoencefálica identificaron tres propiedades, es decir, el volumen molecular, la lipofilia y el potencial de enlace de hidrógeno, que contribuyen significativamente al transporte a través de la barrera hematoencefálica. En 2021 se publicaron dos conjuntos de datos, uno con valores logBB numéricos (1058 moléculas) y otro con etiquetas categóricas (7807 moléculas con 4956 BBB+ y 2851 BBB−). El conjunto de datos categóricos se utilizó en 2022 para seleccionar cuatro modelos de clasificación diferentes basados en huellas dactilares moleculares, claves MACCS166 y descriptores moleculares.
Historia
En 1898, Arthur Biedl y R. Kraus observaron que las "sales biliares" no afectó el comportamiento cuando se inyectó en el torrente sanguíneo de los animales. Por lo tanto, en teoría, no habían logrado ingresar al cerebro. Dos años después, Max Lewandowsky acuñó el término "barrera hematoencefálica" en 1900, refiriéndose a la hipotética membrana semipermeable (entonces denominada barrera hematoencefálica).
Mientras tanto, el bacteriólogo Paul Ehrlich estudiaba la tinción, un procedimiento que se utiliza en muchos estudios de microscopía para hacer visibles estructuras biológicas finas mediante colorantes químicos. Cuando Ehrlich inyectó algunos de estos tintes (en particular, los tintes de anilina que entonces se usaban ampliamente), el tinte tiñó todos los órganos de algunos tipos de animales, excepto el cerebro. En ese momento, Ehrlich atribuyó esta falta de tinción a que el cerebro simplemente no captaba tanto tinte.
Sin embargo, en un experimento posterior en 1913, Edwin Goldmann (uno de los estudiantes de Ehrlich) inyectó el tinte directamente en el líquido cefalorraquídeo de cerebros de animales. Encontró entonces que los cerebros se tiñeron, pero el resto del cuerpo no, lo que demuestra la existencia de una compartimentación entre los dos. En ese momento, se pensó que los propios vasos sanguíneos eran los responsables de la barrera, ya que no se pudo encontrar ninguna membrana obvia.
Contenido relacionado
Esquema de ciencias de la salud
Pruebas y procedimientos de diagnóstico de cardiología
Aislamiento de sustancias corporales