Azeótropo
Un azeotropo () o una mezcla de punto de calentamiento constante es una mezcla de dos o más líquidos cuyas proporciones no pueden ser alteradas o cambiadas por simple destilación. Esto sucede porque cuando se hierve un azeótropo, el vapor tiene las mismas proporciones de constituyentes que la mezcla sin hervir. Debido a que su composición no cambia por destilación, los azeótropos también se denominan (especialmente en textos más antiguos) mezclas de punto de ebullición constante.
Se conocen algunas mezclas azeotrópicas de pares de compuestos, y también se conocen muchos azeótropos de tres o más compuestos. En tal caso, no es posible separar los componentes por destilación fraccionada y, en su lugar, generalmente se usa la destilación azeotrópica. Hay dos tipos de azeótropos: azeótropo de mínima ebullición y azeótropo de máxima ebullición. Una solución que muestra una mayor desviación positiva de la ley de Raoult forma un azeótropo de ebullición mínima en una composición específica. Por ejemplo, una mezcla de etanol y agua (obtenida por fermentación de azúcares) en destilación fraccionada produce una solución que contiene como máximo el 95% (en volumen) de etanol. Una vez que se ha logrado esta composición, el líquido y el vapor tienen la misma composición y no se produce más separación. Una solución que muestra una gran desviación negativa de la ley de Raoult forma un azeótropo de máxima ebullición en una composición específica. El ácido nítrico y el agua son un ejemplo de esta clase de azeótropo. Este azeótropo tiene una composición aproximada de 68% de ácido nítrico y 32% de agua en masa, con un punto de ebullición de 393,5 K (120,4 °C).
Etimología
El término azeotropo se deriva de las palabras griegas ζέειν (hervir) y τρόπος (girar) con el prefijo α- (no) para dar el significado general, "sin cambios al hervir& #34;. El término fue acuñado en 1911 por el químico inglés John Wade y Richard William Merriman.
Tipos
Azeótropos positivos y negativos
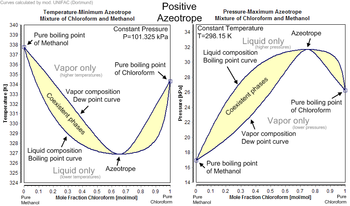
Cada azeótropo tiene un punto de ebullición característico. El punto de ebullición de un azeótropo es menor que las temperaturas del punto de ebullición de cualquiera de sus componentes (un azeótropo positivo) o mayor que el punto de ebullición de cualquiera de sus componentes (un azeótropo negativo).
La construcción del diagrama p-v-x que muestra el comportamiento azeotrópico se muestra en el diagrama adjunto
Un ejemplo bien conocido de un azeótropo positivo es el 95,63 % de etanol y el 4,37 % de agua (en masa), que hierve a 78,2 °C. El etanol hierve a 78,4 °C, el agua hierve a 100 °C, pero el azeótropo hierve a 78,2 °C, que es inferior a cualquiera de sus constituyentes. De hecho, 78,2 °C es la temperatura mínima a la que cualquier solución de etanol/agua puede hervir a presión atmosférica. En general, un azeótropo positivo hierve a una temperatura más baja que cualquier otra proporción de sus constituyentes. Los azeótropos positivos también se denominan mezclas de ebullición mínima o azeótropos de presión máxima.
En general, un azeótropo negativo hierve a una temperatura más alta que cualquier otra proporción de sus constituyentes. Los azeótropos negativos también se denominan mezclas de ebullición máxima o azeótropos de presión mínima. Un ejemplo de azeótropo negativo es el ácido clorhídrico a una concentración de 20,2% y 79,8% de agua (en masa). El cloruro de hidrógeno hierve a -84 °C y el agua a 100 °C, pero el azeótropo hierve a 110 °C, que es más alto que cualquiera de sus constituyentes. La temperatura máxima a la que puede hervir cualquier solución de ácido clorhídrico es de 110 °C. Otros ejemplos:
- ácido hidrofluorico (35,6%) / agua, hierve a 111,35 °C
- ácido nítrico (68%) / agua, hierve a 120.2 °C a 1 atm
- ácido perclorítico (71,6%) / agua, hierve a 203 °C
- ácido sulfúrico (98,3%) / agua, hierve a 338 °C
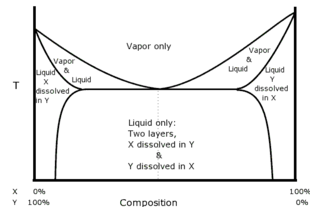
Azeótropos homogéneos y heterogéneos
Si los constituyentes de una mezcla son completamente miscibles entre sí en todas las proporciones, el tipo de azeótropo se denomina azeotropo homogéneo. Por ejemplo, se puede mezclar cualquier cantidad de etanol con cualquier cantidad de agua para formar una solución homogénea.
Si los constituyentes no son completamente miscibles, se puede encontrar un azeótropo dentro del espacio de miscibilidad. Este tipo de azeótropo se denomina azeótropo heterogéneo o heteroazeótropo. Una destilación heteroazeotrópica tendrá dos fases líquidas. Por ejemplo, la acetona/metanol/cloroformo forman un azeótropo de punto de ebullición intermedio (silla de montar).
Por ejemplo, si se agitan juntos volúmenes iguales de cloroformo (solubilidad en agua 0,8 g/100 ml a 20 °C) y agua y luego se dejan reposar, el líquido se separará en dos capas. El análisis de las capas muestra que la capa superior es principalmente agua con una pequeña cantidad de cloroformo disuelto y la capa inferior es principalmente cloroformo con una pequeña cantidad de agua disuelta. Si las dos capas se calientan juntas, el sistema de capas hervirá a 53,3 °C, que es inferior al punto de ebullición del cloroformo (61,2 °C) o al punto de ebullición del agua (100 °C). El vapor constará de 97,0 % de cloroformo y 3,0 % de agua, independientemente de la cantidad presente de cada capa líquida, siempre que ambas capas estén realmente presentes. Si el vapor se vuelve a condensar, las capas se reformarán en el condensado y lo harán en una proporción fija, que en este caso es el 4,4 % del volumen en la capa superior y el 95,6 % en la capa inferior.
El diagrama ilustra cómo se relacionan las distintas fases de un heteroazeótropo.
Número de constituyentes
Los azeótropos que constan de dos constituyentes se denominan azeótropos binarios, como el éter dietílico (33 %)/halotano (66 %), una mezcla que alguna vez se usó comúnmente en la anestesia. Por ejemplo, el benceno y el hexafluorobenceno forman un azeótropo binario doble.
Los azeótropos que constan de tres constituyentes se denominan azeótropos ternarios, p. acetona/metanol/cloroformo. También se conocen azeótropos de más de tres constituyentes.
Zeotropía
Se dice que las combinaciones de solventes que no forman un azeótropo cuando se mezclan en cualquier proporción son zeotrópicas. Los azeótropos son útiles para separar mezclas zeotrópicas. Un ejemplo es el ácido acético y el agua, que no forman un azeótropo. A pesar de esto, es muy difícil separar el ácido acético puro (punto de ebullición: 118,1 °C) de una solución de ácido acético y agua solo por destilación. A medida que las destilaciones progresivas producen soluciones con cada vez menos agua, cada destilación adicional se vuelve menos eficaz para eliminar el agua restante. Por lo tanto, la destilación de la solución para secar ácido acético es económicamente poco práctica. Pero el acetato de etilo forma un azeótropo con agua que hierve a 70,4 °C. Al agregar acetato de etilo como agente de arrastre, es posible eliminar el azeótropo por destilación y dejar ácido acético casi puro como residuo.
Mecanismo
Condición de existencia
La condición relaciona los coeficientes de actividad en fase líquida con la presión total y las presiones de vapor de los componentes puros.
Los azeótropos pueden formarse solo cuando una mezcla se desvía de la ley de Raoult, la igualdad de composiciones en fase líquida y fases de vapor, en equilibrio vapor-líquido y la ley de Dalton, siendo la igualdad de presiones para la presión total igual a la suma de las presiones parciales en mezclas reales.
En otras palabras: la ley de Raoult predice las presiones de vapor de mezclas ideales en función de la relación de composición. Más simplemente: según la ley de Raoult, las moléculas de los constituyentes se adhieren entre sí en la misma medida en que lo hacen entre sí. Por ejemplo, si los constituyentes son X e Y, entonces X se adhiere a Y con aproximadamente la misma energía que X con X e Y con Y. Una llamada desviación positiva de la teoría de Raoult La ley se produce cuando los constituyentes tienen una falta de afinidad entre sí, es decir, X se adhiere a X e Y a Y mejor que X a Y. Debido a que esto da como resultado que la mezcla tenga menos afinidad total de las moléculas que los constituyentes puros, se unen más fácilmente. escapar de la fase pegada, es decir, la fase líquida, y pasar a la fase de vapor. Cuando X se adhiere a Y más agresivamente que X a X e Y a Y, el resultado es una desviación negativa de la ley de Raoult. En este caso, debido a que las moléculas en la mezcla se pegan más que en los constituyentes puros, son más reacias a escapar de la fase líquida pegada.
Cuando la desviación es lo suficientemente grande como para causar un máximo o un mínimo en la función de presión de vapor versus composición, es una consecuencia matemática que en ese punto, el vapor tendrá la misma composición que el líquido, lo que resultará en un azeótropo.
El diagrama adyacente ilustra la presión de vapor total de tres mezclas hipotéticas de constituyentes, X e Y. Se supone que la temperatura en todo el gráfico es constante.
La traza central es una línea recta, que es lo que predice la ley de Raoult para una mezcla ideal. En general, las mezclas únicas de disolventes químicamente similares, como el n-hexano con el n-heptano, forman mezclas casi ideales que se acercan a obedecer la ley de Raoult. El trazo superior ilustra una mezcla no ideal que tiene una desviación positiva de la ley de Raoult, donde la presión de vapor combinada total de los constituyentes, X e Y, es mayor que lo predicho por la ley de Raoult. La traza superior se desvía lo suficiente como para que haya un punto en la curva donde su tangente sea horizontal. Siempre que una mezcla tiene una desviación positiva y tiene un punto en el que la tangente es horizontal, la composición en ese punto es un azeótropo positivo. En ese punto, la presión de vapor total es máxima. Asimismo, la traza inferior ilustra una mezcla no ideal que tiene una desviación negativa de la ley de Raoult, y en la composición donde la tangente a la traza es horizontal, hay un azeótropo negativo. Este es también el punto donde la presión de vapor total es mínima.
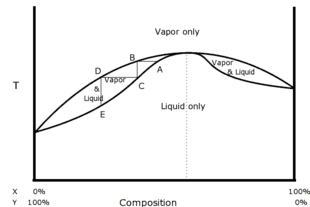
Azeótropo positivo o de mínima ebullición
La ebullición y recondensación de una mezcla de dos solventes son cambios de estado químico; como tales, se ilustran mejor con un diagrama de fase. Si la presión se mantiene constante, los dos parámetros variables son la temperatura y la composición.
El diagrama de fase de la derecha muestra un azeótropo positivo de componentes hipotéticos, X e Y. La traza inferior ilustra la temperatura de ebullición de varias composiciones. Debajo de la traza inferior, solo la fase líquida está en equilibrio. La traza superior ilustra la composición del vapor sobre el líquido a una temperatura dada. Por encima de la traza superior, solo el vapor está en equilibrio. Entre las dos trazas, las fases de líquido y vapor existen simultáneamente en equilibrio: por ejemplo, calentar una mezcla de 25 % X: 75 % Y a la temperatura AB generaría vapor de composición B sobre líquido de composición A. El azeótropo es el punto en el diagrama donde se tocan las dos curvas. Los pasos horizontales y verticales muestran el camino de las destilaciones repetidas. El punto A es el punto de ebullición de una mezcla no azeotrópica. El vapor que se separa a esa temperatura tiene composición B. La forma de las curvas requiere que el vapor en B sea más rico en constituyente X que el líquido en el punto A. El vapor se separa físicamente del sistema VLE (equilibrio vapor-líquido) y se enfría hasta el punto C, donde se condensa. El líquido resultante (punto C) ahora es más rico en X que en el punto A. Si el líquido recolectado se vuelve a hervir, avanza al punto D, y así sucesivamente. La progresión paso a paso muestra cómo la destilación repetida nunca puede producir un destilado que sea más rico en constituyente X que el azeótropo. Tenga en cuenta que comenzar a la derecha del punto del azeótropo da como resultado el mismo proceso gradual que se cierra en el punto del azeótropo desde la otra dirección.
Azeótropo de máxima ebullición o Negativo
El diagrama de fase de la derecha muestra un azeótropo negativo de constituyentes ideales, X e Y. De nuevo, el trazo inferior ilustra la temperatura de ebullición en varias composiciones, y nuevamente, debajo del trazo inferior, la mezcla debe estar totalmente en fase líquida. El trazo superior nuevamente ilustra la temperatura de condensación de varias composiciones, y nuevamente, arriba del trazo superior, la mezcla debe estar completamente en fase de vapor. El punto A que se muestra aquí es un punto de ebullición con una composición elegida muy cercana al azeótropo. El vapor se recolecta a la misma temperatura en el punto B. Ese vapor se enfría, se condensa y se recolecta en el punto C. Debido a que este ejemplo es un azeótropo negativo en lugar de uno positivo, el destilado está más lejos de el azeótropo que la mezcla líquida original en el punto A era. Por tanto, el destilado es más pobre en componente X y más rico en componente Y que la mezcla original. Debido a que este proceso ha eliminado una fracción mayor de Y del líquido que la que tenía originalmente, el residuo debe ser más pobre en Y y más rico en X después de la destilación que antes.
Si el punto A se hubiera elegido a la derecha del azeótropo en lugar de a la izquierda, el destilado en el punto C estaría más a la derecha que A, lo que significa que el destilado sería más rico en X y más pobre en Y. que la mezcla original. Entonces, también en este caso, el destilado se aleja del azeótropo y el residuo se acerca a él. Esto es característico de los azeótropos negativos. Sin embargo, ninguna cantidad de destilación puede hacer que el destilado o el residuo lleguen al lado opuesto del azeótropo de la mezcla original. Esto es característico de todos los azeótropos.
Rastros
Las trazas en los diagramas de fase se separan cuando la composición del vapor difiere de la composición del líquido a la misma temperatura. Supongamos que la composición total fuera 50/50%. Podrías hacer esta composición usando un 50 % de 50/50 % de vapor y un 50 % de 50/50 % de líquido, pero también podrías hacerla con un 83,33 % de 45/55 % de vapor y un 16,67 % de 75 %/25 % de líquido, así como de muchas otras combinaciones. La separación de las dos trazas representa el rango de combinaciones de líquido y vapor que pueden hacer cada composición total.
Dependencia temperatura-presión
Para las trazas superior e inferior, el punto de temperatura del azeótropo es la temperatura constante elegida para el gráfico. Si la presión ambiental se controla para que sea igual a la presión de vapor total en la mezcla azeotrópica, entonces la mezcla hervirá a esta temperatura fija.
La presión de vapor tanto de líquidos puros como de mezclas es una función sensible de la temperatura. Como regla general, la presión de vapor de un líquido aumenta casi exponencialmente en función de la temperatura. Si el gráfico se volviera a trazar para una temperatura fija diferente, entonces la presión de vapor total en la composición azeotrópica ciertamente cambiaría, pero también es posible que cambie la composición en la que se produce el azeótropo. Esto implica que la composición de un azeótropo se ve afectada por la presión elegida para hervir la mezcla. Normalmente, la destilación se realiza a presión atmosférica, pero con el equipo adecuado es posible llevar a cabo la destilación a una amplia variedad de presiones, tanto por encima como por debajo de la presión atmosférica.
Separación de constituyentes
Si los dos disolventes pueden formar un azeótropo negativo, la destilación de cualquier mezcla de esos constituyentes dará como resultado que el residuo esté más cerca de la composición del azeótropo que la mezcla original. Por ejemplo, si una solución de ácido clorhídrico contiene menos del 20,2 % de cloruro de hidrógeno, hervir la mezcla dejará una solución más rica en cloruro de hidrógeno que la original. Si la solución contiene inicialmente más del 20,2 % de cloruro de hidrógeno, la ebullición dejará una solución más pobre en cloruro de hidrógeno que la original. La ebullición de cualquier solución de ácido clorhídrico durante el tiempo suficiente hará que la solución que queda se acerque a la proporción azeotrópica. Por otro lado, si dos solventes pueden formar un azeótropo positivo, entonces la destilación de cualquier mezcla de esos constituyentes dará como resultado que el residuo se aleje de la composición en el azeótropo que en la mezcla original. Por ejemplo, si se destila una vez una mezcla 50/50 de etanol y agua, el destilado será 80 % de etanol y 20 % de agua, que está más cerca de la mezcla azeotrópica que la original, lo que significa que la solución que queda será más pobre en etanol. La destilación de la mezcla 80/20 % produce un destilado que es 87 % de etanol y 13 % de agua. Las destilaciones repetidas posteriores producirán mezclas que se acercan progresivamente a la relación azeotrópica de 95,5/4,5 %. Ninguna cantidad de destilaciones dará como resultado un destilado que exceda la relación azeotrópica. Asimismo, al destilar una mezcla de etanol y agua más rica en etanol que el azeótropo, el destilado (contrariamente a la intuición) será más pobre en etanol que el original pero aún más rico que el azeótropo.
La destilación es una de las principales herramientas que utilizan los químicos y los ingenieros químicos para separar las mezclas en sus componentes. Debido a que la destilación no puede separar los constituyentes de un azeótropo, la separación de mezclas azeotrópicas (también llamada rotura de azeótropos) es un tema de considerable interés. De hecho, esta dificultad llevó a algunos de los primeros investigadores a creer que los azeótropos eran en realidad compuestos de sus constituyentes. Pero hay dos razones para creer que no es así. Una es que la proporción molar de los constituyentes de un azeótropo generalmente no es la proporción de números enteros pequeños. Por ejemplo, el azeótropo formado por agua y acetonitrilo contiene 2,253 moles (o 9/4 con un error relativo de solo el 2%) de acetonitrilo por cada mol de agua. Una razón más convincente para creer que los azeótropos no son compuestos es, como se discutió en la última sección, que la composición de un azeótropo puede verse afectada por la presión. Compare eso con un compuesto verdadero, el dióxido de carbono, por ejemplo, que son dos moles de oxígeno por cada mol de carbono, sin importar a qué presión se observe el gas. Que la composición azeotrópica pueda verse afectada por la presión sugiere un medio por el cual dicha mezcla puede separarse.
Destilación por oscilación de presión
En el diagrama adyacente se muestra un azeótropo hipotético de los constituyentes X e Y. Dos conjuntos de curvas en un diagrama de fase, uno a una presión baja elegida arbitrariamente y otro a una presión elegida arbitrariamente, pero más alta. La composición del azeótropo es sustancialmente diferente entre las gráficas de alta y baja presión, mayor en X para el sistema de alta presión. El objetivo es separar X en la mayor concentración posible a partir del punto A. A baja presión, es posible por destilación progresiva llegar a un destilado en el punto, B, que está en el mismo lado del azeótropo que A. Tenga en cuenta que los pasos de destilación sucesivos cerca de la composición azeotrópica muestran muy poca diferencia en la temperatura de ebullición. Si este destilado se expone ahora a la alta presión, hierve al punto C. A partir del C, por destilación progresiva es posible llegar a un destilado en el punto D, que se encuentra en el mismo lado del azeótropo de alta presión que el C. Si ese destilado se vuelve a exponer a la baja presión, hierve en el punto E, que está en el lado opuesto del azeótropo de baja presión al A. Entonces, por medio del cambio de presión, es posible cruzar el azeótropo de baja presión.
Cuando la solución se hierve en el punto E, el destilado es más pobre en X que el residuo en el punto E. Esto significa que el residuo es más rico en X que el destilado en el punto E. De hecho, la destilación progresiva puede producir un residuo tan rico en X como se requiera.
En resumen:
1. Rectificación de baja presión (A a B) |
|
Tenga en cuenta que los dos azeótropos anteriores son del tipo positivo o de ebullición mínima; se debe tener cuidado para asegurar que se retiene el componente correcto del paso de separación, es decir, el diagrama binario fase-envolvente (curva de punto de ebullición) debe leerse correctamente.
Una mezcla de 5 % de agua con 95 % de tetrahidrofurano es un ejemplo de un azeótropo que se puede separar económicamente usando una oscilación de presión, una oscilación en este caso entre 1 atm y 8 atm. Por el contrario, la composición del azeótropo de agua a etanol discutido anteriormente no se ve lo suficientemente afectada por la presión como para separarse fácilmente usando cambios de presión y, en su lugar, se puede agregar un agente de arrastre que o modifica la composición azeotrópica y exhibe inmiscibilidad con uno de los componentes, o se puede utilizar destilación extractiva.
Destilación azeotrópica
Otros métodos de separación involucran la introducción de un agente adicional, llamado entrenador, que afectará la volatilidad de uno de los constituyentes del azeótropo más que otro. Cuando se agrega un agente de arrastre a un azeótropo binario para formar un azeótropo ternario y la mezcla resultante se destila, el método se denomina destilación azeotrópica. El ejemplo más conocido es la adición de benceno o ciclohexano al azeótropo agua/etanol. Con ciclohexano como agente de arrastre, el azeótropo ternario es 7 % de agua, 17 % de etanol y 76 % de ciclohexano, y hierve a 62,1 °C. Se añade suficiente ciclohexano al azeótropo de agua/etanol para incorporar toda el agua al azeótropo ternario. Cuando la mezcla se hierve, el azeótropo se vaporiza dejando un residuo compuesto casi en su totalidad por el exceso de etanol.
Separación por acción química
Otro tipo de agente de arrastre es el que tiene una fuerte afinidad química por uno de los constituyentes. Usando de nuevo el ejemplo del azeótropo agua/etanol, el líquido se puede agitar con óxido de calcio, que reacciona fuertemente con el agua para formar el compuesto no volátil, hidróxido de calcio. Casi todo el hidróxido de calcio se puede separar por filtración y el filtrado redestilado para obtener etanol 100% puro.
Un ejemplo más extremo es el azeótropo de 1,2 % de agua con 98,8 % de éter dietílico. El éter retiene la última gota de agua con tanta tenacidad que solo un desecante muy poderoso como el sodio metálico agregado a la fase líquida puede dar como resultado un éter completamente seco.
El cloruro de calcio anhidro se usa como desecante para secar una amplia variedad de solventes, ya que es económico y no reacciona con la mayoría de los solventes no acuosos. El cloroformo es un ejemplo de un solvente que se puede secar de manera efectiva usando cloruro de calcio.
Destilación usando una sal disuelta
Cuando una sal se disuelve en un solvente, siempre tiene el efecto de elevar el punto de ebullición de ese solvente, es decir, disminuye la volatilidad del solvente. Cuando la sal es fácilmente soluble en un constituyente de una mezcla pero no en otro, la volatilidad del constituyente en el que es soluble disminuye y el otro constituyente no se ve afectado. De esta forma, por ejemplo, es posible romper el azeótropo agua/etanol disolviendo en él acetato de potasio y destilando el resultado.
Destilación extractiva
La destilación extractiva es similar a la destilación azeotrópica, excepto que en este caso el agente de arrastre es menos volátil que cualquiera de los componentes del azeótropo. Por ejemplo, el azeótropo de 20 % de acetona con 80 % de cloroformo se puede romper agregando agua y destilando el resultado. El agua forma una capa separada en la que se disuelve preferentemente la acetona. El resultado es que el destilado es más rico en cloroformo que el azeótropo original.
Pervaporación y otros métodos de membrana
El método de pervaporación utiliza una membrana que es más permeable a un componente que a otro para separar los componentes de un azeótropo a medida que pasa de la fase líquida a la de vapor. La membrana está preparada para quedar entre las fases líquida y de vapor. Otro método de membrana es la permeación de vapor, donde los constituyentes pasan a través de la membrana completamente en fase de vapor. En todos los métodos de membrana, la membrana separa el fluido que pasa a través de ella en un permeado (lo que pasa) y un retenido (lo que queda atrás). Cuando la membrana se elige de modo que sea más permeable a un constituyente que a otro, entonces el permeado será más rico en ese primer constituyente que el retenido.
Sistemas complejos
Las reglas para azeótropos positivos y negativos se aplican a todos los ejemplos discutidos hasta ahora, pero hay algunos ejemplos que no encajan en las categorías de azeótropos positivos o negativos. El más conocido de ellos es el azeótropo ternario formado por 30 % de acetona, 47 % de cloroformo y 23 % de metanol, que hierve a 57,5 °C. Cada par de estos constituyentes forma un azeótropo binario, pero el cloroformo/metanol y la acetona/metanol forman azeótropos positivos mientras que el cloroformo/acetona forma un azeótropo negativo. El azeótropo ternario resultante no es ni positivo ni negativo. Su punto de ebullición cae entre los puntos de ebullición de la acetona y el cloroformo, por lo que no es un punto de ebullición máximo ni mínimo. Este tipo de sistema se denomina azeótropo de silla de montar. Solo los sistemas de tres o más constituyentes pueden formar azeótropos de silla de montar.
Un tipo raro de azeótropo binario complejo es aquel en el que las curvas del punto de ebullición y del punto de condensación se tocan en dos puntos del diagrama de fase. Tal sistema se denomina azeótropo doble y tendrá dos composiciones azeotrópicas y puntos de ebullición. Un ejemplo es el agua y la N-metiletilendiamina.
Contenido relacionado
Grupo de vinilo
Hidronio
Óxido de aluminio