Azatioprina
Azatioprina, vendida bajo la marca Imuran, entre otras, es un medicamento inmunosupresor. Se utiliza para el tratamiento de la artritis reumatoide, la granulomatosis con poliangeítis, la enfermedad de Crohn, la colitis ulcerosa y el lupus eritematoso sistémico; y en trasplantes de riñón para prevenir el rechazo. Está catalogado por la Agencia Internacional para la Investigación del Cáncer como carcinógeno humano del grupo 1. Se toma por vía oral o se inyecta en una vena.
Los efectos secundarios comunes incluyen supresión de la médula ósea y vómitos. La supresión de la médula ósea es especialmente común en personas con una deficiencia genética de la enzima tiopurina S-metiltransferasa. Otros factores de riesgo graves incluyen un mayor riesgo de ciertos cánceres. El uso durante el embarazo puede provocar daños al bebé. La azatioprina pertenece a la familia de medicamentos análogos de las purinas y antimetabolitos. Funciona a través de 6-tioguanina para interrumpir la producción de ARN y ADN por parte de las células.
La azatioprina se fabricó por primera vez en 1957. Está en la Lista de medicamentos esenciales de la Organización Mundial de la Salud. En 2018, ocupó el puesto 358 entre los medicamentos más recetados en los Estados Unidos, con más de 800.000 recetas.
Usos médicos
La azatioprina se usa sola o en combinación con otra terapia inmunosupresora para prevenir el rechazo después de un trasplante de órganos y para tratar una variedad de enfermedades autoinmunes, incluida la artritis reumatoide, el pénfigo, el lupus eritematoso sistémico, la enfermedad de Behçet y otras formas. de vasculitis, hepatitis autoinmune, dermatitis atópica, miastenia gravis, neuromielitis óptica (enfermedad de Devic), enfermedad pulmonar restrictiva y otras. También es una terapia importante y un agente ahorrador de esteroides para la enfermedad inflamatoria intestinal (como la enfermedad de Crohn y la colitis ulcerosa) y para la esclerosis múltiple.
En los Estados Unidos, está aprobado por la Administración de Alimentos y Medicamentos para su uso en trasplantes de riñón de donantes humanos y para la artritis reumatoide.
Trasplante
La azatioprina se usa para prevenir el rechazo de aloinjertos de riñón o hígado, generalmente junto con otras terapias que incluyen corticosteroides, otros inmunosupresores y radioterapia local. El protocolo de administración comienza ya sea en el momento del trasplante o dentro de los dos días siguientes.
Artritis reumatoide
Al ser un fármaco antirreumático modificador de la enfermedad (FAME), la azatioprina se ha utilizado para el tratamiento de los signos y síntomas de la artritis reumatoide en adultos. Los antiinflamatorios no esteroides y los corticosteroides se pueden combinar o continuar (si ya se estaban usando) con azatioprina, pero no se recomienda la combinación con otros FAME.
Enfermedad inflamatoria intestinal
La azatioprina se ha utilizado en el tratamiento de la enfermedad de Crohn crónicamente activa de moderada a grave, para mantener la remisión clínica (ausencia de actividad de la enfermedad) en pacientes dependientes de corticosteroides y para proporcionar beneficios en personas con enfermedad de Crohn fistulizante.;s enfermedad. El inicio de acción es lento y pueden ser necesarios varios meses para lograr una respuesta clínica.
El tratamiento con azatioprina se asocia con un mayor riesgo de linfoma, pero no está claro si esto se debe al fármaco o a una predisposición relacionada con la enfermedad de Crohn. Se utilizan dosis más bajas de azatioprina como terapia en niños con enfermedad de Crohn refractaria o dependiente de corticosteroides, sin causar muchos efectos secundarios. También se puede utilizar para prevenir los brotes en personas con colitis ulcerosa.
Otros
La azatioprina se utiliza a veces en el lupus eritematoso sistémico y requiere una dosis de mantenimiento de 15 mg o más de prednisona en aquellos que experimentan brotes recurrentes.
Se utiliza como terapia complementaria cuando se administra terapia con esteroides por vía oral para el pénfigo y la miastenia gravis, como tratamiento "ahorrador de esteroides" agente. La azatioprina también se usa para mantener la remisión en personas que tienen granulomatosis con poliangeítis.
Puede ser muy eficaz en el eccema y la dermatitis atópica, aunque no se utiliza habitualmente. La Sociedad Nacional Británica de Eczema lo cataloga como tratamiento de tercera línea para casos graves a moderados de estas enfermedades de la piel.
Se utilizó ampliamente para el tratamiento de la esclerosis múltiple hasta la primera mitad de la década de 1990. Las preocupaciones sobre el mayor riesgo de malignidad han llevado a un menor uso, sin embargo, todavía se usa en el tratamiento de mantenimiento para personas que recaen con frecuencia. Una revisión Cochrane de 2007 encontró que la azatioprina redujo el número de recaídas en el primer año de tratamiento y la progresión de la enfermedad en los primeros dos o tres años y no encontró un aumento en el cáncer, y señaló la necesidad de una comparación directa entre la azatioprina y el interferón beta. conclusiones contradictorias sobre el cáncer y el potencial de riesgos a largo plazo.
Una terapia ampliamente utilizada para la fibrosis pulmonar idiopática fue la azatioprina en combinación con prednisona y N-acetilcisteína. Un estudio de 2012 demostró que los resultados fueron peores con esta combinación que con placebo.
Efectos adversos

Las náuseas y los vómitos son efectos adversos comunes, especialmente al comienzo de un tratamiento. Estos casos se enfrentan con la toma de azatioprina después de las comidas o con la administración intravenosa transitoria. Los efectos secundarios que probablemente sean reacciones de hipersensibilidad incluyen mareos, diarrea, fatiga y erupciones cutáneas. La pérdida de cabello se observa a menudo en pacientes trasplantados que reciben el medicamento, pero rara vez ocurre bajo otras indicaciones. Debido a que la azatioprina suprime la médula ósea, los pacientes pueden desarrollar anemia y ser más susceptibles a las infecciones; Se recomienda un control regular del hemograma durante el tratamiento. También puede ocurrir pancreatitis aguda, especialmente en pacientes con enfermedad de Crohn. El tratamiento se interrumpe en hasta el 30 % de los pacientes debido a estos efectos, pero la monitorización terapéutica de los metabolitos biológicamente activos, es decir, nucleótidos de tiopurina, puede ayudar a optimizar la eficacia y la seguridad. Clínicamente, la mayoría de los hospitales recurren a LC-MS (cromatografía líquida – espectrometría de masas) de intercambio, pero el enfoque recientemente desarrollado de cromatografía porosa basada en carbono grafítico separada con espectrometría de masas parece superior con respecto a la atención al paciente en este sentido.
Está catalogado por la Agencia Internacional para la Investigación del Cáncer como carcinógeno del grupo 1 (cancerígeno para los humanos).
Farmacogenética
La enzima tiopurina S-metiltransferasa (TPMT) es responsable de varios pasos de activación y desactivación en el mecanismo de acción de la azatioprina. El primer paso metabólico que sufre la azatioprina en el cuerpo es la conversión a 6-mercaptopurina (6-MP; ver Farmacocinética), que es en sí misma un profármaco inmunosupresor. La enzima TPMT es responsable, en parte, de la metilación de 6-MP en el metabolito inactivo 6-metilmercaptopurina; esta metilación evita que 6-MP se convierta aún más en metabolitos activos y citotóxicos de nucleótidos de tioguanina (TGN). Ciertas variaciones genéticas dentro del gen TPMT pueden provocar una disminución o ausencia de la actividad de la enzima TPMT, y los individuos que son homocigotos o heterocigotos para estos tipos de variaciones genéticas pueden tener mayores niveles de metabolitos de TGN y un mayor riesgo de supresión grave de la médula ósea (mielosupresión) cuando recibiendo azatioprina. En muchas etnias, los polimorfismos TPMT que dan como resultado una actividad TPMT disminuida o ausente ocurren con una frecuencia de aproximadamente el 5%, lo que significa que alrededor del 0,25% de los pacientes son homocigotos para estas variantes. Sin embargo, un ensayo de la actividad de TPMT en los glóbulos rojos o una prueba genética de TPMT puede identificar a los pacientes con actividad de TPMT reducida, lo que permite ajustar la dosis de azatioprina o evitar el fármaco por completo. La etiqueta del medicamento aprobado por la FDA para la azatioprina recomienda realizar pruebas de actividad TPMT para identificar a los pacientes con riesgo de mielotoxicidad. De hecho, las pruebas de actividad de TPMT son uno de los pocos ejemplos de farmacogenética que se traduce en la atención clínica de rutina. Se ha identificado que el SNP sin sentido en NUDT15 (p. ej., rs116855232, que induce R139C)) es un factor causal de la leucopenia inducida por AZA mediante un estudio de asociación de todo el genoma (GWAS) en asiáticos orientales.
Cánceres
La azatioprina figura como carcinógeno humano en el 12.º Informe sobre carcinógenos del Programa Nacional de Toxicología del Departamento de Salud y Servicios Humanos de EE. UU., afirmando que "se sabe que es un carcinógeno humano basado en evidencia suficiente de carcinogenicidad". de estudios en humanos." Desde agosto de 2009, la FDA de EE. UU. exige que se coloquen advertencias en los envases con respecto al mayor riesgo de ciertos cánceres.
Los riesgos involucrados parecen estar relacionados tanto con la duración como con la dosis utilizada. Las personas que han sido tratadas previamente con un agente alquilante pueden tener un riesgo excesivo de sufrir cáncer si se tratan con azatioprina. Los estudios epidemiológicos realizados por la Agencia Internacional para la Investigación del Cáncer han proporcionado información "suficiente" Hay evidencia de carcinogenicidad de la azatioprina en humanos (grupo 1), aunque se cuestiona la metodología de estudios anteriores y los posibles mecanismos subyacentes.
Las diversas enfermedades que requieren trasplante pueden por sí mismas aumentar los riesgos de linfoma no Hodgkin, carcinomas de células escamosas de la piel, carcinomas hepatobiliares y tumores mesenquimales a los que la azatioprina puede agregar riesgos adicionales. Quienes reciben azatioprina para la artritis reumatoide pueden tener un riesgo menor que quienes se someten a un trasplante.
Se han notificado casos de linfoma hepatoesplénico de células T, un tipo poco común de linfoma, en pacientes tratados con azatioprina. La mayoría ocurrió en pacientes con enfermedad inflamatoria intestinal. La mayoría de los casos fueron adolescentes y adultos jóvenes varones. Presentaron un curso de enfermedad muy agresivo y, con una excepción, murieron a causa del linfoma. La FDA ha exigido cambios en el etiquetado para informar a los usuarios y médicos sobre el problema.
Cánceres de piel
En los pacientes trasplantados, el cáncer de piel es de 50 a 250 veces más común que en la población general, y entre el 60 y el 90% de los pacientes se ven afectados 20 años después del trasplante. El uso de medicamentos inmunosupresores, incluida la azatioprina, en el trasplante de órganos se ha relacionado con mayores tasas de desarrollo de cáncer de piel. La azatioprina provoca la acumulación de 6-tioguanina (6-TG) en los pacientes. ADN, que podría desencadenar cáncer cuando el paciente se exponga posteriormente a la luz ultravioleta. Se descubrió que los pacientes que tomaban azatioprina eran anormalmente sensibles a la luz UVA.
Sobredosis
Las dosis únicas grandes generalmente se toleran bien; un paciente que tomó 7,5 g de azatioprina (150 comprimidos) a la vez no mostró síntomas relevantes aparte de vómitos, una ligera disminución del recuento de glóbulos blancos y cambios marginales en los parámetros de la función hepática. Los síntomas principales de una sobredosis prolongada son infecciones de origen poco claro, úlceras en la boca y sangrado espontáneo, todos los cuales son consecuencias de la supresión de la médula ósea.
Interacciones
Otros análogos de purina, como el alopurinol, inhiben la xantina oxidasa, la enzima que descompone la azatioprina, aumentando así la toxicidad de la azatioprina. Sin embargo, se ha demostrado que dosis bajas de alopurinol mejoran de forma segura la eficacia de la azatioprina, especialmente en quienes no responden a la enfermedad inflamatoria intestinal. Esto aún puede conducir a recuentos de linfocitos más bajos y tasas más altas de infección, por lo que la combinación requiere un seguimiento cuidadoso.
La azatioprina disminuye los efectos del anticoagulante warfarina y de los relajantes musculares no despolarizantes, pero aumenta el efecto de los relajantes musculares despolarizantes. También puede interferir con la niacina (vitamina B3), provocando al menos un caso de pelagra y aplasia medular mortal.
Embarazo y lactancia
La azatioprina puede causar defectos de nacimiento. Un estudio poblacional realizado en Dinamarca en 2003 mostró que el uso de azatioprina y mercaptopurina relacionada resultó en una incidencia siete veces mayor de anomalías fetales, así como un aumento de 20 veces en los abortos espontáneos. También se han informado defectos de nacimiento en un niño cuyo padre estaba tomando azatioprina. Aunque no se han realizado estudios adecuados y bien controlados en humanos, cuando se administró a animales en dosis equivalentes a las humanas, se observó teratogénesis. Las pacientes trasplantadas que ya toman este medicamento no deben suspenderlo al quedar embarazadas. Esto contrasta con los fármacos desarrollados posteriormente, tacrolimus y micofenolato, que están contraindicados durante el embarazo.
Tradicionalmente, como ocurre con todos los medicamentos citotóxicos, el fabricante aconseja no amamantar mientras se toma azatioprina, pero la "categoría de riesgo de lactancia" informado por Thomas Hale en su libro Medications and Mothers' Milk enumera la azatioprina como "L3", denominada "moderadamente segura".
Farmacología
Farmacocinética
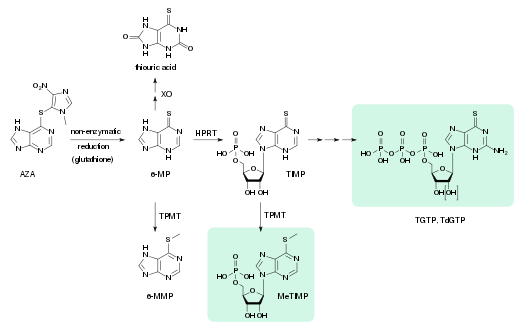
- XO: xanthine oxidase
- 6-MP: 6-mercaptopurina
- TPMT: tiopurina metiltransferasa
- 6-MMP: 6-metilmercaptopurina
- HPRT: hipoxanthine-guanine fosforibosiltransferasa
- TIMP: monofosfato tioinosino, ácido tioinosinico
- MeTIMP: monofosfato metil-tiinosino
- TGTP: thioguanosine triphosphate
- TdGTP: thio-deoxyguanosine triphosphate
La azatioprina se absorbe en el intestino en aproximadamente un 88%. La biodisponibilidad varía mucho entre pacientes individuales, entre 30 y 90%, porque el fármaco está parcialmente inactivado en el hígado. Las concentraciones plasmáticas más altas, contando no sólo el fármaco en sí sino también sus metabolitos, se alcanzan después de 1 a 2 horas, y la vida media plasmática promedio es de 26 a 80 minutos para la azatioprina y de 3 a 5 horas para el fármaco más sus metabolitos. Del 20 al 30% se unen a las proteínas plasmáticas mientras circulan en el torrente sanguíneo.
La azatioprina es un profármaco, una sustancia que no es un fármaco activo en sí mismo, pero que se activa en el organismo. Esto sucede en varios pasos; Al principio, se convierte lenta y casi por completo en 6-mercaptopurina (6-MP) mediante escisión reductora del tioéter (–S–). Esto está mediado por el glutatión y compuestos similares en la pared intestinal, el hígado y los glóbulos rojos, sin la ayuda de enzimas. La 6-MP se metaboliza de manera análoga a las purinas naturales, dando trifosfato de tioguanosina (TGTP) y trifosfato de tiodesoxiguanosina (TdGTP) a través de monofosfato de tioinosina (TIMP) y varios intermediarios más. En un segundo camino, se metila el átomo de azufre de 6-MP y TIMP. Los productos finales del metabolismo de la azatioprina son el ácido tioúrico (38%) y diversas purinas metiladas e hidroxiladas, que se excretan por la orina.
Mecanismo de acción
La azatioprina inhibe la síntesis de purinas. Las purinas son necesarias para producir ADN y ARN. Al inhibir la síntesis de purinas, se produce menos ADN y ARN para la síntesis de glóbulos blancos, provocando así inmunosupresión.
La azatioprina se convierte dentro de los tejidos en 6-MP, parte del cual se convierte, a su vez, en 6-tioguanina mediante la adición de un grupo amino. Tanto la 6-MP como la 6-tioguanina se conjugan con ribosa y luego se fosforilan para formar los nucleótidos ácido tioinosínico y ácido tioguanílico, respectivamente. Estos nucleótidos se disfrazan, respectivamente, de ácido inosínico y ácido guanílico; el primero es el punto de partida para la biosíntesis de nucleótidos de purina, mientras que el segundo es uno de los componentes básicos del ADN y el ARN.
- Los nucleótidos se incorporan en el ADN recién sintetizado (pero no funcional), deteniendo la replicación.
- Los nucleótidos actúan para inhibir la glutamina-phosphoribosyl pyrophosphate amidotransferase (GPAT), una de las enzimas involucradas en la biosíntesis purina, uno de los pasos anteriores en la síntesis del ADN y el ARN. Consiguieron la inhibición de GPAT mediante una forma de retroalimentación negativa llamada inhibición del producto. Debido a que las células replicantes activas (como las células cancerosas y las células T y B del sistema inmunitario) son más activas en la sintetización de la purina, haciendo nuevo ADN, estas células están más fuertemente afectadas.
- Una parte de los nucleótidos es además fosforilada a las formas trífosfatas. Estos se unen a la proteína de unión GTP Rac1, bloqueando la síntesis de la proteína Bcl-xL, enviando así células T activadas y células mononucleares en apoptosis (muerte celular programado). El aumento de la apoptosis de células mononucleares se observa en pacientes inflamatorios de enfermedades intestinales tratados con azathioprina.
Química
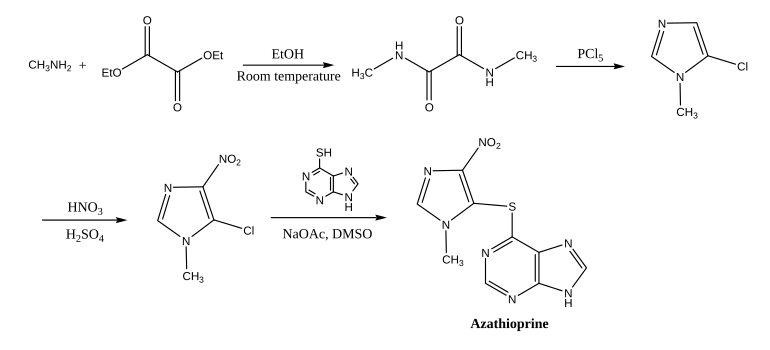
La azatioprina es una tiopurina unida a un segundo heterociclo (un derivado de imidazol) mediante un tioéter. Es un sólido de color amarillo pálido con un sabor ligeramente amargo y un punto de fusión de 238 a 245 °C. Es prácticamente insoluble en agua y sólo ligeramente soluble en disolventes lipófilos como cloroformo, etanol y dietiléter. Se disuelve en soluciones acuosas alcalinas, donde se hidroliza a 6-mercaptopurina.
La azatioprina se sintetiza a partir de 5-cloro-1-metil-4-nitro-1H-imidazol y 6-mercaptopurina en dimetilsulfóxido. La síntesis del primero comienza con una amida a partir de metilamina y oxalato de dietilo, que luego se cicla y clora con pentacloruro de fósforo; el grupo nitro se introduce con ácido nítrico y sulfúrico.
Historia
La azatioprina fue sintetizada por George Herbert Hitchings y Gertrude Elion en 1957 (llamada BW 57-322) para producir 6-MP en una forma metabólicamente activa, pero enmascarada, y al principio se utilizó como fármaco de quimioterapia.
Robert Schwartz investigó el efecto de la 6-MP en la respuesta inmune en 1958 y descubrió que suprime profundamente la formación de anticuerpos cuando se administra a conejos junto con antígenos. Siguiendo el trabajo realizado por Sir Peter Medawar y Gertrude Elion en el descubrimiento de las bases inmunológicas del rechazo de tejidos y órganos trasplantados, y las investigaciones de Schwartz sobre el 6-MP, Sir Roy Calne, el pionero británico en trasplantes, introdujo el 6-MP. como inmunosupresor experimental para trasplantes de riñón y corazón. Cuando Calne le pidió a Elion compuestos relacionados para investigar, ella sugirió azatioprina, que posteriormente Calne descubrió que era superior (tan efectiva y menos tóxica para la médula ósea).
En abril de 1962, con regímenes consistentes en azatioprina y prednisona, el trasplante de riñones a receptores no emparentados (alotrasplante) tuvo éxito por primera vez. Durante muchos años, este tipo de terapia dual con azatioprina y glucocorticoides fue el régimen antirrechazo estándar, hasta que la ciclosporina fue introducida en la práctica clínica (también por Calne) en 1978.
La ciclosporina ahora ha reemplazado parte del uso de azatioprina debido a un mayor tiempo de supervivencia, especialmente en trasplantes relacionados con el corazón. Además, a pesar de ser considerablemente más caro, el micofenolato de mofetilo también se utiliza cada vez más en lugar de la azatioprina en el trasplante de órganos, ya que se asocia con una menor supresión de la médula ósea, menos infecciones oportunistas y una menor incidencia de rechazo agudo.