Átomo cúbico
El átomo cúbico fue uno de los primeros modelos atómicos en el que los electrones se colocaban en las ocho esquinas de un cubo en un átomo o molécula no polar. Esta teoría fue desarrollada en 1902 por Gilbert N. Lewis y publicada en 1916 en el artículo "The Atom and the Molecule" y se utiliza para explicar el fenómeno de la valencia. Lewis' La teoría se basó en la regla de Abegg. Fue desarrollado aún más en 1919 por Irving Langmuir como el átomo de octeto cúbico. La siguiente figura muestra representaciones estructurales de los elementos de la segunda fila de la tabla periódica.
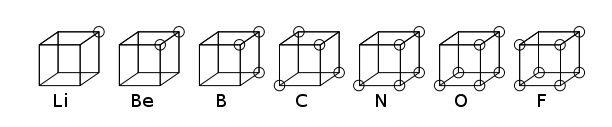
Aunque el modelo cúbico del átomo pronto fue abandonado en favor del modelo mecánico cuántico basado en la ecuación de Schrödinger y, por lo tanto, ahora es principalmente de interés histórico, representó un paso importante hacia la comprensión del enlace químico. El artículo de Lewis de 1916 también introdujo el concepto de par de electrones en el enlace covalente, la regla del octeto y la ahora llamada estructura de Lewis.
Enlace en el modelo del átomo cúbico
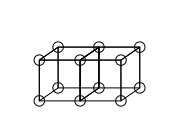
Los enlaces covalentes simples se forman cuando dos átomos comparten un borde, como en la estructura C a continuación. Esto da como resultado el intercambio de dos electrones. Los enlaces iónicos se forman mediante la transferencia de un electrón de un cubo a otro sin compartir arista (estructura A). Lewis también postuló un estado intermedio en el que sólo se comparte una esquina (estructura B).
Los dobles enlaces se forman al compartir una cara entre dos átomos cúbicos. Esto da como resultado compartir cuatro electrones:
El modelo del átomo cúbico no puede explicar los enlaces triples, porque no hay forma de que dos cubos compartan tres aristas paralelas. Lewis sugirió que los pares de electrones en los enlaces atómicos tienen una atracción especial, lo que da como resultado una estructura tetraédrica, como en la figura siguiente (la nueva ubicación de los electrones está representada por los círculos punteados en el medio de los bordes gruesos). Esto permite la formación de un enlace simple al compartir una esquina, un enlace doble al compartir un borde y un enlace triple al compartir una cara. También explica la rotación libre alrededor de enlaces simples y la geometría tetraédrica del metano.
Contenido relacionado
Aldona de Lituania
Alfonso iii
Adhemar de Le Puy