Átomo
Un átomo es la unidad más pequeña de materia ordinaria que forma un elemento químico. Todo sólido, líquido, gas y plasma está compuesto de átomos neutros o ionizados. Los átomos son extremadamente pequeños, normalmente alrededor de 100 picómetros de diámetro. Son tan pequeños que predecir con precisión su comportamiento utilizando la física clásica, como si fueran pelotas de tenis, por ejemplo, no es posible debido a los efectos cuánticos.
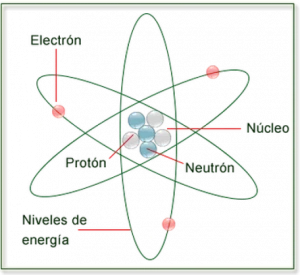
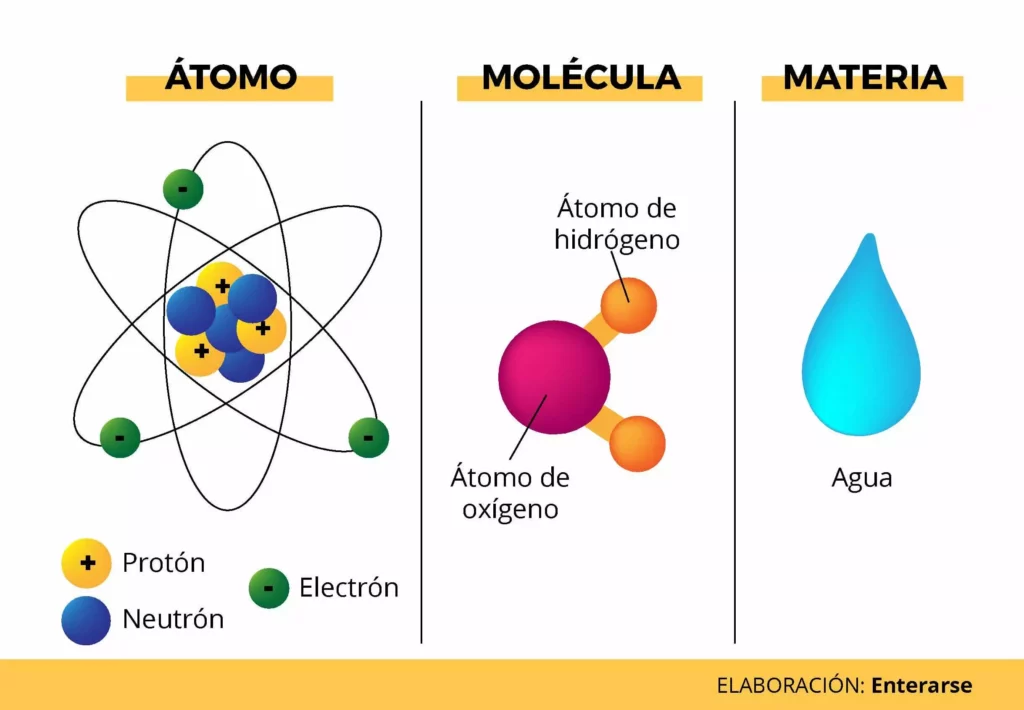
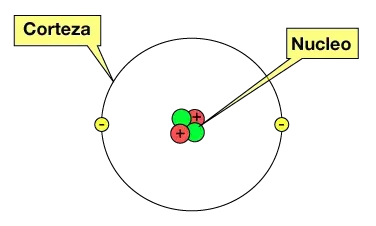
Cada átomo está compuesto por un núcleo y uno o más electrones unidos al núcleo. El núcleo está formado por uno o más protones y varios neutrones. Solo la variedad más común de hidrógeno no tiene neutrones. Más del 99,94% de la masa de un átomo está en el núcleo. Los protones tienen carga eléctrica positiva, los electrones tienen carga eléctrica negativa y los neutrones no tienen carga eléctrica. Si el número de protones y electrones es igual, entonces el átomo es eléctricamente neutro. Si un átomo tiene más o menos electrones que protones, entonces tiene una carga general negativa o positiva, respectivamente; estos átomos se denominan iones.
Los electrones de un átomo son atraídos por los protones en un núcleo atómico por la fuerza electromagnética. Los protones y neutrones en el núcleo son atraídos entre sí por la fuerza nuclear. Esta fuerza suele ser más fuerte que la fuerza electromagnética que repele los protones cargados positivamente entre sí. Bajo ciertas circunstancias, la fuerza electromagnética de repulsión se vuelve más fuerte que la fuerza nuclear. En este caso, el núcleo se divide y deja atrás diferentes elementos. Esta es una forma de descomposición nuclear.
El número de protones en el núcleo es el número atómico y define a qué elemento químico pertenece el átomo. Por ejemplo, cualquier átomo que contenga 29 protones es cobre. El número de neutrones define el isótopo del elemento. Los átomos pueden unirse a uno o más átomos mediante enlaces químicos para formar compuestos químicos como moléculas o cristales. La capacidad de los átomos para asociarse y disociarse es responsable de la mayoría de los cambios físicos observados en la naturaleza. La química es la disciplina que estudia estos cambios.
Historia de la teoría atómica
En filosofía
La idea básica de que la materia está formada por partículas diminutas e indivisibles aparece en muchas culturas antiguas, como las de Grecia e India. La palabra átomo se deriva de la palabra griega antigua atomos (una combinación del término negativo "a-" y "τομή", el término para "cortar") que significa "incortable". Esta antigua idea se basaba en el razonamiento filosófico más que en el razonamiento científico; la teoría atómica moderna no se basa en estos viejos conceptos. No obstante, el término "átomo" fue utilizado a lo largo de los siglos por pensadores que sospechaban que, en última instancia, la materia era de naturaleza granular. Desde entonces se ha descubierto que los "átomos" se pueden dividir, pero todavía se usa el nombre inapropiado.
Ley de Dalton de las proporciones múltiples
A principios del siglo XIX, el químico inglés John Dalton recopiló datos experimentales recopilados por él mismo y otros científicos y descubrió un patrón que ahora se conoce como la "ley de las proporciones múltiples". Observó que en los compuestos químicos que contienen un elemento químico en particular, el contenido de ese elemento en estos compuestos diferirá en proporciones de números enteros pequeños. Este patrón le sugirió a Dalton que cada elemento químico se combina con otros por alguna unidad de masa básica y consistente.
Por ejemplo, hay dos tipos de óxido de estaño: uno es un polvo negro que tiene un 88,1 % de estaño y un 11,9 % de oxígeno, y el otro es un polvo blanco que tiene un 78,7 % de estaño y un 21,3 % de oxígeno. Ajustando estas cifras, en el óxido negro hay unos 13,5 g de oxígeno por cada 100 g de estaño, y en el óxido blanco hay unos 27 g de oxígeno por cada 100 g de estaño. 13,5 y 27 forman una relación de 1:2. En estos óxidos, por cada átomo de estaño hay uno o dos átomos de oxígeno respectivamente (SnO y SnO 2 ).
Como segundo ejemplo, Dalton consideró dos óxidos de hierro: un polvo negro que tiene un 78,1 % de hierro y un 21,9 % de oxígeno, y un polvo rojo que tiene un 70,4 % de hierro y un 29,6 % de oxígeno. Ajustando estas cifras, en el óxido negro hay unos 28 g de oxígeno por cada 100 g de hierro, y en el óxido rojo hay unos 42 g de oxígeno por cada 100 g de hierro. 28 y 42 forman una relación de 2:3. En estos respectivos óxidos, por cada dos átomos de hierro, hay dos o tres átomos de oxígeno (Fe 2 O 2 y Fe 2 O 3 ).
Como ejemplo final: el óxido nitroso es 63,3 % nitrógeno y 36,7 % oxígeno, el óxido nítrico es 44,05 % nitrógeno y 55,95 % oxígeno, y el dióxido de nitrógeno es 29,5 % nitrógeno y 70,5 % oxígeno. Ajustando estas cifras, en el óxido nitroso hay 80 g de oxígeno por cada 140 g de nitrógeno, en el óxido nítrico hay unos 160 g de oxígeno por cada 140 g de nitrógeno, y en el dióxido de nitrógeno hay 320 g de oxígeno por cada 140 g de nitrógeno. g de nitrógeno. 80, 160 y 320 forman una proporción de 1:2:4. Las fórmulas respectivas de estos óxidos son N 2 O, NO y NO 2 .
Teoría cinética de los gases.
A fines del siglo XVIII, varios científicos descubrieron que podían explicar mejor el comportamiento de los gases describiéndolos como colecciones de partículas submicroscópicas y modelando su comportamiento utilizando estadísticas y probabilidad. A diferencia de la teoría atómica de Dalton, la teoría cinética de los gases no describe cómo reaccionan químicamente los gases entre sí para formar compuestos, sino cómo se comportan físicamente: difusión, viscosidad, conductividad, presión, etc.
Movimiento browniano
En 1827, el botánico Robert Brown usó un microscopio para observar los granos de polvo que flotaban en el agua y descubrió que se movían de forma errática, un fenómeno que se conoció como "movimiento browniano". Se pensaba que esto se debía a que las moléculas de agua golpeaban los granos. En 1905, Albert Einstein demostró la realidad de estas moléculas y sus movimientos al producir el primer análisis físico estadístico del movimiento browniano. El físico francés Jean Perrin usó el trabajo de Einstein para determinar experimentalmente la masa y las dimensiones de las moléculas, proporcionando así evidencia física de la naturaleza de las partículas de la materia.
Descubrimiento del electrón
En 1897, JJ Thomson descubrió que los rayos catódicos no son ondas electromagnéticas sino que están formados por partículas que son 1.800 veces más ligeras que el hidrógeno (el átomo más ligero). Thomson concluyó que estas partículas provenían de los átomos dentro del cátodo: eran partículas subatómicas . Llamó a estas nuevas partículas corpúsculos , pero luego se les cambió el nombre a electrones . Thomson también demostró que los electrones eran idénticos a las partículas emitidas por materiales fotoeléctricos y radiactivos. Rápidamente se reconoció que los electrones son las partículas que transportan corrientes eléctricas en los cables metálicos. Thomson concluyó que estos electrones surgieron de los mismos átomos del cátodo en sus instrumentos, lo que significaba que los átomos no son indivisibles como el nombre atomos. sugiere.
Descubrimiento del núcleo
JJ Thomson pensó que los electrones cargados negativamente se distribuyeron por todo el átomo en un mar de carga positiva que se distribuyó por todo el volumen del átomo. Este modelo a veces se conoce como modelo de pudín de ciruelas.
Ernest Rutherford y sus colegas Hans Geiger y Ernest Marsden comenzaron a tener dudas sobre el modelo de Thomson después de que encontraron dificultades cuando intentaron construir un instrumento para medir la relación carga-masa de las partículas alfa (estas son partículas cargadas positivamente emitidas por determinadas sustancias radiactivas como el radio). Las partículas alfa estaban siendo dispersadas por el aire en la cámara de detección, lo que hizo que las mediciones no fueran confiables. Thomson se había encontrado con un problema similar en su trabajo sobre los rayos catódicos, que resolvió creando un vacío casi perfecto en sus instrumentos. Rutherford no pensó que se encontraría con el mismo problema porque las partículas alfa son mucho más pesadas que los electrones. Según el modelo del átomo de Thomson, la carga positiva en el átomo no está lo suficientemente concentrada para producir un campo eléctrico lo suficientemente fuerte como para desviar una partícula alfa, y los electrones son tan livianos que las partículas alfa, mucho más pesadas, deberían apartarlos sin esfuerzo. Sin embargo, hubo dispersión, por lo que Rutherford y sus colegas decidieron investigar esta dispersión cuidadosamente.
Entre 1908 y 1913, Rutheford y sus colegas realizaron una serie de experimentos en los que bombardearon finas láminas de metal con partículas alfa. Detectaron partículas alfa desviadas en ángulos superiores a 90°. Para explicar esto, Rutherford propuso que la carga positiva del átomo no se distribuye por todo el volumen del átomo como creía Thomson, sino que se concentra en un diminuto núcleo en el centro. Solo una concentración de carga tan intensa podría producir un campo eléctrico lo suficientemente fuerte como para desviar las partículas alfa como se observa.
Descubrimiento de isótopos
Mientras experimentaba con los productos de la desintegración radiactiva, en 1913 el radioquímico Frederick Soddy descubrió que parecía haber más de un tipo de átomo en cada posición de la tabla periódica. El término isótopo fue acuñado por Margaret Todd como un nombre adecuado para diferentes átomos que pertenecen a un mismo elemento. JJ Thomson creó una técnica para la separación de isótopos a través de su trabajo sobre gases ionizados, que posteriormente condujo al descubrimiento de isótopos estables.
Modelo bohr
En 1913, el físico Niels Bohr propuso un modelo en el que se suponía que los electrones de un átomo giraban alrededor del núcleo, pero solo podían hacerlo en un conjunto finito de órbitas, y podían saltar entre estas órbitas solo en cambios discretos de energía correspondientes a la absorción. o radiación de un fotón. Esta cuantización se usó para explicar por qué las órbitas de los electrones son estables (dado que normalmente las cargas en aceleración, incluido el movimiento circular, pierden energía cinética que se emite como radiación electromagnética, ver radiación de sincrotrón ) y por qué los elementos absorben y emiten radiación electromagnética en forma discreta. espectros
Más tarde, en el mismo año, Henry Moseley proporcionó evidencia experimental adicional a favor de la teoría de Niels Bohr. Estos resultados refinaron el modelo de Ernest Rutherford y Antonius van den Broek, que proponía que el átomo contiene en su núcleo un número de cargas nucleares positivas que es igual a su número (atómico) en la tabla periódica. Hasta estos experimentos, no se sabía que el número atómico fuera una cantidad física y experimental. Que sea igual a la carga nuclear atómica sigue siendo el modelo atómico aceptado hoy.
Los enlaces químicos entre átomos fueron explicados por Gilbert Newton Lewis en 1916, como las interacciones entre sus electrones constituyentes. Como se sabía que las propiedades químicas de los elementos se repetían en gran medida de acuerdo con la ley periódica, en 1919 el químico estadounidense Irving Langmuir sugirió que esto podría explicarse si los electrones de un átomo estuvieran conectados o agrupados de alguna manera. Se pensaba que los grupos de electrones ocupaban un conjunto de capas de electrones alrededor del núcleo.
El modelo de Bohr del átomo fue el primer modelo físico completo del átomo. Describió la estructura general del átomo, cómo los átomos se unen entre sí y predijo las líneas espectrales del hidrógeno. El modelo de Bohr no era perfecto y pronto fue reemplazado por el modelo de Schrödinger, más preciso, pero fue suficiente para evaporar cualquier duda restante de que la materia está compuesta de átomos. Para los químicos, la idea del átomo había sido una herramienta heurística útil, pero los físicos tenían dudas sobre si la materia realmente está formada por átomos, ya que nadie había desarrollado aún un modelo físico completo del átomo.
El modelo de Schrödinger
El experimento de Stern-Gerlach de 1922 proporcionó más pruebas de la naturaleza cuántica de las propiedades atómicas. Cuando un haz de átomos de plata pasó a través de un campo magnético de forma especial, el haz se dividió de una manera correlacionada con la dirección del momento angular o espín de un átomo. Como esta dirección de giro es inicialmente aleatoria, se esperaría que el haz se desviara en una dirección aleatoria. En cambio, el haz se dividió en dos componentes direccionales, correspondientes a la orientación del espín atómico hacia arriba o hacia abajo con respecto al campo magnético.
En 1925, Werner Heisenberg publicó la primera formulación matemática consistente de la mecánica cuántica (mecánica de matrices). Un año antes, Louis de Broglie había propuesto la hipótesis de de Broglie: que todas las partículas se comportan como ondas hasta cierto punto, y en 1926 Erwin Schrödinger utilizó esta idea para desarrollar la ecuación de Schrödinger, un modelo matemático del átomo (mecánica ondulatoria) que describía los electrones como formas de onda tridimensionales en lugar de partículas puntuales.
Una consecuencia del uso de formas de onda para describir partículas es que es matemáticamente imposible obtener valores precisos tanto para la posición como para el momento de una partícula en un momento dado; esto se conoció como el principio de incertidumbre, formulado por Werner Heisenberg en 1927. En este concepto, para una precisión dada en la medición de una posición, solo se podía obtener un rango de valores probables para el momento, y viceversa. Este modelo pudo explicar las observaciones del comportamiento atómico que los modelos anteriores no pudieron, como ciertos patrones estructurales y espectrales de átomos más grandes que el hidrógeno. Por lo tanto, el modelo planetario del átomo se descartó en favor de uno que describía las zonas orbitales atómicas alrededor del núcleo donde es más probable que se observe un electrón dado.
Descubrimiento del neutrón

El desarrollo del espectrómetro de masas permitió medir la masa de los átomos con mayor precisión. El dispositivo utiliza un imán para doblar la trayectoria de un haz de iones, y la cantidad de desviación está determinada por la relación entre la masa de un átomo y su carga. El químico Francis William Aston utilizó este instrumento para demostrar que los isótopos tenían masas diferentes. La masa atómica de estos isótopos variaba en cantidades enteras, lo que se conoce como la regla del número entero. La explicación de estos diferentes isótopos esperó el descubrimiento del neutrón, una partícula sin carga con una masa similar al protón, por parte del físico James Chadwick en 1932. Los isótopos se explicaron entonces como elementos con el mismo número de protones, pero diferente número de neutrones. dentro del núcleo.
Fisión, física de altas energías y materia condensada
En 1938, el químico alemán Otto Hahn, alumno de Rutherford, dirigió neutrones sobre átomos de uranio esperando obtener elementos transuránicos. En cambio, sus experimentos químicos mostraron bario como producto. Un año después, Lise Meitner y su sobrino Otto Frisch comprobaron que el resultado de Hahn fue la primera fisión nuclear experimental . En 1944, Hahn recibió el Premio Nobel de Química. A pesar de los esfuerzos de Hahn, las contribuciones de Meitner y Frisch no fueron reconocidas.
En la década de 1950, el desarrollo de aceleradores de partículas y detectores de partículas mejorados permitió a los científicos estudiar los impactos de los átomos que se mueven a altas energías. Se descubrió que los neutrones y los protones eran hadrones, o compuestos de partículas más pequeñas llamadas quarks. Se desarrolló el modelo estándar de física de partículas que hasta ahora ha explicado con éxito las propiedades del núcleo en términos de estas partículas subatómicas y las fuerzas que gobiernan sus interacciones.
Estructura
Partículas subatómicas
Aunque la palabra átomo originalmente denotaba una partícula que no se puede dividir en partículas más pequeñas, en el uso científico moderno el átomo se compone de varias partículas subatómicas. Las partículas constituyentes de un átomo son el electrón, el protón y el neutrón.
El electrón es, con mucho, la menos masiva de estas partículas en9,11 × 10 kg , con carga eléctrica negativa y un tamaño demasiado pequeño para medirlo con las técnicas disponibles. Fue la partícula más ligera con una masa en reposo positiva medida, hasta el descubrimiento de la masa del neutrino. En condiciones ordinarias, los electrones están unidos al núcleo cargado positivamente por la atracción creada por las cargas eléctricas opuestas. Si un átomo tiene más o menos electrones que su número atómico, entonces se carga negativa o positivamente como un todo, respectivamente; un átomo cargado se llama ion. Los electrones se conocen desde finales del siglo XIX, principalmente gracias a JJ Thomson; ver historia de la física subatómica para más detalles.
Los protones tienen una carga positiva y una masa 1836 veces mayor que la del electrón, en1,6726 × 10 kg . El número de protones en un átomo se llama su número atómico. Ernest Rutherford (1919) observó que el nitrógeno bajo el bombardeo de partículas alfa expulsa lo que parecían ser núcleos de hidrógeno. Para 1920 había aceptado que el núcleo de hidrógeno es una partícula distinta dentro del átomo y lo llamó protón.
Los neutrones no tienen carga eléctrica y tienen una masa libre de 1839 veces la masa del electrón, o1,6749 × 10 kg . Los neutrones son las más pesadas de las tres partículas constituyentes, pero su masa puede reducirse por la energía de enlace nuclear. Los neutrones y los protones (conocidos colectivamente como nucleones) tienen dimensiones comparables, del orden de2,5 × 10 m , aunque la "superficie" de estas partículas no está claramente definida. El neutrón fue descubierto en 1932 por el físico inglés James Chadwick.
En el modelo estándar de la física, los electrones son verdaderamente partículas elementales sin estructura interna, mientras que los protones y los neutrones son partículas compuestas de partículas elementales llamadas quarks. Hay dos tipos de quarks en los átomos, cada uno con una carga eléctrica fraccionaria. Los protones están compuestos por dos quarks up (cada uno con carga +2/3) y un quark down (con una carga de −1/3). Los neutrones están formados por un quark up y dos quarks down. Esta distinción explica la diferencia de masa y carga entre las dos partículas.
Los quarks se mantienen unidos por la interacción fuerte (o fuerza fuerte), que está mediada por gluones. Los protones y los neutrones, a su vez, se mantienen unidos en el núcleo por la fuerza nuclear, que es un residuo de la fuerza fuerte que tiene propiedades de rango algo diferentes (consulte el artículo sobre la fuerza nuclear para obtener más información). El gluón es un miembro de la familia de bosones de medida, que son partículas elementales que median fuerzas físicas.
Núcleo
Todos los protones y neutrones unidos en un átomo forman un pequeño núcleo atómico y se denominan colectivamente nucleones. El radio de un núcleo es aproximadamente igual a ![{\displaystyle 1.07{\sqrt[{3}]{A}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a74a6ca6998768195969eef75ca046e8431c29d3)

Los átomos de un mismo elemento tienen el mismo número de protones, llamado número atómico. Dentro de un solo elemento, el número de neutrones puede variar, determinando el isótopo de ese elemento. El número total de protones y neutrones determina el nucleido. El número de neutrones en relación con los protones determina la estabilidad del núcleo, con ciertos isótopos que sufren decaimiento radiactivo.
El protón, el electrón y el neutrón se clasifican como fermiones. Los fermiones obedecen al principio de exclusión de Pauli que prohíbe que fermiones idénticos , como protones múltiples, ocupen el mismo estado cuántico al mismo tiempo. Así, cada protón del núcleo debe ocupar un estado cuántico diferente de todos los demás protones, y lo mismo se aplica a todos los neutrones del núcleo ya todos los electrones de la nube de electrones.
Un núcleo que tiene una cantidad diferente de protones que de neutrones puede caer potencialmente a un estado de energía más bajo a través de una desintegración radiactiva que hace que la cantidad de protones y neutrones coincida más. Como resultado, los átomos con el mismo número de protones y neutrones son más estables frente a la descomposición, pero a medida que aumenta el número atómico, la repulsión mutua de los protones requiere una proporción creciente de neutrones para mantener la estabilidad del núcleo.
El número de protones y neutrones en el núcleo atómico se puede modificar, aunque esto puede requerir energías muy altas debido a la fuerza fuerte. La fusión nuclear ocurre cuando múltiples partículas atómicas se unen para formar un núcleo más pesado, como por ejemplo a través de la colisión energética de dos núcleos. Por ejemplo, en el núcleo del Sol, los protones requieren energías de 3 a 10 keV para superar su repulsión mutua (la barrera de Coulomb) y fusionarse en un solo núcleo. La fisión nuclear es el proceso opuesto, que hace que un núcleo se divida en dos núcleos más pequeños, generalmente a través de la desintegración radiactiva. El núcleo también se puede modificar mediante el bombardeo de partículas subatómicas de alta energía o fotones. Si esto modifica el número de protones en un núcleo, el átomo cambia a un elemento químico diferente.
Si la masa del núcleo después de una reacción de fusión es menor que la suma de las masas de las partículas separadas, entonces la diferencia entre estos dos valores puede emitirse como un tipo de energía utilizable (como un rayo gamma o la energía cinética de una partícula beta), como se describe en la fórmula de equivalencia masa-energía de Albert Einstein, 


La fusión de dos núcleos que crean núcleos más grandes con números atómicos más bajos que el hierro y el níquel (un número total de nucleones de aproximadamente 60) suele ser un proceso exotérmico que libera más energía de la necesaria para unirlos. Es este proceso de liberación de energía lo que hace que la fusión nuclear en las estrellas sea una reacción autosuficiente. Para núcleos más pesados, la energía de enlace por nucleón en el núcleo comienza a disminuir. Eso significa que los procesos de fusión que producen núcleos que tienen números atómicos superiores a 26 y masas atómicas superiores a 60, es un proceso endotérmico. Estos núcleos más masivos no pueden sufrir una reacción de fusión productora de energía que pueda mantener el equilibrio hidrostático de una estrella.
Nube de electrones
Los electrones en un átomo son atraídos por los protones en el núcleo por la fuerza electromagnética. Esta fuerza une a los electrones dentro de un pozo de potencial electrostático que rodea al núcleo más pequeño, lo que significa que se necesita una fuente externa de energía para que el electrón escape. Cuanto más cerca está un electrón del núcleo, mayor es la fuerza de atracción. Por lo tanto, los electrones unidos cerca del centro del pozo de potencial requieren más energía para escapar que los que se encuentran a mayores separaciones.
Los electrones, como otras partículas, tienen propiedades tanto de partícula como de onda. La nube de electrones es una región dentro del pozo de potencial donde cada electrón forma un tipo de onda estacionaria tridimensional, una forma de onda que no se mueve en relación con el núcleo. Este comportamiento está definido por un orbital atómico, una función matemática que caracteriza la probabilidad de que un electrón parezca estar en una ubicación particular cuando se mide su posición. Solo existe un conjunto discreto (o cuantificado) de estos orbitales alrededor del núcleo, ya que otros posibles patrones de onda decaen rápidamente en una forma más estable. Los orbitales pueden tener una o más estructuras de anillos o nodos, y difieren entre sí en tamaño, forma y orientación.
Cada orbital atómico corresponde a un nivel de energía particular del electrón. El electrón puede cambiar su estado a un nivel de energía superior al absorber un fotón con suficiente energía para impulsarlo al nuevo estado cuántico. Asimismo, a través de la emisión espontánea, un electrón en un estado de mayor energía puede caer a un estado de menor energía mientras irradia el exceso de energía como un fotón. Estos valores energéticos característicos, definidos por las diferencias en las energías de los estados cuánticos, son los responsables de las líneas espectrales atómicas.
La cantidad de energía necesaria para eliminar o agregar un electrón, la energía de enlace de electrones, es mucho menor que la energía de enlace de los nucleones. Por ejemplo, se requieren solo 13,6 eV para extraer un electrón del estado fundamental de un átomo de hidrógeno, en comparación con 2,23 millones de eV para dividir un núcleo de deuterio. Los átomos son eléctricamente neutros si tienen el mismo número de protones y electrones. Los átomos que tienen un déficit o un exceso de electrones se llaman iones. Los electrones que están más alejados del núcleo pueden transferirse a otros átomos cercanos o compartirse entre átomos. Mediante este mecanismo, los átomos pueden unirse en moléculas y otros tipos de compuestos químicos como cristales de redes iónicas y covalentes.
Propiedades
Propiedades nucleares
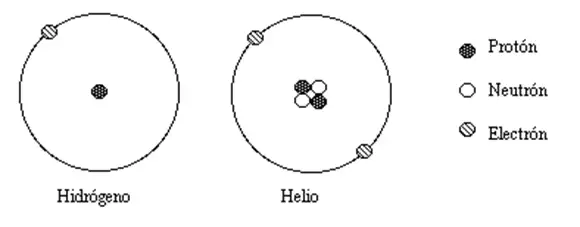
Por definición, dos átomos cualesquiera con el mismo número de protones en sus núcleos pertenecen al mismo elemento químico. Los átomos con igual número de protones pero diferente número de neutrones son isótopos diferentes del mismo elemento. Por ejemplo, todos los átomos de hidrógeno admiten exactamente un protón, pero existen isótopos sin neutrones (hidrógeno-1, con mucho la forma más común, también llamada protio), un neutrón (deuterio), dos neutrones (tritio) y más de dos neutrones. . Los elementos conocidos forman un conjunto de números atómicos, desde el elemento hidrógeno de un solo protón hasta el elemento oganesón de 118 protones.Todos los isótopos conocidos de elementos con números atómicos superiores a 82 son radiactivos, aunque la radiactividad del elemento 83 (bismuto) es tan pequeña que es prácticamente insignificante.
Alrededor de 339 nucleidos ocurren naturalmente en la Tierra,de los cuales 252 (alrededor del 74%) no se ha observado que se desintegren y se denominan "isótopos estables". Solo 90 nucleidos son teóricamente estables, mientras que otros 162 (lo que eleva el total a 252) no se ha observado que se desintegren, aunque en teoría es energéticamente posible. Estos también se clasifican formalmente como "estables". Otros 34 nucleidos radiactivos tienen vidas medias de más de 100 millones de años y son lo suficientemente longevos como para haber estado presentes desde el nacimiento del Sistema Solar. Esta colección de 286 nucleidos se conoce como nucleidos primordiales. Finalmente, se sabe que 53 nucleidos adicionales de vida corta ocurren naturalmente, como productos secundarios de la descomposición de nucleidos primordiales (como el radio del uranio), o como productos de procesos energéticos naturales en la Tierra, como el bombardeo de rayos cósmicos (por ejemplo, carbono -14).
Para 80 de los elementos químicos, existe al menos un isótopo estable. Como regla general, solo hay un puñado de isótopos estables para cada uno de estos elementos, el promedio es de 3,2 isótopos estables por elemento. Veintiséis elementos tienen un solo isótopo estable, mientras que el mayor número de isótopos estables observados para cualquier elemento es diez, para el elemento estaño. Los elementos 43, 61 y todos los elementos con el número 83 o superior no tienen isótopos estables.
La estabilidad de los isótopos se ve afectada por la relación entre protones y neutrones, y también por la presencia de ciertos "números mágicos" de neutrones o protones que representan capas cuánticas cerradas y llenas. Estas capas cuánticas corresponden a un conjunto de niveles de energía dentro del modelo de capa del núcleo; las capas llenas, como la capa llena de 50 protones para el estaño, confieren una estabilidad inusual al nucleido. De los 252 nucleidos estables conocidos, solo cuatro tienen un número impar de protones ynúmero impar de neutrones: hidrógeno-2 (deuterio), litio-6, boro-10 y nitrógeno-14. Además, solo cuatro nucleidos impares radiactivos de origen natural tienen una vida media de más de mil millones de años: potasio-40, vanadio-50, lantano-138 y tantalio-180m. La mayoría de los núcleos impares son muy inestables con respecto a la desintegración beta, porque los productos de la desintegración son pares-pares y, por lo tanto, están más fuertemente unidos debido a los efectos de emparejamiento nuclear.
Masa
La gran mayoría de la masa de un átomo proviene de los protones y neutrones que lo componen. El número total de estas partículas (llamadas "nucleones") en un átomo dado se llama número de masa. Es un número entero positivo y adimensional (en lugar de tener dimensión de masa), porque expresa una cuenta. Un ejemplo del uso de un número de masa es "carbono-12", que tiene 12 nucleones (seis protones y seis neutrones).
La masa real de un átomo en reposo a menudo se expresa en daltons (Da), también llamada unidad de masa atómica unificada (u). Esta unidad se define como la doceava parte de la masa de un átomo neutro libre de carbono-12, que es aproximadamente1,66 × 10 kg . El hidrógeno-1 (el isótopo más ligero de hidrógeno que también es el nucleido con la masa más baja) tiene un peso atómico de 1,007825 Da. El valor de este número se llama masa atómica. Un átomo dado tiene una masa atómica aproximadamente igual (dentro del 1%) a su número de masa multiplicado por la unidad de masa atómica (por ejemplo, la masa de un nitrógeno-14 es aproximadamente 14 Da), pero este número no será exactamente un número entero excepto ( por definición) en el caso del carbono-12. El átomo estable más pesado es el plomo-208, con una masa de207.976 6521 Da .
Como incluso los átomos más masivos son demasiado ligeros para trabajar con ellos directamente, los químicos utilizan la unidad de moles. Un mol de átomos de cualquier elemento siempre tiene el mismo número de átomos (aproximadamente6.022 × 10 ). Este número se eligió para que si un elemento tiene una masa atómica de 1 u, un mol de átomos de ese elemento tiene una masa cercana a un gramo. Debido a la definición de la unidad de masa atómica unificada, cada átomo de carbono-12 tiene una masa atómica de exactamente 12 Da, por lo que un mol de átomos de carbono-12 pesa exactamente 0,012 kg.
Forma y tamaño
Los átomos carecen de un límite exterior bien definido, por lo que sus dimensiones generalmente se describen en términos de un radio atómico. Esta es una medida de la distancia a la que se extiende la nube de electrones desde el núcleo. Esto supone que el átomo exhibe una forma esférica, que solo se cumple para los átomos en el vacío o en el espacio libre. Los radios atómicos pueden derivarse de las distancias entre dos núcleos cuando los dos átomos se unen en un enlace químico. El radio varía según la ubicación de un átomo en la carta atómica, el tipo de enlace químico, el número de átomos vecinos (número de coordinación) y una propiedad mecánica cuántica conocida como espín. En la tabla periódica de los elementos, el tamaño del átomo tiende a aumentar cuando se mueve hacia abajo en las columnas, pero disminuye cuando se mueve a través de las filas (de izquierda a derecha). En consecuencia, el átomo más pequeño es el helio con un radio de 32 pm, mientras que uno de los más grandes es el cesio con 225 pm.
Cuando se somete a fuerzas externas, como campos eléctricos, la forma de un átomo puede desviarse de la simetría esférica. La deformación depende de la magnitud del campo y del tipo de orbital de los electrones de la capa externa, como se muestra en las consideraciones de teoría de grupos. Las desviaciones asféricas pueden provocarse, por ejemplo, en cristales, donde pueden producirse grandes campos eléctricos de cristal en sitios de red de baja simetría. Se ha demostrado que se producen deformaciones elipsoidales significativas para los iones de azufre y los iones de calcógeno en compuestos de tipo pirita.
Las dimensiones atómicas son miles de veces más pequeñas que las longitudes de onda de la luz (400-700 nm), por lo que no se pueden ver con un microscopio óptico, aunque se pueden observar átomos individuales con un microscopio de efecto túnel. Para visualizar la minuciosidad del átomo, considere que un cabello humano típico tiene aproximadamente 1 millón de átomos de carbono de ancho. Una sola gota de agua contiene alrededor de 2 sextillones (2 × 10 ) átomos de oxígeno y el doble de átomos de hidrógeno. Un diamante de un solo quilate con una masa de2 × 10 kg contienen alrededor de 10 sextillones (10 ) de átomos de carbono. Si una manzana fuera ampliada al tamaño de la Tierra, entonces los átomos en la manzana serían aproximadamente del tamaño de la manzana original.
Desintegración radioactiva
Cada elemento tiene uno o más isótopos que tienen núcleos inestables que están sujetos a la descomposición radiactiva, lo que hace que el núcleo emita partículas o radiación electromagnética. La radiactividad puede ocurrir cuando el radio de un núcleo es grande en comparación con el radio de la fuerza fuerte, que solo actúa en distancias del orden de 1 fm.
Las formas más comunes de desintegración radiactiva son:
- Desintegración alfa: este proceso se produce cuando el núcleo emite una partícula alfa, que es un núcleo de helio formado por dos protones y dos neutrones. El resultado de la emisión es un nuevo elemento con un número atómico más bajo.
- Decaimiento beta (y captura de electrones): estos procesos están regulados por la fuerza débil y resultan de la transformación de un neutrón en un protón, o de un protón en un neutrón. La transición de neutrón a protón va acompañada de la emisión de un electrón y un antineutrino, mientras que la transición de protón a neutrón (excepto en la captura de electrones) provoca la emisión de un positrón y un neutrino. Las emisiones de electrones o positrones se denominan partículas beta. La desintegración beta aumenta o disminuye el número atómico del núcleo en uno. La captura de electrones es más común que la emisión de positrones, porque requiere menos energía. En este tipo de desintegración, el núcleo absorbe un electrón, en lugar de emitir un positrón desde el núcleo. Todavía se emite un neutrino en este proceso, y un protón cambia a neutrón.
- Decaimiento gamma: este proceso resulta de un cambio en el nivel de energía del núcleo a un estado más bajo, lo que resulta en la emisión de radiación electromagnética. El estado excitado de un núcleo que da como resultado la emisión gamma generalmente ocurre después de la emisión de una partícula alfa o beta. Por lo tanto, la desintegración gamma suele seguir a la desintegración alfa o beta.
Otros tipos más raros de desintegración radiactiva incluyen la eyección de neutrones o protones o grupos de nucleones de un núcleo, o más de una partícula beta. Un análogo de la emisión gamma que permite que los núcleos excitados pierdan energía de una manera diferente es la conversión interna, un proceso que produce electrones de alta velocidad que no son rayos beta, seguido de la producción de fotones de alta energía que no son rayos gamma. Unos pocos núcleos grandes explotan en dos o más fragmentos cargados de masas variables más varios neutrones, en una descomposición llamada fisión nuclear espontánea.
Cada isótopo radiactivo tiene un período de tiempo de descomposición característico, la vida media, que está determinada por la cantidad de tiempo necesario para que se desintegre la mitad de una muestra. Este es un proceso de decaimiento exponencial que disminuye constantemente la proporción del isótopo restante en un 50% cada vida media. Por lo tanto, después de que han pasado dos vidas medias, solo está presente el 25% del isótopo, y así sucesivamente.
Momento magnético
Las partículas elementales poseen una propiedad mecánica cuántica intrínseca conocida como espín. Esto es análogo al momento angular de un objeto que gira alrededor de su centro de masa, aunque estrictamente hablando se cree que estas partículas son puntuales y no se puede decir que estén girando. El espín se mide en unidades de la constante de Planck reducida (ħ), con electrones, protones y neutrones, todos con espín ½ ħ, o "espín-½". En un átomo, los electrones en movimiento alrededor del núcleo poseen un momento angular orbital además de su espín, mientras que el propio núcleo posee un momento angular debido a su espín nuclear.
El campo magnético producido por un átomo, su momento magnético, está determinado por estas diversas formas de momento angular, del mismo modo que un objeto cargado en rotación produce clásicamente un campo magnético, pero la contribución más dominante proviene del espín del electrón. Debido a la naturaleza de los electrones para obedecer el principio de exclusión de Pauli, en el que no se pueden encontrar dos electrones en el mismo estado cuántico, los electrones enlazados se emparejan entre sí, con un miembro de cada par en un estado de espín y el otro en el contrario, girar hacia abajo el estado. Por lo tanto, estos espines se anulan entre sí, reduciendo el momento dipolar magnético total a cero en algunos átomos con un número par de electrones.
En elementos ferromagnéticos como el hierro, el cobalto y el níquel, un número impar de electrones conduce a un electrón desapareado y a un momento magnético general neto. Los orbitales de los átomos vecinos se superponen y se logra un estado de menor energía cuando los espines de los electrones desapareados se alinean entre sí, un proceso espontáneo conocido como interacción de intercambio. Cuando los momentos magnéticos de los átomos ferromagnéticos se alinean, el material puede producir un campo macroscópico medible. Los materiales paramagnéticos tienen átomos con momentos magnéticos que se alinean en direcciones aleatorias cuando no hay un campo magnético presente, pero los momentos magnéticos de los átomos individuales se alinean en presencia de un campo.
El núcleo de un átomo no tendrá espín cuando tenga números pares tanto de neutrones como de protones, pero para otros casos de números impares, el núcleo puede tener espín. Normalmente, los núcleos con espín están alineados en direcciones aleatorias debido al equilibrio térmico, pero para ciertos elementos (como el xenón-129) es posible polarizar una proporción significativa de los estados de espín nuclear para que estén alineados en la misma dirección, una condición. llamado hiperpolarización. Esto tiene aplicaciones importantes en la formación de imágenes por resonancia magnética.
Niveles de energía
La energía potencial de un electrón en un átomo es negativa en relación a cuando la distancia desde el núcleo llega al infinito; su dependencia de la posición del electrón alcanza el mínimo dentro del núcleo, aproximadamente en proporción inversa a la distancia. En el modelo de la mecánica cuántica, un electrón ligado puede ocupar solo un conjunto de estados centrados en el núcleo, y cada estado corresponde a un nivel de energía específico; consulte la ecuación de Schrödinger independiente del tiempo para obtener una explicación teórica. Un nivel de energía se puede medir por la cantidad de energía necesaria para separar el electrón del átomo y, por lo general, se expresa en unidades de electronvoltios (eV). El estado de energía más bajo de un electrón enlazado se denomina estado fundamental, es decir, estado estacionario, mientras que la transición de un electrón a un nivel superior da como resultado un estado excitado.La energía del electrón aumenta junto con n porque aumenta la distancia (promedio) al núcleo. La dependencia de la energía de ℓ no se debe al potencial electrostático del núcleo, sino a la interacción entre los electrones.
Para que un electrón haga la transición entre dos estados diferentes, por ejemplo, del estado fundamental al primer estado excitado, debe absorber o emitir un fotón con una energía que coincida con la diferencia en la energía potencial de esos niveles, según el modelo de Niels Bohr, lo que puede ser precisamente calculado por la ecuación de Schrödinger. Los electrones saltan entre orbitales como partículas. Por ejemplo, si un solo fotón golpea a los electrones, solo un solo electrón cambia de estado en respuesta al fotón; ver Propiedades de los electrones.
La energía de un fotón emitido es proporcional a su frecuencia, por lo que estos niveles de energía específicos aparecen como bandas distintas en el espectro electromagnético. Cada elemento tiene un espectro característico que puede depender de la carga nuclear, las subcapas llenas de electrones, las interacciones electromagnéticas entre los electrones y otros factores.
Cuando un espectro continuo de energía pasa a través de un gas o plasma, algunos de los fotones son absorbidos por los átomos, lo que hace que los electrones cambien su nivel de energía. Esos electrones excitados que permanecen unidos a su átomo emiten espontáneamente esta energía en forma de fotón, viajando en una dirección aleatoria y, por lo tanto, regresan a niveles de energía más bajos. Así, los átomos se comportan como un filtro que forma una serie de bandas oscuras de absorción en la salida de energía. (Un observador que observa los átomos desde una perspectiva que no incluye el espectro continuo en el fondo, en cambio ve una serie de líneas de emisión de los fotones emitidos por los átomos). Las mediciones espectroscópicas de la fuerza y el ancho de las líneas espectrales atómicas permiten la composición y propiedades físicas de una sustancia a determinar.
Un examen minucioso de las líneas espectrales revela que algunas muestran una división de estructura fina. Esto ocurre debido al acoplamiento espín-órbita, que es una interacción entre el espín y el movimiento del electrón más externo. Cuando un átomo está en un campo magnético externo, las líneas espectrales se dividen en tres o más componentes; un fenómeno llamado efecto Zeeman. Esto es causado por la interacción del campo magnético con el momento magnético del átomo y sus electrones. Algunos átomos pueden tener múltiples configuraciones electrónicas con el mismo nivel de energía, que por lo tanto aparecen como una sola línea espectral. La interacción del campo magnético con el átomo cambia estas configuraciones electrónicas a niveles de energía ligeramente diferentes, lo que da como resultado múltiples líneas espectrales.La presencia de un campo eléctrico externo puede causar una división y un desplazamiento comparables de las líneas espectrales al modificar los niveles de energía de los electrones, un fenómeno llamado efecto Stark.
Si un electrón enlazado está en un estado excitado, un fotón que interactúa con la energía adecuada puede provocar la emisión estimulada de un fotón con un nivel de energía equivalente. Para que esto ocurra, el electrón debe caer a un estado de menor energía que tenga una diferencia de energía que coincida con la energía del fotón que interactúa. El fotón emitido y el fotón que interactúa luego se mueven en paralelo y con fases coincidentes. Es decir, los patrones de onda de los dos fotones están sincronizados. Esta propiedad física se utiliza para fabricar láseres, que pueden emitir un haz coherente de energía luminosa en una banda de frecuencia estrecha.
Comportamiento de valencia y enlace
La valencia es el poder de combinación de un elemento. Está determinado por el número de enlaces que puede formar con otros átomos o grupos. La capa de electrones más externa de un átomo en su estado no combinado se conoce como capa de valencia, y los electrones en esa capa se llaman electrones de valencia. El número de electrones de valencia determina el comportamiento de enlace con otros átomos. Los átomos tienden a reaccionar químicamente entre sí de una manera que llena (o vacía) sus capas exteriores de valencia.Por ejemplo, una transferencia de un solo electrón entre átomos es una aproximación útil para los enlaces que se forman entre átomos con un electrón más que una capa llena, y otros que tienen un electrón menos que una capa completa, como ocurre en el compuesto cloruro de sodio y otras sales iónicas químicas. Muchos elementos muestran múltiples valencias o tendencias para compartir diferentes números de electrones en diferentes compuestos. Por lo tanto, el enlace químico entre estos elementos toma muchas formas de intercambio de electrones que son más que simples transferencias de electrones. Los ejemplos incluyen el elemento carbono y los compuestos orgánicos.
Los elementos químicos a menudo se muestran en una tabla periódica que se presenta para mostrar propiedades químicas recurrentes, y los elementos con el mismo número de electrones de valencia forman un grupo que se alinea en la misma columna de la tabla. (Las filas horizontales corresponden al llenado de una capa cuántica de electrones). Los elementos en el extremo derecho de la tabla tienen su capa exterior completamente llena de electrones, lo que da como resultado elementos químicamente inertes conocidos como gases nobles.
Estados
Cantidades de átomos se encuentran en diferentes estados de la materia que dependen de las condiciones físicas, como la temperatura y la presión. Al variar las condiciones, los materiales pueden pasar de sólidos, líquidos, gases y plasmas. Dentro de un estado, un material también puede existir en diferentes alótropos. Un ejemplo de esto es el carbono sólido, que puede existir como grafito o diamante. También existen alótropos gaseosos, como el dioxígeno y el ozono.
A temperaturas cercanas al cero absoluto, los átomos pueden formar un condensado de Bose-Einstein, momento en el que los efectos de la mecánica cuántica, que normalmente solo se observan a escala atómica, se hacen evidentes a escala macroscópica. Esta colección de átomos superenfriados se comporta entonces como un solo superátomo, lo que puede permitir comprobaciones fundamentales del comportamiento de la mecánica cuántica.
Identificación
Si bien los átomos son demasiado pequeños para ser vistos, dispositivos como el microscopio de túnel de barrido (STM) permiten su visualización en las superficies de los sólidos. El microscopio utiliza el fenómeno de tunelización cuántica, que permite que las partículas atraviesen una barrera que sería infranqueable en la perspectiva clásica. Los electrones hacen un túnel a través del vacío entre dos electrodos polarizados, proporcionando una corriente de túnel que depende exponencialmente de su separación. Un electrodo es una punta afilada que idealmente termina con un solo átomo. En cada punto del escaneo de la superficie, la altura de la punta se ajusta para mantener la corriente de tunelización en un valor establecido. El movimiento de la punta hacia y desde la superficie se interpreta como el perfil de altura. Para un sesgo bajo,Debido a las distancias involucradas, ambos electrodos deben ser extremadamente estables; sólo entonces se pueden observar periodicidades que corresponden a átomos individuales. El método por sí solo no es químicamente específico y no puede identificar las especies atómicas presentes en la superficie.
Los átomos se pueden identificar fácilmente por su masa. Si un átomo se ioniza quitando uno de sus electrones, su trayectoria cuando pasa a través de un campo magnético se doblará. El radio por el cual el campo magnético gira la trayectoria de un ion en movimiento está determinado por la masa del átomo. El espectrómetro de masas utiliza este principio para medir la relación masa-carga de los iones. Si una muestra contiene múltiples isótopos, el espectrómetro de masas puede determinar la proporción de cada isótopo en la muestra midiendo la intensidad de los diferentes haces de iones. Las técnicas para vaporizar átomos incluyen espectroscopía de emisión atómica de plasma acoplado inductivamente y espectrometría de masas de plasma acoplado inductivamente, las cuales utilizan un plasma para vaporizar muestras para análisis.
El tomógrafo de sonda atómica tiene una resolución subnanométrica en 3-D y puede identificar químicamente átomos individuales utilizando espectrometría de masas de tiempo de vuelo.
Las técnicas de emisión de electrones, como la espectroscopia de fotoelectrones de rayos X (XPS) y la espectroscopia de electrones Auger (AES), que miden las energías de enlace de los electrones del núcleo, se utilizan para identificar las especies atómicas presentes en una muestra de forma no destructiva. Con un enfoque adecuado, ambos pueden hacerse específicos del área. Otro método de este tipo es la espectroscopia de pérdida de energía de electrones (EELS), que mide la pérdida de energía de un haz de electrones dentro de un microscopio electrónico de transmisión cuando interactúa con una parte de una muestra.
Los espectros de estados excitados se pueden utilizar para analizar la composición atómica de estrellas distantes. Las longitudes de onda de luz específicas contenidas en la luz observada de las estrellas se pueden separar y relacionar con las transiciones cuantificadas en los átomos de gas libre. Estos colores se pueden replicar usando una lámpara de descarga de gas que contenga el mismo elemento. El helio se descubrió de esta manera en el espectro del Sol 23 años antes de que se encontrara en la Tierra.
Origen y estado actual
La materia bariónica forma alrededor del 4% de la densidad de energía total del Universo observable, con una densidad promedio de alrededor de 0,25 partículas/m (principalmente protones y electrones). Dentro de una galaxia como la Vía Láctea, las partículas tienen una concentración mucho mayor, con una densidad de materia en el medio interestelar (ISM) que oscila entre 10 y 10 átomos/m . Se cree que el Sol está dentro de la Burbuja Local, por lo que la densidad en la vecindad solar es de solo unos 10 átomos/m . Las estrellas se forman a partir de nubes densas en el ISM, y los procesos evolutivos de las estrellas dan como resultado el constante enriquecimiento del ISM con elementos más masivos que el hidrógeno y el helio.
Hasta el 95% de la materia bariónica de la Vía Láctea se concentra dentro de las estrellas, donde las condiciones son desfavorables para la materia atómica. La masa bariónica total es aproximadamente el 10% de la masa de la galaxia; el resto de la masa es una materia oscura desconocida. La alta temperatura dentro de las estrellas hace que la mayoría de los "átomos" estén completamente ionizados, es decir, separa todos los electrones de los núcleos. En los remanentes estelares, con la excepción de sus capas superficiales, una inmensa presión hace que las capas de electrones sean imposibles.
Formación
Se cree que los electrones existen en el Universo desde las primeras etapas del Big Bang. Los núcleos atómicos se forman en las reacciones de nucleosíntesis. En unos tres minutos, la nucleosíntesis del Big Bang produjo la mayor parte del helio, el litio y el deuterio del Universo, y quizás algo del berilio y el boro.
La ubicuidad y la estabilidad de los átomos se basan en su energía de enlace, lo que significa que un átomo tiene una energía más baja que un sistema libre de núcleo y electrones. Donde la temperatura es mucho más alta que el potencial de ionización, la materia existe en forma de plasma, un gas de iones cargados positivamente (posiblemente, núcleos desnudos) y electrones. Cuando la temperatura cae por debajo del potencial de ionización, los átomos se vuelven estadísticamente favorables. Los átomos (con los electrones unidos) llegaron a dominar sobre las partículas cargadas 380.000 años después del Big Bang, una época llamada recombinación, cuando el Universo en expansión se enfrió lo suficiente como para permitir que los electrones se adhirieran a los núcleos.
Desde el Big Bang, que no produjo carbono ni elementos más pesados, los núcleos atómicos se han combinado en estrellas a través del proceso de fusión nuclear para producir más del elemento helio y (a través del proceso triple alfa) la secuencia de elementos desde el carbono hasta planchar; ver nucleosíntesis estelar para más detalles.
Isótopos como el litio-6, así como algo de berilio y boro, se generan en el espacio a través de la espalación de rayos cósmicos. Esto ocurre cuando un protón de alta energía golpea un núcleo atómico, lo que provoca la expulsión de una gran cantidad de nucleones.
Los elementos más pesados que el hierro se produjeron en supernovas y estrellas de neutrones en colisión a través del proceso r, y en estrellas AGB a través del proceso s, los cuales involucran la captura de neutrones por núcleos atómicos. Elementos como el plomo se formaron en gran parte a través de la desintegración radiactiva de elementos más pesados.
Tierra
La mayoría de los átomos que componen la Tierra y sus habitantes estaban presentes en su forma actual en la nebulosa que colapsó de una nube molecular para formar el Sistema Solar. El resto son el resultado de la desintegración radiactiva y su proporción relativa se puede utilizar para determinar la edad de la Tierra a través de la datación radiométrica. La mayor parte del helio en la corteza de la Tierra (alrededor del 99% del helio de los pozos de gas, como lo demuestra su menor abundancia de helio-3) es producto de la descomposición alfa.
Hay algunos átomos traza en la Tierra que no estaban presentes al principio (es decir, no son "primordiales"), ni son resultado de la desintegración radiactiva. El carbono-14 es generado continuamente por los rayos cósmicos en la atmósfera. Algunos átomos en la Tierra han sido generados artificialmente ya sea deliberadamente o como subproductos de reactores nucleares o explosiones. De los elementos transuránicos, aquellos con números atómicos superiores a 92, solo el plutonio y el neptunio se encuentran naturalmente en la Tierra. Los elementos transuránicos tienen tiempos de vida radiactivos más cortos que la edad actual de la Tierra y, por lo tanto, cantidades identificables de estos elementos se han desintegrado hace mucho tiempo, con la excepción de rastros de plutonio-244 posiblemente depositados por el polvo cósmico.Los depósitos naturales de plutonio y neptunio se producen mediante la captura de neutrones en el mineral de uranio.
La Tierra contiene aproximadamente1,33 × 10 átomos. Aunque existe una pequeña cantidad de átomos independientes de gases nobles, como el argón, el neón y el helio, el 99 % de la atmósfera está unida en forma de moléculas, incluidos el dióxido de carbono y el oxígeno y el nitrógeno diatómicos. En la superficie de la Tierra, una abrumadora mayoría de átomos se combinan para formar varios compuestos, incluidos agua, sal, silicatos y óxidos. Los átomos también pueden combinarse para crear materiales que no consisten en moléculas discretas, incluidos cristales y metales líquidos o sólidos. Esta materia atómica forma arreglos en red que carecen del tipo particular de orden interrumpido a pequeña escala asociado con la materia molecular.
Formas raras y teóricas.
Elementos superpesados
Se sabe que todos los nucleidos con números atómicos superiores a 82 (plomo) son radiactivos. Ningún nucleido con un número atómico superior a 92 (uranio) existe en la Tierra como un nucleido primordial, y los elementos más pesados generalmente tienen vidas medias más cortas. Sin embargo, podría existir una "isla de estabilidad" que abarque isótopos de elementos superpesados de vida relativamente larga con números atómicos de 110 a 114. Las predicciones de la vida media del nucleido más estable de la isla van desde unos pocos minutos hasta millones de años. En cualquier caso, los elementos superpesados (con Z > 104) no existirían debido al aumento de la repulsión de Coulomb (lo que da como resultado una fisión espontánea con vidas medias cada vez más cortas) en ausencia de efectos estabilizadores.
Materia exótica
Cada partícula de materia tiene una partícula de antimateria correspondiente con la carga eléctrica opuesta. Así, el positrón es un antielectrón con carga positiva y el antiprotón es el equivalente de un protón con carga negativa. Cuando una materia y la correspondiente partícula de antimateria se encuentran, se aniquilan entre sí. Debido a esto, junto con un desequilibrio entre el número de partículas de materia y antimateria, estas últimas son raras en el universo. Las primeras causas de este desequilibrio aún no se comprenden completamente, aunque las teorías de la bariogénesis pueden ofrecer una explicación. Como resultado, no se han descubierto átomos de antimateria en la naturaleza. En 1996, el equivalente de antimateria del átomo de hidrógeno (antihidrógeno) se sintetizó en el laboratorio del CERN en Ginebra.
Se han creado otros átomos exóticos reemplazando uno de los protones, neutrones o electrones con otras partículas que tienen la misma carga. Por ejemplo, un electrón puede ser reemplazado por un muón más masivo, formando un átomo muónico. Estos tipos de átomos se pueden utilizar para probar predicciones fundamentales de la física.
Contenido relacionado
Ley de Fick
Fuerza nuclear débil
Dalton (unidad)
Fuerza nuclear fuerte
Cátodo