Asimilación de azufre
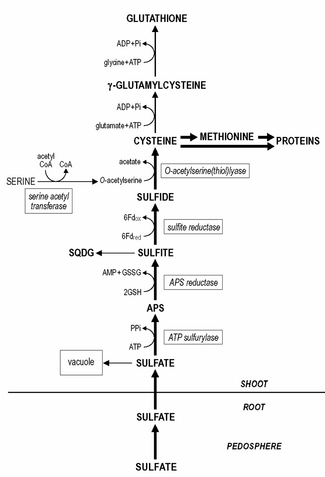
La asimilación del azufre es el proceso mediante el cual los organismos vivos incorporan el azufre a sus moléculas biológicas. En las plantas, el sulfato es absorbido por las raíces y luego transportado a los cloroplastos por la corriente de transpiración, donde el azufre se reduce a sulfuro con la ayuda de una serie de reacciones enzimáticas. Además, el azufre reducido se incorpora a la cisteína, un aminoácido que es precursor de muchos otros compuestos que contienen azufre. En los animales, la asimilación del azufre se produce principalmente a través de la dieta, ya que los animales no pueden producir compuestos que contienen azufre directamente. El azufre se incorpora a aminoácidos como la cisteína y la metionina, que se utilizan para construir proteínas y otras moléculas importantes.
Sulfate uptake by plants
La absorción de sulfato ocurre primero en las raíces que tienen una alta afinidad por el azufre. La tasa máxima de absorción de sulfato generalmente se alcanza ya con niveles de sulfato de 0,1 mM o inferiores. La absorción de sulfato por las raíces y su transporte hasta el brote está estrictamente controlado y parece ser uno de los principales sitios reguladores de la asimilación de azufre.
El sulfato se absorbe activamente a través de la membrana plasmática de las células de la raíz, se carga posteriormente en los vasos del xilema y se transporta al brote por la corriente de transpiración. La absorción y el transporte de sulfato dependen de la energía (impulsados por un gradiente de protones generado por las ATPasas) a través de un cotransporte protón/sulfato. En el brote, el sulfato se descarga y se transporta a los cloroplastos, donde se reduce. El sulfato restante en el tejido vegetal está presente predominantemente en la vacuola, ya que la concentración de sulfato en el citoplasma se mantiene bastante constante.
Distintas proteínas transportadoras de sulfato median la captación, el transporte y la distribución subcelular del sulfato. La familia de genes transportadores de sulfato se ha clasificado en hasta cinco grupos diferentes según su expresión génica celular y subcelular y su posible funcionamiento. Cada grupo de proteínas transportadoras puede expresarse exclusivamente en las raíces o los brotes de la planta, o en ambos.
- Grupo 1 son 'transportadores de sulfato de alta afinidad', que están involucrados en la toma de sulfato por las raíces.
- El grupo 2 son transportadores vasculares y son 'transportadores de sulfato de baja afinidad'.
- El grupo 3 es el llamado "grupo sordo", sin embargo, todavía poco se sabe sobre las características de este grupo.
- Los transportistas del grupo 4 están involucrados en el eflujo de sulfato de los vacuoles, mientras que la función de los transportistas de sulfato del Grupo 5 todavía no se conoce, y probablemente sólo funcionan como transportadores de molibdato.
La regulación y expresión de la mayoría de los transportadores de sulfato están controladas por el estado nutricional de azufre de las plantas. Tras la privación de sulfato, la rápida disminución del sulfato en las raíces se acompaña regularmente de una expresión fuertemente aumentada de la mayoría de los genes transportadores de sulfato (hasta 100 veces), acompañada de una capacidad de absorción de sulfato sustancialmente mejorada. Todavía no se entiende completamente si el sulfato y otros productos metabólicos de la asimilación de azufre (O-acetilserina, cisteína, glutatión) actúan como señales en la regulación de la absorción y el transporte de sulfato, o en la expresión de los transportadores de sulfato involucrados.
Reducción de sulfatos en plantas
La reducción de sulfato ocurre predominantemente en los cloroplastos de las hojas. Allí, la reducción de sulfato a sulfuro ocurre en tres pasos. El sulfato necesita ser activado a adenosina 5'-fosfosulfato (APS) antes de su reducción a sulfito.
La activación del sulfato es catalizada por la ATP sulfurilasa, cuya afinidad por el sulfato es bastante baja (Km aproximadamente 1 mM) y la concentración de sulfato in situ en el cloroplasto es muy probablemente uno de los pasos limitantes/reguladores en la reducción del azufre. Posteriormente, la APS se reduce a sulfito, catalizada por la APS reductasa con probablemente glutatión como reductor.
Se supone que esta última reacción es uno de los puntos de regulación primarios en la reducción de sulfato, ya que la actividad de la APS reductasa es la más baja de las enzimas de la vía de reducción de sulfato y tiene una tasa de recambio rápida. El sulfito es reducido con alta afinidad por la sulfito reductasa a sulfuro con ferredoxina como reductor. El sulfato restante en el tejido vegetal se transfiere a la vacuola. La removilización y redistribución de las reservas de sulfato vacuolar parece ser bastante lenta y las plantas deficientes en azufre pueden contener aún niveles detectables de sulfato.
Síntesis y función de compuestos de azufre en plantas
Cysteine
El sulfuro se incorpora a la cisteína, catalizada por la O-acetilserina (tiol)liasa, con la O-acetilserina como sustrato. La síntesis de O-acetilserina es catalizada por la serina acetiltransferasa y junto con la O-acetilserina (tiol)liasa se asocia a un complejo enzimático denominado cisteína sintasa.
La formación de cisteína es el paso de acoplamiento directo entre el azufre (metabolismo del azufre) y la asimilación del nitrógeno en las plantas. Esto difiere del proceso en la levadura, donde el sulfuro debe incorporarse primero a la homocisteína y luego convertirse en cisteína en dos pasos.
La cisteína es un donante de azufre para la síntesis de metionina, el otro aminoácido que contiene azufre más importante presente en las plantas. Esto sucede a través de la vía de transulfuración y la metilación de la homocisteína.
Tanto la cisteína como la metionina son aminoácidos que contienen azufre y son de gran importancia en la estructura, conformación y función de las proteínas y enzimas, pero también pueden estar presentes altos niveles de estos aminoácidos en las proteínas de almacenamiento de semillas. Los grupos tiol de los residuos de cisteína en las proteínas pueden oxidarse dando lugar a puentes disulfuro con otras cadenas laterales de cisteína (y formar cistina) y/o enlaces de polipéptidos.
Los puentes disulfuro (enlaces disulfuro) contribuyen de manera importante a la estructura de las proteínas. Los grupos tiol también son de gran importancia en la unión de los sustratos de las enzimas, en los grupos de azufre y metal en las proteínas (p. ej., ferredoxinas) y en las proteínas reguladoras (p. ej., tiorredoxinas).
Glutathione
El glutatión o sus homólogos, por ejemplo, el homoglutatión en Fabaceae; el hidroximetilglutatión en Poaceae son los principales compuestos tiólicos no proteicos solubles en agua presentes en el tejido vegetal y representan el 1-2% del azufre total. El contenido de glutatión en el tejido vegetal varía de 0,1 a 3 mM. La cisteína es el precursor directo de la síntesis de glutatión (y sus homólogos). En primer lugar, la γ-glutamilcisteína se sintetiza a partir de cisteína y glutamato catalizada por la gamma-glutamilcisteína sintetasa. En segundo lugar, el glutatión se sintetiza a partir de γ-glutamilcisteína y glicina (en los homólogos del glutatión, β-alanina o serina) catalizada por la glutatión sintetasa. Ambos pasos de la síntesis de glutatión son reacciones dependientes de ATP. El glutatión se mantiene en forma reducida por una glutatión reductasa dependiente de NADPH y la relación entre glutatión reducido (GSH) y glutatión oxidado (GSSG) generalmente supera un valor de 7. El glutatión cumple varias funciones en el funcionamiento de las plantas. En el metabolismo del azufre, funciona como reductor en la reducción de APS a sulfito. También es la principal forma de transporte de azufre reducido en las plantas. Es probable que las raíces dependan en gran medida para su suministro de azufre reducido de la transferencia de glutatión de brotes/raíces a través del floema, ya que la reducción de azufre ocurre predominantemente en el cloroplasto. El glutatión está directamente involucrado en la reducción y asimilación de selenito en selenocisteína. Además, el glutatión es de gran importancia en la protección de las plantas contra el estrés oxidativo y ambiental y deprime/elimina la formación de especies reactivas de oxígeno tóxicas, por ejemplo, superóxido, peróxido de hidrógeno e hidroperóxidos lipídicos. El glutatión funciona como reductor en la desintoxicación enzimática de especies reactivas de oxígeno en el ciclo glutatión-ascorbato y como tampón de tiol en la protección de proteínas mediante la reacción directa con especies reactivas de oxígeno o mediante la formación de disulfuros mixtos. El potencial del glutatión como protector está relacionado con el tamaño del depósito de glutatión, su estado redox (relación GSH/GSSG) y la actividad de la glutatión reductasa. El glutatión es el precursor de la síntesis de fitoquelatinas, que se sintetizan enzimáticamente por una fitoquelatina sintasa constitutiva. El número de residuos de γ-glutamil-cisteína en las fitoquelatinas puede variar de 2 a 5, a veces hasta 11. A pesar del hecho de que las fitoquelatinas forman complejos que contienen algunos metales pesados, a saber, Cadmio, se supone que estos compuestos desempeñan un papel en la homeostasis y desintoxicación de metales pesados mediante el amortiguamiento de la concentración citoplasmática de metales pesados esenciales. El glutatión también está involucrado en la desintoxicación de xenobióticos, compuestos sin valor nutricional directo o importancia en el metabolismo, que en niveles demasiado altos pueden afectar negativamente al funcionamiento de la planta. Los xenobióticos pueden desintoxicarse en reacciones de conjugación con glutatión catalizadas por la glutatión S-transferasa, cuya actividad es constitutiva; diferentes xenobióticos pueden inducir isoformas distintas de la enzima. Las glutatión S-transferasas tienen gran importancia en la desintoxicación y tolerancia a herbicidas en la agricultura y su inducción por antídotos de herbicidas ("protectores") es el paso decisivo para la inducción de tolerancia a herbicidas en muchas plantas de cultivo. En condiciones naturales, se supone que las glutatión S-transferasas tienen importancia en la desintoxicación de hidroperóxidos lipídicos, en la conjugación de metabolitos endógenos, hormonas y productos de degradación del ADN, y en el transporte de flavonoides.
Sulfolipids
Los sulfolípidos son lípidos que contienen azufre. Los sulfoquinovosil diacilgliceroles son los sulfolípidos predominantes presentes en las plantas. En las hojas su contenido comprende hasta un 3 - 6% del azufre total presente. Este sulfolípido está presente en las membranas de los plástidos y probablemente esté involucrado en el funcionamiento de los cloroplastos. La ruta de biosíntesis y la función fisiológica del sulfoquinovosil diacilglicerol aún están bajo investigación. A partir de estudios recientes es evidente que el sulfito es el probable precursor del azufre para la formación del grupo sulfoquinovosa de este lípido.
Compuestos de azufre secundario
Las especies de Brassica contienen glucosinolatos, que son compuestos secundarios que contienen azufre. Los glucosinolatos están compuestos por una fracción de β-tioglucosa, una oxima sulfonada y una cadena lateral. La síntesis de glucosinolatos comienza con la oxidación del aminoácido original a una aldoxima, seguida de la adición de un grupo tiol (a través de la conjugación con glutatión) para producir tiohidroximato. La transferencia de una fracción de glucosa y una de sulfato completa la formación de los glucosinolatos.
El significado fisiológico de los glucosinolatos es aún ambiguo, aunque se considera que funcionan como compuestos sumideros en situaciones de exceso de azufre. Tras la ruptura de los tejidos, los glucosinolatos son degradados enzimáticamente por la mirosinasa y pueden dar lugar a una variedad de productos biológicamente activos, como isotiocianatos, tiocianatos, nitrilos y oxazolidina-2-tionas. Se supone que el sistema glucosinolato-mirosinasa desempeña un papel en las interacciones planta-herbívoro y planta-patógeno.
Además, los glucosinolatos son responsables de las propiedades del sabor de las Brassicaceae y recientemente han recibido atención en vista de sus posibles propiedades anticancerígenas. Las especies de Allium contienen γ-glutamilpéptidos y aliinas (sulfóxidos de S-alqu(en)il cisteína). El contenido de estos compuestos secundarios que contienen azufre depende en gran medida de la etapa de desarrollo de la planta, la temperatura, la disponibilidad de agua y el nivel de nutrición de nitrógeno y azufre. En los bulbos de cebolla, su contenido puede representar hasta el 80% de la fracción de azufre orgánico. Se sabe menos sobre el contenido de compuestos secundarios de azufre en la etapa de plántula de la planta.
Se supone que las aliinas se sintetizan predominantemente en las hojas, desde donde se transfieren posteriormente a la escama del bulbo adherida. Las vías biosintéticas de síntesis de γ-glutamilpéptidos y aliinas aún son ambiguas. Los γ-glutamilpéptidos pueden formarse a partir de cisteína (a través de γ-glutamilcisteína o glutatión) y pueden metabolizarse en las aliinas correspondientes a través de oxidación y posterior hidrolización por γ-glutamil transpeptidasas.
Sin embargo, no se pueden excluir otras posibles vías de síntesis de γ-glutamilpéptidos y aliinas. Se sabe que las aliinas y los γ-glutamilpéptidos tienen utilidad terapéutica y podrían tener un valor potencial como fitofármacos. Las aliinas y sus productos de degradación (por ejemplo, la alicina) son los precursores del sabor que dan lugar al olor y al gusto de las especies. El sabor solo se libera cuando se rompen las células vegetales y la enzima aliinasa de la vacuola es capaz de degradar las aliinas, lo que produce una amplia variedad de compuestos volátiles y no volátiles que contienen azufre. La función fisiológica de los γ-glutamilpéptidos y las aliinas no está muy clara.
Asimilación de azufre en animal
A diferencia de las plantas, los animales no tienen una vía para la asimilación directa del sulfato inorgánico en compuestos orgánicos. En los animales, la fuente principal de azufre es la metionina dietética, un aminoácido esencial que contiene un átomo de azufre. La metionina se convierte primero en S-adenosilmetionina (SAM), un compuesto que participa en muchos procesos biológicos importantes, incluida la metilación del ADN y la síntesis de neurotransmisores.
El SAM puede utilizarse para sintetizar otros compuestos importantes que contienen azufre, como la cisteína, la taurina y el glutatión. La cisteína es un precursor de la síntesis de varias proteínas y péptidos importantes, así como del glutatión, un poderoso antioxidante que protege a las células del estrés oxidativo. La taurina participa en diversos procesos fisiológicos, como la osmorregulación, la modulación de la señalización del calcio y la regulación de la función mitocondrial.
Asimición azufre en microorganismos
En las bacterias y los hongos, la vía de asimilación del azufre es similar a la de las plantas, donde el sulfato inorgánico se reduce a sulfuro y luego se incorpora a la cisteína y otros compuestos que contienen azufre.
Las bacterias y los hongos pueden absorber sulfato inorgánico del medio ambiente a través de un transportador de sulfato, que está regulado por la presencia de sulfato en el medio. Una vez dentro de la célula, el sulfato es activado por la ATP sulfurilasa para formar adenosina 5'-fosfosulfato (APS), que luego es reducido a sulfito por la APS reductasa. El sulfito es reducido a sulfuro por la sulfito reductasa, que luego es incorporado a la cisteína por la enzima.
La cisteína, una vez sintetizada, puede utilizarse para la biosíntesis de metionina y otras biomoléculas importantes. Además, los microorganismos también utilizan compuestos que contienen azufre para otros fines, como la síntesis de antibióticos.
La asimilación de azufre en los microorganismos está regulada por una variedad de factores ambientales, incluida la disponibilidad de azufre en el medio y la presencia de otros nutrientes. La actividad de las enzimas clave en la vía de asimilación de azufre también está regulada por la inhibición por retroalimentación de los productos posteriores, de manera similar a la regulación observada en las plantas.
metabolismo de azufre en plantas y contaminación del aire
El rápido crecimiento económico, la industrialización y la urbanización están asociados a un fuerte aumento de la demanda energética y de las emisiones de contaminantes atmosféricos, entre ellos el dióxido de azufre (véase también lluvia ácida) y el sulfuro de hidrógeno, que pueden afectar al metabolismo de las plantas. Los gases de azufre son potencialmente fitotóxicos, sin embargo, también pueden metabolizarse y utilizarse como fuente de azufre e incluso resultar beneficiosos si la fertilización con azufre de las raíces no es suficiente.
Los brotes de las plantas forman un sumidero para los gases de azufre atmosféricos, que pueden ser absorbidos directamente por el follaje (deposición seca). La absorción foliar del dióxido de azufre depende generalmente de forma directa del grado de apertura de los estomas, ya que la resistencia interna a este gas es baja. El sulfito es muy soluble en el agua apoplástica del mesófilo, donde se disocia bajo la formación de bisulfito y sulfito.
El sulfito puede entrar directamente en la vía de reducción del azufre y ser reducido a sulfuro, incorporado a la cisteína y posteriormente a otros compuestos de azufre. El sulfito también puede ser oxidado a sulfato, extra e intracelularmente por peroxidasas o catalizado no enzimáticamente por iones metálicos o radicales superóxido y posteriormente reducido y asimilado nuevamente. El exceso de sulfato se transfiere a la vacuola; los niveles elevados de sulfato foliar son característicos de las plantas expuestas. La absorción foliar de sulfuro de hidrógeno parece depender directamente de la tasa de su metabolismo en cisteína y posteriormente en otros compuestos de azufre. Hay evidencia sólida de que la O-acetil-serina (tiol)liasa es directamente responsable de la fijación activa del sulfuro de hidrógeno atmosférico por las plantas.
Las plantas pueden transferir del sulfato al azufre atmosférico absorbido por las hojas como fuente de azufre y niveles de 60 ppb o superiores parecen ser suficientes para cubrir el requerimiento de azufre de las plantas. Existe una interacción entre la utilización del azufre atmosférico y pedosfera. Por ejemplo, la exposición al sulfuro de hidrógeno puede resultar en una actividad reducida de la APS reductasa y una absorción reducida de sulfato.
Véase también
- Nutrición vegetal
- Reductasa de sulfonucleótido
- Sulfur metabolism
Referencias
- ^ Karvansara, Parisa Rahimzadeh; Komenda, Josef; Kopriva, Stanislav (2024), "El metabolismo de los aviones en la cianobacteria", Cyanobacteria, Elsevier, pp. 117–157, doi:10.1016/b978-0-443-13231-5.00018-0, ISBN 978-0-443-13231-5, recuperado 2024-04-15
- ^ a b Vallon, Olivier; Spalding, Martin H. (2009), "Amino Acid Metabolism", The Chlamydomonas Sourcebook, Elsevier, pp. 115–158, doi:10.1016/b978-0-12-370873-1.00012-5, ISBN 978-0-12-370873-1, recuperado 2024-04-15
- ^ a b Khan, Muhammad Sayyar; Haas, Florian Heinrich; Allboje Samami, Arman; Moghaddas Gholami, Amin; Bauer, Andrea; Fellenberg, Kurt; Reichelt, Michael; HÄnsch, Robert; Mendel, Ralf R.; Meyer, Andreas J.; Wirtz, Markus; Hell, Rüdiger (2010-06-04). "Sulfite Reductase Defines a Newly Discovered Bottleneck for Assimilatory Sulfate Reduction and Is Essential for Growth and Development in Arabidopsis thaliana". La célula vegetal. 22 (4): 1216–1231. doi:10.1105/tpc.110.074088. ISSN 1532-298X. PMC 2879758. PMID 20424176.
- ^ Gigolashvili, Tamara; Kopriva, Stanislav (2014-09-09). "Transporters in plant sulfur metabolism". Frontiers in Plant Science. 5: 442. doi:10.3389/fpls.2014.00442. ISSN 1664-462X. PMC 4158793. PMID 25250037.
- ^ Hawkesford, Malcolm J.; Davidian, Jean-Claude; Grignon, Claude (1993-06-01). "Cotransporte sulfato/protón en vesículas plasma-membranas aisladas de las raíces de Brassica napus L.: mayor transporte en membranas aisladas de plantas de azufre". Planta. 190 (3): 297–304. doi:10.1007/BF00196957. ISSN 1432-2048.
- ^ Davidian, Jean-Claude; Kopriva, Stanislav (marzo de 2010). "Regulación de la absorción y asimilación de sulfatos, ¿lo mismo o no lo mismo?". Planta molecular. 3 (2): 314-325. doi:10.1093/mp/ssq001. ISSN 1674-2052. PMID 20139159.
- ^ Puresmaeli, Fatemeh; Heidari, Parviz; Lawson, Shaneka (2023-01-27). "Insights into the Sulfate Transporter Gene Family and Its Expression Patterns in Durum Wheat Seedlings under Salinity". Genes. 14 (2): 333. doi:10.3390/genes14020333. ISSN 2073-4425. PMC 9956213. PMID 36833260.
- ^ Buchner, Peter; Stuiver, C. Elisabeth E.; Westerman, Sue; Wirtz, Markus; Hell, Rüdiger; Hawkesford, Malcolm J.; De Kok, Luit J. (2004-10-01). "Regulación de la absorción sulfato y expresión de los genes transportadores de sulfato en Brassica oleracea como afectados por H2S atmosférico y nutrición de sulfato pedosférico". Fisiología vegetal. 136 (2): 3396–3408. doi:10.1104/pp.104.046441. ISSN 1532-2548. PMID 15377780.
- Schnug, E. (1998) Sulfur in Agroecosystems. Kluwer Academic Publishers, Dordrecht, 221 pp, ISBN 0-7923-5123-1.
- Grill, D., Tausz, M. and De Kok, L.J. (2001) Significance of Glutathione to Plant Adaptation to the Environment. Kluwer Academic Publishers, Dordrecht, ISBN 1-4020-0178-9.
- Abrol Y.P. y Ahmad A. (2003) Sulphur in Plants. Kluwer Academic Publishers, Dordrecht, ISBN 1-4020-1247-0.
- Saito, K., De Kok, L.J., Stulen, I., Hawkesford, M.J., Schnug, E., Sirko, A. and Rennenberg, H. (2005) Sulfur Transport and Assimilation in Plants in the Post Genomic Era. Backhuys Publishers, Leiden, ISBN 90-5782-166-4.
- Hawkesford, M.J. and De Kok, L.J. (2006) Gestión del metabolismo de azufre en las plantas. Plant Cell and Environment 29: 382-395.