Aromatización
aromatización es una reacción química en la que se forma un sistema aromático a partir de un único precursor no aromático. Normalmente, la aromatización se logra mediante la deshidrogenación de compuestos cíclicos existentes, ilustrada por la conversión de ciclohexano en benceno. La aromatización incluye la formación de sistemas heterocíclicos.

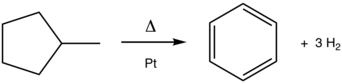
La conversión de metilciclohexano a tolueno es una reacción clásica de aromatización. Este proceso de platino (Pt)-catalizado se practica a escala en la producción de gasolina del petróleo.
Práctica industrial
Aunque no se practica bajo este nombre, la aromatización es una piedra angular del refinado del petróleo. Una de las principales reacciones de reformado es la deshidrogenación de naftenos en aromáticos. El proceso, catalizado por platino, se ejemplifica en la conversión de metilciclohexano (un nafteno) en tolueno (un aromático). La deshidrociclización convierte las parafinas (hidrocarburos acíclicos) en aromáticos. Un proceso de aromatización relacionado incluye la deshidroisomerización de metilciclopentano a benceno:
Procesos bioquímicos
Las aromatasas son enzimas que aromatizan los anillos dentro de los esteroides. Las conversiones específicas son testosterona en estradiol y androstenediona en estrona. Cada una de estas aromatizaciones implica la oxidación del grupo metilo C-19 para permitir la eliminación del ácido fórmico concomitante con la aromatización. Estas conversiones son relevantes para la tumorogénesis de estrógenos en el desarrollo del cáncer de mama y de ovario en mujeres posmenopáusicas y de la ginecomastia en hombres. Los inhibidores de la aromatasa como el exemestano (que forma un vínculo permanente y desactivador con la enzima aromatasa) y el anastrozol y el letrozol (que compiten por la enzima) han demostrado ser más eficaces que los medicamentos antiestrógenos como el tamoxifeno, probablemente porque previenen la formación de estradiol.
Vías de aromatización
Deshidrogenación oxidativa
Para el ciclohexano, el ciclohexeno y el ciclohexadieno, la deshidrogenación es la vía conceptualmente más simple para la aromatización. La barrera de activación disminuye con el grado de insaturación. Por tanto, los ciclohexadienos son especialmente propensos a la aromatización. Formalmente, la deshidrogenación es un proceso redox. La aromatización deshidrogenativa es lo opuesto a la hidrogenación de arenos. Como tales, los catalizadores de hidrogenación son eficaces para la reacción inversa. Las deshidrogenaciones de ciclohexanos y materias primas relacionadas catalizadas por platino son las aplicaciones a mayor escala de esta reacción (ver arriba).
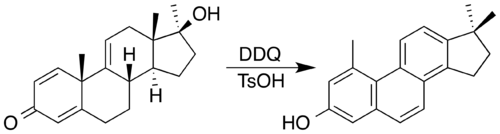
La 2,3-dicloro-5,6-diciano-1,4-benzoquinona (DDQ) suele ser el reactivo elegido. Se ha utilizado DDQ y un catalizador ácido para sintetizar un esteroide con un núcleo de fenantreno mediante oxidación acompañada de una doble migración de metilo. En el proceso, el DDQ se reduce a un producto de hidroquinona aromática.
El azufre y el selenio se utilizan tradicionalmente en la aromatización, siendo el grupo saliente el sulfuro de hidrógeno.
Los complejos de metales de transición solubles pueden inducir una aromatización oxidativa concomitante con la complejación. El α-felandreno (2-metil-5-iso-propil-1,3-ciclohexadieno) se oxida a p-iso-propiltolueno con la reducción de tricloruro de rutenio.
La deshidrogenación oxidativa de la dihidropiridina da como resultado la aromatización, dando piridina.
Deshidratación

Los anillos no aromáticos se pueden aromatizar de muchas maneras. La deshidratación permite la reacción de Semmler-Wolff. de 2-ciclohexenona oxima a anilina en condiciones ácidas.
Tautomerización

La isomerización de ciclohexadienonas da el tautómero aromático fenol. La isomerización de 1,4-naftalenodiol a 200 °C produce una mezcla 2:1 con su forma ceto, 1,4-dioxotetralina.
Abstracción de hidruros y protones
Clásicamente, las reacciones de aromatización implican cambiar la proporción C:H de un sustrato. Cuando se aplica al ciclopentadieno, la eliminación de protones da la base conjugada aromática anión ciclopentadienilo, aislable como ciclopentadienuro de sodio:
- 2 Na + 2 C5H6 → 2 NaC5H5 + H2
La aromatización puede implicar la eliminación de la hidratación. Tropylium, C
7H+
7 surge por la reacción de aromatización del cicloheptatrieno con aceptadores de hidratido.
- C
7H
8 + Br
2 → C
7H+
7 + Br−
+ HBr

De precursores acíclicos
La aromatización de precursores acíclicos es más rara en la síntesis orgánica, aunque es un componente importante de la producción de BTX en las refinerías.
Entre los precursores acíclicos, los alquinos son relativamente propensos a la aromatización ya que están parcialmente deshidrogenados. La ciclación de Bergman convierte una enediina en un diradical intermedio deshidrobenceno, que extrae hidrógeno para aromatizar. El resto enediino se puede incluir dentro de un anillo existente, permitiendo el acceso a un sistema bicíclico en condiciones suaves como consecuencia de la tensión del anillo en el reactivo. El ciclodeca-3-en-1,5-diino reacciona con 1,3-ciclohexadieno para producir benceno y tetralina a 37 °C, siendo la reacción muy favorable debido a la formación de dos nuevos anillos aromáticos: