Aromaticidad
En química, aromaticidad significa que la molécula tiene estructuras cíclicas (en forma de anillo) con enlaces pi en resonancia (aquellas que contienen electrones deslocalizados). Los anillos aromáticos brindan una mayor estabilidad en comparación con los compuestos saturados que tienen enlaces simples y otros arreglos no cíclicos geométricos o conectivos con el mismo conjunto de átomos. Los anillos aromáticos son muy estables y no se rompen fácilmente. Los compuestos orgánicos que no son aromáticos se clasifican como compuestos alifáticos; pueden ser cíclicos, pero solo los anillos aromáticos tienen mayor estabilidad. El término aromaticidad con este significado está históricamente relacionado con el concepto de tener un aroma, pero es una propiedad distinta de ese significado.
Dado que los compuestos aromáticos más comunes son derivados del benceno (un hidrocarburo aromático común en el petróleo y sus destilados), la palabra aromático ocasionalmente se refiere informalmente a los derivados del benceno, y así se definió por primera vez. Sin embargo, existen muchos compuestos aromáticos distintos del benceno. En los organismos vivos, por ejemplo, los anillos aromáticos más comunes son las bases de doble anillo (Purina) en el ARN y el ADN. Un grupo funcional aromático u otro sustituyente se denomina grupo arilo.
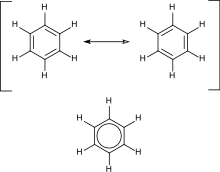
En términos de la naturaleza electrónica de la molécula, la aromaticidad describe un sistema conjugado que a menudo se representa en los diagramas de Lewis como enlaces simples y dobles alternados en un anillo. En realidad, los electrones representados por los dobles enlaces en el diagrama de Lewis se distribuyen uniformemente alrededor del anillo ('deslocalizados'), lo que aumenta la estabilidad de la molécula. Debido a las restricciones impuestas por la forma en que se dibujan los diagramas de Lewis, la molécula no se puede representar con un solo diagrama, sino con un híbrido de múltiples diagramas diferentes (llamado resonancia), como las dos estructuras de resonancia del benceno. Estas moléculas no se pueden encontrar en ninguna de estas representaciones, con los enlaces simples más largos en un lugar y el doble enlace más corto en otro (ver § Teoría a continuación). Más bien, la molécula exhibe todas las longitudes de enlace iguales entre las de los enlaces simples y dobles. Este modelo comúnmente visto de anillos aromáticos, a saber, la idea de que el benceno se formó a partir de un anillo de carbono de seis miembros con enlaces simples y dobles alternantes (ciclohexatrieno), fue desarrollado por August Kekulé (ver § Historia a continuación). El modelo para el benceno consta de dos formas de resonancia, que corresponden a los enlaces dobles y sencillos que se superponen para producir seis enlaces uno y medio. El benceno es una molécula más estable de lo que cabría esperar sin tener en cuenta la deslocalización de la carga.
Teoría
Como es un estándar para los diagramas de resonancia, el uso de una flecha de dos puntas indica que dos estructuras no son entidades distintas sino meras posibilidades hipotéticas. Tampoco es una representación precisa del compuesto real, que está mejor representado por un híbrido (promedio) de estas estructuras. Un enlace C=C es más corto que un enlace C−C. El benceno es un hexágono regular: es plano y los seis enlaces carbono-carbono tienen la misma longitud, que es intermedia entre la de un enlace simple y la de un enlace doble.
En una molécula cíclica con tres dobles enlaces alternos, ciclohexatrieno, la longitud del enlace del enlace simple sería de 1,54 Å y la del doble enlace sería de 1,34 Å. Sin embargo, en una molécula de benceno, la longitud de cada uno de los enlaces es de 1,40 Å, lo que indica que es el promedio de enlace simple y doble.
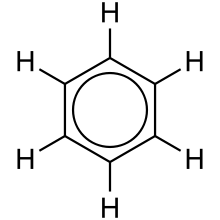
Una mejor representación es la del enlace π circular (el ciclo interno de Armstrong), en el que la densidad de electrones se distribuye uniformemente a través de un enlace π por encima y por debajo del anillo. Este modelo representa más correctamente la ubicación de la densidad de electrones dentro del anillo aromático.
Los enlaces simples se forman a partir de la superposición de orbitales sp2 atómicos hibridados en línea entre los núcleos de carbono; estos se denominan enlaces σ. Los dobles enlaces consisten en un enlace σ y un enlace π. Los enlaces π se forman a partir de la superposición de orbitales p atómicos por encima y por debajo del plano del anillo. El siguiente diagrama muestra las posiciones de estos orbitales p:
Dado que están fuera del plano de los átomos, estos orbitales pueden interactuar entre sí libremente y deslocalizarse. Esto significa que, en lugar de estar ligado a un átomo de carbono, cada electrón es compartido por los seis del anillo. Por lo tanto, no hay suficientes electrones para formar dobles enlaces en todos los átomos de carbono, pero el "extra" los electrones fortalecen todos los enlaces en el anillo por igual. Se considera que el orbital molecular resultante tiene simetría π.
Historia
El término "aromático"
El primer uso conocido de la palabra "aromático" como un término químico, es decir, para aplicar a compuestos que contienen el grupo fenilo, aparece en un artículo de August Wilhelm Hofmann en 1855. Hofmann usó el término para una clase de compuestos de benceno, muchos de los cuales tienen olores (aromas), a diferencia de los hidrocarburos saturados puros. La aromaticidad como propiedad química no tiene una relación general con las propiedades olfativas de dichos compuestos (cómo huelen), aunque en 1855, antes de que se comprendiera la estructura del benceno o de los compuestos orgánicos, químicos como Hofmann comenzaban a comprender que las moléculas olorosas de las plantas, como los terpenos, tenían propiedades químicas que hoy reconocemos son similares a los hidrocarburos de petróleo insaturados como el benceno. Si esta fue la introducción más temprana del término, es curioso que Hofmann no diga nada acerca de por qué introdujo un adjetivo que indica carácter olfativo para aplicarlo a un grupo de sustancias químicas, de las cuales solo algunas tienen aromas notables. Además, algunas de las sustancias orgánicas más odoríferas que se conocen son los terpenos, que no son aromáticos en el sentido químico. Los terpenos y las sustancias bencenoides tienen una característica química en común, es decir, una mayor insaturación que muchos compuestos alifáticos, y es posible que Hofmann no haya hecho una distinción entre las dos categorías. Muchos de los primeros ejemplos conocidos de compuestos aromáticos, como el benceno y el tolueno, tienen olores agradables característicos. Esta propiedad llevó al término "aromático" para esta clase de compuestos, y de ahí el término "aromaticidad" para la propiedad electrónica eventualmente descubierta.
La estructura del anillo de benceno
En el siglo XIX, a los químicos les resultó desconcertante que el benceno pudiera ser tan poco reactivo frente a las reacciones de adición, dado su supuesto alto grado de insaturación. La estructura del ciclohexatrieno para el benceno fue propuesta por primera vez por August Kekulé en 1865. La mayoría de los químicos aceptaron rápidamente esta estructura, ya que representaba la mayoría de las relaciones isoméricas conocidas de la química aromática. La estructura hexagonal explica por qué solo existe un isómero de benceno y por qué los compuestos disustituidos tienen tres isómeros.
Entre 1897 y 1906, J. J. Thomson, el descubridor del electrón, propuso tres electrones equivalentes entre cada par de átomos de carbono en el benceno. Una explicación de la estabilidad excepcional del benceno se atribuye convencionalmente a Sir Robert Robinson, quien aparentemente fue el primero (en 1925) en acuñar el término sexteto aromático como un grupo de seis electrones que resiste la disrupción.
De hecho, este concepto se remonta más atrás, a través de Ernest Crocker en 1922, a Henry Edward Armstrong, quien en 1890 escribió "las [seis] afinidades céntricas actúan dentro de un ciclo... el benceno puede ser representado por un doble anillo… y cuando se forma un compuesto aditivo, el ciclo interno de afinidad sufre una interrupción, los átomos de carbono contiguos a los que nada se ha unido necesariamente adquieren la condición etilénica".
Aquí, Armstrong describe al menos cuatro conceptos modernos. Primero, su "afinidad" es más conocido hoy en día como el electrón, que sería descubierto sólo siete años después por J. J. Thomson. En segundo lugar, describe la sustitución aromática electrófila, procediendo (tercero) a través de un intermedio de Wheland, en el que (cuarto) se rompe la conjugación del anillo. Introdujo el símbolo C centrado en el anillo como abreviatura del ciclo interior, anticipándose así a la notación de Erich Clar. Se argumenta que también anticipó la naturaleza de la mecánica ondulatoria, ya que reconoció que sus afinidades tenían dirección, no siendo meramente partículas puntuales, y colectivamente tenían una distribución que podía alterarse introduciendo sustituyentes en el anillo de benceno (tanto como la distribución de la carga eléctrica de un cuerpo se altera al acercarlo a otro cuerpo).
Los orígenes de la mecánica cuántica de esta estabilidad, o aromaticidad, fueron modelados por primera vez por Hückel en 1931. Fue el primero en separar los electrones de enlace en electrones sigma y pi.
La aromaticidad de un compuesto aromático arbitrario se puede medir cuantitativamente mediante el método computacional de desplazamiento químico independiente del núcleo (NICS) y los métodos de porcentaje de aromaticidad.
Características de los sistemas aromáticos
Un anillo aromático (o arilo) contiene un conjunto de átomos unidos covalentemente con características específicas:
- Un sistema de π conjugado deslocalizado, más comúnmente un arreglo de enlaces individuales y dobles alternados
- Estructura plano, con todos los átomos contribuyentes en el mismo plano
- Contribuir átomos dispuestos en uno o más anillos
- Un número de electrones descalizados π que es incluso, pero no un múltiple de 4. Es decir, 4n+ 2 π-electrons, donde n= 0, 1, 2, 3, y así sucesivamente. Esto se conoce como la regla de Hückel.
Según la regla de Hückel, si una molécula tiene 4n + 2 π-electrones, es aromática, pero si tiene 4n π- electrones y tiene las características 1 a 3 anteriores, se dice que la molécula es antiaromática. Mientras que el benceno es aromático (6 electrones, de 3 dobles enlaces), el ciclobutadieno es antiaromático, ya que el número de electrones π deslocalizados es 4, que por supuesto es un múltiplo de 4. Sin embargo, el ion ciclobutadienuro (2−) es aromático (6 electrones). Un átomo en un sistema aromático puede tener otros electrones que no son parte del sistema y, por lo tanto, se ignoran para la regla 4n + 2. En el furano, el átomo de oxígeno tiene hibridación sp2. Un par solitario está en el sistema π y el otro en el plano del anillo (análogo al enlace C-H en las otras posiciones). Hay 6 electrones π, por lo que el furano es aromático.
Las moléculas aromáticas suelen mostrar una mayor estabilidad química, en comparación con moléculas no aromáticas similares. Una molécula que puede ser aromática tenderá a cambiar hacia la aromaticidad, y la estabilidad añadida cambia la química de la molécula. Los compuestos aromáticos sufren reacciones de sustitución aromática electrófila y sustitución aromática nucleófila, pero no reacciones de adición electrófila como ocurre con los dobles enlaces carbono-carbono.
En presencia de un campo magnético, los electrones π que circulan en una molécula aromática producen una corriente de anillo aromático que induce un campo magnético adicional, un efecto importante en la resonancia magnética nuclear. La señal de RMN de los protones en el plano de un anillo aromático se desplaza sustancialmente más hacia abajo que la de los carbonos sp2 no aromáticos. Esta es una forma importante de detectar aromaticidad. Por el mismo mecanismo, las señales de los protones ubicados cerca del eje del anillo se desplazan campo arriba.
Las moléculas aromáticas pueden interactuar entre sí en el llamado apilamiento π–π: los sistemas π forman dos anillos paralelos que se superponen en un "cara a cara" orientación. Las moléculas aromáticas también pueden interactuar entre sí en un 'borde a cara'. Orientación: La ligera carga positiva de los sustituyentes en los átomos del anillo de una molécula es atraída por la ligera carga negativa del sistema aromático en otra molécula.
Las moléculas monocíclicas planas que contienen 4n electrones π se denominan antiaromáticas y, en general, son inestables. Las moléculas que podrían ser antiaromáticas tenderán a cambiar de esta conformación electrónica o, por lo tanto, se volverán no aromáticas. Por ejemplo, el ciclooctatetraeno (COT) se distorsiona fuera de la planitud, rompiendo la superposición π entre dobles enlaces adyacentes. Estudios recientes han determinado que el ciclobutadieno adopta una configuración rectangular asimétrica en la que efectivamente se alternan enlaces simples y dobles, sin resonancia; los enlaces sencillos son notablemente más largos que los enlaces dobles, lo que reduce la superposición desfavorable del orbital p. Esta reducción de la simetría elimina la degeneración de los dos orbitales moleculares anteriormente no enlazantes, que según la regla de Hund obliga a los dos electrones desapareados a entrar en un nuevo orbital débilmente enlazante (y también crea un orbital débilmente antienlazante). Por lo tanto, el ciclobutadieno no es aromático; la tensión de la configuración asimétrica supera la desestabilización anti-aromática que afectaría a la configuración cuadrada simétrica.
La regla de aromaticidad de Hückel trata a las moléculas en sus estados fundamentales singulete (S0). Se encuentra que las tendencias de estabilidad de los compuestos descritos aquí se invierten en los estados excitados de triplete y singlete más bajos (T1 y S1), según Baird' regla s. Esto significa que compuestos como el benceno, con 4n + 2 π-electrones y propiedades aromáticas en el estado fundamental, se vuelven antiaromáticos y, a menudo, adoptan estructuras menos simétricas en el estado excitado.
Compuestos aromáticos
Importancia
Los compuestos aromáticos juegan un papel clave en la bioquímica de todos los seres vivos. Los cuatro aminoácidos aromáticos histidina, fenilalanina, triptófano y tirosina sirven como uno de los 20 componentes básicos de las proteínas. Además, los 5 nucleótidos (adenina, timina, citosina, guanina y uracilo) que componen la secuencia del código genético en el ADN y el ARN son purinas aromáticas o pirimidinas. La molécula hemo contiene un sistema aromático con 22 electrones π. La clorofila también tiene un sistema aromático similar.
Los compuestos aromáticos son importantes en la industria. Los hidrocarburos aromáticos clave de interés comercial son el benceno, el tolueno, el ortoxileno y el paraxileno. Cada año se producen alrededor de 35 millones de toneladas en todo el mundo. Se extraen de mezclas complejas obtenidas por refinación de petróleo o por destilación de alquitrán de hulla, y se utilizan para producir una gama de importantes productos químicos y polímeros, incluidos estireno, fenol, anilina, poliéster y nailon.
Homocíclicos neutros
Benceno, así como la mayoría de los otros anulenos (con la excepción del ciclodecapentaeno, porque no es plano) con la fórmula C4n+2H4n+2 donde n es un número natural, como ciclotetradecaheptaeno (n=3).
Heterocíclicos
En los aromáticos heterocíclicos (heteroaromáticos), uno o más de los átomos en el anillo aromático es de un elemento distinto del carbono. Esto puede disminuir la aromaticidad del anillo y, por lo tanto (como en el caso del furano), aumentar su reactividad. Otros ejemplos incluyen piridina, pirazina, pirrol, imidazol, pirazol, oxazol, tiofeno y sus análogos benzanulados (por ejemplo, bencimidazol). En todos estos ejemplos, el número de electrones π es 6, debido a los electrones π de los dobles enlaces, así como a los dos electrones de cualquier par solitario que esté en el orbital p que esté en el plano del π aromático. sistema. Por ejemplo, en la piridina, los cinco carbonos con hibridación sp2 tienen cada uno un orbital p que es perpendicular al plano del anillo, y cada uno de estos orbitales p contiene un electrón π. Además, el átomo de nitrógeno también tiene hibridación sp2 y tiene un electrón en un orbital p, que suma 6 electrones p, lo que hace que la piridina sea aromática. El par solitario en el nitrógeno no forma parte del sistema π aromático. El pirrol y el imidazol son anillos aromáticos de cinco miembros que contienen heteroátomos. En el pirrol, cada uno de los cuatro carbonos con hibridación sp2 contribuye con un electrón π, y el átomo de nitrógeno también tiene hibridación sp2 y contribuye con dos electrones π de su par solitario, que ocupa un orbital p. En el imidazol, ambos nitrógenos tienen hibridación sp2; el que está en el doble enlace aporta un electrón y el que no está en el doble enlace y está en un par solitario aporta dos electrones al sistema π.
Aromáticos fusionados y policíclicos
Los hidrocarburos aromáticos policíclicos son moléculas que contienen dos o más anillos aromáticos simples fusionados al compartir dos átomos de carbono vecinos. Los ejemplos son naftaleno, antraceno y fenantreno. En los aromáticos fusionados, no todos los enlaces carbono-carbono son necesariamente equivalentes, ya que los electrones no están deslocalizados en toda la molécula. La aromaticidad de estas moléculas se puede explicar utilizando su imagen orbital. Al igual que el benceno y otras moléculas aromáticas monocíclicas, los policíclicos tienen un sistema pi conjugado cíclico con superposición de orbitales p por encima y por debajo del plano del anillo.
Aromáticos sustituidos
Muchos compuestos químicos son anillos aromáticos con otros grupos funcionales adjuntos. Los ejemplos incluyen trinitrotolueno (TNT), ácido acetilsalicílico (aspirina), paracetamol y los nucleótidos del ADN.
Iones aromáticos
Las moléculas aromáticas no tienen por qué ser moléculas neutras. Los iones que cumplen la regla de Huckel de 4n + 2 electrones π en una molécula plana, cíclica y conjugada se consideran iones aromáticos. Por ejemplo, el anión ciclopentadienilo y el catión cicloheptatrienilio se consideran iones aromáticos, y la molécula de azuleno se puede aproximar como una combinación de ambos.
Para convertir el átomo de sp3 a sp2, se debe formar un radical carbocatión, carbanión o carbono. Estos dejan carbonos con hibridación sp2 que pueden participar en el sistema π de una molécula aromática. Al igual que los compuestos aromáticos neutros, estos compuestos son estables y se forman fácilmente. El anión ciclopentadienilo se forma muy fácilmente y, por lo tanto, el 1,3-ciclopentadieno es un hidrocarburo muy ácido con un pKa de 16. Otros ejemplos de iones aromáticos incluyen el catión ciclopropenio (2 electrones π) y el dianión ciclooctatetraenilo (10 electrones π).
Compuestos aromáticos atípicos
La aromaticidad también ocurre en compuestos que no son carbocíclicos o heterocíclicos; Se han sintetizado compuestos inorgánicos de anillos de seis miembros análogos al benceno. Por ejemplo, la borazina es un anillo de seis miembros compuesto por átomos de boro y nitrógeno alternados, cada uno con un hidrógeno unido. Tiene un sistema π deslocalizado y sufre reacciones de sustitución electrofílica apropiadas para anillos aromáticos en lugar de reacciones esperadas de moléculas no aromáticas.
Muy recientemente, la aromaticidad del planar Si6−
5 anillos que ocurren en la fase Zintl Li12Si7 fue evidenciado experimentalmente por RMN de estado sólido de Li. Se cree que la aromaticidad del metal existe en ciertos grupos de aluminio y galio, específicamente Ga32- y Al42-, por ejemplo.
La homoaromaticidad es el estado de los sistemas donde la conjugación es interrumpida por un solo átomo de carbono con hibridación sp3.
La aromaticidad Y se usa para describir una molécula plana (plana) en forma de Y con enlaces resonantes. El concepto fue desarrollado para explicar la extraordinaria estabilidad y alta basicidad del catión guanidinio. El guanidinio no es una molécula de anillo y está conjugado de forma cruzada en lugar de un sistema π de átomos unidos consecutivamente, pero se informa que tiene sus seis electrones π deslocalizados en toda la molécula. El concepto es controvertido y algunos autores enfatizan diferentes efectos. Esto también se ha sugerido como la razón por la que el dication de trimetilenmetano es más estable que el dication de butadienilo.
σ-aromaticidad se refiere a la estabilización que surge de la deslocalización de los enlaces sigma. A menudo se invoca en la química de grupos y está estrechamente relacionada con la regla de Wade. Además, en 2021 se informó de un complejo σ-aromático Th3, lo que indica que el concepto de σ-aromaticidad sigue siendo relevante para los orbitales con el número cuántico principal 6.
Otras simetrías
| Tipo | Simetría cíclica | Regla de electrones | Occurrence |
|---|---|---|---|
| Hückel aromaticity | Cilíndricos | 4n + 2 | Anillos aromáticos |
| Möbius aromaticity | Möbius | 4n | Trans anillos aromáticos |
| Aromática esférica | Spherical | 2(n+1)2 | Fullerenes |
La aromaticidad de Möbius ocurre cuando un sistema cíclico de orbitales moleculares, formado a partir de orbitales atómicos pπ y poblado en una capa cerrada por 4n (n es un número entero) electrones, se le da un solo medio giro para formar una tira de Möbius. Un sistema π con 4n electrones en un anillo plano (no torcido) sería antiaromático, y por tanto muy inestable, debido a la simetría de las combinaciones de orbitales atómicos p. Al girar el anillo, la simetría del sistema cambia y se permite (ver también el concepto de Möbius-Hückel para más detalles). Debido a que el giro puede ser zurdo o diestro, los compuestos aromáticos de Möbius resultantes son disimétricos o quirales. Pero a partir de 2012, no se habían sintetizado moléculas aromáticas de Möbius. Los aromáticos con dos medios giros correspondientes a las topologías paradrómicas fueron sugeridos por primera vez por Johann Listing. En una forma de carbobenceno, el anillo se expande y contiene grupos alquino y aleno.
La aromaticidad esférica es la aromaticidad que ocurre en los fullerenos. En 2000, Andreas Hirsch y colaboradores en Erlangen, Alemania, formularon una regla para determinar cuándo sería aromático un fullereno. Descubrieron que si hubiera 2(n + 1)2 electrones π, entonces el fullereno mostraría propiedades aromáticas. Esto se deriva del hecho de que un fullereno aromático debe tener una simetría icosaédrica completa (u otra apropiada), por lo que los orbitales moleculares deben estar completamente llenos. Esto es posible solo si hay exactamente 2(n + 1)2 electrones, donde n es un número entero no negativo.
Contenido relacionado
Red de equilibrio
Sustancia
KL1