ARN ribosómico 16S
Contenido keyboard_arrow_down

Funciones
- Como el ARN ribosomal grande (23S), tiene un papel estructural, actuando como un andamio que define las posiciones de las proteínas ribosomal.
- El 3′-end contiene la secuencia anti-Shine-Dalgarno, que se une hasta el codón de inicio de AUG en el mRNA. Los 3.-fin de 16S ARN se une a las proteínas S1 y S21 que se sabe que participan en la iniciación de la síntesis de proteínas
- Interactúa con 23S, ayudando en la unión de las dos subunidades ribosomal (50S y 30S)
- Estabiliza el codon-anticodon correcto emparejando en el sitio A mediante la formación de un enlace de hidrógeno entre el átomo N1 de residuos de adenina 1492 y 1493 y el 2.Grupo OH de la columna vertebral del MRNA.
Estructura
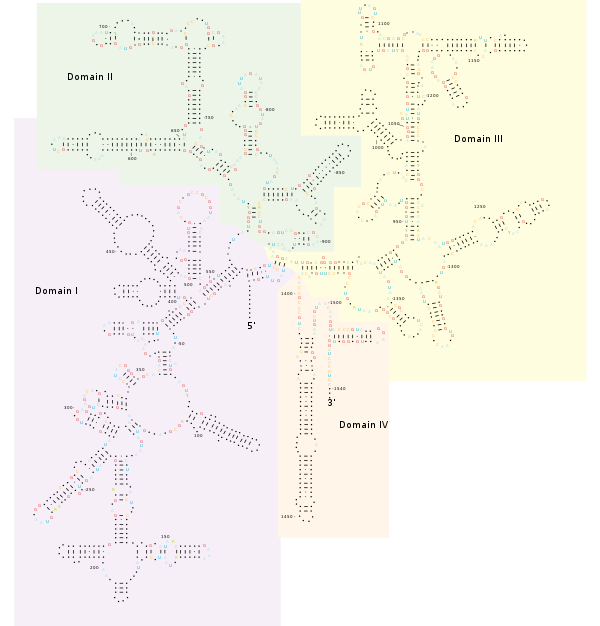
Cartillas universales
| Nombre | Secuencia (5).-3.) | Ref. |
|---|---|---|
| 8F | AGA GTT TGA TCC TGG CTC AG | |
| 27F | AGA GTT TGA TCM TGG CTC AG | |
| 336R | ACT GCT GCS YCC CGT AGG AGT CT | |
| 337F | GAC TCC TAC GGG AGG CWG CAG | |
| 518R | GTA TTA CCG CGG CTG G | |
| 533F | GTG CCA GCM GCC GCG GTA A | |
| 785F | GGA TTA GAT ACC CTG GTA | |
| 806R | GGA CTA CVS GGG TAT CTA AT | |
| 907R | CCG TCA ATT CCT TTR AGT TT | |
| 928F | TAA AAC TYA AAK GAA TTG ACG | |
| 1100F | YAA CGA GCG CAA CCC | |
| 1100R | GG TTG CGC TCG TTG | |
| U1492R | GT TAC CTT GTT ACG ACT T | |
| 1492R | CG TTA CCT TGT TAC GAC TT |
Aplicaciones PCR y NGS
Regiones hipervariables
Promiscuidad de genes de 16S rRNA
16S bases de datos costosomal
SILVA
GreenGenes
EzBioCloud
MIMT
Ribosomal Database Project
Referencias
- ^ Schluenzen F, Tocilj A, Zarivach R, Harms J, Gluehmann M, Janell D, et al. (septiembre de 2000). "La estructura de la pequeña subunidad ribosomal activada funcionalmente en resolución de 3.3 angstroms". Celular. 102 5): 615 –623. doi:10.1016/S0092-8674(00)00084-2. PMID 11007480. S2CID 1024446.
- ^ a b Woese CR, Fox GE (noviembre de 1977). "La estructura pilogenética del dominio procariota: los reinos primarios". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 74 (11): 5088–5090. Bibcode:1977PNAS...74.5088W. doi:10.1073/pnas.74.11.5088. PMC 432104. PMID 270744.

- ^ Woese CR, Kandler O, Wheelis ML (junio de 1990). "Hacia un sistema natural de organismos: propuesta para los dominios Archaea, Bacteria y Eucarya". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 87 (12): 4576 –4579. Bibcode:1990PNAS...87.4576W. doi:10.1073/pnas.87.12.4576. PMC 54159. PMID 2112744.
- ^ Case RJ, Boucher Y, Dahllöf I, Holmström C, Doolittle WF, Kjelleberg S (enero de 2007). "Uso de genes rRNA 16S y rpoB como marcadores moleculares para estudios de ecología microbiana". Microbiología aplicada y ambiental. 73 1): 278 –288. Bibcode:2007ApEnM..73..278C. doi:10.1128/AEM.01177-06. PMC 1797146. PMID 17071787.
- ^ Czernilofsky AP, Kurland CG, Stöffler G (octubre de 1975). "30S proteínas ribosomal asociadas con el 3'-terminus de 16S ARN". Cartas FEBS. 58 1): 281 –284. Bibcode:1975 FEBSL..58..281C. doi:10.1016/0014-5793(75)80279-1PMID 1225593. S2CID 22941368.
- ^ Woese CR (junio de 1987). "Evolución bacteriana". Microbiológica Reseñas. 51 2): 221 –271. doi:10.1128/MR.51.2.221-271.1987. PMC 373105. PMID 2439888.
- ^ a b c Weisburg WG, Barns SM, Pelletier DA, Lane DJ (enero de 1991). "16S amplificación de ADN ribosomal para estudio filogenético". Journal of Bacteriology. 173 2): 697 –703. doi:10.1128/jb.173.2.697-703.1991. PMC 207061. PMID 1987160.
- ^ a b Coenye T, Vandamme P (noviembre de 2003). "Heterogeneidad intrageómica entre múltiples operones de ARN ribosomal 16S en genomas bacterianos secuenciados". FEMS Cartas de microbiología. 228 1): 45 –49. doi:10.1016/S0378-1097(03)00717-1. PMID 14612235.
- ^ Tsukuda M, Kitahara K, Miyazaki K (agosto de 2017). "El análisis comparativo de la función del ARN revela una alta similitud funcional entre los 16 S rRNAs bacterianos distantes relacionados". Scientific Reports. 7 (1): 9993. Bibcode:2017NatSR...7.9993T doi:10.1038/s41598-017-10214-3. PMC 5577257. PMID 28855596.
- ^ Jay ZJ, Inskeep WP (julio 2015). "La distribución, diversidad e importancia de los intrones de genes de 16S rRNA en el orden Thermoproteales". Biology Direct. 10 35 doi:10.1186/s13062-015-0065-6. PMC 4496867. PMID 26156036.
- ^ Walker, Sidney P.; Barrett, Maurice; Hogan, Glenn; Flores Bueso, Yensi; Claesson, Marcus J.; Tangney, Mark (2020-10-01). "La amplificación específica del ADN humano es un reto importante para el análisis de secuencias de genes de 16S rRNA". Scientific Reports. 10 (1): 16356. doi:10.1038/s41598-020-73403-7. ISSN 2045-2322. 7529756. PMID 33004967.
- ^ "Human Microbiome Project DACC - Home". www.hmpdacc.org. Archivado desde el original el 2010-10-30.
- ^ a b "Primers, 16S ribosomal DNA - François Lutzoni's Lab". lutzonilab.net. Archivado desde el original el 2012-12-27.
- ^ a b Eden PA, Schmidt TM, Blakemore RP, Pace NR (abril de 1991). "Análisis fitogenético de Aquaspirillum magnetotacticum usando ADN específico de reacción de cadena polimerasa amplificado 16S rRNA". International Journal of Systematic Bacteriology. 41 2): 324 –325. doi:10.1099/00207713-41-2-324. PMID 1854644.
- ^ a b James, Greg (15 de mayo de 2018). "Identificación bacteriana universal por PCR y secuencia de ADN de 16S rRNA Gene". PCR para microbiología clínica. Springer, Dordrecht. pp. 209 –214. doi:10.1007/978-90-481-9039-3_28. ISBN 978-90-481-9038-6.
- ^ a b Weidner S, Arnold W, Puhler A (marzo de 1996). "Diversidad de microorganismos no cultivados asociados con la estipulacea de Halophila estimada por análisis de polimorfismo de longitud fragmentada de restricción de genes de 16S rRNA amplificados por PCR" (PDF). Microbiología aplicada y ambiental. 62 3): 766–771. Bibcode:1996ApEnM.62..766W. doi:10.1128/AEM.62.3.766-771.1996 167844. PMID 8975607. Archivado (PDF) del original el 2011-07-15.
- ^ Park, Changwoo; Kim, Seung Bum; Choi, Sang Ho; Kim, Seil (2021). "Comparison of 16S rRNA Gene Based Microbial Profiling Using Five Next-Generation Sequencers and Various Primers". Fronteras en Microbiología. 12. doi:10.3389/fmicb.2021.715500. ISSN 1664-302X. PMC 8552068. PMID 34721319.
- ^ Eloe-Fadrosh EA, Ivanova NN, Woyke T, Kyrpides NC (febrero 2016). "La metagenomía descubre lagunas en la detección basada en amplicon de la diversidad microbiana". Nature Microbiology. 1 (4): 15032. doi:10.1038/nmicrobiol.2015.32. OSTI 1379258. PMID 27572438. S2CID 27232975.
- ^ Bergmann GT, Bates ST, Eilers KG, Lauber CL, Caporaso JG, Walters WA, et al. (Julio 2011). "La dominación sub-reconocida de Verrucomicrobia en comunidades bacterianas del suelo". Biología del suelo " Bioquímica ". 43 (7): 1450 –1455. Bibcode:2011SBi...43.1450B. doi:10.1016/j.soilbio.2011.03.012. PMC 3260529. PMID 22267877.
- ^ Jiang H, Dong H, Zhang G, Yu B, Chapman LR, Fields MW (junio de 2006). "Diversidad microbiana en agua y sedimento del lago Chaka, un lago athalassohaline en el noroeste de China". Microbiología aplicada y ambiental. 72 (6): 3832–3845. Bibcode:2006ApEnM..72.3832J. doi:10.1128/AEM.02869-05. PMC 1489620. PMID 16751487.
- ^ Pereira F, Carneiro J, Matthiesen R, van Asch B, Pinto N, Gusmão L, Amorim A (diciembre de 2010). "Identificación de especies por análisis de múltiplesx de secuencias de longitud variable". Nucleic Acids Research. 38 (22): e203. doi:10.1093/nar/gkq865. PMC 3001097. PMID 20923781.
- ^ Kolbert CP, Persing DH (junio de 1999). "Secuenciación de ADN rimosomal como herramienta para la identificación de patógenos bacterianos". Opinión actual en microbiología. 2 3): 299 –305. doi:10.1016/S1369-5274(99)80052-6. PMID 10383862.
- ^ Clarridge JE (octubre de 2004). "Impact of 16S rRNA gene sequence analysis for identification of bacterias on clinic microbiology and infected diseases". Microbiología clínica Reseñas. 17 4): 840 –62, cuadro de contenidos. doi:10.1128/CMR.17.4.840-862.2004. PMC 523561. PMID 15489351.
- ^ Lu T, Stroot PG, Oerther DB (julio de 2009). "La transcripción reversa de 16S rRNA para monitorear poblaciones bacterianas bilioso-sintetizadoras en el medio ambiente". Microbiología aplicada y ambiental. 75 (13): 4589–4598. Bibcode:2009ApEnM.75.4589L. doi:10.1128/AEM.02970-08. PMC 2704851. PMID 19395563.
- ^ Brett PJ, DeShazer D, Woods DE (enero de 1998). "Burkholderia thailandensis sp. nov., a Burkholderia pseudomallei-like species". International Journal of Systematic Bacteriology48 Pt 1 (1): 317–320. doi:10.1099/00207713-48-1-317. PMID 9542103.
- ^ Schmidt, Relman DA (1994). "Identificación física de patógenos no cultivados usando secuencias de ARN ribosomal". Bacterial Pathogenesis Parte A: Identificación y Regulación de Factores de Virulencia. Métodos en Enzimología. Vol. 235. pp. 205–222. doi:10.1016/0076-6879(94)35142-2. ISBN 978-0-12-182136-4. PMID 7520119.
- ^ Gray JP, Herwig RP (noviembre de 1996). "Análisis hipergenético de las comunidades bacterianas en sedimentos marinos". Microbiología aplicada y ambiental. 62 (11): 4049 –4059. Bibcode:1996ApEnM.62.4049G. doi:10.1128/AEM.62.11.4049-4059.1996. PMC 168226. PMID 8899989.
- ^ Sanschagrin S, Yergeau E (agosto de 2014). "Secuenciación de próxima generación de amplicons de genes de ARN ribosomal 16S". Journal of Visualized Experiments (90). doi:10.3791/51709. PMC 4828026. PMID 25226019.
- ^ Botan, Alexandru; Campisciano, Giuseppina; Zerbato, Verena; Di Bella, Stefano; Simonetti, Omar; Busetti, Marina; Toc, Dan Alexandru; Luzzati, Roberto; Comar, Manola (2024-06-21). "Performance of 16S rRNA Gene Next-Generation Sequencing and the Culture Method in the Detection of Bacteria in Clinical Specimens". Diagnosticos. 14 13): 1318. doi:10.3390/diagnostics14131318. ISSN 2075-4418. PMC 11240331. PMID 39001210.
- ^ Gray MW, Sankoff D, Cedergren RJ (julio de 1984). "Sobre la descendencia evolutiva de organismos y organelas: una filogenía global basada en un núcleo estructural altamente conservado en ARN ribosomal pequeño subunidad". Nucleic Acids Research. 12 (14): 5837 –5852. doi:10.1093/nar/12.14.5837. PMC 320035. PMID 6462918.
- ^ a b c d Yang B, Wang Y, Qian PY (marzo 2016). "La sensibilidad y correlación de regiones hipervariables en genes de RRNA 16S en análisis filogenético". BMC Bioinformática. 17 (1): 135. doi:10.1186/s12859-016-0992-y. PMC 4802574. PMID 27000765.
- ^ Bartram AK, Lynch MD, Stearns JC, Moreno-Hagelsieb G, Neufeld JD (junio de 2011). "Generación de bibliotecas de genes de 16S rRNA multimillonarias de comunidades microbianas complejas mediante la asimilación de iluminas de extremo pareado". Microbiología aplicada y ambiental. 77 (11): 3846 –3852. Bibcode:2011ApEnM..77.3846B. doi:10.1128/AEM.02772-10. PMC 3127616. PMID 21460107.
- ^ a b Burke CM, Darling AE (2016-09-20). "Un método de secuenciación de alta precisión de genes cerca de la longitud completa de 16S rRNA en un Illumina MiSeq". PeerJ. 4: e2492. doi:10.7717/peerj.2492. PMC 5036073. PMID 27688981.
- ^ Van de Peer Y, Chapelle S, De Wachter R (septiembre de 1996). "Un mapa cuantitativo de las tasas de sustitución de nucleótidos en ARN bacteriano". Nucleic Acids Research. 24 (17): 3381–3391. doi:10.1093/nar/24.17.3381. PMC 146102. PMID 8811093.
- ^ a b c Větrovský T, Baldrian P (2013-02-27). "La variabilidad del gen 16S rRNA en los genomas bacterianos y sus consecuencias para los análisis comunitarios bacterianos". PLOS ONE. 8 (2): e57923. Bibcode:2013PLoSO...857923V. doi:10.1371/journal.pone.0057923. PMC 3583900. PMID 23460914.
- ^ a b Chakravorty S, Helb D, Burday M, Connell N, Alland D (mayo de 2007). "Un análisis detallado de segmentos de genes RNA costosomal 16S para el diagnóstico de bacterias patógenas". Journal of Microbiological Métodos. 69 2): 330 –339. doi:10.1016/j.mimet.2007.02.005. PMC 2562909. PMID 17391789.
- ^ a b c Jovel J, Patterson J, Wang W, Hotte N, O'Keefe S, Mitchel T, et al. (2016-01-01). "Caracterización del microbioma Gut usando metagenomics 16S o Shotgun". Fronteras en Microbiología. 7: 459. doi:10.3389/fmicb.2016.00459. PMC 4837688. PMID 27148170.
- ^ Kitahara K, Yasutake Y, Miyazaki K (noviembre de 2012). "Fortaleza musical de ARN ribosomal 16S, demostrada por transferencia experimental de genes horizontales en Escherichia coli". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 109 (47): 19220 –19225. Bibcode:2012PNAS..10919220K. doi:10.1073/pnas.1213609109. PMC 3511107. PMID 23112186.
- ^ Tsukuda M, Kitahara K, Miyazaki K (agosto de 2017). "El análisis comparativo de la función del ARN revela una alta similitud funcional entre los 16 S rRNAs bacterianos distantes relacionados". Scientific Reports. 7 (1): 9993. Bibcode:2017NatSR...7.9993T doi:10.1038/s41598-017-10214-3. PMC 5577257. PMID 28855596.
- ^ Miyazaki K, Tomariguchi N (agosto 2019). "Occurrence of randomly recombined functional 16S rRNA genes in Thermus thermophilus suggests genetic interoperability and promiscuity of bacterial 16S rRNAs". Scientific Reports. 9 (1): 11233. Código:2019 NatSR...911233M. doi:10.1038/s41598-019-47807-z. PMC 6677816. PMID 31375780.
- ^ Miyazaki, Kentaro; Tomariguchi, Natsuki (2019-08-02). "Occurrence of randomly recombined functional 16S rRNA genes in Thermus thermophilus suggests genetic interoperability and promiscuity of bacterial 16S rRNAs". Scientific Reports. 9 (1): 11233. Código:2019 NatSR...911233M. doi:10.1038/s41598-019-47807-z. ISSN 2045-2322. 6677816. PMID 31375780.
- ^ Yarza P, Yilmaz P, Pruesse E, Glöckner FO, Ludwig W, Schleifer KH, et al. (septiembre de 2014). "Uniting the classification of cultured and uncultured bacterias and archaea using 16S rRNA gene sequences". Reseñas de la naturaleza. Microbiología. 12 (9): 635 –645. doi:10.1038/nrmicro3330. PMID 25118885. S2CID 21895693.
- ^ Elmar Pruesse, Christian Quast, Katrin Knittel, Bernhard M. Fuchs, Wolfgang Ludwig, Jörg Peplies, Frank Oliver Glöckner (2007) Nucleic Acids Res. SILVA: un recurso en línea integral para datos de secuencia de RNA ribosomal de calidad verificados y alineados compatibles con ARB. Diciembre; 35(21): 7188–7196.
- ^ DeSantis TZ, Hugenholtz P, Larsen N, Rojas M, Brodie EL, Keller K, et al. (Julio de 2006). "Greengenes, una base de datos gen de 16S rRNA revisada por la quimera y un banco de trabajo compatible con ARB". Microbiología aplicada y ambiental. 72 (7): 5069 –5072. Bibcode:2006ApEnM..72.5069D. doi:10.1128/aem.03006-05. PMC 1489311. PMID 16820507.
- ^ McDonald D, Price MN, Goodrich J, Nawrocki EP, DeSantis TZ, Probst A, et al. (Marzo 2012). "Una mejor taxonomía de Greengenes con rangos explícitos para análisis ecológicos y evolutivos de bacterias y arqueas". The ISME Journal. 6 3): 610 –618. Bibcode:2012ISMEJ...6..610M. doi:10.1038/ismej.2011.139. PMC 3280142. PMID 221346.
- ^ McDonald D, Jiang Y, Balaban M, Cantrell K, Zhu Q, Gonzalez A, et al. (Julio 2023). "Greengenes2 unifica los datos microbianos en un solo árbol de referencia". Nature Biotechnology. 42 5): 715–718. doi:10.1038/s41587-023-01845-1. PMC 10818020. PMID 37500913.
- ^ Yoon, S. H., Ha, S. M., Kwon, S., Lim, J., Kim, Y., Seo, H. and Chun, J. (2017). Introducción de EzBioCloud: Una base de datos taxonómicamente unida de 16S rRNA y conjuntos genomas enteros. Int J Syst Evol Microbiol. 67:1613-1617
- ^ "MIMt - (Identificación Mástica de pruebas de Metagenomics)". mimt.bu.biopolis.pt. Retrieved 11 de febrero 2024.
- ^ Larsen N, Olsen GJ, Maidak BL, McCaughey MJ, Overbeek R, Macke TJ, Marsh TL, Woese CR (Julio de 1993). "El proyecto de base de datos ribosomal". Resoluciones de ácidos nucleicos. 21 (13): 3021 –3. doi:10.1093/nar/21.13.3021. PMC 309730. PMID 8332524.
- ^ Allard G, Ryan FJ, Jeffery IB, Claesson MJ (octubre de 2015). "SPINGO: Un clasificador rápido de especies para secuencias microbianas de amplicon". BMC Bioinformática. 16 (1): 324. doi:10.1186/s12859-015-0747-1. PMC 4599320. PMID 26450747.
- ^ The RDP Classifier is available as a stand-alone tool at https://sourceforge.net/projects/rdp-classifier/. Está escrito en Java y así funcionará en cualquier ordenador que tenga instalado Java. Los RDPTools están disponibles en GitHub y como imagen Docker. See installation instructions at https://john-quensen.com/tutorials/tutorial-1/ and https://jfq3.gitbook.io/rdptools-docker/rdptools-docker/readme. En https://john-quensen.com/tutorials/seqmatch/ pueden consultarse instrucciones para descargar una base de datos SeqMatch y ejecutarla desde la línea de comandos.
Enlaces externos
- Medicina del Laboratorio de la Universidad de Washington: Diagnóstico molecular
- Base de datos MIMt 16S
- El proyecto de base de datos Ribosomal Archivado 2020-08-19 en la máquina Wayback
- Ribosomas y ARN Ribosomal: (rRNA)
- Base de datos SILVA rRNA
- Greengenes: Datos y herramientas del RDNA 16S
- EzBioCloud
Más resultados...