ARN de horquilla corta
Un ARN de horquilla corta o ARN de horquilla pequeña (shRNA/Vector de horquilla) es una molécula de ARN artificial con una curva de horquilla cerrada que se puede utilizar para silenciar la expresión de genes objetivo mediante interferencia de ARN (RNAi). La expresión de shRNA en células se logra típicamente mediante la administración de plásmidos o a través de vectores virales o bacterianos. El shRNA es un mediador ventajoso de RNAi porque tiene una tasa relativamente baja de degradación y recambio. Sin embargo, requiere el uso de un vector de expresión, que tiene el potencial de causar efectos secundarios en aplicaciones medicinales.
La elección del promotor es esencial para lograr una expresión robusta del shRNA. Al principio, se utilizaban promotores de la polimerasa III, como U6 y H1; sin embargo, estos promotores carecen de control espacial y temporal. Por ello, se ha producido un cambio hacia el uso de promotores de la polimerasa II, que son inducibles, para regular la expresión del shRNA.
Entrega
La expresión de shRNA en células puede obtenerse mediante la administración de plásmidos o a través de vectores virales o bacterianos.
La administración de plásmidos a las células mediante transfección para obtener la expresión de ARNsh se puede lograr utilizando reactivos disponibles comercialmente in vitro. Sin embargo, este método no es aplicable in vivo y, por lo tanto, tiene una utilidad limitada.
El uso de un vector bacteriano para obtener la expresión de ARNhc en células es un enfoque relativamente reciente. Se basa en investigaciones que muestran que la Escherichia coli recombinante, que contiene un plásmido con ARNhc, administrada a ratones puede inhibir la expresión de genes específicos en el epitelio intestinal. Este enfoque se utilizó en 2012 en ensayos clínicos para tratar de tratar a pacientes con poliposis adenomatosa familiar.
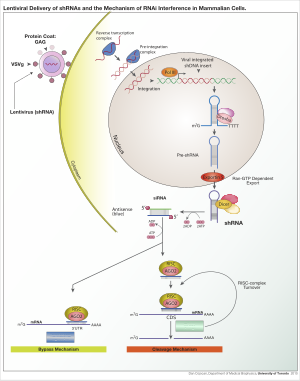
Se puede utilizar una variedad de vectores virales para obtener la expresión de shRNA en células, incluidos los virus adenoasociados (AAV), los adenovirus y los lentivirus. Con los virus adenoasociados y los adenovirus, los genomas permanecen episomales. Esto es ventajoso ya que se evita la mutagénesis insercional. Es desventajoso porque la progenie de la célula perderá el virus rápidamente a través de la división celular a menos que la célula se divida muy lentamente. Los AAV se diferencian de los adenovirus en que se han eliminado los genes virales y tienen una capacidad de empaquetamiento reducida. Los lentivirus se integran en secciones de cromatina transcripcionalmente activa y, por lo tanto, se transmiten a las células de la progenie. Con este enfoque, existe un mayor riesgo de mutagénesis insercional; sin embargo, el riesgo se puede reducir utilizando un lentivirus deficiente en integrasa.

Mecanismo de acción
Una vez que el vector se ha integrado en el genoma del huésped, el ARNsh se transcribe en el núcleo mediante la polimerasa II o la polimerasa III, según el promotor elegido. El producto imita al pri-microARN (pri-miARN) y es procesado por Drosha. El pre-ARNsh resultante es exportado desde el núcleo por Exportin 5. Este producto es procesado por Dicer y cargado en el complejo de silenciamiento inducido por ARN (RISC). La hebra con sentido (pasajera) se degrada. La hebra antisentido (guía) dirige al RISC hacia el ARNm que tiene una secuencia complementaria. En el caso de complementariedad perfecta, el RISC corta el ARNm. En el caso de complementariedad imperfecta, el RISC reprime la traducción del ARNm. En ambos casos, el ARNsh conduce al silenciamiento del gen diana.
Aplicaciones en terapia génica
Debido a la capacidad del ARNsh de proporcionar un silenciamiento genético específico y duradero, ha habido un gran interés en el uso del ARNsh para aplicaciones de terapia génica. A continuación se analizan tres ejemplos de terapias basadas en ARNsh.
Gradalis, Inc. desarrolló la vacuna FANG, que se utiliza en el tratamiento de cánceres avanzados. FANG se basa en un ARNhc bifuncional (bi-ARNhc) contra los factores de crecimiento transformantes (TGF) inmunosupresores β1 y β2. Se extrajeron células tumorales autólogas de los pacientes y se introdujo un plásmido que codifica el ARNhc bifuncional y el factor estimulante de colonias de granulocitos y macrófagos (GMCSF) ex vivo mediante electroporación. Estas células se irradiaron posteriormente y se inyectaron nuevamente en el paciente.
Marina Biotech desarrolló CEQ508, que se utiliza para tratar la poliposis adenomatosa familiar. CEQ508 utiliza un vector bacteriano para administrar ARNhc contra la β-catenina.
Gradalis, Inc. desarrolló el shRNA-STMN1 bifuncional (pbi-shRNA STMN1), que se utiliza para tratar cánceres avanzados y/o metastásicos. Este pbi-shRNA STMN1 actúa contra la estatmina 1 y se administra intratumoralmente a través de la tecnología de lipoplex (LP) de vesículas invaginadas bilaminares (BIV).
Las terapias basadas en shRNA suelen enfrentarse a varios desafíos. El más importante es la administración. El shRNA se administra normalmente mediante el uso de un vector y, aunque generalmente son eficientes, plantean importantes problemas de seguridad. En particular, los enfoques de terapia génica basados en virus han demostrado ser peligrosos en ensayos clínicos anteriores. En la primera generación de terapia génica retroviral, algunos pacientes tratados con vectores virales para el síndrome de Wiskott-Aldrich desarrollaron leucemia aguda de células T. Se determinó que esto se debía a la ubicación de inserción del vector viral. La posible sobresaturación de RISC también es un problema. Si el shRNA se expresa en niveles demasiado altos, la célula podría no ser capaz de procesar correctamente el ARN endógeno, lo que podría causar problemas importantes. Otro desafío es la posibilidad de que el paciente pueda generar una respuesta inmunitaria contra la terapia. Finalmente, puede haber efectos no deseados y el shRNA podría silenciar otros genes no deseados. Al desarrollar nuevas terapias basadas en shRNA exitosas, se deben tener en cuenta todos estos desafíos.
Véase también
- Pequeño ARN interferente
- VIRsiRNAdb
Referencias
- ^ Paddison PJ, Caudy AA, Bernstein E, Hannon GJ, Conklin DS (abril de 2002). "Los ARNs de horquilla corta (shRNAs) inducen el silenciamiento específico de secuencia en células mamíferas". Genes " Development. 16 8): 948–58. doi:10.1101/gad.981002. PMC 152352. PMID 11959843.
- ^ Brummelkamp TR, Bernards R, Agami R (abril de 2002). "Un sistema de expresión estable de ARNs interferentes cortos en células mamíferas". Ciencia. 296 (5567): 550-3. Bibcode:2002Sci...296..550B. doi:10.1126/science.1068999. Hdl:1874/15573. PMID 11910072.
- ^ a b Wang Z, Rao DD, Senzer N, Nemunaitis J (diciembre de 2011). "Intromisión de ARN y terapia de cáncer". Pharmaceutical Research. 28 (12): 2983–95. doi:10.1007/s11095-011-0604-5. PMID 22009588. S2CID 36738846.
- ^ Xiang S, Fruehauf J, Li CJ (junio de 2006). "La horca corta Las bacterias expresivas del ARN provocan interferencia del ARN en mamíferos". Nature Biotechnology. 24 (6): 697–702. doi:10.1038/nbt1211. PMID 16699500. S2CID 17700388.
- ^ Burnett JC, Rossi JJ, Tiemann K (septiembre de 2011). "Progreso actual de la terapéutica siRNA/shRNA en ensayos clínicos". Biotechnology Journal. 6 (9): 1130–46. doi:10.1002/biot.201100054. PMC 3388104. PMID 21744502.
- ^ Lombardo A, Genovese P, Beausejour CM, Colleoni S, Lee YL, Kim KA, Ando D, Urnov FD, Galli C, Gregory PD, Holmes MC, Naldini L (noviembre 2007). "Edición de genes en células madre humanas usando núcleos de dedos de zinc y entrega de vectores lentivirales defectuosas con la integración". Nature Biotechnology. 25 11): 1298–306. doi:10.1038/nbt1353. PMID 17965707. S2CID 16008349.
- ^ Macrae IJ, Zhou K, Li F, Repic A, Brooks AN, Cande WZ, Adams PD, Doudna JA (enero de 2006). "Structural basis for double-stranded RNA processing by Dicer". Ciencia. 311 (5758): 195–8. Código:2006...311..195M. doi:10.1126/ciencia.1121638. PMID 16410517. S2CID 23785494.
- ^ Senzer N, Barve M, Kuhn J, Melnyk A, Beitsch P, Lazar M, Lifshitz S, Magee M, Oh J, Mill SW, Bedell C, Higgs C, Kumar P, Yu Y, Norvell F, Phalon C, Taquet, Rao DD, Wang Z, Jay CM, Pappen BO, Wallraven G, Brunicardi FC, Shana "Phase I trial of "bi-shRNAi(furin)/GMCSF DNA/autologous tumor cell" Vacuna (FANG) en cáncer avanzado". Terapia molecular. 20 (3): 679–86. doi:10.1038/mt.2011.269. PMC 3293620. PMID 22186789.
- ^ Personas DA, Baum C (febrero de 2011). "Solving the problem of γ-retroviral vectors containing long terminal repeats". Terapia molecular. 19 (2): 229–31. doi:10.1038/mt.2010.305. PMC 3034864. PMID 21289636.
- ^ Whitehead KA, Dahlman JE, Langer RS, Anderson DG (2011). "Silencing or stimulation? siRNA delivery and themun system". Annual Review of Chemical and Biomolecular Engineering. 2: 77–96. doi:10.1146/annurev-chembioeng-061010-114133. PMID 22432611.