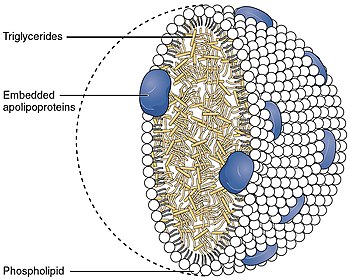
Apolipoproteína B
La Apolipoproteína B (ApoB) es una proteína que en los humanos está codificada por el gen APOB. Se utiliza comúnmente para detectar el riesgo de enfermedad cardiovascular aterosclerótica.
Función
La apolipoproteína B es la apolipoproteína principal de los quilomicrones, VLDL, Lp(a), IDL y partículas de LDL (LDL, comúnmente conocido como "colesterol malo" cuando se hace referencia tanto a enfermedades cardíacas como a enfermedades vasculares en general), que es responsable de transportar moléculas de grasa (lípidos), incluido el colesterol, por todo el cuerpo a todas las células dentro de todos los tejidos. Si bien todas las funciones funcionales de ApoB dentro de las partículas de LDL (y todas las partículas más grandes) siguen sin estar claras, es la proteína organizadora principal (de toda la capa compleja que encierra/transporta moléculas de grasa en su interior) componente de las partículas y es absolutamente necesaria para la formación. de estas partículas. Lo que también está claro es que la ApoB en la partícula de LDL actúa como ligando para los receptores de LDL en varias células del cuerpo (es decir, de manera menos formal, ApoB indica que las partículas que transportan grasa están listas para ingresar a cualquier célula con receptores ApoB y liberar las grasas transportadas). dentro de las células).
A través de mecanismos que sólo se comprenden parcialmente, los niveles altos de ApoB, especialmente asociados con las concentraciones más altas de partículas LDL, son el principal impulsor de las placas que causan enfermedades vasculares (aterosclerosis), y comúnmente se vuelven sintomáticas como enfermedades cardíacas, accidentes cerebrovasculares y muchas otras. complicaciones en todo el cuerpo después de décadas de progresión. Existe evidencia considerable de que las concentraciones de ApoB y especialmente el ensayo de RMN (específico para las concentraciones de partículas LDL) son indicadores superiores de la fisiología que impulsa las enfermedades vasculares/cardíacas que el colesterol total o el colesterol LDL (como lo promueven desde hace tiempo los NIH a partir de las primeras etapas de la vida). década de 1970). Sin embargo, principalmente por razones históricas de costo/complejidad, el colesterol y el colesterol LDL estimado mediante cálculo siguen siendo la prueba de lípidos más comúnmente promovida para el factor de riesgo de aterosclerosis. ApoB se mide de forma rutinaria mediante inmunoensayos como ELISA o nefelometría. Los métodos de RMN refinados y automatizados permiten hacer distinciones de medición entre las diferentes partículas de ApoB.
Trastornos genéticos
Los niveles altos de ApoB están relacionados con enfermedades cardíacas. La hipobetalipoproteinemia es un trastorno genético que puede ser causado por una mutación en el gen ApoB, APOB. La abetalipoproteinemia suele estar causada por una mutación en el gen MTP, MTP.
Las mutaciones en el gen APOB100 también pueden causar hipercolesterolemia familiar, una forma hereditaria (autosómica dominante) de hipercolesterolemia, un trastorno metabólico.
Estudios de ratón
Se han utilizado ratones como organismos modelo en el estudio de ApoB, ya que expresan una proteína equivalente conocida como ApoB de ratón (mApoB). Los ratones que sobreexpresan mApoB tienen niveles elevados de LDL y niveles reducidos de HDL. Los ratones que contienen sólo una copia funcional del gen mApoB muestran el efecto contrario, siendo resistentes a la hipercolesterolemia. Los ratones que no contienen copias funcionales del gen no son viables.
Biología molecular
La proteína se presenta en el plasma en dos isoformas principales, ApoB48 y ApoB100. El primero se sintetiza exclusivamente en el intestino delgado, el segundo en el hígado. ApoB-100 es la más grande del grupo de proteínas apoB y consta de 4563 aminoácidos. Ambas isoformas están codificadas por APOB y por una única transcripción de ARNm de más de 16 kb. ApoB48 se genera cuando se crea un codón de parada (UAA) en el residuo 2153 mediante edición de ARN. Parece haber un gen de empalme específico de tejido de acción trans que determina qué isoforma se produce finalmente. Alternativamente, existe alguna evidencia de que un elemento que actúa cis varios miles de pb aguas arriba determina qué isoforma se produce.
Como resultado de la edición del ARN, ApoB48 y ApoB100 comparten una secuencia N-terminal común, pero ApoB48 carece de la región de unión al receptor de LDL C-terminal de ApoB100. De hecho, ApoB48 se llama así porque constituye el 48% de la secuencia de ApoB100.
ApoB 48 es una proteína exclusiva de los quilomicrones del intestino delgado. Después de que la mayoría de los lípidos del quilomicrón se han absorbido, ApoB48 regresa al hígado como parte del remanente del quilomicrón, donde se endocitosa y se degrada.
Significado clínico
Beneficios
Papel en el sistema inmunitario innato
Las lipoproteínas de muy baja densidad y las lipoproteínas de baja densidad interfieren con el sistema de detección de quórum que regula positivamente los genes necesarios para la infección invasiva por Staphylococcus aureus. El mecanismo de antagonismo implica unir ApoB a un S. aureus feromona autoinductora, impidiendo la señalización a través de su receptor. Los ratones con deficiencia de ApoB son más susceptibles a la infección bacteriana invasiva.
Efectos adversos
Papel en la resistencia a la insulina
La sobreproducción de apolipoproteína B puede provocar estrés en el retículo endoplásmico inducido por lípidos y resistencia a la insulina en el hígado.
Papel en lipoproteínas y aterosclerosis
La ApoB100 se encuentra en las lipoproteínas originadas en el hígado (VLDL, IDL, LDL). Es importante destacar que hay una molécula de ApoB100 por cada lipoproteína de origen hepático. Por lo tanto, utilizando ese hecho, se puede cuantificar el número de partículas de lipoproteínas observando la concentración total de ApoB100 en la circulación. Dado que hay una y sólo una ApoB100 por partícula, el número de partículas se refleja en la concentración de ApoB100. La misma técnica se puede aplicar a clases individuales de lipoproteínas (por ejemplo, LDL) y, por lo tanto, permitir contarlas también.
Está bien establecido que los niveles de ApoB100 están asociados con la enfermedad coronaria; son un predictor mucho mejor de la misma que las concentraciones de LDL-C. Motivo: LDL-C no refleja las concentraciones y niveles reales de partículas. El colesterol no puede disolverse ni moverse (en agua) sin partículas que lo transporten. Una forma sencilla de entender esta observación es el hecho de que ApoB100, uno por partícula, refleja la concentración real de partículas de lipoproteínas (independientemente de su colesterol u otro contenido de lípidos). De esta manera, se puede entender que la cantidad de partículas de lipoproteína que contienen ApoB100 que pueden transportar lípidos a las paredes arteriales es un determinante clave, impulsor de la aterosclerosis y las enfermedades cardíacas.
Una forma de explicar lo anterior es considerar que una gran cantidad de partículas de lipoproteínas y, en particular, una gran cantidad de partículas de LDL, conducen a una competencia en el receptor ApoB100 (es decir, el receptor de LDL) de las células periféricas. Dado que dicha competencia prolongará el tiempo de residencia de las partículas de LDL en la circulación, puede generar mayores oportunidades para que sufran oxidación y/u otras modificaciones químicas. Tales modificaciones pueden disminuir la cantidad de partículas. capacidad de ser eliminado por el receptor de LDL clásico y/o aumentar su capacidad para interactuar con los llamados receptores "depuradores" receptores. El resultado neto es la desviación de las partículas de LDL hacia estos receptores eliminadores. Los receptores carroñeros se encuentran típicamente en los macrófagos, y los macrófagos cargados de colesterol son más conocidos como "células espumosas". Las células espumosas caracterizan las lesiones ateroscleróticas. Además de este posible mecanismo de generación de células espumosas, un aumento en los niveles de partículas de LDL químicamente modificadas también puede conducir a un aumento del daño endotelial. Esto ocurre como resultado del efecto tóxico del LDL modificado sobre el endotelio vascular, así como de su capacidad para reclutar células efectoras inmunes y promover la activación plaquetaria.
El estudio INTERHEART encontró que la relación ApoB100/ApoA1 es más efectiva para predecir el riesgo de ataque cardíaco, en pacientes que habían tenido un infarto agudo de miocardio, que la medida ApoB100 o ApoA1 sola. (La ApoA1 es la principal proteína HDL). En la población general esto aún no está claro, aunque en un estudio reciente la ApoB fue el marcador de riesgo más potente de eventos cardiovasculares.
Se recomienda una dieta mediterránea como medio para reducir la apolipoproteína B.
Interacciones
Se ha demostrado que la ApoB interactúa con la apo(a), PPIB, el receptor de calcitonina y HSP90B1. Se cree que la interacción de ApoB con proteoglicanos, colágeno y fibronectina causa aterosclerosis.
Mapa de la ruta interactiva
Haga clic en genes, proteínas y metabolitos a continuación para vincular a los artículos respectivos.
- ^ El mapa interactivo se puede editar en WikiPathways: "Statin_Pathway_WP430".
Reglamento
La expresión de APOB está regulada por elementos reguladores cis en APOB 5′ UTR y 3′ UTR.
Edición de ARN
El ARNm que codifica esta proteína está sujeto a la edición de ARN específica del sitio de citidina a uridina (C a U). ApoB100 y ApoB48 están codificados por el mismo gen; sin embargo, las diferencias en las proteínas traducidas no se deben a un empalme alternativo sino al evento de edición de ARN específico del tejido. La edición del ARNm de ApoB fue el primer ejemplo de edición observado en vertebrados. La edición del ARNm de ApoB ocurre en todos los mamíferos placentarios. La edición se produce postranscripcionalmente ya que los polinucleótidos nacientes no contienen nucleósidos editados.
Tipo
La edición de C a U del ARNm de ApoB requiere un complejo de edición u holoenzima (editosoma) que consiste en la enzima de edición de C a U, la enzima de edición de ARNm de apolipoproteína B, el polipéptido catalítico 1 (ApoBEC-1), así como otros factores auxiliares. ApoBEC-1 es una proteína que en humanos está codificada por el gen APOBEC1.[1]Es un miembro de la familia de las citidina desaminasas. ApoBEC-1 por sí solo no es suficiente para la edición del ARNm de ApoB y requiere al menos uno de estos factores auxiliares, el factor de complementación APOBEC1 (A1CF), para que se produzca la edición. A1CF contiene 3 repeticiones no idénticas. Actúa como subunidad de unión al ARN y dirige ApoBEC-1 al ARNm de ApoB aguas abajo de la citidina editada. Se sabe que otros factores auxiliares forman parte de la holoenzima. Algunas de estas proteínas han sido identificadas. estas son la proteína de unión a CUG 2 (CUGBP2), SYNCRIP (proteína de unión a ARN rica en glicina-arginina-tirosina, GRY-RBP), ribonucleoproteína nuclear heterogénea (hnRNP)-C1 (HNRNPC), proteína de unión a ApoBEC-1 ABBP1 ( HNRNPAB), ABBP2, proteína de unión reguladora de empalme tipo KH (KHSRP), atanogén 4 asociado a Bcl-2 (BAG4) y factor auxiliar (AUX )240. Todas estas proteínas se han identificado mediante ensayos de detección y se ha demostrado que todas interactúan con el ARN ApoBEC-1, A1CF o ApoB. Se desconoce la función de estas proteínas auxiliares en el complejo de edición. Además de editar el ARNm de ApoB, el editsoma ApoBEC-1 también edita el ARNm de NF1. La edición de ARNm de ARNm de ApoB es el ejemplo mejor definido de este tipo de edición de ARN C a U en humanos.
Ubicación
A pesar de ser una transcripción de 14.000 residuos de longitud, el objetivo de edición es una sola citidina. Dentro del ARNm de ApoB se encuentra una secuencia formada por 26 nucleótidos necesarios para la edición. Esto se conoce como motivo de edición. Se determinó que estos nucleótidos (6662–6687) eran esenciales mediante experimentos de mutagénesis de sitio específico. Una porción de 11 nucleótidos de esta secuencia, de 4 a 5 nucleótidos aguas abajo del sitio de edición, es una región importante conocida como secuencia de amarre. Una región llamada elemento espaciador se encuentra entre 2 y 8 nucleótidos entre el nucleósido editado y esta secuencia de amarre. También hay una secuencia reguladora 3′ con respecto al sitio de edición. Se cree que el sitio activo de ApoBEC-1, el componente catalítico de la holoenzima de edición, se une a una región rica en AU de la secuencia de anclaje con la ayuda de ACF para unir el complejo al ARNm. El residuo de citidina editado se encuentra en el nucleótido 6666 ubicado en el exón 26 del gen. La edición en este sitio da como resultado un cambio de codón de un codón de glutamina (CAA) a un codón de parada en marco (UAA). El modelado por computadora ha detectado que se producirá la edición, la citidina editada se encuentra en un bucle. La selección de la citidina editada también depende en gran medida de esta estructura secundaria del ARN circundante. También hay algunos indicios de que esta región en bucle se forma entre la secuencia de anclaje y la región reguladora 3' del ARNm de ApoB. Se cree que la estructura secundaria prevista formada por el ARNm de ApoB permite el contacto entre el residuo que se va a editar y el sitio activo de APOBEC1, así como la unión de ACF y otros factores auxiliares asociados con el editosoma.
Reglamento
La edición del ARNm de ApoB en humanos está regulada por tejidos, siendo ApoB48 la principal proteína ApoB del intestino delgado en humanos. Ocurre en menores cantidades en el colon, el riñón y el estómago junto con la versión no editada. La edición también está regulada por el desarrollo: la versión no editada solo se traduce al principio del desarrollo, pero la forma editada aumenta durante el desarrollo en los tejidos donde puede ocurrir la edición. Se ha demostrado que los niveles de edición de ARNm de ApoB varían en respuesta a los cambios en la dieta. exposición a niveles de alcohol y hormonas.
Conservación
La edición del ARNm de ApoB también ocurre en ratones y ratas. A diferencia de lo que ocurre en humanos, la edición se produce en el hígado de ratones y ratas con una frecuencia del 65%. No se ha observado en aves ni en especies menores.
Consecuencias
Estructura
La edición da como resultado un cambio de codón que crea un codón de parada en marco que conduce a la traducción de una proteína truncada, ApoB48. Este codón de parada da como resultado la traducción de una proteína que carece del extremo carboxilo terminal que contiene el dominio de unión LDLR de la proteína. La proteína completa ApoB100, que tiene casi 4500 aminoácidos, está presente en VLDL y LDL. Dado que muchas partes de ApoB100 se encuentran en condición anfipática, la estructura de algunos de sus dominios depende de las condiciones lipídicas subyacentes. Sin embargo, se sabe que tiene el mismo plegamiento general en LDL que tiene cinco dominios principales. Recientemente se ha encontrado la primera estructura de LDL a la temperatura del cuerpo humano en condiciones naturales mediante microscopía crioelectrónica con una resolución de 16 Angstrom. Se ha confirmado el plegamiento general de ApoB-100 y se ha mapeado cierta heterogeneidad en la estructura local de sus dominios.
Función
La edición está restringida a aquellas transcripciones expresadas en el intestino delgado. Esta versión más corta de la proteína tiene una función específica del intestino delgado. La función principal de la ApoB100 expresada en hígado de longitud completa es como ligando para la activación del LDL-R. Sin embargo, la edición da como resultado una proteína que carece de esta región de unión a LDL-R de la proteína. Esto altera la función de la proteína y de la proteína más corta ApoB48 como funciones específicas en relación con el intestino delgado. ApoB48 es idéntico al 48% amino terminal de ApoB100. La función de esta isoforma es en la absorción de grasas del intestino delgado y participa en la síntesis, ensamblaje y secreción de quilomicrones. Estos quilomicrones transportan los lípidos de la dieta a los tejidos, mientras que los quilomicrones restantes, junto con los lípidos residuales asociados, son absorbidos por el hígado en 2 a 3 horas mediante la interacción de la apolipoproteína E (ApoE) con los receptores de lipoproteínas. Es la proteína ApoB dominante en el intestino delgado de la mayoría de los mamíferos. Es una proteína clave en la vía exógena del metabolismo de las lipoproteínas. Las proteínas intestinales que contienen ApoB48 se metabolizan en partículas remanentes de quilomicrones que son captadas por los receptores remanentes.
Véase también
- Apolipoproteína A1
- ACAT2
- Enfermedad cardiovascular
- Lipid metabolism
Referencias
- ^ a b c GRCh38: Ensembl release 89: ENSG00084674 – Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00020609 – Ensembl, May 2017
- ^ "Human PubMed Referencia:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Referencia:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Glavinovic T, Thanassoulis G, de Graaf J, Couture P, Hegele RA, Sniderman AD (octubre 2022). "Basaciones polisiológicas para la superioridad de la apolipoproteína B sobre el colesterol de la lipoproteína de baja densidad y el colesterol de la lipoproteína no alta como marcador del riesgo cardiovascular". Journal of the American Heart Association. 11 (20): e025858. doi:10.1161/JAHA.122.02585858. PMC 9673669. PMID 36216435.
- ^ Behbodikhah J, Ahmed S, Elyasi A, Kasselman LJ, De Leon J, Glass AD, Reiss AB (octubre 2021). "Apolipoproteína B y Enfermedad Cardiovascular: Meta Terapéutica Biomarcador y Potencial". Metabolitos. 11 (10): 690. doi:10.3390/metabo11100690. PMC 8540246. PMID 34677405.
- ^ Lim JS, Lee DH, Park JY, Jin SH, Jacobs DR (2011). "Reliability of low-density lipoprotein colesterol, non-high-density lipoprotein colesterol, and apolipoprotein B measurement". Journal of Clinical Lipidology. 5 (4): 264–272. doi:10.1016/j.jacl.2011.05.004. PMID 21784371.
- ^ Jacobson TA (2011). "Abrir un nuevo lípido "apo-thecary": incorporar apolipoproteínas como factores de riesgo potenciales y objetivos de tratamiento para reducir el riesgo cardiovascular". Procesos clínicos de Mayo. 86 (8): 762–780. doi:10.4065/mcp.2011.0128. PMC 3146376. PMID 21803958.
- ^ Carmena R, Duriez P, Fruchart JC (2004). "Ateroesclerosis: evolución de la biología vascular e implicaciones clínicas". Circulación. 109 (23): III–2. doi:10.1161/01.CIR.0000131511.50734.44. PMID 15198959.
- ^ Young, Stephen G.; Hubl, Susan T.; Chappell, David A.; Smith, Richard S.; Claiborne, Frederica; Snyder, Steven M.; Terdiman, Joseph F. (1989-06-15). "Hipobetalipoproteinemia familiar asociada a una especie mutante de apolipoproteína B (B-46)". New England Journal of Medicine. 320 (24): 1604-1610. doi:10.1056/NEJM198906153202407. ISSN 0028-4793. PMID 2725600.
- ^ "Proteína de transferencia de triglicéridos microsómicos MTTP [Homo sapiens (humano)] - Gene - NCBI". www.ncbi.nlm.nih.gov. Retrieved 2024-03-28.
- ^ Andersen, Lars H.; Miserez, André R.; Ahmad, Zahid; Andersen, Rolf L. (noviembre 2016). "Apolipoproteína defectuosa familiar B-100: Una revisión". Journal of Clinical Lipidology. 10 (6): 1297–1302. doi:10.1016/j.jacl.2016.09.009. PMID 27919345.
- ^
 McCormick SP, Ng JK, Véniant M, Borén J, Pierotti V, Flynn LM, et al. (mayo de 1996). "Los ratones transgénicos que sobreexpresan el ratón apolipoproteína B. Evidencia de que las secuencias de ADN que controlan la expresión intestinal del gen apolipoproteína B están distantes del gen estructural". El Diario de Química Biológica. 271 (20): 11963–11970. doi:10.1074/jbc.271.20.11963. PMID 8662599.
McCormick SP, Ng JK, Véniant M, Borén J, Pierotti V, Flynn LM, et al. (mayo de 1996). "Los ratones transgénicos que sobreexpresan el ratón apolipoproteína B. Evidencia de que las secuencias de ADN que controlan la expresión intestinal del gen apolipoproteína B están distantes del gen estructural". El Diario de Química Biológica. 271 (20): 11963–11970. doi:10.1074/jbc.271.20.11963. PMID 8662599. - ^
 Farese RV, Ruland SL, Flynn LM, Stokowski RP, Young SG (febrero de 1995). "Knockout of the mouse apolipoprotein B gene results in embrionic lethality in homozygotes and protection against diet-induced hypercholesterolemia in heterozygotes". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 92 (5): 1774-1778. Bibcode:1995PNAS...92.1774F. doi:10.1073/pnas.92.5.1774. PMC 42602. PMID 7878058.
Farese RV, Ruland SL, Flynn LM, Stokowski RP, Young SG (febrero de 1995). "Knockout of the mouse apolipoprotein B gene results in embrionic lethality in homozygotes and protection against diet-induced hypercholesterolemia in heterozygotes". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 92 (5): 1774-1778. Bibcode:1995PNAS...92.1774F. doi:10.1073/pnas.92.5.1774. PMC 42602. PMID 7878058. - ^ a b Chen SH, Yang CY, Chen PF, Setzer D, Tanimura M, Li WH, Gotto AM Jr, Chan L (1986). "La secuencia completa de cDNA y aminoácidos de la apolipoproteína humana B-100". Journal of Biological Chemistry. 261 (28): 12918–12921. doi:10.1016/S0021-9258(18)69248-8. PMID 3759943.
- ^ Peterson MM, Mack JL, Hall PR, Alsup AA, Alexander SM, Sully EK, Sawires YS, Cheung AL, Otto M, Gresham HD (2008). "La apolipoproteína B es una barrera innata contra la infección de Staphylococcus aureus invasiva". Cell Host & Microbe. 4 (6): 507–509. doi:10.1016/j.chom.2008.10.001. PMC 2639768. PMID 19064256.
- ^ Su Q, Tsai J, Xu E, Qiu W, Bereczki E, Santha M, Adeli K (2009). "La apolipoproteína B100 actúa como un vínculo molecular entre el estrés reticulum endoplasmático inducido por lípidos y la resistencia a la insulina hepática". Hepatología. 50 (1): 77–84. doi:10.1002/hep.22960PMID 19434737. S2CID 205869807.
- ^ MedlinePlus enciclopedia: Apolipoproteína B100
- ^ Cromwell WC, Otvos JD, Keyes MJ, Pencina MJ, Sullivan L, Vasan RS, Wilson PW, D'Agostino RB (diciembre de 2007). "Número de partículas y riesgo de futuras enfermedades cardiovasculares en el estudio Framingham Offspring - Implications for LDL Management". Journal of Clinical Lipidology. 1 (6): 583–592. doi:10.1016/j.jacl.2007.10.001. PMC 2720529. PMID 19657464.
- ^ Sniderman AD, Lamarche B, Contois JH, de Graaf J (diciembre de 2014). "Análisis de discordia y el nudo gordiano de LDL y colesterol no HDL contra apoB". Opinión actual en Lipidology. 25 (6): 461-467. doi:10.1097/MOL.0000000000127. PMID 25340478. S2CID 23464159.
- ^ Glavinovic T, Thanassoulis G, Sniderman AD (2022). "Basaciones polisiológicas para la superioridad de la apolipoproteína B sobre el colesterol de la lipoproteína de baja densidad y el colesterol de la lipoproteína no alta como marcador del riesgo cardiovascular". Journal of the American Heart Association. 11 (20): e025858. doi:10.1161/JAHA.122.02585858. PMC 9673669. PMID 36216435.
- ^ McQueen MJ, Hawken S, Wang X, Ounpuu S, Sniderman A, Probstfield J, Steyn K, Sanderson JE, Hasani M, Volkova E, Kazmi K, Yusuf S (Julio de 2008). "Lipids, lipoproteínas y apolipoproteínas como marcadores de riesgo de infarto miocárdico en 52 países (el estudio INTERHEART): un estudio de control de casos". Lancet. 372 (9634): 224–233. doi:10.1016/S0140-6736(08)61076-4. PMID 18640459. S2CID 26567691.
- ^ van der Vorst EP (2020). "Lipoproteínas de alta densidad y Apolipoproteína A1". Proteínas respiratorias, Lipoproteínas y otras proteínas del cuerpo. Bioquímica Subcelular. Vol. 94. pp. 399-420. doi:10.1007/978-3-030-41769-7_16. ISBN 978-3-030-41768-0. PMID 32189309. S2CID 213180689.
- ^ Benn M, Nordestgaard BG, Jensen GB, Tybjaerg-Hansen A (2007). "Mejor predicción de enfermedades cardiovasculares isquémicas en la población general usando la apolipoproteína B: el estudio del corazón de la ciudad de Copenhague". Arterioscler Thromb Vasc Biol. 27 (3): 661-670. doi:10.1161/01.ATV.0000255580.73689.8e. PMID 17170368.
- ^ Lamantia V, Sniderman A, Faraj M (2016). "Manejo nutrico de hiperapoB". Reseñas de investigación en materia de nutrición. 29 (2): 202–233. doi:10.1017/S0954422416000147. PMID 27821191.
- ^ Malaguarnera M, Vacante M, Russo C, Malaguarnera G, Antic T, Malaguarnera L, Bella R, Pennisi G, Galvano F, Frigiola A (2013). "Lipoproteína(a) en enfermedades cardiovasculares". BioMed Research International. 2013 1–9. doi:10.1155/2013/650989. PMC 3591100. PMID 23484137.
- ^ a b c Zhang J, Herscovitz H (febrero de 2003). "La lipidación naciente apolipoproteína B se transporta a los Golgi como intermediario incompletamente plegado como probeda por su asociación con red de chaperones moleculares endoplasmáticos reticulum, GRP94, ERp72, BiP, calreticulina y ciclofilina B". J. Biol. Chem. 278 (9): 7459–7468. doi:10.1074/jbc.M207976200. PMID 12397072.
- ^ a b Linnik KM, Herscovitz H (Ago 1998). "Los caperones moleculares múltiples interactúan con la apolipoproteína B durante su maduración. La red de chaperones reticularios endoplasmáticos (ERp72, GRP94, calreticulina y BiP) interactúa con apolipoproteína b independientemente de su estado de lipidación". J. Biol. Chem. 273 (33): 21368–21373. doi:10.1074/jbc.273.33.21368. PMID 9694898.
- ^ Khalil MF, Wagner WD, Goldberg IJ (2004). "Lipoproteína(a) en enfermedades cardiovasculares". Arteriosclerosis, trombosis y biología vascular. 24 (12): 2211–2218. doi:10.1161/01.ATV.0000147163.54024.70. PMID 15472124.
- ^ Tabas I, Williams KJ, Borén J (2007). "La retención de lipoproteína subendotelial como el proceso iniciado en la aterosclerosis: actualización e implicaciones terapéuticas". Circulación. 116 (16): 1832-1844. doi:10.1161/circulationaha.106.676890. PMID 17938300.
- ^ Pontrelli L, Sidiropoulos KG, Adeli K (2004). "Control traslacional de la apolipoproteína B mRNA: regulación a través de elementos cis en las regiones no traducidas de 5′ y 3′". Bioquímica. 43 (21): 6734-6744. doi:10.1021/bi049887s. PMID 15157107.
- ^ a b Powell LM, Wallis SC, Pease RJ, Edwards YH, Knott TJ, Scott J (septiembre de 1987). "Una nueva forma de procesamiento de ARN específico para tejido produce apolipoproteína-B48 en intestino". Celular. 50 (6): 831–840. doi:10.1016/0092-8674(87)90510-1. PMID 3621347. S2CID 37938313.
- ^ Fujino T, Navaratnam N, Jarmuz A, von Haeseler A, Scott J (julio de 1999). "C→Edicion de apolipoproteína B mRNA en marsupiales: identificación y caracterización de APOBEC-1 del opossum americano Monodelphus domestica". Res. 27 13): 2662–2671. doi:10.1093/nar/27.13.2662. 148475. PMID 10373583.
- ^ Lau PP, Xiong WJ, Zhu HJ, Chen SH, Chan L (octubre de 1991). "La edición de Apolipoproteína B mRNA es un evento intranuclear que ocurre posttranscripciónmente coincidiendo con el aguijón y la poliadenylación". J. Biol. Chem. 266 (30): 20550–20554. doi:10.1016/S0021-9258(18)54960-7. PMID 1939106.
- ^ "APOBEC1 Gene - GeneCards TEN ABEC1 Protein TEN ABEC1 Antibody". Archivado desde el original el 2011-07-26. Retrieved 2011-02-24.
- ^ Navaratnam N, Fujino T, Bayliss J, Jarmuz A, How A, Richardson N, Somasekaram A, Bhattacharya S, Carter C, Scott J (enero de 1998). "Escherichia coli cytidine deaminase proporciona un modelo molecular para la edición del ARN ApoB y un mecanismo para el reconocimiento del sustrato del ARN". J. Mol. Biol. 275 (4): 695–714. doi:10.1006/jmbi.1997.1506. PMID 9466941.
- ^ "A1CF Gene - GeneCards ← A1CF Protein ← Anticuerpo A1CF". Archivado desde el original el 2011-07-26. Retrieved 2011-02-24.
- ^ Blanc V, Kennedy S, Davidson NO (octubre de 2003). "Una nueva señal de localización nuclear en el dominio auxiliar del factor de complementación apobec-1 regula la importación y obturación nucleocitoplasmática". J. Biol. Chem. 278 (42): 41198–41204. doi:10.1074/jbc.M302951200. PMID 12896982.
- ^ Anant S, Henderson JO, Mukhopadhyay D, Navaratnam N, Kennedy S, Min J, Davidson NO (diciembre de 2001). "Asunto importante para la proteína de unión del ARN CUGBP2 en la edición del ARN mamífero. CUGBP2 modula C a U edición de apolipoproteína B mRNA interactuando con apobec-1 y A1CF, el factor de complementación apobec-1". J. Biol. Chem. 276 (50): 47338–47351. doi:10.1074/jbc.M104911200. PMID 11577082.
- ^ Blanc V, Navaratnam N, Henderson JO, Anant S, Kennedy S, Jarmuz A, Scott J, Davidson NO (marzo 2001). "Identificación de GRY-RBP como una proteína de unión de RNA apolipoproteína B que interactúa con el factor de complementación apobec-1 y apobec-1 para modular C a la edición U". J. Biol. Chem. 276 (13): 10272–10283. doi:10.1074/jbc.M006435200. PMID 11134005.
- ^ Greeve J, Lellek H, Rautenberg P, Greten H (1998). "Inhibición de la apolipoproteína B mRNA editando enzima-complejo por la proteína hnRNP C1 y complejos 40S hnRNP". Biol. Chem. 379 (8–9): 1063–1073. doi:10.1515/bchm.1998.379.8-9.1063. PMID 9792439. S2CID 25911416.
- ^ Lau PP, Villanueva H, Kobayashi K, Nakamuta M, Chang BH, Chan L (diciembre de 2001). "Una proteína DnaJ, apobec-1-binding protein-2, modula la edición de apolipoproteína B mRNA". J. Biol. Chem. 276 (49): 46445-46452. doi:10.1074/jbc.M109215200. PMID 11584023.
- ^ Lau PP, Chan L (diciembre de 2003). "Involvement of a chaperone regulator, Bcl2-asociated athanogene-4, in apolipoprotein B mRNA editing". J. Biol. Chem. 278 (52): 52988-52996. doi:10.1074/jbc.M310153200. PMID 14559896.
- ^ Schock D, Kuo SR, Steinburg MF, Bolognino M, Sparks JD, Sparks CE, Smith HC (febrero de 1996). "Un factor auxiliar que contiene un complejo de proteína 240 kDa está involucrado en la edición de ARN apolipoproteína B". Proc. Natl. Acad. Sci. 93 (3): 1097–1102. Código:1996PNAS...93.1097S. doi:10.1073/pnas.93.3.1097. PMC 40037. PMID 8577721.
- ^ Davies MS, Wallis SC, Driscoll DM, Wynne JK, Williams GW, Powell LM, Scott J (agosto de 1989). "Requisitos de secuencia para la edición de ARN apolipoproteína B en células hepatoma de rata transfectadas". J. Biol. Chem. 264 (23): 13395–13398. doi:10.1016/S0021-9258(18)80008-4. PMID 2760026.
- ^ a b Shah RR, Knott TJ, Legros JE, Navaratnam N, Greeve JC, Scott J (septiembre 1991). "Requisitos de secuencia para la edición de apolipoproteína B mRNA". J. Biol. Chem. 266 (25): 16301–16304. doi:10.1016/S0021-9258(18)55296-0. PMID 1885564.
- ^ Driscoll DM, Lakhe-Reddy S, Oleksa LM, Martinez D (diciembre de 1993). "Inducción de la edición de ARN en sitios heterologosos por secuencias en apolipoproteína B mRNA". Mol. Celda. 13 (12): 7288–7294. doi:10.1128/MCB.13.12.7288. PMC 364799. PMID 8246950.
- ^ Greeve J, Navaratnam N, Scott J (julio de 1991). "Caracterización de la enzima de edición de apolipoproteína B mRNA: ninguna similitud con el mecanismo propuesto de edición de ARN en protozoa kinetoplastida". Res. 19 (13): 3569–3576. doi:10.1093/nar/19.13.3569. PMC 328381. PMID 1649450.
- ^ Richardson N, Navaratnam N, Scott J (noviembre de 1998). "Segundary structure for the apolipoprotein B mRNA editing site. Las proteínas autóctonas interactúan con un tallo". J. Biol. Chem. 273 (48): 31707-31717. doi:10.1074/jbc.273.48.31707. PMID 9822632.
- ^ Teng B, Verp M, Salomon J, Davidson NO (noviembre de 1990). "La edición de ARN mensajero Apolipoproteína B está regulada por el desarrollo y ampliamente expresada en los tejidos humanos". J. Biol. Chem. 265 (33): 20616–20620. doi:10.1016/S0021-9258(17)30547-1. PMID 2243107.
- ^ Wu JH, Semenkovich CF, Chen SH, Li WH, Chan L (julio de 1990). "Apolipoproteína B mRNA editando. Validación de un ensayo sensible y biología de desarrollo de la edición del ARN en la rata". J. Biol. Chem. 265 (21): 12312–12316. doi:10.1016/S0021-9258(19)38347-4. PMID 2373694.
- ^ Glickman RM, Rogers M, Glickman JN (julio de 1986). "Apolipoproteína B síntesis por hígado humano e intestina in vitro". Proc. Natl. Acad. Sci. 83 (14): 5296-5300. Bibcode:1986PNAS...83.5296G. doi:10.1073/pnas.83.14.5296. PMC 323938. PMID 3460091.
- ^ Baum CL, Teng BB, Davidson NO (noviembre de 1990). "Apolipoproteína B mensajero RNA edición en el hígado de rata. Modulación por ayuno y resentimiento de una dieta alta de carbohidratos". J. Biol. Chem. 265 (31): 19263–19270. doi:10.1016/S0021-9258(17)30653-1. PMID 2229075.
- ^ Lau PP, Cahill DJ, Zhu HJ, Chan L (octubre de 1995). "Ethanol modulates apolipoprotein B mRNA editing in the rat". J. Lipid Res. 36 (10): 2069–2078. doi:10.1016/S0022-2275(20)39192-6. PMID 8576634.
- ^ Chan L, Chang BH, Nakamuta M, Li WH, Smith LC (marzo de 1997). "Apobec-1 y apolipoproteína B mRNA editando". Biochim. Biofias. Acta. 1345 (1): 11–26. doi:10.1016/S0005-2760(96)00156-7. PMID 9084497.
- ^ Chan L (enero de 1993). "RNA editando: explorando un modo con apolipoproteína B mRNA". BioEnsayos. 15 (1): 33–41. doi:10.1002/bies.950150106. PMID 8466474. S2CID 314984.
- ^ Tarugi P, Albertazzi L, Nicolini S, Calandra S (marzo de 1990). "Absence of apolipoprotein B-48 in the poll, Gallus domesticus". J. Lipid Res. 31 (3): 417-427. doi:10.1016/S0022-2275(20)43164-5. hdl:11380/742118. PMID 2341807.
- ^ Kumar V, Butcher SJ, Öörni K, Engelhardt P, Heikkonen J, Kaski K, Ala-Korpela M, Kovanen PT (mayo de 2011). "Three-Dimensional cryoEM Reconstrucción de partículas nativas de LDL a 16Å Resolución de Temperatura corporal fisiológica". PLOS ONE. 6 (5): e18841. Bibcode:2011PLoSO...618841K. doi:10.1371/journal.pone.0018841. PMC 3090388. PMID 21573056.
- ^ Knott TJ, Pease RJ, Powell LM, Wallis SC, Rall SC, Innerarity TL, Blackhart B, Taylor WH, Marcel Y, Milne R (1986). "Secuencia completa de proteínas e identificación de dominios estructurales de la apolipoproteína humana B". Naturaleza. 323 (6090): 734-738. Bibcode:1986Natur.323..734K doi:10.1038/323734a0. PMID 3773997. S2CID 536926.
Más lectura
- Mahley RW, Innerarity TL, Rall SC, Weisgraber KH (1985). "Plasma lipoproteínas: estructura y función apolipoproteína". J. Lipid Res. 25 (12): 1277–1294. doi:10.1016/S0022-2275(20)34443-6. PMID 6099394.
- Itakura H, Matsumoto A (1995). "[Apolipoproteína B]". Nippon Rinsho. 52 (12): 3113–3118. PMID 7853698.
- Chumakova OS, Zatevisiónshchikov DA, Sidorenko BA (2006). "[Apolipoproteína B: estructura, función, polimorfismo genético y relación con la aterosclerosis]". Kardiologiia. 45 (6): 43 a 55. PMID 16007035.
- Ye J (2007). "Reliance of host colesterol metabolic pathways for the life cycle of hepatitis C virus". PLOS Pathog. 3 (8): e108. doi:10.1371/journal.ppat.0030108. PMC 1959368. PMID 17784784.
Enlaces externos
- Base de datos de edición de ARN (DARNED).
- Investigación aplicada sobre la Apolipoproteína-B
- Localización del genoma APOB humano y página de detalles del gen APOB en el navegador del genoma UCSC.