Antioxidante
Los antioxidantes son compuestos que inhiben la oxidación, una reacción química que puede producir radicales libres. Esto puede conducir a la polimerización y otras reacciones en cadena. Se añaden con frecuencia a productos industriales, como combustibles y lubricantes, para evitar la oxidación, ya los alimentos para evitar su deterioro, en particular el enranciamiento de aceites y grasas. En las células, los antioxidantes como el glutatión, el micotiol o el bacilitiol y los sistemas enzimáticos como la superóxido dismutasa pueden prevenir el daño causado por el estrés oxidativo.
Los únicos antioxidantes dietéticos son las vitaminas A, C y E, pero el término antioxidante también se ha aplicado a muchos otros compuestos dietéticos que solo tienen propiedades antioxidantes in vitro, con poca evidencia de propiedades antioxidantes. en vivo. No se ha demostrado que los suplementos dietéticos comercializados como antioxidantes mantengan la salud o prevengan enfermedades en humanos.
Historia
Como parte de su adaptación de la vida marina, las plantas terrestres comenzaron a producir antioxidantes no marinos como el ácido ascórbico (vitamina C), polifenoles y tocoferoles. La evolución de las plantas de angiospermas hace entre 50 y 200 millones de años resultó en el desarrollo de muchos pigmentos antioxidantes, particularmente durante el período Jurásico, como defensas químicas contra las especies reactivas de oxígeno que son subproductos de la fotosíntesis. Originalmente, el término antioxidante se refería específicamente a una sustancia química que impedía el consumo de oxígeno. A finales del siglo XIX y principios del XX, un extenso estudio se concentró en el uso de antioxidantes en importantes procesos industriales, como la prevención de la corrosión de metales, la vulcanización del caucho y la polimerización de combustibles en el ensuciamiento de motores de combustión interna.
Las primeras investigaciones sobre el papel de los antioxidantes en biología se centraron en su uso para prevenir la oxidación de las grasas no saturadas, que es la causa de la rancidez. La actividad antioxidante podría medirse simplemente colocando la grasa en un recipiente cerrado con oxígeno y midiendo la tasa de consumo de oxígeno. Sin embargo, fue la identificación de las vitaminas C y E como antioxidantes lo que revolucionó el campo y llevó a la comprensión de la importancia de los antioxidantes en la bioquímica de los organismos vivos. Los posibles mecanismos de acción de los antioxidantes se exploraron por primera vez cuando se reconoció que una sustancia con actividad antioxidante es probable que se oxide fácilmente. La investigación sobre cómo la vitamina E previene el proceso de peroxidación lipídica condujo a la identificación de antioxidantes como agentes reductores que previenen las reacciones oxidativas, a menudo mediante la eliminación de especies reactivas de oxígeno antes de que puedan dañar las células.
Usos en tecnología
Conservadores de alimentos
Los antioxidantes se utilizan como aditivos alimentarios para ayudar a proteger contra el deterioro de los alimentos. La exposición al oxígeno y la luz solar son los dos factores principales en la oxidación de los alimentos, por lo que los alimentos se conservan manteniéndolos en la oscuridad y sellándolos en recipientes o incluso cubriéndolos con cera, como ocurre con los pepinos. Sin embargo, como el oxígeno también es importante para la respiración de las plantas, el almacenamiento de materiales vegetales en condiciones anaeróbicas produce sabores desagradables y colores desagradables. En consecuencia, los envases de frutas y verduras frescas contienen una atmósfera de oxígeno de ≈8 %. Los antioxidantes son una clase de conservantes especialmente importante ya que, a diferencia del deterioro por bacterias o hongos, las reacciones de oxidación todavía ocurren relativamente rápido en los alimentos congelados o refrigerados. Estos conservantes incluyen antioxidantes naturales como ácido ascórbico (AA, E300) y tocoferoles (E306), así como antioxidantes sintéticos como galato de propilo (PG, E310), butilhidroquinona terciaria (TBHQ), hidroxianisol butilado (BHA, E320) y butilhidroquinona hidroxitolueno (BHT, E321).
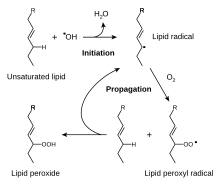
Las moléculas más comúnmente atacadas por la oxidación son las grasas insaturadas; la oxidación hace que se vuelvan rancios. Dado que los lípidos oxidados a menudo se decoloran y suelen tener sabores desagradables, como sabores metálicos o sulfurosos, es importante evitar la oxidación en alimentos ricos en grasas. Por lo tanto, estos alimentos rara vez se conservan mediante secado; en cambio, se conservan ahumados, salados o fermentados. Incluso los alimentos menos grasos, como las frutas, se rocían con antioxidantes sulfurosos antes del secado al aire. La oxidación a menudo es catalizada por metales, por lo que las grasas como la mantequilla nunca deben envolverse en papel de aluminio ni guardarse en recipientes de metal. Algunos alimentos grasos como el aceite de oliva están parcialmente protegidos de la oxidación por su contenido natural de antioxidantes, pero siguen siendo sensibles a la fotooxidación. Los estabilizadores antioxidantes también se agregan a los cosméticos a base de grasa, como el lápiz labial y los humectantes, para evitar la rancidez.
Usos industriales
Con frecuencia se agregan antioxidantes a los productos industriales. Un uso común es como estabilizadores en combustibles y lubricantes para evitar la oxidación, y en gasolinas para evitar la polimerización que conduce a la formación de residuos que ensucian el motor. En 2014, el mercado mundial de antioxidantes naturales y sintéticos fue de 2250 millones de USD con una previsión de crecimiento de 3250 millones de USD para 2020.
Los estabilizadores de polímeros antioxidantes se utilizan ampliamente para evitar la degradación de polímeros como cauchos, plásticos y adhesivos que provoca una pérdida de resistencia y flexibilidad en estos materiales. Los polímeros que contienen dobles enlaces en sus cadenas principales, como el caucho natural y el polibutadieno, son especialmente susceptibles a la oxidación y la ozonólisis. Pueden ser protegidos por antiozonantes. Los productos de polímeros sólidos comienzan a agrietarse en las superficies expuestas a medida que el material se degrada y las cadenas se rompen. El modo de agrietamiento varía entre el ataque de oxígeno y ozono, el primero provoca un "pavimento loco" efecto, mientras que el ataque del ozono produce grietas más profundas alineadas en ángulo recto con la tensión de tracción en el producto. La oxidación y la degradación UV también están frecuentemente vinculadas, principalmente porque la radiación UV crea radicales libres al romperse los enlaces. Luego, los radicales libres reaccionan con el oxígeno para producir radicales peroxi que causan aún más daño, a menudo en una reacción en cadena. Otros polímeros susceptibles a la oxidación incluyen polipropileno y polietileno. El primero es más sensible debido a la presencia de átomos de carbono secundarios presentes en cada unidad repetida. El ataque ocurre en este punto porque el radical libre formado es más estable que uno formado en un átomo de carbono primario. La oxidación del polietileno tiende a ocurrir en los eslabones débiles de la cadena, como los puntos de ramificación en el polietileno de baja densidad.
| Aditivo de combustible | Componentes | Aplicaciones |
|---|---|---|
| AO-22 | N'-di-2-butyl-1,4-phenylenediamine | Aceites de Turbina, aceites transformadores, fluidos hidráulicos, ceras y grasas |
| AO-24 | N'-di-2-butyl-1,4-phenylenediamine | Aceites de baja temperatura |
| AO-29 | 2,6-di-tert-butyl-4-methylphenol (BHT) | Aceites de Turbina, aceites transformadores, fluidos hidráulicos, ceras, grasas y gasolinas |
| AO-30 | 2,4-dimetil-6-tert-butilfenol | Combustibles de Jet y gasolinas, incluyendo gasolinas de aviación |
| AO-31 | 2,4-dimetil-6-tert-butilfenol | Combustibles de Jet y gasolinas, incluyendo gasolinas de aviación |
| AO-32 | 2,4-dimetil-6-tert-butylphenol y 2,6-di-tert-butyl-4-methylphenol | Combustibles de Jet y gasolinas, incluyendo gasolinas de aviación |
| AO-37 | 2,6-di-tert-butylphenol | combustibles Jet y gasolinas, ampliamente aprobados para combustibles de aviación |
Desafío oxidativo en biología
Una paradoja en el metabolismo es que, mientras que la gran mayoría de la vida compleja en la Tierra requiere oxígeno para su existencia, el oxígeno es un elemento altamente reactivo que daña a los organismos vivos al producir especies reactivas de oxígeno. En consecuencia, los organismos contienen una red compleja de metabolitos y enzimas antioxidantes que trabajan juntos para prevenir el daño oxidativo de componentes celulares como el ADN, las proteínas y los lípidos. En general, los sistemas antioxidantes evitan que se formen estas especies reactivas o las eliminan antes de que puedan dañar los componentes vitales de la célula. Sin embargo, las especies reactivas de oxígeno también tienen funciones celulares útiles, como la señalización redox. Por lo tanto, la función de los sistemas antioxidantes no es eliminar los oxidantes por completo, sino mantenerlos en un nivel óptimo.
Las especies reactivas de oxígeno producidas en las células incluyen peróxido de hidrógeno (H2O2), ácido hipocloroso (HClO) y radicales libres como el radical hidroxilo (· OH) y el anión superóxido (O2−). El radical hidroxilo es particularmente inestable y reaccionará rápidamente y de forma no específica con la mayoría de las moléculas biológicas. Esta especie se produce a partir de peróxido de hidrógeno en reacciones redox catalizadas por metales, como la reacción de Fenton. Estos oxidantes pueden dañar las células al iniciar reacciones químicas en cadena, como la peroxidación de lípidos, o al oxidar el ADN o las proteínas. El daño al ADN puede causar mutaciones y posiblemente cáncer, si los mecanismos de reparación del ADN no lo revierten, mientras que el daño a las proteínas provoca la inhibición de las enzimas, la desnaturalización y la degradación de las proteínas.
El uso de oxígeno como parte del proceso de generación de energía metabólica produce especies reactivas de oxígeno. En este proceso, el anión superóxido se produce como subproducto de varios pasos en la cadena de transporte de electrones. Particularmente importante es la reducción de la coenzima Q en el complejo III, ya que se forma un radical libre altamente reactivo como intermediario (Q·−). Este intermedio inestable puede provocar una 'fuga' de electrones, cuando los electrones saltan directamente al oxígeno y forman el anión superóxido, en lugar de moverse a través de la serie normal de reacciones bien controladas de la cadena de transporte de electrones. El peróxido también se produce a partir de la oxidación de flavoproteínas reducidas, como el complejo I. Sin embargo, aunque estas enzimas pueden producir oxidantes, no está clara la importancia relativa de la cadena de transferencia de electrones en otros procesos que generan peróxido. En plantas, algas y cianobacterias, también se producen especies reactivas de oxígeno durante la fotosíntesis, particularmente en condiciones de alta intensidad de luz. Este efecto se compensa en parte por la participación de los carotenoides en la fotoinhibición, y en las algas y cianobacterias, por la gran cantidad de yoduro y selenio, lo que implica que estos antioxidantes reaccionan con formas sobre-reducidas de los centros de reacción fotosintéticos para evitar la producción de especies reactivas de oxígeno..
Ejemplos de compuestos antioxidantes bioactivos
Los antioxidantes fisiológicos se clasifican en dos grandes divisiones, dependiendo de si son solubles en agua (hidrofílicos) o en lípidos (lipófilos). En general, los antioxidantes solubles en agua reaccionan con los oxidantes en el citosol celular y el plasma sanguíneo, mientras que los antioxidantes solubles en lípidos protegen las membranas celulares de la peroxidación lipídica. Estos compuestos pueden sintetizarse en el cuerpo u obtenerse de la dieta. Los diferentes antioxidantes están presentes en una amplia gama de concentraciones en los fluidos y tejidos corporales, algunos como el glutatión o la ubiquinona se encuentran principalmente dentro de las células, mientras que otros como el ácido úrico se distribuyen más sistémicamente (consulte la tabla a continuación). Algunos antioxidantes solo se encuentran en unos pocos organismos y pueden ser patógenos o factores de virulencia.
Las interacciones entre estos diferentes antioxidantes pueden ser sinérgicas e interdependientes. Por lo tanto, la acción de un antioxidante puede depender de la función adecuada de otros miembros del sistema antioxidante. La cantidad de protección proporcionada por cualquier antioxidante también dependerá de su concentración, su reactividad hacia las especies reactivas de oxígeno particulares que se están considerando y el estado de los antioxidantes con los que interactúa.
Algunos compuestos contribuyen a la defensa antioxidante al quelar los metales de transición y evitar que catalicen la producción de radicales libres en la célula. La capacidad de secuestrar hierro para proteínas de unión a hierro, como la transferrina y la ferritina, es una de esas funciones. El selenio y el zinc se conocen comúnmente como minerales antioxidantes, pero estos elementos químicos no tienen acción antioxidante por sí mismos, sino que son necesarios para la actividad de las enzimas antioxidantes, como la glutatión reductasa y la superóxido dismutasa. (Ver también selenio en biología y zinc en biología).
| Antioxidante | Solubility | Concentración en suero humanoμM) | Concentración en el tejido hepáticoμmol/kg) |
|---|---|---|---|
| Ácido ascórbico (vitamina C) | Agua | 50-60 | 260 (humanos) |
| Glutathione | Agua | 4 | 6.400 (humanos) |
| Ácido lipoico | Agua | 0.1 a 0.7 | 4-5 (rat) |
| Ácido úrico | Agua | 200 a 400 | 1.600 (humanos) |
| Carotenes | Lipid | β-caroteno: 0,5-1
retinol (vitamina A): 1–3 | 5 (carotenoides humanos y totales) |
| α-Tocopherol (vitamina E) | Lipid | 10 a 40 | 50 (humanos) |
| Ubiquinol (coenzyme Q) | Lipid | 5 | 200 (humanos) |
Ácido úrico
El ácido úrico es, con mucho, el antioxidante de mayor concentración en la sangre humana. El ácido úrico (AU) es una oxipurina antioxidante producida a partir de xantina por la enzima xantina oxidasa, y es un producto intermedio del metabolismo de las purinas. En casi todos los animales terrestres, la urato oxidasa cataliza aún más la oxidación del ácido úrico a alantoína, pero en los humanos y en la mayoría de los primates superiores, el gen de la urato oxidasa no es funcional, por lo que el AU no se descompone más. Las razones evolutivas de esta pérdida de conversión de urato en alantoína siguen siendo un tema de especulación activa. Los efectos antioxidantes del ácido úrico han llevado a los investigadores a sugerir que esta mutación era beneficiosa para los primeros primates y humanos. Los estudios de aclimatación a grandes altitudes respaldan la hipótesis de que el urato actúa como antioxidante al mitigar el estrés oxidativo causado por la hipoxia a grandes altitudes.
El ácido úrico tiene la concentración más alta de cualquier antioxidante en la sangre y proporciona más de la mitad de la capacidad antioxidante total del suero humano. Las actividades antioxidantes del ácido úrico también son complejas, ya que no reacciona con algunos oxidantes, como el superóxido, pero sí contra el peroxinitrito, los peróxidos y el ácido hipocloroso. Las preocupaciones sobre la contribución elevada de AU a la gota deben considerarse uno de los muchos factores de riesgo. Por sí mismo, el riesgo de gota relacionado con AU en niveles altos (415–530 μmol/L) es solo del 0,5 % por año con un aumento al 4,5 % por año en niveles de sobresaturación de AU (535+ μmol/L). Muchos de estos estudios antes mencionados determinaron las acciones antioxidantes del AU dentro de niveles fisiológicos normales, y algunos encontraron actividad antioxidante en niveles tan altos como 285 μmol/L.
Vitamina C
El ácido ascórbico o vitamina C es un catalizador de oxidación-reducción (redox) de monosacáridos que se encuentra tanto en animales como en plantas. Como una de las enzimas necesarias para producir ácido ascórbico se ha perdido por mutación durante la evolución de los primates, los humanos deben obtenerla de su dieta; por lo tanto, es una vitamina dietética. La mayoría de los otros animales pueden producir este compuesto en sus cuerpos y no lo requieren en sus dietas. El ácido ascórbico es necesario para la conversión del procolágeno en colágeno al oxidar los residuos de prolina en hidroxiprolina. En otras células, se mantiene en su forma reducida por reacción con el glutatión, que puede ser catalizado por la proteína disulfuro isomerasa y las glutaredoxinas. El ácido ascórbico es un catalizador redox que puede reducir y, por lo tanto, neutralizar las especies reactivas del oxígeno, como el peróxido de hidrógeno. Además de sus efectos antioxidantes directos, el ácido ascórbico también es un sustrato para la enzima redox ascorbato peroxidasa, una función que se utiliza en la resistencia al estrés en las plantas. El ácido ascórbico está presente en niveles elevados en todas las partes de las plantas y puede alcanzar concentraciones de 20 milimolares en los cloroplastos.
Glutatión
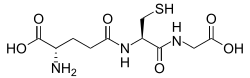
El glutatión es un péptido que contiene cisteína que se encuentra en la mayoría de las formas de vida aeróbica. No se requiere en la dieta y, en cambio, se sintetiza en las células a partir de sus aminoácidos constituyentes. El glutatión tiene propiedades antioxidantes ya que el grupo tiol en su fracción de cisteína es un agente reductor y puede oxidarse y reducirse de manera reversible. En las células, el glutatión se mantiene en forma reducida por la enzima glutatión reductasa y, a su vez, reduce otros metabolitos y sistemas enzimáticos, como el ascorbato en el ciclo glutatión-ascorbato, las glutatión peroxidasas y las glutaredoxinas, además de reaccionar directamente con los oxidantes. Debido a su alta concentración y su papel central en el mantenimiento del estado redox de la célula, el glutatión es uno de los antioxidantes celulares más importantes. En algunos organismos, el glutatión se reemplaza por otros tioles, como el micotiol en los actinomicetos, el bacilitiol en algunas bacterias grampositivas o la tripanotiona en los cinetoplástidos.
Vitamina E
La vitamina E es el nombre colectivo de un conjunto de ocho tocoferoles y tocotrienoles relacionados, que son vitaminas liposolubles con propiedades antioxidantes. De estos, el α-tocoferol ha sido el más estudiado, ya que tiene la biodisponibilidad más alta, y el cuerpo absorbe y metaboliza preferentemente esta forma.
Se ha afirmado que la forma de α-tocoferol es el antioxidante soluble en lípidos más importante y que protege las membranas de la oxidación al reaccionar con los radicales lipídicos producidos en la reacción en cadena de la peroxidación lipídica. Esto elimina los intermediarios de radicales libres y evita que continúe la reacción de propagación. Esta reacción produce radicales α-tocoferoxilo oxidados que se pueden reciclar de nuevo a la forma reducida activa mediante la reducción con otros antioxidantes, como el ascorbato, el retinol o el ubiquinol. Esto está en línea con los hallazgos que muestran que el α-tocoferol, pero no los antioxidantes solubles en agua, protege de manera eficiente a las células deficientes en glutatión peroxidasa 4 (GPX4) de la muerte celular. GPx4 es la única enzima conocida que reduce de manera eficiente los hidroperóxidos de lípidos dentro de las membranas biológicas.
Sin embargo, las funciones y la importancia de las diversas formas de vitamina E no están claras en la actualidad, e incluso se ha sugerido que la función más importante del α-tocoferol es como molécula señalizadora, y esta molécula no tiene una función significativa en la función antioxidante. metabolismo. Las funciones de las otras formas de vitamina E son aún menos conocidas, aunque el γ-tocoferol es un nucleófilo que puede reaccionar con mutágenos electrofílicos, y los tocotrienoles pueden ser importantes para proteger a las neuronas del daño.
Actividades pro-oxidantes
Los antioxidantes que son agentes reductores también pueden actuar como prooxidantes. Por ejemplo, la vitamina C tiene actividad antioxidante cuando reduce sustancias oxidantes como el peróxido de hidrógeno; sin embargo, también reducirá los iones metálicos que generan radicales libres a través de la reacción de Fenton.
- 2 Fe3+ + Ascorbate → 2 Fe2+ + Dehidroascorbate
- 2 Fe2+ + 2 H2O2 → 2 Fe3+ + 2 OH· + 2 OH−
La importancia relativa de las actividades antioxidantes y prooxidantes de los antioxidantes es un área de investigación actual, pero la vitamina C, que ejerce sus efectos como vitamina mediante la oxidación de polipéptidos, parece tener una acción principalmente antioxidante en el cuerpo humano.
Sistemas enzimáticos
Al igual que con los antioxidantes químicos, las células están protegidas contra el estrés oxidativo por una red de enzimas antioxidantes que interactúan. Aquí, el superóxido liberado por procesos como la fosforilación oxidativa se convierte primero en peróxido de hidrógeno y luego se reduce aún más para dar agua. Esta vía de desintoxicación es el resultado de múltiples enzimas, con superóxido dismutasas que catalizan el primer paso y luego catalasas y varias peroxidasas que eliminan el peróxido de hidrógeno. Al igual que con los metabolitos antioxidantes, las contribuciones de estas enzimas a las defensas antioxidantes pueden ser difíciles de separar unas de otras, pero la generación de ratones transgénicos que carecen de una sola enzima antioxidante puede ser informativa.
Superóxido dismutasa, catalasa y peroxirredoxinas
Las superóxido dismutasas (SOD) son una clase de enzimas estrechamente relacionadas que catalizan la descomposición del anión superóxido en oxígeno y peróxido de hidrógeno. Las enzimas SOD están presentes en casi todas las células aeróbicas y en los fluidos extracelulares. Las enzimas superóxido dismutasa contienen cofactores de iones metálicos que, dependiendo de la isoenzima, pueden ser cobre, zinc, manganeso o hierro. En humanos, la SOD de cobre/zinc está presente en el citosol, mientras que la SOD de manganeso está presente en la mitocondria. También existe una tercera forma de SOD en los fluidos extracelulares, que contiene cobre y zinc en sus sitios activos. La isoenzima mitocondrial parece ser la más importante biológicamente de estas tres, ya que los ratones que carecen de esta enzima mueren poco después del nacimiento. Por el contrario, los ratones que carecen de SOD de cobre/zinc (Sod1) son viables pero tienen numerosas patologías y una vida útil reducida (ver artículo sobre superóxido), mientras que los ratones sin SOD extracelular tienen defectos mínimos (sensibles a la hiperoxia). En las plantas, las isoenzimas SOD están presentes en el citosol y las mitocondrias, con una SOD de hierro que se encuentra en los cloroplastos y que está ausente en los vertebrados y las levaduras.
Las catalasas son enzimas que catalizan la conversión de peróxido de hidrógeno en agua y oxígeno, utilizando un cofactor de hierro o manganeso. Esta proteína se localiza en los peroxisomas en la mayoría de las células eucariotas. La catalasa es una enzima inusual ya que, aunque el peróxido de hidrógeno es su único sustrato, sigue un mecanismo de ping-pong. Aquí, su cofactor es oxidado por una molécula de peróxido de hidrógeno y luego regenerado transfiriendo el oxígeno unido a una segunda molécula de sustrato. A pesar de su aparente importancia en la eliminación del peróxido de hidrógeno, los humanos con deficiencia genética de catalasa — "acatalasemia" — o los ratones modificados genéticamente para que carezcan por completo de catalasa, experimentan pocos efectos nocivos.
Las peroxirredoxinas son peroxidasas que catalizan la reducción de peróxido de hidrógeno, hidroperóxidos orgánicos y peroxinitrito. Se dividen en tres clases: peroxirredoxinas de 2-cisteína típicas; peroxirredoxinas de 2-cisteína atípicas; y peroxirredoxinas de 1-cisteína. Estas enzimas comparten el mismo mecanismo catalítico básico, en el cual una cisteína redox activa (la cisteína peroxidatica) en el sitio activo es oxidada a un ácido sulfénico por el sustrato de peróxido. La oxidación excesiva de este residuo de cisteína en las peroxirredoxinas inactiva estas enzimas, pero esto puede revertirse mediante la acción de la sulfiredoxina. Las peroxirredoxinas parecen ser importantes en el metabolismo antioxidante, ya que los ratones que carecen de peroxirredoxina 1 o 2 tienen una esperanza de vida más corta y desarrollan anemia hemolítica, mientras que las plantas usan peroxirredoxinas para eliminar el peróxido de hidrógeno generado en los cloroplastos.
Sistemas de tiorredoxina y glutatión
El sistema de tiorredoxina contiene la proteína tiorredoxina de 12 kDa y su compañera, la tiorredoxina reductasa. Las proteínas relacionadas con la tiorredoxina están presentes en todos los organismos secuenciados. Las plantas, como Arabidopsis thaliana, tienen una diversidad de isoformas particularmente grande. El sitio activo de la tiorredoxina consta de dos cisteínas vecinas, como parte de un motivo CXXC altamente conservado, que puede alternar entre una forma activa de ditiol (reducida) y una forma oxidada de disulfuro. En su estado activo, la tiorredoxina actúa como un agente reductor eficaz, eliminando especies reactivas de oxígeno y manteniendo otras proteínas en su estado reducido. Después de ser oxidada, la tiorredoxina activa es regenerada por la acción de la tiorredoxina reductasa, utilizando NADPH como donante de electrones.
El sistema del glutatión incluye glutatión, glutatión reductasa, glutatión peroxidasas y glutatión S-transferasas. Este sistema se encuentra en animales, plantas y microorganismos. La glutatión peroxidasa es una enzima que contiene cuatro cofactores de selenio que cataliza la descomposición del peróxido de hidrógeno y los hidroperóxidos orgánicos. Hay al menos cuatro isoenzimas de glutatión peroxidasa diferentes en animales. La glutatión peroxidasa 1 es la más abundante y es un eliminador muy eficaz de peróxido de hidrógeno, mientras que la glutatión peroxidasa 4 es más activa con los hidroperóxidos lipídicos. Sorprendentemente, la glutatión peroxidasa 1 es prescindible, ya que los ratones que carecen de esta enzima tienen una esperanza de vida normal, pero son hipersensibles al estrés oxidativo inducido. Además, las glutatión S-transferasas muestran una alta actividad con los peróxidos de lípidos. Estas enzimas se encuentran en niveles particularmente altos en el hígado y también sirven en el metabolismo de desintoxicación.
Investigación en salud
Relación con la dieta
Las vitaminas antioxidantes A, C y E de la dieta son esenciales y se requieren en cantidades diarias específicas para prevenir enfermedades. Los polifenoles, que tienen propiedades antioxidantes in vitro debido a sus grupos hidroxi libres, se metabolizan ampliamente por la catecol-O-metiltransferasa que metila los grupos hidroxilo libres y, por lo tanto, evita que actúen como antioxidantes in vivo.
Interacciones
Los productos farmacéuticos comunes (y los suplementos) con propiedades antioxidantes pueden interferir con la eficacia de ciertos medicamentos contra el cáncer y la radioterapia.
Efectos adversos
Los ácidos reductores relativamente fuertes pueden tener efectos antinutrientes al unirse a los minerales de la dieta, como el hierro y el zinc, en el tracto gastrointestinal y evitar que se absorban. Algunos ejemplos son el ácido oxálico, los taninos y el ácido fítico, que son ricos en dietas basadas en plantas. Las deficiencias de calcio y hierro no son infrecuentes en las dietas de los países en desarrollo, donde se come menos carne y hay un alto consumo de ácido fítico de frijoles y pan integral sin levadura. Sin embargo, la germinación, el remojo o la fermentación microbiana son estrategias domésticas que reducen el contenido de fitato y polifenoles del cereal sin refinar. Se han informado aumentos en la absorción de Fe, Zn y Ca en adultos alimentados con cereales desfitinizados en comparación con cereales que contienen su fitato nativo.
| Alimentos | Reducir el ácido presente |
|---|---|
| Cacao frijol y chocolate, espinacas, nabos y rhubarb | Ácido oxálico |
| Granos enteros, maíz, legumbres | Ácido fético |
| Té, frijoles, col | Taninos |
Las altas dosis de algunos antioxidantes pueden tener efectos nocivos a largo plazo. El estudio Beta-Carotene and Retinol Efficacy Trial (CARET) de pacientes con cáncer de pulmón encontró que los fumadores que recibieron suplementos que contenían betacaroteno y vitamina A tenían mayores tasas de cáncer de pulmón. Estudios posteriores confirmaron estos efectos adversos. Estos efectos nocivos también pueden verse en los no fumadores, ya que un metanálisis que incluyó datos de aproximadamente 230 000 pacientes mostró que la suplementación con β-caroteno, vitamina A o vitamina E se asocia con una mayor mortalidad, pero no observó un efecto significativo de la vitamina C. No se observó ningún riesgo para la salud cuando se examinaron juntos todos los estudios controlados aleatorios, pero se detectó un aumento en la mortalidad cuando solo se examinaron por separado los ensayos de alta calidad y bajo riesgo de sesgo. Debido a que la mayoría de estos ensayos de bajo sesgo trataron con personas de edad avanzada o con enfermedades, es posible que estos resultados no se apliquen a la población general. Este metanálisis fue posteriormente repetido y ampliado por los mismos autores, confirmando los resultados anteriores. Estas dos publicaciones son consistentes con algunos metanálisis previos que también sugirieron que la suplementación con vitamina E aumentó la mortalidad y que los suplementos antioxidantes aumentaron el riesgo de cáncer de colon. El betacaroteno también puede aumentar el cáncer de pulmón. En general, la gran cantidad de ensayos clínicos realizados con suplementos antioxidantes sugiere que estos productos no tienen ningún efecto sobre la salud o que causan un pequeño aumento en la mortalidad en personas mayores o poblaciones vulnerables.
Niveles en alimentos
Las vitaminas antioxidantes se encuentran en verduras, frutas, huevos, legumbres y frutos secos. Las vitaminas A, C y E pueden destruirse con el almacenamiento a largo plazo o la cocción prolongada. Los efectos de la cocción y el procesamiento de alimentos son complejos, ya que estos procesos también pueden aumentar la biodisponibilidad de los antioxidantes, como algunos carotenoides en las verduras. Los alimentos procesados contienen menos vitaminas antioxidantes que los alimentos frescos y crudos, ya que la preparación expone los alimentos al calor y al oxígeno.
| Vitaminas antioxidantes | Alimentos que contienen altos niveles de vitaminas antioxidantes |
|---|---|
| Vitamina C (ácido ascórbico) | Frutas y verduras frescas o congeladas |
| Vitamina E (tocoferoles, tocotrienoles) | Aceites vegetales, nueces y semillas |
| Carotenoides (carotenos como provitamina A) | Frutas, verduras y huevos |
Otros antioxidantes no se obtienen de la dieta, sino que se producen en el cuerpo. Por ejemplo, el ubiquinol (coenzima Q) se absorbe poco en el intestino y se produce a través de la vía del mevalonato. Otro ejemplo es el glutatión, que está hecho de aminoácidos. Como cualquier glutatión en el intestino se descompone en cisteína libre, glicina y ácido glutámico antes de ser absorbido, incluso una gran ingesta oral tiene poco efecto sobre la concentración de glutatión en el cuerpo. Aunque grandes cantidades de aminoácidos que contienen azufre, como la acetilcisteína, pueden aumentar el glutatión, no existe evidencia de que comer altos niveles de estos precursores de glutatión sea beneficioso para los adultos sanos.
Medición e invalidación de ORAC
La medición del contenido de polifenoles y carotenoides en los alimentos no es un proceso sencillo, ya que los antioxidantes colectivamente son un grupo diverso de compuestos con diferentes reactividades a varias especies reactivas de oxígeno. En los análisis de ciencia de los alimentos in vitro, la capacidad de absorción de radicales de oxígeno (ORAC) fue una vez un estándar de la industria para estimar la fuerza antioxidante de los alimentos integrales, jugos y aditivos alimentarios, principalmente a partir de la presencia de polifenoles. Las mediciones y calificaciones anteriores del Departamento de Agricultura de los Estados Unidos se retiraron en 2012 como biológicamente irrelevantes para la salud humana, en referencia a la ausencia de evidencia fisiológica de que los polifenoles tengan propiedades antioxidantes in vivo. En consecuencia, el método ORAC, derivado únicamente de experimentos in vitro, ya no se considera relevante para la dieta o la biología humana, a partir de 2010.
Las mediciones in vitro alternativas del contenido de antioxidantes en los alimentos, también basadas en la presencia de polifenoles, incluyen el reactivo de Folin-Ciocalteu y el ensayo de capacidad antioxidante equivalente de Trolox.