Antiaromaticidad
La antiaromaticidad es una característica de una molécula cíclica con un sistema de electrones π que tiene mayor energía debido a la presencia de 4n electrones deslocalizados (π o par solitario) en ella. A diferencia de los compuestos aromáticos, que siguen la regla de Hückel ([4 n +2] π electrones) y son muy estables, los compuestos antiaromáticos son muy inestables y muy reactivos. Para evitar la inestabilidad de la antiaromaticidad, las moléculas pueden cambiar de forma, volviéndose no planas y, por lo tanto, rompiendo algunas de las interacciones π. A diferencia de la corriente de anillo diamagnético presente en los compuestos aromáticos, los compuestos antiaromáticos tienen una corriente de anillo paramagnético, que se puede observar mediante espectroscopía de RMN.
Ejemplos de compuestos antiaromáticos son pentaleno (A), bifenileno (B), catión ciclopentadienilo (C). El ejemplo prototípico de antiaromaticidad, el ciclobutadieno, es objeto de debate, y algunos científicos argumentan que la antiaromaticidad no es un factor importante que contribuya a su desestabilización.
El ciclooctatetraeno es un ejemplo de una molécula que adopta una geometría no plana para evitar la desestabilización que resulta de la antiaromaticidad. Si fuera plano, tendría un solo sistema π de ocho electrones alrededor del anillo, pero en cambio adopta una forma similar a la de un bote con cuatro enlaces π individuales. Debido a que los compuestos antiaromáticos suelen tener una vida corta y es difícil trabajar con ellos experimentalmente, la energía de desestabilización antiaromática a menudo se modela mediante simulación en lugar de experimentación.
Definición
El término 'antiaromaticidad' fue propuesto por primera vez por Ronald Breslow en 1967 como "una situación en la que se desestabiliza una deslocalización cíclica de electrones". Los criterios de la IUPAC para la antiaromaticidad son los siguientes:
- La molécula debe ser cíclica.
- La molécula debe ser plana.
- La molécula debe tener un sistema de electrones π conjugado completo dentro del anillo.
- La molécula debe tener 4 n π-electrones donde n es cualquier número entero dentro del sistema π conjugado.
Esto difiere de la aromaticidad solo en el cuarto criterio: las moléculas aromáticas tienen 4 n +2 electrones π en el sistema π conjugado y, por lo tanto, siguen la regla de Hückel. Las moléculas no aromáticas son no cíclicas, no planas o no tienen un sistema π conjugado completo dentro del anillo.
| Aromático | Antiaromático | no aromático | |
|---|---|---|---|
| ¿Cíclico? | Sí | Sí | Reprobará al menos uno de estos |
| ¿Tiene un sistema completamente conjugado de orbitales p en el anillo de la molécula? | Sí | Sí | |
| plano? | Sí | Sí | |
| ¿Cuántos electrones π hay en el sistema conjugado? | 4n+2 (es decir, 2, 6, 10, …) | 4n (4, 8, 12, …) | N / A |
Tener un sistema de anillos planos es esencial para maximizar la superposición entre los orbitales p que forman el sistema π conjugado. Esto explica por qué ser una molécula plana y cíclica es una característica clave tanto de las moléculas aromáticas como de las antiaromáticas. Sin embargo, en realidad, es difícil determinar si una molécula está completamente conjugada o no simplemente mirando su estructura: a veces las moléculas pueden distorsionarse para aliviar la tensión y esta distorsión tiene el potencial de interrumpir la conjugación. Por lo tanto, se deben realizar esfuerzos adicionales para determinar si una determinada molécula es o no genuinamente antiaromática.
Un compuesto antiaromático puede demostrar su antiaromaticidad tanto cinética como termodinámicamente. Como se discutirá más adelante, los compuestos antiaromáticos experimentan una reactividad química excepcionalmente alta (ser altamente reactivo no es "indicativo" de un compuesto antiaromático, simplemente sugiere que el compuesto podría ser antiaromático). Un compuesto antiaromático también puede reconocerse termodinámicamente midiendo la energía del sistema de electrones π conjugado cíclico. En un compuesto antiaromático, la cantidad de energía de conjugación en la molécula será significativamente mayor que en un compuesto de referencia apropiado.
En realidad, se recomienda analizar exhaustivamente la estructura de un compuesto potencialmente antiaromático antes de declarar que sí es antiaromático. Si no existe una estructura determinada experimentalmente de la molécula en cuestión, se debe realizar un análisis computacional. La energía potencial de la molécula debe probarse para varias geometrías a fin de evaluar cualquier distorsión de una conformación plana simétrica. Se recomienda este procedimiento porque ha habido múltiples casos en el pasado en los que moléculas que parecen ser antiaromáticas en el papel resultan no serlo realmente. La más famosa (y muy debatida) de estas moléculas es el ciclobutadieno, como se analiza más adelante.
Ejemplos de compuestos antiaromáticos son pentaleno (A), bifenileno (B), catión ciclopentadienilo (C). El ejemplo prototípico de antiaromaticidad, el ciclobutadieno, es objeto de debate, y algunos científicos argumentan que la antiaromaticidad no es un factor importante que contribuya a su desestabilización. El ciclooctatetraeno parece a primera vista ser antiaromático, pero es un excelente ejemplo de una molécula que adopta una geometría no plana para evitar la desestabilización que resulta de la antiaromaticidad. Debido a que los compuestos antiaromáticos suelen tener una vida corta y es difícil trabajar con ellos experimentalmente, la energía de desestabilización antiaromática a menudo se modela mediante simulación en lugar de experimentación.
Espectroscopia de RMN
La corriente de anillo paramagnético resultante de la deslocalización de electrones en compuestos antiaromáticos puede observarse mediante RMN. Esta corriente de anillo conduce a una desprotección (cambio de campo hacia abajo) de los núcleos dentro del anillo y una protección (cambio de campo hacia arriba) de los núcleos fuera del anillo. [12] El anuleno es un hidrocarburo antiaromático lo suficientemente grande como para tener protones tanto dentro como fuera del anillo. El desplazamiento químico de los protones dentro de su anillo es de 5,91 ppm y el de los protones fuera del anillo es de 7,86 ppm, en comparación con el rango normal de 4,5-6,5 ppm para los alquenos no aromáticos. Este efecto es de menor magnitud que los cambios correspondientes en los compuestos aromáticos.
Muchos compuestos aromáticos y antiaromáticos (benceno y ciclobutadieno) son demasiado pequeños para tener protones dentro del anillo, donde los efectos de protección y desprotección pueden ser más útiles en el diagnóstico para determinar si un compuesto es aromático, antiaromático o no aromático. El análisis de desplazamiento químico independiente del núcleo (NICS) es un método para calcular el blindaje (o desprotección) del anillo en el centro de un sistema de anillos para predecir la aromaticidad o la antiaromaticidad. Un valor NICS negativo es indicativo de aromaticidad y un valor positivo es indicativo de antiaromaticidad.
Ejemplos
Si bien existen multitud de moléculas que parecen ser antiaromáticas en el papel, la cantidad de moléculas que son antiaromáticas en realidad es considerablemente menor. Esto se ve agravado por el hecho de que normalmente no se pueden hacer derivados de moléculas antiaromáticas añadiendo más anillos de hidrocarburos antiaromáticos, etc. porque la molécula normalmente pierde su naturaleza plana o su sistema conjugado de electrones π y se vuelve no aromática. En esta sección, solo se incluyen ejemplos de compuestos antiaromáticos que no son discutibles.
Pentalene es un compuesto antiaromático que ha sido bien estudiado tanto experimental como computacionalmente durante décadas. Es dicíclico, plano y tiene ocho electrones π, cumpliendo con la definición de antiaromaticidad de la IUPAC. Los estados dianiónico y dicatiónico de Pentalene son aromáticos, ya que siguen la regla de 4 n +2 π-electrones de Hückel.
Al igual que su pariente [12]anuleno, el hexadehidro-[12]anuleno también es antiaromático. Su estructura ha sido estudiada computacionalmente a través de cálculos ab initio y de la teoría funcional de la densidad y se confirma que es antiaromática.
Ciclobutadieno
El ciclobutadieno es un ejemplo clásico de libro de texto de un compuesto antiaromático. Se entiende convencionalmente que es plano, cíclico y tiene 4 electrones π (4 n para n = 1) en un sistema conjugado.
Sin embargo, durante mucho tiempo se ha cuestionado si el ciclobutadieno es genuinamente antiaromático y descubrimientos recientes han sugerido que podría no serlo. El ciclobutadieno está particularmente desestabilizado y esto se atribuyó originalmente a la antiaromaticidad. Sin embargo, el ciclobutadieno adopta más carácter de doble enlace en dos de sus enlaces paralelos que en otros y los electrones π no están deslocalizados entre los dos enlaces similares a doble enlace, lo que le da una forma rectangular en lugar de un cuadrado regular. Como tal, el ciclobutadieno se comporta como dos alquenos discretos unidos por dos enlaces simples y, por lo tanto, es no aromático en lugar de antiaromático.
A pesar de la falta de este efecto de desestabilización π-antiaromática, ninguno de sus parientes de 4 n π-electrones (ciclooctatetraeno, etc.) tuvo tanta desestabilización, lo que sugiere que había algo más en el caso del ciclobutadieno. Se encontró que una combinación de tensión angular, tensión torsional y repulsión de Pauli conduce a la desestabilización extrema experimentada en esta molécula.
Este descubrimiento es incómodo porque contradice las enseñanzas básicas de la antiaromaticidad. En este momento, se presume que el ciclobutadieno se seguirá utilizando para introducir el concepto de antiaromaticidad en los libros de texto por conveniencia, aunque clasificarlo como antiaromático técnicamente puede no ser exacto.
Catión ciclopentadienilo
El catión ciclopentadienilo es otro ejemplo de libro de texto de un compuesto antiaromático. Se entiende convencionalmente que es plano, cíclico y tiene 4 electrones π (4 n para n = 1) en un sistema conjugado.
Sin embargo, durante mucho tiempo se ha cuestionado si el catión ciclopentadienilo es genuinamente antiaromático y descubrimientos recientes han sugerido que puede no serlo. El estado singulete de energía más baja es antiaromático, pero el estado triplete de energía más baja es aromático debido a la regla de Baird, y la investigación en 2007 mostró que el estado triplete es el estado fundamental.
Ciclooctatetraeno
El ciclooctatetraeno es otro ejemplo de una molécula que no es antiaromática aunque inicialmente pueda parecerlo. El ciclooctatetraeno asume una conformación de tina (es decir, similar a un bote). Como no es plano, aunque tiene 4 n π-electrones, estos electrones no están deslocalizados ni conjugados. Por lo tanto, la molécula no es aromática.
Efectos sobre la reactividad
Los compuestos antiaromáticos, que a menudo son muy inestables, pueden ser muy reactivos para aliviar la desestabilización antiaromática. El ciclobutadieno, por ejemplo, se dimeriza rápidamente sin barrera de energía potencial a través de una reacción de cicloadición 2 + 2 para formar triciclooctadieno. Si bien el carácter antiaromático del ciclobutadieno es tema de debate, el alivio de la antiaromaticidad suele invocarse como la fuerza impulsora de esta reacción.

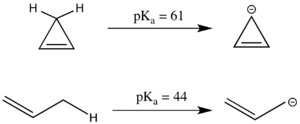
La antiaromaticidad también puede tener un efecto significativo sobre la pKa. El compuesto lineal propeno tiene un ap Ka de 44, que es relativamente ácido para un centro de carbono sp porque el anión alilo resultante puede estabilizarse por resonancia. El sistema cíclico análogo parece tener aún más resonancia estabilizada, ya que la carga negativa puede deslocalizarse entre tres carbonos en lugar de dos. Sin embargo, el anión ciclopropenilo tiene 4 electrones π en un sistema cíclico y, de hecho, tiene un p K a sustancialmente más alto que el 1-propeno porque es antiaromático y, por lo tanto, está desestabilizado.Debido a que los compuestos antiaromáticos suelen tener una vida corta y es difícil trabajar con ellos experimentalmente, la energía de desestabilización antiaromática a menudo se modela mediante simulación en lugar de experimentación.
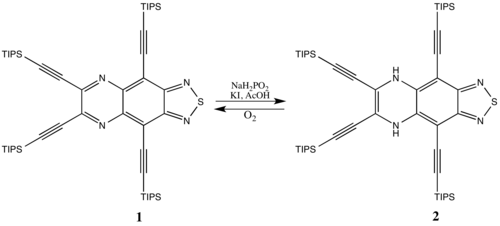
Algunos compuestos antiaromáticos son estables, especialmente los sistemas cíclicos más grandes (en los que la desestabilización antiaromática no es tan sustancial). Por ejemplo, la especie aromática 1 se puede reducir a 2 con una penalización relativamente pequeña por formar un sistema antiaromático. El antiaromático 2 vuelve a la especie aromática 1 con el tiempo al reaccionar con el oxígeno del aire porque se prefiere la aromaticidad.
La pérdida de antiaromaticidad a veces puede ser la fuerza motriz de una reacción. En la siguiente tautomerización de ceto-enol, el producto enol es más estable que la cetona original a pesar de que la cetona contiene un resto de benceno aromático (azul). Sin embargo, también hay un resto de lactona antiaromática (verde). El alivio de la desestabilización antiaromática proporciona una fuerza impulsora que compensa incluso la pérdida de un benceno aromático.

Contenido relacionado
Historia de la tabla periódica
Creosota
Galvanoplastia