Anfetamina
La anfetamina (contraída a partir de alfa-metilfenetilamina) es un potente estimulante del sistema nervioso central (SNC) que se utiliza en el tratamiento del trastorno por déficit de atención con hiperactividad (TDAH), la narcolepsia y la obesidad. También se usa comúnmente como una droga recreativa. La anfetamina se descubrió en 1887 y existe en dos enantiómeros: levoanfetamina y dextroanfetamina. Anfetamina se refiere correctamente a una sustancia química específica, la base libre racémica, que es partes iguales de los dos enantiómeros en sus formas de amina pura. El término se usa con frecuencia de manera informal para referirse a cualquier combinación de los enantiómeros, o a cualquiera de ellos solo. Históricamente, se ha utilizado para tratar la congestión nasal y la depresión. La anfetamina también se usa como potenciador del rendimiento atlético y potenciador cognitivo, y recreativamente como afrodisíaco y euforizante. Es un medicamento recetado en muchos países, y la posesión y distribución no autorizadas de anfetamina a menudo se controlan estrictamente debido a los importantes riesgos para la salud asociados con el uso recreativo.
La primera anfetamina farmacéutica fue Benzedrine, una marca que se usaba para tratar una variedad de condiciones. Actualmente, la anfetamina farmacéutica se prescribe como anfetamina racémica, Adderall, dextroanfetamina o el profármaco inactivo lisdexanfetamina. La anfetamina aumenta la monoamina y la neurotransmisión excitatoria en el cerebro, con sus efectos más pronunciados dirigidos a los sistemas de neurotransmisores de norepinefrina y dopamina.
En dosis terapéuticas, la anfetamina provoca efectos emocionales y cognitivos, como euforia, cambios en el deseo sexual, mayor vigilia y mejor control cognitivo. Induce efectos físicos tales como un mejor tiempo de reacción, resistencia a la fatiga y aumento de la fuerza muscular. Las dosis más altas de anfetamina pueden afectar la función cognitiva e inducir una degradación muscular rápida. La adicción es un riesgo grave con el uso recreativo intenso de anfetaminas, pero es poco probable que ocurra con el uso médico a largo plazo en dosis terapéuticas. Las dosis muy altas pueden provocar psicosis (p. ej., delirios y paranoia), lo que rara vez ocurre a dosis terapéuticas, incluso durante el uso a largo plazo. Las dosis recreativas son generalmente mucho mayores que las dosis terapéuticas prescritas y conllevan un riesgo mucho mayor de efectos secundarios graves.
La anfetamina pertenece a la clase de fenetilamina. También es el compuesto original de su propia clase estructural, las anfetaminas sustituidas, que incluye sustancias destacadas como el bupropión, la catinona, la MDMA y la metanfetamina. Como miembro de la clase de fenetilamina, la anfetamina también está químicamente relacionada con los neuromoduladores de aminas traza que se producen de forma natural, específicamente la fenetilamina y la N-metilfenetilamina, que se producen en el cuerpo humano. La fenetilamina es el compuesto original de la anfetamina, mientras que la N-metilfenetilamina es un isómero posicional de la anfetamina que difiere solo en la ubicación del grupo metilo.
Usos
Médica
(feminine)La anfetamina se usa para tratar el trastorno por déficit de atención con hiperactividad (TDAH), la narcolepsia (un trastorno del sueño) y la obesidad, y a veces se prescribe fuera de etiqueta por sus indicaciones médicas anteriores., particularmente para la depresión y el dolor crónico. Se sabe que la exposición prolongada a las anfetaminas en dosis suficientemente altas en algunas especies animales produce un desarrollo anormal del sistema de dopamina o daño nervioso, pero en humanos con TDAH, las anfetaminas farmacéuticas en dosis terapéuticas parecen mejorar el desarrollo cerebral y el crecimiento nervioso. Las revisiones de los estudios de imágenes por resonancia magnética (IRM) sugieren que el tratamiento a largo plazo con anfetamina disminuye las anomalías en la estructura y función del cerebro que se encuentran en sujetos con TDAH y mejora la función en varias partes del cerebro, como el núcleo caudado derecho de los ganglios basales..
Las revisiones de la investigación clínica sobre estimulantes han establecido la seguridad y la eficacia del uso continuo de anfetaminas a largo plazo para el tratamiento del TDAH. Los ensayos controlados aleatorios de la terapia estimulante continua para el tratamiento del TDAH que abarcan 2 años han demostrado la eficacia y la seguridad del tratamiento. Dos revisiones han indicado que la terapia estimulante continua a largo plazo para el TDAH es efectiva para reducir los síntomas centrales del TDAH (es decir, hiperactividad, falta de atención e impulsividad), mejorar la calidad de vida y el rendimiento académico, y producir mejoras en un gran número de aspectos funcionales. resultados en 9 categorías de resultados relacionados con aspectos académicos, comportamiento antisocial, conducción, uso de drogas no medicinales, obesidad, ocupación, autoestima, uso de servicios (es decir, servicios académicos, ocupacionales, de salud, financieros y legales) y función social. Una revisión destacó un ensayo controlado aleatorizado de nueve meses sobre el tratamiento con anfetaminas para el TDAH en niños que encontró un aumento promedio de 4,5 puntos de coeficiente intelectual, aumentos continuos en la atención y disminuciones continuas en conductas perturbadoras e hiperactividad. Otra revisión indicó que, según los estudios de seguimiento más prolongados realizados hasta la fecha, la terapia estimulante de por vida que comienza durante la niñez es continuamente efectiva para controlar los síntomas del TDAH y reduce el riesgo de desarrollar un trastorno por uso de sustancias en la edad adulta.
Los modelos actuales de TDAH sugieren que está asociado con deficiencias funcionales en algunos de los sistemas de neurotransmisores del cerebro; estas deficiencias funcionales implican una alteración de la neurotransmisión de dopamina en la proyección mesocorticolímbica y de la neurotransmisión de norepinefrina en las proyecciones noradrenérgicas desde el locus coeruleus hasta la corteza prefrontal. Los psicoestimulantes como el metilfenidato y la anfetamina son eficaces para tratar el TDAH porque aumentan la actividad de los neurotransmisores en estos sistemas. Aproximadamente el 80% de quienes usan estos estimulantes ven mejoras en los síntomas del TDAH. Los niños con TDAH que usan medicamentos estimulantes generalmente tienen mejores relaciones con sus compañeros y miembros de la familia, se desempeñan mejor en la escuela, se distraen menos y son menos impulsivos, y tienen períodos de atención más prolongados. Las revisiones Cochrane sobre el tratamiento del TDAH en niños, adolescentes y adultos con anfetaminas farmacéuticas señalaron que los estudios a corto plazo han demostrado que estos medicamentos disminuyen la gravedad de los síntomas, pero tienen tasas de interrupción más altas que los medicamentos no estimulantes debido a sus efectos adversos. efectos secundarios. Una revisión de Cochrane sobre el tratamiento del TDAH en niños con trastornos de tics como el síndrome de Tourette indicó que los estimulantes en general no empeoran los tics, pero las dosis altas de dextroanfetamina podrían exacerbar los tics en algunas personas.
Mejorar el rendimiento
Rendimiento cognitivo
En 2015, una revisión sistemática y un metanálisis de ensayos clínicos de alta calidad encontraron que, cuando se usa en dosis bajas (terapéuticas), la anfetamina produce mejoras modestas pero inequívocas en la cognición, incluida la memoria de trabajo, la memoria episódica a largo plazo, control inhibitorio, y algunos aspectos de la atención, en adultos sanos normales; Se sabe que estos efectos potenciadores de la cognición de la anfetamina están parcialmente mediados por la activación indirecta tanto del receptor de dopamina D1 como del adrenoceptor α2 en la corteza prefrontal. Una revisión sistemática de 2014 encontró que las dosis bajas de anfetamina también mejoran la consolidación de la memoria, lo que a su vez conduce a un mejor recuerdo de la información. Las dosis terapéuticas de anfetamina también mejoran la eficiencia de la red cortical, un efecto que media mejoras en la memoria de trabajo en todos los individuos. La anfetamina y otros estimulantes del TDAH también mejoran la prominencia de la tarea (motivación para realizar una tarea) y aumentan la excitación (vigilia), a su vez, promueven el comportamiento dirigido a objetivos. Los estimulantes como las anfetaminas pueden mejorar el rendimiento en tareas difíciles y aburridas y algunos estudiantes los utilizan como ayuda para estudiar y tomar exámenes. Según los estudios sobre el uso de estimulantes ilícitos autoinformados, 5–35 % de los estudiantes universitarios usan estimulantes para el TDAH desviados, que se usan principalmente para mejorar el rendimiento académico en lugar de como drogas recreativas. Sin embargo, las dosis altas de anfetamina que están por encima del rango terapéutico pueden interferir con la memoria de trabajo y otros aspectos del control cognitivo.
Rendimiento físico
Algunos atletas consumen anfetamina por sus efectos psicológicos y de mejora del rendimiento atlético, como una mayor resistencia y estado de alerta; sin embargo, el uso de anfetaminas con fines no médicos está prohibido en eventos deportivos regulados por agencias antidopaje colegiadas, nacionales e internacionales. En personas sanas en dosis terapéuticas orales, se ha demostrado que la anfetamina aumenta la fuerza muscular, la aceleración, el rendimiento atlético en condiciones anaeróbicas y la resistencia (es decir, retrasa la aparición de la fatiga), al tiempo que mejora el tiempo de reacción. La anfetamina mejora la resistencia y el tiempo de reacción principalmente a través de la inhibición de la recaptación y la liberación de dopamina en el sistema nervioso central. La anfetamina y otras drogas dopaminérgicas también aumentan la producción de energía a niveles fijos de esfuerzo percibido al anular un 'interruptor de seguridad', lo que permite que aumente el límite de temperatura central para acceder a una capacidad de reserva que normalmente está fuera de los límites. En dosis terapéuticas, los efectos adversos de la anfetamina no impiden el rendimiento deportivo; sin embargo, en dosis mucho más altas, la anfetamina puede inducir efectos que perjudican gravemente el rendimiento, como una degradación muscular rápida y una temperatura corporal elevada.
Contraindicaciones
Según el Programa Internacional sobre Seguridad Química (IPCS) y la Administración de Drogas y Alimentos de los Estados Unidos (USFDA), la anfetamina está contraindicada en personas con antecedentes de abuso de drogas, enfermedad cardiovascular, agitación intensa o ansiedad intensa. También está contraindicado en personas con arteriosclerosis avanzada (endurecimiento de las arterias), glaucoma (aumento de la presión ocular), hipertiroidismo (producción excesiva de hormona tiroidea) o hipertensión de moderada a grave. Estas agencias indican que las personas que han experimentado reacciones alérgicas a otros estimulantes o que están tomando inhibidores de la monoaminooxidasa (IMAO) no deben tomar anfetamina, aunque se ha documentado el uso simultáneo seguro de anfetamina e inhibidores de la monoaminooxidasa. Estas agencias también establecen que cualquier persona con anorexia nerviosa, trastorno bipolar, depresión, hipertensión, problemas hepáticos o renales, manía, psicosis, fenómeno de Raynaud, convulsiones, problemas de tiroides, tics o síndrome de Tourette debe controlar sus síntomas mientras toma anfetamina.. La evidencia de estudios en humanos indica que el uso terapéutico de anfetaminas no causa anomalías en el desarrollo del feto o los recién nacidos (es decir, no es un teratógeno humano), pero el abuso de anfetaminas sí presenta riesgos para el feto. También se ha demostrado que la anfetamina pasa a la leche materna, por lo que el IPCS y la USFDA aconsejan a las madres que eviten amamantar cuando la usan. Debido al potencial de alteraciones reversibles del crecimiento, la USFDA recomienda controlar la altura y el peso de los niños y adolescentes a los que se les receta un fármaco de anfetamina.
Efectos adversos
Los efectos secundarios adversos de la anfetamina son muchos y variados, y la cantidad de anfetamina utilizada es el factor principal para determinar la probabilidad y la gravedad de los efectos adversos. Los productos de anfetaminas como Adderall, Dexedrine y sus equivalentes genéricos están actualmente aprobados por la USFDA para uso terapéutico a largo plazo. El uso recreativo de la anfetamina generalmente implica dosis mucho mayores, que tienen un mayor riesgo de efectos adversos graves que las dosis utilizadas con fines terapéuticos.
Física
(feminine)Los efectos secundarios cardiovasculares pueden incluir hipertensión o hipotensión por una respuesta vasovagal, el fenómeno de Raynaud (reducción del flujo sanguíneo a las manos y los pies) y taquicardia (aumento del ritmo cardíaco). Los efectos secundarios sexuales en los hombres pueden incluir disfunción eréctil, erecciones frecuentes o erecciones prolongadas. Los efectos secundarios gastrointestinales pueden incluir dolor abdominal, estreñimiento, diarrea y náuseas. Otros posibles efectos secundarios físicos incluyen pérdida de apetito, visión borrosa, sequedad de boca, rechinamiento excesivo de los dientes, hemorragia nasal, sudoración profusa, rinitis medicamentosa (congestión nasal inducida por fármacos), reducción del umbral de convulsiones, tics (un tipo de trastorno del movimiento) y pérdida de peso. Los efectos secundarios físicos peligrosos son raros en dosis farmacéuticas típicas.
La anfetamina estimula los centros respiratorios medulares, produciendo respiraciones más rápidas y profundas. En una persona normal a dosis terapéuticas, este efecto no suele notarse, pero cuando la respiración ya está comprometida, puede ser evidente. La anfetamina también induce la contracción en el esfínter de la vejiga urinaria, el músculo que controla la micción, lo que puede provocar dificultad para orinar. Este efecto puede ser útil para tratar la enuresis nocturna y la pérdida del control de la vejiga. Los efectos de la anfetamina en el tracto gastrointestinal son impredecibles. Si la actividad intestinal es alta, la anfetamina puede reducir la motilidad gastrointestinal (la velocidad a la que se mueve el contenido a través del sistema digestivo); sin embargo, la anfetamina puede aumentar la motilidad cuando el músculo liso del tracto está relajado. La anfetamina también tiene un ligero efecto analgésico y puede aumentar los efectos analgésicos de los opioides.
Los estudios encargados por la USFDA de 2011 indican que en niños, adultos jóvenes y adultos no existe una asociación entre eventos cardiovasculares adversos graves (muerte súbita, ataque cardíaco y accidente cerebrovascular) y el uso médico de anfetaminas u otros estimulantes para el TDAH. Sin embargo, los productos farmacéuticos de anfetamina están contraindicados en personas con enfermedades cardiovasculares.
Psicológico
En dosis terapéuticas normales, los efectos secundarios psicológicos más comunes de la anfetamina incluyen mayor estado de alerta, aprensión, concentración, iniciativa, confianza en sí mismo y sociabilidad, cambios de humor (estado de ánimo eufórico seguido de un estado de ánimo levemente deprimido), insomnio o vigilia y disminución sensación de fatiga. Los efectos secundarios menos comunes incluyen ansiedad, cambios en la libido, grandiosidad, irritabilidad, comportamientos repetitivos u obsesivos e inquietud; estos efectos dependen de la personalidad y el estado mental actual del usuario. La psicosis por anfetaminas (p. ej., delirios y paranoia) puede ocurrir en consumidores intensivos. Aunque es muy raro, esta psicosis también puede ocurrir a dosis terapéuticas durante la terapia a largo plazo. Según la USFDA, "no hay evidencia sistemática" que los estimulantes producen un comportamiento agresivo u hostilidad.
También se ha demostrado que la anfetamina produce una preferencia de lugar condicionada en humanos que toman dosis terapéuticas, lo que significa que las personas adquieren una preferencia por pasar tiempo en lugares donde han consumido anfetamina previamente.
Trastornos de refuerzo
Adicción
Cadena de señalización en el núcleo accumbens que resulta en la adicción a la anfetamina |
La adicción es un riesgo grave con el uso recreativo intenso de anfetaminas, pero es poco probable que ocurra con el uso médico a largo plazo en dosis terapéuticas; de hecho, la terapia estimulante de por vida para el TDAH que comienza durante la niñez reduce el riesgo de desarrollar trastornos por uso de sustancias en la edad adulta. La sobreactivación patológica de la vía mesolímbica, una vía de dopamina que conecta el área tegmental ventral con el núcleo accumbens, juega un papel central en la adicción a las anfetaminas. Las personas que se autoadministran con frecuencia altas dosis de anfetamina tienen un alto riesgo de desarrollar una adicción a las anfetaminas, ya que el uso crónico de altas dosis aumenta gradualmente el nivel de ΔFosB accumbal, un "interruptor molecular" y "proteína de control maestro" por adiccion Una vez que el núcleo accumbens ΔFosB se sobreexpresa lo suficiente, comienza a aumentar la gravedad del comportamiento adictivo (es decir, la búsqueda compulsiva de drogas) con aumentos adicionales en su expresión. Si bien actualmente no existen medicamentos efectivos para tratar la adicción a las anfetaminas, la práctica regular de ejercicio aeróbico parece reducir el riesgo de desarrollar dicha adicción. El ejercicio aeróbico sostenido de forma regular también parece ser un tratamiento eficaz para la adicción a las anfetaminas; la terapia con ejercicios mejora los resultados del tratamiento clínico y se puede usar como una terapia complementaria con las terapias conductuales para la adicción.
Mecanismos biomoleculares
El consumo crónico de anfetamina en dosis excesivas provoca alteraciones en la expresión génica en la proyección mesocorticolímbica, que surgen a través de mecanismos transcripcionales y epigenéticos. Los factores de transcripción más importantes que producen estas alteraciones son el delta FBJ homólogo B del oncogén viral del osteosarcoma murino (ΔFosB), la proteína de unión al elemento de respuesta cAMP (CREB) y la nuclear factor-kappa B (NF-κB). ΔFosB es el mecanismo biomolecular más importante en la adicción porque la sobreexpresión de ΔFosB (es decir, un nivel anormalmente alto de expresión génica que produce un fenotipo pronunciado relacionado con el gen) en las neuronas espinosas medianas de tipo D1 en el núcleo accumbens es necesaria y suficiente para muchas de las las adaptaciones neuronales y regula múltiples efectos conductuales (p. ej., sensibilización a la recompensa y aumento de la autoadministración de drogas) implicados en la adicción. Una vez que ΔFosB se sobreexpresa lo suficiente, induce un estado adictivo que se vuelve cada vez más grave con aumentos adicionales en la expresión de ΔFosB. Se ha implicado en adicciones al alcohol, cannabinoides, cocaína, metilfenidato, nicotina, opioides, fenciclidina, propofol y anfetaminas sustituidas, entre otras.
ΔJunD, un factor de transcripción, y G9a, una enzima histona metiltransferasa, se oponen a la función de ΔFosB e inhiben los aumentos en su expresión. La sobreexpresión suficiente de ΔJunD en el núcleo accumbens con vectores virales puede bloquear por completo muchas de las alteraciones neurales y conductuales observadas en el abuso crónico de drogas (es decir, las alteraciones mediadas por ΔFosB). Del mismo modo, la hiperexpresión de G9a accumbal da como resultado un aumento notable de la dimetilación del residuo 9 de lisina de la histona 3 (H3K9me2) y bloquea la inducción de la plasticidad neural y conductual mediada por ΔFosB por el uso crónico de drogas, que se produce a través de la represión mediada por H3K9me2 de los factores de transcripción para ΔFosB y H3K9me2- represión mediada por varios objetivos transcripcionales de ΔFosB (p. ej., CDK5). ΔFosB también juega un papel importante en la regulación de las respuestas conductuales a las recompensas naturales, como la comida sabrosa, el sexo y el ejercicio. Dado que tanto las recompensas naturales como las drogas adictivas inducen la expresión de ΔFosB (es decir, hacen que el cerebro produzca más), la adquisición crónica de estas recompensas puede resultar en un estado patológico similar de adicción. En consecuencia, ΔFosB es el factor más importante involucrado tanto en la adicción a las anfetaminas como en las adicciones sexuales inducidas por anfetaminas, que son comportamientos sexuales compulsivos que resultan de la actividad sexual excesiva y el uso de anfetaminas. Estas adicciones sexuales están asociadas con un síndrome de desregulación de la dopamina que ocurre en algunos pacientes que toman drogas dopaminérgicas.
Los efectos de la anfetamina en la regulación génica dependen tanto de la dosis como de la ruta. La mayor parte de la investigación sobre la regulación genética y la adicción se basa en estudios en animales con administración intravenosa de anfetaminas en dosis muy altas. Los pocos estudios que han utilizado dosis terapéuticas humanas equivalentes (ajustadas al peso) y administración oral muestran que estos cambios, si ocurren, son relativamente menores. Esto sugiere que el uso médico de la anfetamina no afecta significativamente la regulación genética.
Tratamientos farmacológicos
Hasta diciembre de 2019, no existe una farmacoterapia eficaz para la adicción a las anfetaminas. Las revisiones de 2015 y 2016 indicaron que los agonistas selectivos de TAAR1 tienen un potencial terapéutico significativo como tratamiento para las adicciones a los psicoestimulantes; sin embargo, a partir de febrero de 2016, los únicos compuestos que se sabe que funcionan como agonistas selectivos de TAAR1 son fármacos experimentales. La adicción a las anfetaminas está mediada en gran medida por una mayor activación de los receptores de dopamina y de los receptores NMDA co-localizados en el núcleo accumbens; Los iones de magnesio inhiben los receptores NMDA al bloquear el canal receptor de calcio. Una revisión sugirió que, con base en pruebas con animales, el uso de psicoestimulantes patológicos (que inducen adicción) reduce significativamente el nivel de magnesio intracelular en todo el cerebro. Se ha demostrado que el tratamiento complementario con magnesio reduce la autoadministración de anfetaminas (es decir, las dosis que uno mismo se administra) en humanos, pero no es una monoterapia eficaz para la adicción a las anfetaminas.
Una revisión sistemática y un metanálisis de 2019 evaluaron la eficacia de 17 farmacoterapias diferentes utilizadas en ensayos controlados aleatorios (ECA) para la adicción a la anfetamina y la metanfetamina; solo encontró evidencia de baja solidez de que el metilfenidato podría reducir la anfetamina o la autoadministración de metanfetamina. Hubo evidencia de fuerza baja a moderada de ningún beneficio para la mayoría de los otros medicamentos utilizados en los ECA, que incluyeron antidepresivos (bupropión, mirtazapina, sertralina), antipsicóticos (aripiprazol), anticonvulsivos (topiramato, baclofeno, gabapentina), naltrexona, vareniclina, citicolina, ondansetrón, prometa, riluzol, atomoxetina, dextroanfetamina y modafinilo.
Tratamientos conductuales
Una revisión sistemática de 2018 y un metanálisis en red de 50 ensayos que incluyeron 12 intervenciones psicosociales diferentes para la adicción a la anfetamina, la metanfetamina o la cocaína encontraron que la terapia combinada con el manejo de contingencias y el enfoque de refuerzo comunitario tuvo la mayor eficacia (es decir, tasa de abstinencia) y aceptabilidad (es decir, la tasa de deserción más baja). Otras modalidades de tratamiento examinadas en el análisis incluyeron monoterapia con manejo de contingencias o enfoque de refuerzo comunitario, terapia cognitiva conductual, programas de 12 pasos, terapias basadas en recompensas no contingentes, terapia psicodinámica y otras terapias combinadas que las involucran.
Además, la investigación sobre los efectos neurobiológicos del ejercicio físico sugiere que el ejercicio aeróbico diario, especialmente el ejercicio de resistencia (p. ej., correr una maratón), previene el desarrollo de la adicción a las drogas y es una terapia complementaria eficaz (es decir, un tratamiento complementario) para las anfetaminas. adiccion. El ejercicio conduce a mejores resultados del tratamiento cuando se usa como tratamiento complementario, particularmente para las adicciones a los psicoestimulantes. En particular, el ejercicio aeróbico disminuye la autoadministración de psicoestimulantes, reduce el restablecimiento (es decir, la recaída) de la búsqueda de drogas e induce un aumento de la densidad del receptor de dopamina D2 (DRD2) en el cuerpo estriado. Esto es lo opuesto al uso de estimulantes patológicos, que induce una disminución de la densidad DRD2 estriatal. Una revisión señaló que el ejercicio también puede prevenir el desarrollo de una adicción a las drogas al alterar la inmunorreactividad ΔFosB o c-Fos en el cuerpo estriado u otras partes del sistema de recompensa.
| Forma de neuroplicidad o plasticidad conductual | Tipo de refuerzo | Fuentes | |||||
|---|---|---|---|---|---|---|---|
| Opiates | Psicoestimulantes | Alimentos altos en grasa o azúcar | Relaciones sexuales | Ejercicio físico (aerobio) | Environmentalenrichment | ||
| ΔFosB expresión en nucleus accumbens D1-type MSNs | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | |
| plasticidad conductual | |||||||
| Escala de la ingesta | Sí. | Sí. | Sí. | ||||
| Psicoestimulante cross-sensitization | Sí. | No aplicable | Sí. | Sí. | Atenuación | Atenuación | |
| Psicoestimulante autoadministración | ↑ | ↑ | ↓ | ↓ | ↓ | ||
| Psicoestimulante preferencia de lugar condicionado | ↑ | ↑ | ↓ | ↑ | ↓ | ↑ | |
| Reinstatement of drug-seeking behaviour | ↑ | ↑ | ↓ | ↓ | |||
| plasticidad neuroquímica | |||||||
| Fosforilación CREB en el nucleus accumbens | ↓ | ↓ | ↓ | ↓ | ↓ | ||
| Respuesta de la dopamina sensible en el nucleus accumbens | No | Sí. | No | Sí. | |||
| Señal de dopamina estrital alterada | ↓DRD2, ↑DRD3 | ↑DRD1, ↓DRD2, ↑DRD3 | ↑DRD1, ↓DRD2, ↑DRD3 | ↑DRD2 | ↑DRD2 | ||
| Señal de opioides alterados | No hay cambio o Receptores ↑μ-opioide | Receptores ↑μ-opioide ↑κ-opioid receives | Receptores ↑μ-opioide | Receptores ↑μ-opioide | No hay cambio | No hay cambio | |
| Cambios en los péptidos de opioides estritales | ↑dynorphin Sin cambios: encefalina | ↑dynorphin | ↓enkephalin | ↑dynorphin | ↑dynorphin | ||
| plasticidad sináptica mesocorticolimúbica | |||||||
| Número de dendritas en el nucleus accumbens | ↓ | ↑ | ↑ | ||||
| Densidad de columna dentada en el nucleus accumbens | ↓ | ↑ | ↑ | ||||
Dependencia y abstinencia
La tolerancia a las drogas se desarrolla rápidamente en el abuso de anfetaminas (es decir, el uso recreativo de anfetaminas), por lo que los períodos de abuso prolongado requieren dosis cada vez mayores de la droga para lograr el mismo efecto. Según una revisión de Cochrane sobre la abstinencia en personas que consumen anfetamina y metanfetamina de manera compulsiva, "cuando los grandes consumidores crónicos interrumpen abruptamente el uso de anfetamina, muchos informan un síndrome de abstinencia de tiempo limitado que ocurre dentro de las 24 horas posteriores a su última dosis".; Esta revisión señaló que los síntomas de abstinencia en usuarios crónicos de dosis altas son frecuentes, ocurren en aproximadamente el 88 % de los casos y persisten durante 3–4 semanas con un marcado " accidente" fase que ocurre durante la primera semana. Los síntomas de abstinencia de las anfetaminas pueden incluir ansiedad, antojo de drogas, estado de ánimo deprimido, fatiga, aumento del apetito, aumento o disminución del movimiento, falta de motivación, insomnio o somnolencia y sueños lúcidos. La revisión indicó que la gravedad de los síntomas de abstinencia se correlaciona positivamente con la edad del individuo y el grado de su dependencia. Los síntomas leves de abstinencia por la interrupción del tratamiento con anfetaminas en dosis terapéuticas pueden evitarse disminuyendo la dosis.
Sobredosis
Una sobredosis de anfetaminas puede provocar muchos síntomas diferentes, pero rara vez es fatal con el cuidado adecuado. La gravedad de los síntomas de sobredosis aumenta con la dosis y disminuye con la tolerancia a las anfetaminas. Se sabe que las personas tolerantes toman hasta 5 gramos de anfetamina en un día, que es aproximadamente 100 veces la dosis terapéutica diaria máxima. Los síntomas de una sobredosis moderada y extremadamente grande se enumeran a continuación; el envenenamiento fatal por anfetamina generalmente también implica convulsiones y coma. En 2013, una sobredosis de anfetamina, metanfetamina y otros compuestos implicados en un "trastorno por consumo de anfetamina" resultó en un estimado de 3788 muertes en todo el mundo (3425–4145 muertes, 95 % de confianza).
| Sistema | Sobredosis menor o moderada | Sobredosis graves |
|---|---|---|
| Cardiovascular |
|
|
| Sistema nervioso central |
|
|
| Musculosqueleto |
|
|
| Respiratorio |
|
|
| Urinary |
|
|
| Otros |
|
|
Toxicidad
En roedores y primates, dosis suficientemente altas de anfetamina causan neurotoxicidad dopaminérgica o daño a las neuronas dopaminérgicas, que se caracteriza por la degeneración terminal de dopamina y la reducción de la función del transportador y el receptor. No hay evidencia de que la anfetamina sea directamente neurotóxica en humanos. Sin embargo, grandes dosis de anfetamina pueden causar indirectamente neurotoxicidad dopaminérgica como resultado de la hiperpirexia, la formación excesiva de especies reactivas del oxígeno y el aumento de la autooxidación de la dopamina. Los modelos animales de neurotoxicidad por exposición a dosis altas de anfetamina indican que la aparición de hiperpirexia (es decir, temperatura corporal central ≥ 40 °C) es necesaria para el desarrollo de neurotoxicidad inducida por anfetamina. Es probable que las elevaciones prolongadas de la temperatura cerebral por encima de los 40 °C promuevan el desarrollo de neurotoxicidad inducida por anfetaminas en animales de laboratorio al facilitar la producción de especies reactivas de oxígeno, alterar la función de las proteínas celulares y aumentar transitoriamente la permeabilidad de la barrera hematoencefálica.
Psicosis
Una sobredosis de anfetaminas puede provocar una psicosis estimulante que puede implicar una variedad de síntomas, como delirios y paranoia. Una revisión de Cochrane sobre el tratamiento de la psicosis por anfetamina, dextroanfetamina y metanfetamina establece que alrededor del 5-15 % de los usuarios no se recuperan por completo. Según la misma revisión, hay al menos un ensayo que muestra que los medicamentos antipsicóticos resuelven de manera efectiva los síntomas de la psicosis anfetamínica aguda. La psicosis rara vez surge del uso terapéutico.
Interacciones medicamentosas
Se sabe que muchos tipos de sustancias interactúan con la anfetamina, lo que altera la acción del fármaco o el metabolismo de la anfetamina, la sustancia que interactúa o ambas. Los inhibidores de las enzimas que metabolizan la anfetamina (p. ej., CYP2D6 y FMO3) prolongarán su vida media de eliminación, lo que significa que sus efectos durarán más. La anfetamina también interactúa con los IMAO, en particular los inhibidores de la monoaminooxidasa A, ya que tanto los IMAO como la anfetamina aumentan las catecolaminas plasmáticas (es decir, norepinefrina y dopamina); por lo tanto, el uso simultáneo de ambos es peligroso. La anfetamina modula la actividad de la mayoría de las drogas psicoactivas. En particular, la anfetamina puede disminuir los efectos de los sedantes y depresores y aumentar los efectos de los estimulantes y antidepresivos. La anfetamina también puede disminuir los efectos de los antihipertensivos y antipsicóticos debido a sus efectos sobre la presión arterial y la dopamina, respectivamente. La suplementación con zinc puede reducir la dosis mínima efectiva de anfetamina cuando se usa para el tratamiento del TDAH.
En general, no existe una interacción significativa cuando se consume anfetamina con alimentos, pero el pH del contenido gastrointestinal y de la orina afecta la absorción y excreción de anfetamina, respectivamente. Las sustancias ácidas reducen la absorción de la anfetamina y aumentan la excreción urinaria, y las sustancias alcalinas hacen lo contrario. Debido al efecto que tiene el pH sobre la absorción, la anfetamina también interactúa con los reductores del ácido gástrico, como los inhibidores de la bomba de protones y los antihistamínicos H2, que aumentan el pH gastrointestinal (es decir, lo hacen menos ácido).
Farmacología
Farmacodinámica
Farmacodinámica de la anfetamina en una neurona dopamina |
La anfetamina ejerce sus efectos conductuales al alterar el uso de monoaminas como señales neuronales en el cerebro, principalmente en las neuronas de catecolaminas en las vías de recompensa y funciones ejecutivas del cerebro. Las concentraciones de los principales neurotransmisores implicados en los circuitos de recompensa y el funcionamiento ejecutivo, la dopamina y la norepinefrina, aumentan drásticamente de forma dependiente de la dosis por la anfetamina debido a sus efectos sobre los transportadores de monoamina. Los efectos de refuerzo y promoción de la prominencia motivacional de la anfetamina se deben principalmente a una mayor actividad dopaminérgica en la vía mesolímbica. Los efectos eufóricos y estimulantes del aparato locomotor de la anfetamina dependen de la magnitud y la velocidad con la que aumenta las concentraciones sinápticas de dopamina y norepinefrina en el cuerpo estriado.
La anfetamina se ha identificado como un potente agonista completo del receptor 1 asociado a trazas de amina (TAAR1), un acoplado con Gs y Gq- receptor acoplado a proteína G (GPCR) descubierto en 2001, que es importante para la regulación de las monoaminas cerebrales. La activación del TAAR1 aumenta la producción de AMPc a través de la activación de la adenilil ciclasa e inhibe la función del transportador de monoaminas. Los autorreceptores de monoaminas (p. ej., D2 corto, presináptico α2 y presináptico 5-HT1A) tienen el efecto opuesto de TAAR1 y, juntos, estos receptores proporcionan un sistema regulador para las monoaminas. En particular, las anfetaminas y las trazas de aminas poseen altas afinidades de unión por TAAR1, pero no por los autorreceptores de monoamina. Los estudios de imágenes indican que la inhibición de la recaptación de monoaminas por la anfetamina y las trazas de aminas es específica del sitio y depende de la presencia de co-localización de TAAR1 en las neuronas de monoamina asociadas.
Además de los transportadores de monoaminas neuronales, la anfetamina también inhibe los transportadores de monoaminas vesiculares, VMAT1 y VMAT2, así como SLC1A1, SLC22A3 y SLC22A5. SLC1A1 es el transportador de aminoácidos excitatorios 3 (EAAT3), un transportador de glutamato ubicado en las neuronas, SLC22A3 es un transportador de monoaminas extraneuronal que está presente en los astrocitos y SLC22A5 es un transportador de carnitina de alta afinidad. Se sabe que la anfetamina induce fuertemente la expresión génica de la transcripción regulada por anfetamina y cocaína (CART), un neuropéptido involucrado en el comportamiento de alimentación, el estrés y la recompensa, que induce aumentos observables en el desarrollo neuronal y la supervivencia in vitro. El receptor CART aún no se ha identificado, pero hay pruebas significativas de que CART se une a un gi/go-acoplado GPCR único . La anfetamina también inhibe las monoaminooxidasas en dosis muy altas, lo que da como resultado un menor metabolismo de monoaminas y trazas de aminas y, en consecuencia, concentraciones más altas de monoaminas sinápticas. En humanos, el único receptor postsináptico al que se sabe que se une la anfetamina es el receptor 5-HT1A, donde actúa como agonista con baja afinidad micromolar.
El perfil completo de los efectos de las drogas a corto plazo de las anfetaminas en humanos se deriva principalmente a través de una mayor comunicación celular o neurotransmisión de dopamina, serotonina, norepinefrina, epinefrina, histamina, péptidos CART, opioides endógenos, hormona adrenocorticotrópica, corticosteroides, y glutamato, al que afecta a través de interacciones con CART, 5-HT1A , EAAT3, TAAR1, VMAT1, VMAT2 y posiblemente otros objetivos biológicos. La anfetamina también activa siete enzimas anhidrasa carbónica humana, varias de las cuales se expresan en el cerebro humano.
La dextroanfetamina es un agonista más potente del TAAR1 que la levoanfetamina. En consecuencia, la dextroanfetamina produce una mayor estimulación del SNC que la levoanfetamina, aproximadamente de tres a cuatro veces más, pero la levoanfetamina tiene efectos cardiovasculares y periféricos ligeramente más fuertes.
Dopamina
En ciertas regiones del cerebro, la anfetamina aumenta la concentración de dopamina en la hendidura sináptica. La anfetamina puede entrar en la neurona presináptica a través del DAT o difundiéndose directamente a través de la membrana neuronal. Como consecuencia de la captación de DAT, la anfetamina produce una inhibición competitiva de la recaptación en el transportador. Al entrar en la neurona presináptica, la anfetamina activa el TAAR1 que, a través de la señalización de la proteína quinasa A (PKA) y la proteína quinasa C (PKC), provoca la fosforilación de DAT. La fosforilación por cualquiera de las proteínas quinasas puede resultar en la internalización de DAT (inhibición de la recaptación no competitiva), pero la fosforilación mediada por PKC por sí sola induce la inversión del transporte de dopamina a través de DAT (es decir, salida de dopamina). También se sabe que la anfetamina aumenta el calcio intracelular, un efecto que está asociado con la fosforilación de DAT a través de una vía no identificada dependiente de la proteína quinasa dependiente de Ca2+/calmodulina (CAMK), que a su vez produce la salida de dopamina. A través de la activación directa de los canales de potasio rectificadores internos acoplados a la proteína G, TAAR1 reduce la tasa de activación de las neuronas dopaminérgicas, evitando un estado hiperdopaminérgico.
La anfetamina también es un sustrato para el transportador de monoamina vesicular presináptica, VMAT2. Después de la absorción de anfetamina en VMAT2, la anfetamina induce el colapso del gradiente de pH vesicular, lo que da como resultado la liberación de moléculas de dopamina desde las vesículas sinápticas hacia el citosol a través del flujo de salida de dopamina a través de VMAT2. Posteriormente, las moléculas de dopamina citosólicas se liberan desde la neurona presináptica hacia la hendidura sináptica a través del transporte inverso en DAT.
Norepinefrina
Al igual que la dopamina, la anfetamina aumenta el nivel de norepinefrina sináptica, el precursor directo de la epinefrina, según la dosis. Según la expresión neuronal TAAR1 mRNA, se cree que la anfetamina afecta a la norepinefrina de manera análoga a la dopamina. En otras palabras, la anfetamina induce el flujo de salida mediado por TAAR1 y la inhibición de la recaptación no competitiva en NET fosforilados, inhibición de la recaptación de NET competitivo, y liberación de norepinefrina de VMAT2.
Serotonina
La anfetamina ejerce efectos análogos, aunque menos pronunciados, sobre la serotonina que sobre la dopamina y la norepinefrina. La anfetamina afecta a la serotonina a través del VMAT2 y, al igual que la norepinefrina, se cree que fosforila SERT a través de TAAR1. Al igual que la dopamina, la anfetamina tiene una afinidad micromolar baja en el receptor 5-HT1A humano.
Otros neurotransmisores, péptidos, hormonas y enzimas
| Enzyme | KA (nM) | Fuentes |
|---|---|---|
| hCA4 | 94 | |
| hCA5A | 810 | |
| hCA5B | 2560 | |
| hCA7 | 910 | |
| hCA12 | 640 | |
| hCA13 | 24100 | |
| hCA14 | 9150 |
La administración aguda de anfetaminas en humanos aumenta la liberación de opioides endógenos en varias estructuras cerebrales en el sistema de recompensa. Se ha demostrado que los niveles extracelulares de glutamato, el principal neurotransmisor excitador del cerebro, aumentan en el cuerpo estriado después de la exposición a la anfetamina. Este aumento en el glutamato extracelular presumiblemente ocurre a través de la internalización inducida por anfetaminas de EAAT3, un transportador de recaptación de glutamato, en las neuronas de dopamina. La anfetamina también induce la liberación selectiva de histamina de los mastocitos y la salida de las neuronas histaminérgicas a través de VMAT2. La administración aguda de anfetaminas también puede aumentar la hormona adrenocorticotrópica y los niveles de corticosteroides en el plasma sanguíneo al estimular el eje hipotálamo-pituitario-suprarrenal.
En diciembre de 2017, se publicó el primer estudio que evaluó la interacción entre la anfetamina y las enzimas anhidrasa carbónica humana; de las once enzimas de anhidrasa carbónica que examinó, descubrió que la anfetamina activa potentemente siete, cuatro de las cuales se expresan en gran medida en el cerebro humano, con efectos activadores nanomolares bajos a micromolares bajos. Según investigaciones preclínicas, la activación de la anhidrasa carbónica cerebral tiene efectos que mejoran la cognición; pero, según el uso clínico de los inhibidores de la anhidrasa carbónica, la activación de la anhidrasa carbónica en otros tejidos puede estar asociada con efectos adversos, como la activación ocular que exacerba el glaucoma.
Farmacocinética
La biodisponibilidad oral de la anfetamina varía con el pH gastrointestinal; se absorbe bien en el intestino y la biodisponibilidad suele ser superior al 75 % para la dextroanfetamina. La anfetamina es una base débil con un pKa de 9,9; en consecuencia, cuando el pH es básico, una mayor parte del fármaco se encuentra en su forma de base libre soluble en lípidos y se absorbe más a través de las membranas celulares ricas en lípidos del epitelio intestinal. Por el contrario, un pH ácido significa que el fármaco se encuentra predominantemente en una forma catiónica (sal) soluble en agua y se absorbe menos. Aproximadamente el 20 % de la anfetamina que circula en el torrente sanguíneo se une a las proteínas plasmáticas. Después de la absorción, la anfetamina se distribuye rápidamente en la mayoría de los tejidos del cuerpo, con altas concentraciones en el líquido cefalorraquídeo y el tejido cerebral.
Las vidas medias de los enantiómeros de anfetamina difieren y varían con el pH de la orina. Con un pH urinario normal, las semividas de la dextroanfetamina y la levoanfetamina son 9–11 horas y 11–14 horas, respectivamente. La orina muy ácida reducirá la vida media del enantiómero a 7 horas; la orina altamente alcalina aumentará la vida media hasta 34 horas. Las variantes de liberación inmediata y liberación prolongada de sales de ambos isómeros alcanzan concentraciones plasmáticas máximas a las 3 horas y 7 horas después de la dosis, respectivamente. La anfetamina se elimina a través de los riñones y 30–40 % de la droga se excreta sin cambios con un pH urinario normal. Cuando el pH urinario es básico, la anfetamina se encuentra en su forma de base libre, por lo que se excreta menos. Cuando el pH de la orina es anormal, la recuperación urinaria de anfetamina puede oscilar entre un mínimo del 1 % y un máximo del 75 %, dependiendo principalmente de si la orina es demasiado básica o ácida, respectivamente. Después de la administración oral, la anfetamina aparece en la orina dentro de las 3 horas. Aproximadamente el 90% de la anfetamina ingerida se elimina 3 días después de la última dosis oral.
La lisdexanfetamina es un profármaco de la dextroanfetamina. No es tan sensible al pH como la anfetamina cuando se absorbe en el tracto gastrointestinal. Después de la absorción en el torrente sanguíneo, los glóbulos rojos convierten completamente la lisdexanfetamina en dextroanfetamina y el aminoácido L-lisina por hidrólisis a través de enzimas aminopeptidasas no determinadas. Este es el paso limitante de la velocidad en la bioactivación de lisdexanfetamina. La vida media de eliminación de la lisdexanfetamina es generalmente inferior a 1 hora. Debido a la conversión necesaria de lisdexanfetamina en dextroanfetamina, los niveles de dextroanfetamina con lisdexanfetamina alcanzan su punto máximo aproximadamente una hora más tarde que con una dosis equivalente de dextroanfetamina de liberación inmediata. Presumiblemente, debido a su velocidad limitada de activación por parte de los glóbulos rojos, la administración intravenosa de lisdexanfetamina muestra un gran retraso en el pico y niveles máximos reducidos en comparación con la administración intravenosa de una dosis equivalente de dextroanfetamina. La farmacocinética de la lisdexanfetamina es similar independientemente de si se administra por vía oral, intranasal o intravenosa. Por tanto, a diferencia de la dextroanfetamina, el uso parenteral no potencia los efectos subjetivos de la lisdexanfetamina. Debido a su comportamiento como profármaco y sus diferencias farmacocinéticas, la lisdexanfetamina tiene un efecto terapéutico de mayor duración que la dextroanfetamina de liberación inmediata y muestra un potencial de uso indebido reducido.
CYP2D6, dopamina β-hidroxilasa (DBH), monooxigenasa 3 que contiene flavina (FMO3), butirato-CoA ligasa (XM-ligasa) y glicina N-aciltransferasa (GLYAT) son las enzimas conocidas por metabolizar la anfetamina o sus metabolitos. Inhumanos. La anfetamina tiene una variedad de productos metabólicos excretados, que incluyen 4-hidroxianfetamina, 4-hidroxinorefedrina, 4-hidroxifenilacetona, ácido benzoico, ácido hipúrico, norefedrina y fenilacetona. Entre estos metabolitos, los simpaticomiméticos activos son 4-hidroxianfetamina, 4-hidroxinorefedrina y norefedrina. Las principales vías metabólicas incluyen la parahidroxilación aromática, la hidroxilación alfa y beta alifática, la N-oxidación, la N-desalquilación y la desaminación. Las vías metabólicas conocidas, los metabolitos detectables y las enzimas metabolizantes en humanos incluyen lo siguiente:
Vías metabólicas de la anfetamina en humanos |
Farmacomicrobiómica
El metagenoma humano (es decir, la composición genética de un individuo y todos los microorganismos que residen sobre o dentro del cuerpo del individuo) varía considerablemente entre los individuos. Dado que la cantidad total de células microbianas y virales en el cuerpo humano (más de 100 billones) supera con creces a las células humanas (decenas de billones), existe un potencial considerable de interacciones entre los medicamentos y el microbioma de un individuo, que incluyen: medicamentos que alteran el composición del microbioma humano, metabolismo de fármacos por enzimas microbianas que modifican el perfil farmacocinético del fármaco, y metabolismo de fármacos microbiano que afecta la eficacia clínica y el perfil de toxicidad de un fármaco. El campo que estudia estas interacciones se conoce como farmacomicrobiómica.
Al igual que la mayoría de las biomoléculas y otros xenobióticos (es decir, fármacos) administrados por vía oral, se prevé que la anfetamina sufra un metabolismo promiscuo por parte de la microbiota gastrointestinal humana (principalmente bacterias) antes de su absorción en el torrente sanguíneo. La primera enzima microbiana que metaboliza la anfetamina, la tiramina oxidasa de una cepa de E. coli que se encuentra comúnmente en el intestino humano, se identificó en 2019. Se descubrió que esta enzima metaboliza la anfetamina, la tiramina y la fenetilamina con aproximadamente la misma afinidad de unión por las tres compuestos.
Compuestos endógenos relacionados
La anfetamina tiene una estructura y una función muy similares a las trazas de aminas endógenas, que son moléculas neuromoduladoras naturales producidas en el cuerpo y el cerebro humanos. Entre este grupo, los compuestos más estrechamente relacionados son la fenetilamina, el compuesto original de la anfetamina, y la N-metilfenetilamina, un isómero de la anfetamina (es decir, tiene una fórmula molecular idéntica). En los seres humanos, la fenetilamina se produce directamente a partir de L-fenilalanina mediante la enzima descarboxilasa de aminoácidos aromáticos (AADC), que convierte L-DOPA en dopamina también. A su vez, N-metilfenetilamina se metaboliza a partir de fenetilamina por la feniletanolamina N-metiltransferasa, la misma enzima que metaboliza la norepinefrina en epinefrina. Al igual que la anfetamina, tanto la fenetilamina como la N-metilfenetilamina regulan la neurotransmisión de monoamina a través del TAAR1.; a diferencia de la anfetamina, ambas sustancias se descomponen por la monoamino oxidasa B y, por lo tanto, tienen una vida media más corta que la anfetamina.
Química
Anfetamina racial |
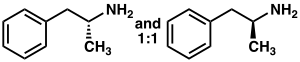
La anfetamina es un metilo homólogo del neurotransmisor de mamíferos fenetilamina con la fórmula química C9H13N. El átomo de carbono adyacente a la amina primaria es un centro estereogénico y la anfetamina está compuesta por una mezcla racémica 1:1 de dos enantiómeros. Esta mezcla racémica se puede separar en sus isómeros ópticos: levoanfetamina y dextroanfetamina. A temperatura ambiente, la base libre pura de la anfetamina es un líquido móvil, incoloro y volátil con un olor a amina característicamente fuerte y un sabor acre y quemante. Las sales sólidas de anfetamina que se preparan con frecuencia incluyen adipato, aspartato, clorhidrato, fosfato, sacarato, sulfato y tanato de anfetamina. El sulfato de dextroanfetamina es la sal enantiopura más común. La anfetamina también es el compuesto original de su propia clase estructural, que incluye varios derivados psicoactivos. En química orgánica, la anfetamina es un excelente ligando quiral para la síntesis estereoselectiva de 1,1'-bi-2-naftol.
Derivados sustituidos
Los derivados sustituidos de la anfetamina, o "anfetaminas sustituidas", son una amplia gama de sustancias químicas que contienen anfetamina como "columna vertebral"; específicamente, esta clase química incluye compuestos derivados que se forman reemplazando uno o más átomos de hidrógeno en la estructura central de la anfetamina con sustituyentes. La clase incluye la anfetamina en sí misma, estimulantes como la metanfetamina, empatógenos serotoninérgicos como la MDMA y descongestionantes como la efedrina, entre otros subgrupos.
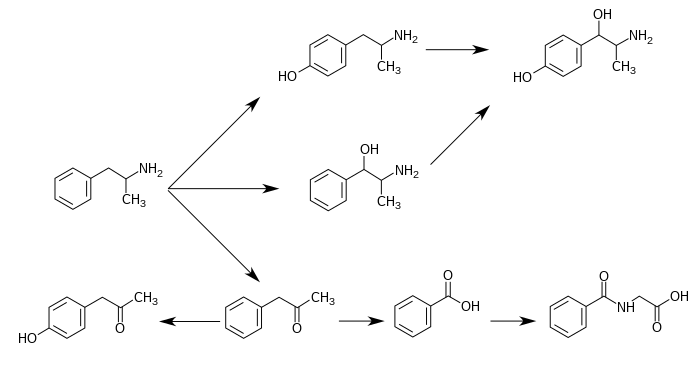
Síntesis
Desde que se informó de la primera preparación en 1887, se han desarrollado numerosas rutas sintéticas a la anfetamina. La ruta más común de síntesis de anfetamina tanto legal como ilícita emplea una reducción no metálica conocida como reacción de Leuckart (método 1). En el primer paso, una reacción entre la fenilacetona y la formamida, ya sea utilizando ácido fórmico adicional o la propia formamida como agente reductor, produce N-formilanfetamina. A continuación, este intermedio se hidroliza con ácido clorhídrico y, posteriormente, se alcaliniza, se extrae con un disolvente orgánico, se concentra y se destila para producir la base libre. Luego, la base libre se disuelve en un solvente orgánico, se agrega ácido sulfúrico y la anfetamina precipita como la sal de sulfato.
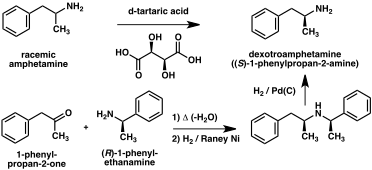
Se han desarrollado varias resoluciones quirales para separar los dos enantiómeros de la anfetamina. Por ejemplo, la anfetamina racémica se puede tratar con ácido d-tartárico para formar una sal diastereoisomérica que se cristaliza fraccionadamente para producir dextroanfetamina. La resolución quiral sigue siendo el método más económico para obtener anfetamina ópticamente pura a gran escala. Además, se han desarrollado varias síntesis enantioselectivas de anfetamina. En un ejemplo, (R)-1-fenil-etanamina ópticamente pura se condensa con fenilacetona para producir una base de Schiff quiral. En el paso clave, este intermedio se reduce por hidrogenación catalítica con una transferencia de quiralidad del átomo de carbono alfa al grupo amino. La escisión del enlace amina bencílico por hidrogenación produce dextroanfetamina ópticamente pura.
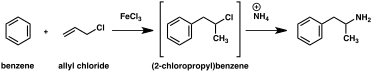
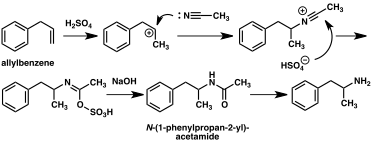
Se ha desarrollado un gran número de rutas sintéticas alternativas a la anfetamina basadas en reacciones orgánicas clásicas. Un ejemplo es la alquilación de benceno de Friedel-Crafts con cloruro de alilo para producir beta cloropropilbenceno que luego reacciona con amoníaco para producir anfetamina racémica (método 2). Otro ejemplo emplea la reacción de Ritter (método 3). En esta ruta, el alilbenceno se hace reaccionar con acetonitrilo en ácido sulfúrico para producir un organosulfato que a su vez se trata con hidróxido de sodio para dar anfetamina a través de un intermedio de acetamida. Una tercera ruta comienza con 3-oxobutanoato de etilo que mediante una doble alquilación con yoduro de metilo seguido de cloruro de bencilo se puede convertir en 2-metil-3 ácido -fenil-propanoico. Este intermedio sintético se puede transformar en anfetamina mediante un reordenamiento de Hofmann o de Curtius (método 4).
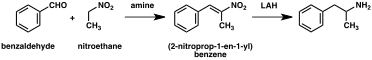
Un número significativo de síntesis de anfetamina presenta una reducción de nitro, imina, oxima u otros grupos funcionales que contienen nitrógeno. En uno de esos ejemplos, una condensación de Knoevenagel de benzaldehído con nitroetano produce fenil-2-nitropropeno. El doble enlace y el grupo nitro de este intermedio se reducen mediante hidrogenación catalítica o mediante tratamiento con hidruro de litio y aluminio (método 5). Otro método es la reacción de fenilacetona con amoníaco, lo que produce una imina intermedia que se reduce a la amina primaria utilizando hidrógeno sobre un catalizador de paladio o hidruro de litio y aluminio (método 6).
Detección en fluidos corporales
La anfetamina se mide con frecuencia en la orina o la sangre como parte de una prueba de drogas para deportes, empleo, diagnóstico de envenenamiento y análisis forense. Técnicas como el inmunoensayo, que es la forma más común de prueba de anfetamina, pueden reaccionar de forma cruzada con varios fármacos simpaticomiméticos. Se emplean métodos cromatográficos específicos para la anfetamina para evitar resultados falsos positivos. Las técnicas de separación quiral se pueden emplear para ayudar a distinguir la fuente de la droga, ya sea anfetamina recetada, profármacos de anfetamina recetados (p. ej., selegilina), medicamentos de venta libre que contienen levometanfetamina o anfetaminas sustitutas obtenidas ilícitamente. Varios medicamentos recetados producen anfetamina como metabolito, incluidos benzfetamina, clobenzorex, famprofazona, fenproporex, lisdexanfetamina, mesocarb, metanfetamina, prenilamina y selegilina, entre otros. Estos compuestos pueden producir resultados positivos para la anfetamina en las pruebas de drogas. Por lo general, la anfetamina solo se detecta mediante una prueba de drogas estándar durante aproximadamente 24 horas, aunque una dosis alta puede detectarse durante 2–4 días.
Para los ensayos, un estudio señaló que un ensayo de técnica de inmunoensayo multiplicado por enzimas (EMIT) para anfetamina y metanfetamina puede producir más falsos positivos que la cromatografía líquida y la espectrometría de masas en tándem. La cromatografía de gases-espectrometría de masas (GC-MS) de anfetamina y metanfetamina con el agente derivatizante (S)-(−)-trifluoroacetylprolyl cloruro permite la Detección de metanfetamina en orina. La GC-MS de anfetamina y metanfetamina con el agente derivador quiral cloruro de ácido de Mosher permite la detección de dextroanfetamina y dextrometanfetamina en la orina. Por lo tanto, el último método puede usarse en muestras que dan positivo usando otros métodos para ayudar a distinguir entre las diversas fuentes de la droga.
Historia, sociedad y cultura
| Sustancia | Mejor Estimación | Baja Estimación | Alto Estimación |
|---|---|---|---|
| Estimulantes de tipo anfetamínico | 34.16 | 13.42 | 55.24 |
| Cannabis | 192.15 | 165.76 | 234.06 |
| Cocaine | 18.20 | 13.87 | 22.85 |
| éxtasis | 20.57 | 8.99 | 32.34 |
| Opiates | 19.38 | 13.80 | 26.15 |
| Opioides | 34.26 | 27.01 | 44.54 |
Los estimulantes de tipo anfetamínico se derivaron originalmente de la planta Ephedra, que contiene la efedrina, un estimulante similar a la anfetamina, y se habían utilizado por sus efectos en China desde hace aproximadamente 5000 años. La efedrina se aisló de Ephedra vulgaris en Japón en 1885 y se estudió por sus propiedades medicinales durante la década de 1920. Las escasas cantidades de efedrina en la planta Ephedra llevaron a investigaciones de análogos sintéticos de la efedrina.
La anfetamina fue sintetizada por primera vez en 1887 en Alemania por el químico rumano Lazăr Edeleanu, quien la denominó fenilisopropilamina; sus efectos estimulantes permanecieron desconocidos hasta 1927, cuando Gordon Alles lo resintetizó de forma independiente y se informó que tenía propiedades simpaticomiméticas. La anfetamina no tuvo uso médico hasta finales de 1933, cuando Smith, Kline y French comenzaron a venderla como inhalador bajo la marca Benzedrine como descongestionante. El sulfato de bencedrina se introdujo 3 años después y se usó para tratar una amplia variedad de afecciones médicas, que incluyen narcolepsia, obesidad, presión arterial baja, libido baja y dolor crónico, entre otras. El efecto beneficioso de la bencedrina en niños con hiperactividad se descubrió por casualidad en 1937 cuando se administró contra un dolor de cabeza por presión intracraneal baja. No mejoró el dolor de cabeza, pero mejoró el rendimiento escolar y el comportamiento de algunos. Durante la Segunda Guerra Mundial, tanto las fuerzas aliadas como las del Eje utilizaron ampliamente anfetamina y metanfetamina por sus efectos estimulantes y de mejora del rendimiento. A medida que se conocieron las propiedades adictivas de la droga, los gobiernos comenzaron a imponer controles estrictos a la venta de anfetamina. Por ejemplo, a principios de la década de 1970 en los Estados Unidos, la anfetamina se convirtió en una sustancia controlada de la lista II en virtud de la Ley de Sustancias Controladas. A pesar de los estrictos controles gubernamentales, la anfetamina ha sido consumida legal o ilícitamente por personas de diversos orígenes, incluidos autores, músicos, matemáticos y atletas.
La anfetamina todavía se sintetiza ilegalmente en laboratorios clandestinos y se vende en el mercado negro, principalmente en países europeos. Entre los estados miembros de la Unión Europea (UE) en 2018, 11,9 millones de adultos de edades 15–64 han consumido anfetamina o metanfetamina al menos una vez en la vida y 1,7 millones han consumido ya sea en el el año pasado. Durante 2012, se incautaron aproximadamente 5,9 toneladas métricas de anfetamina ilícita en los estados miembros de la UE; el "precio de calle" de anfetamina ilícita dentro de la UE osciló entre 6-38 € por gramo durante el mismo período. Fuera de Europa, el mercado ilícito de anfetamina es mucho más pequeño que el mercado de metanfetamina y MDMA.
Estado legal
Como resultado de la Convención de las Naciones Unidas sobre Sustancias Psicotrópicas de 1971, la anfetamina se convirtió en una sustancia controlada de la lista II, tal como se define en el tratado, en los 183 estados parte. En consecuencia, está fuertemente regulado en la mayoría de los países. Algunos países, como Corea del Sur y Japón, han prohibido las anfetaminas sustitutas incluso para uso médico. En otras naciones, como Canadá (droga de la lista I), los Países Bajos (droga de la Lista I), los Estados Unidos (droga de la lista II), Australia (lista 8), Tailandia (droga de la categoría 1) y el Reino Unido (droga de la clase B), la anfetamina se encuentra en una lista nacional de drogas restrictiva que permite su uso como tratamiento médico.
Productos farmacéuticos
Varias formulaciones de anfetaminas comercializadas actualmente contienen ambos enantiómeros, incluidas las comercializadas con las marcas Adderall, Adderall XR, Mydayis, Adzenys ER, Adzenys XR-ODT, Dyanavel XR, Evekeo y Evekeo ODT. De ellos, Evekeo (incluido Evekeo ODT) es el único producto que contiene solo anfetamina racémica (como sulfato de anfetamina) y, por lo tanto, es el único cuyo resto activo puede denominarse con precisión simplemente como "anfetamina". La dextroanfetamina, comercializada bajo las marcas Dexedrine y Zenzedi, es el único producto de anfetamina enantiopura disponible actualmente. Una forma de profármaco de dextroanfetamina, lisdexanfetamina, también está disponible y se comercializa bajo la marca Vyvanse. Como es un profármaco, la lisdexanfetamina es estructuralmente diferente de la dextroanfetamina y está inactiva hasta que se metaboliza en dextroanfetamina. La base libre de anfetamina racémica estaba disponible anteriormente como Benzedrine, Psychedrine y Sympatedrine. La levoanfetamina estaba disponible anteriormente como Cydril. Muchos productos farmacéuticos de anfetamina actuales son sales debido a la volatilidad comparativamente alta de la base libre. Sin embargo, las formas de dosificación de suspensión oral y tabletas de desintegración oral (ODT) compuestas de la base libre se introdujeron en 2015 y 2016, respectivamente. Algunas de las marcas actuales y sus equivalentes genéricos se enumeran a continuación.
| Marca Nombre | Estados Unidos Nombre adoptado | (D:L) ratio | Dosificación forma | Marketing Fecha de inicio | Consumo de EE.UU. datos de precios | Fuentes |
|---|---|---|---|---|---|---|
| Adderall | – | 3:1(saltos) | tableta | 1996 | GoodRx | |
| Adderall XR | – | 3:1(saltos) | cápsula | 2001 | GoodRx | |
| Mydayis | – | 3:1(saltos) | cápsula | 2017 | GoodRx | |
| Adzenys ER | anfetamina | 3:1(base) | suspensión | 2017 | GoodRx | |
| Adzenys XR-ODT | anfetamina | 3:1(base) | ODT | 2016 | GoodRx | |
| Dyanavel XR | anfetamina | 3.2:1(base) | suspensión | 2015 | GoodRx | |
| Evekeo | sulfato de anfetamina | 1:1(saltos) | tableta | 2012 | GoodRx | |
| Evekeo ODT | sulfato de anfetamina | 1:1(saltos) | ODT | 2019 | GoodRx | |
| Dexedrine | dextroamphetamina sulfato | 1:0(saltos) | cápsula | 1976 | GoodRx | |
| Zenzedi | dextroamphetamina sulfato | 1:0(saltos) | tableta | 2013 | GoodRx | |
| Vyvanse | lisdexamfetamina dimesylate | 1:0(prodrug) | cápsula | 2007 | GoodRx | |
| tableta | ||||||
| Xelstrym | dextroamphetamina | 1:0(base) | parche | 2022 | GoodRx |
| drogas | fórmula | masa molar | base de anfetamina | base de anfetamina en dosis iguales | dosis con base igual contenido | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| (g/mol) | (porcentaje) | (30 mg de dosis) | ||||||||
| total | base | total | dextro- | Levo- | dextro- | Levo- | ||||
| dextroamphetamina sulfato | (C)9H13N)2• H2SO4 | 368.49 | 270.41 | 73,38% | 73,38% | — | 22.0 mg | — | 30.0 mg | |
| sulfato de anfetamina | (C)9H13N)2• H2SO4 | 368.49 | 270.41 | 73,38% | 36,69% | 36,69% | 11.0 mg | 11.0 mg | 30.0 mg | |
| Adderall | 62,57% | 47,49% | 15,08% | 14.2 mg | 4.5 mg | 35,2 mg | ||||
| 25% | dextroamphetamina sulfato | (C)9H13N)2• H2SO4 | 368.49 | 270.41 | 73,38% | 73,38% | — | |||
| 25% | sulfato de anfetamina | (C)9H13N)2• H2SO4 | 368.49 | 270.41 | 73,38% | 36,69% | 36,69% | |||
| 25% | dextroamphetamina saccharate | (C)9H13N)2•C6H10O8 | 480.55 | 270.41 | 56,27% | 56,27% | — | |||
| 25% | anfetamina aspartate monohydrate | (C)9H13N)•C4H7NO4• H2O | 286.32 | 135.21 | 47.22% | 23,61% | 23,61% | |||
| lisdexamfetamina dimesylate | C15H25N3O•(CH)4O3S)2 | 455.49 | 135.21 | 29.68% | 29.68% | — | 8,9 mg | — | 74,2 mg | |
| suspensión de la base de anfetamina | C9H13N | 135.21 | 135.21 | 100% | 76,19% | 23,81% | 22,9 mg | 7.1 mg | 22.0 mg | |
Notas de referencia
- ^
- ^
- ^
- ^
- ^
- ^
- ^
- ^
- ^ a b
- ^
- ^
- ^
- ^
- ^ a b
- ^
- ^ a b
- ^
Contenido relacionado
Síndrome de Alicia en el país de las maravillas
Enfermedad de Tay-Sachs
Macropsia