Anestesia general
Los anestésicos generales (o anestésicos, véanse las diferencias ortográficas) a menudo se definen como compuestos que inducen una pérdida de conciencia en humanos o pérdida del reflejo de enderezamiento en animales. Las definiciones clínicas también se amplían para incluir un coma inducido que provoca una falta de conciencia de los estímulos dolorosos, suficiente para facilitar las aplicaciones quirúrgicas en la práctica clínica y veterinaria. Los anestésicos generales no actúan como analgésicos y tampoco deben confundirse con los sedantes. Los anestésicos generales son un grupo estructuralmente diverso de compuestos cuyos mecanismos abarcan múltiples dianas biológicas involucradas en el control de las vías neuronales. El funcionamiento preciso es objeto de cierto debate e investigación en curso.
Los anestésicos generales provocan un estado de anestesia general. Sigue siendo algo controvertido con respecto a cómo se debe definir este estado. Sin embargo, los anestésicos generales suelen provocar varios efectos reversibles clave: inmovilidad, analgesia, amnesia, inconsciencia y respuesta autonómica reducida a los estímulos nocivos.
Modo de administración
Los anestésicos generales se pueden administrar como gases o vapores (anestésicos inhalatorios), o como inyecciones (anestésicos intravenosos o incluso intramusculares). Todos estos agentes comparten la propiedad de ser bastante hidrofóbicos (es decir, como líquidos, no son libremente miscibles o miscibles en agua, y como gases se disuelven en aceites mejor que en agua). Es posible administrar anestesia únicamente por inhalación o inyección, pero lo más común es que las dos formas se combinen, con una inyección para inducir la anestesia y un gas para mantenerla.
Inhalación
Las sustancias anestésicas inhalatorias son líquidos o gases volátiles y, por lo general, se administran mediante una máquina de anestesia. Una máquina de anestesia permite componer una mezcla de oxígeno, anestésicos y aire ambiente, entregándolo al paciente y monitoreando los parámetros del paciente y de la máquina. Los anestésicos líquidos se vaporizan en la máquina.
Se han utilizado muchos compuestos para la anestesia por inhalación, pero solo unos pocos siguen siendo de uso generalizado. El desflurano, el isoflurano y el sevoflurano son los anestésicos volátiles más utilizados en la actualidad. A menudo se combinan con óxido nitroso. Los anestésicos volátiles más antiguos, menos populares, incluyen halotano, enflurano y metoxiflurano. Los investigadores también están explorando activamente el uso de xenón como anestésico.
Inyección
Los anestésicos inyectables se utilizan para la inducción y el mantenimiento de un estado de inconsciencia. Los anestesistas prefieren usar inyecciones intravenosas, ya que son más rápidas, generalmente menos dolorosas y más confiables que las inyecciones intramusculares o subcutáneas. Entre los medicamentos más utilizados se encuentran:
- Propofol
- Etomidate
- Barbituras tales como methohexital y tiopentone/thiopental
- Benzodiazepinas como el midazolam
- La ketamina se utiliza en el Reino Unido como "anaestesia de campo", por ejemplo en incidentes de tráfico por carretera o situaciones similares donde una operación debe realizarse en la escena o cuando no hay tiempo suficiente para trasladarse a un quirófano, mientras que prefiere otras anestesias donde las condiciones permiten su uso. Es más frecuente en el entorno operativo de los Estados Unidos.
Las benzodiazepinas son sedantes y se usan en combinación con otros anestésicos generales
Mecanismo de acción
La inducción y el mantenimiento de la anestesia general y el control de los diversos efectos secundarios fisiológicos generalmente se logran a través de un enfoque de combinación de medicamentos. Los anestésicos generales individuales varían con respecto a sus efectos fisiológicos y cognitivos específicos. Si bien un anestésico general puede facilitar la inducción de la anestesia general, se pueden usar otros en paralelo o posteriormente para lograr y mantener el estado anestésico deseado. El enfoque farmacológico utilizado depende del procedimiento y las necesidades de los proveedores de atención médica.
Se postula que los anestésicos generales ejercen su acción mediante la activación de los receptores inhibidores del sistema nervioso central (SNC) y la inactivación de los receptores excitatorios del SNC. Las funciones relativas de los diferentes receptores todavía están en debate, pero existe evidencia de objetivos particulares que están involucrados con ciertos anestésicos y efectos de fármacos.
A continuación se presentan varios objetivos clave de los anestésicos generales que probablemente medien sus efectos:
Agonistas de los receptores GABAA
- Los receptores GABAA son canales de cloruro que hiperpolarizan las neuronas y funcionan como receptores inhibidores del SNC. Los anestésicos generales que los agonizan se utilizan típicamente para inducir un estado de sedación y/o inconsciencia. Estos fármacos incluyen propofol, etomidato, isoflurana, benzodiazepinas (midazolam, lorazepam, diazepam) y barbituratos (sodium thiopental, methohexital).
Antagónicos de los receptores NMDA
- La ketamina, antagonista del receptor NMDA, se utiliza principalmente para sus efectos analgésicos y en una capacidad fuera de la etiqueta para sus efectos antidepresivos. Este medicamento, sin embargo, también altera la excitación y a menudo se utiliza en paralelo con otras anestesias generales para ayudar a mantener un estado de anestesia general. La administración de la ketamina solo conduce a un estado disociativo, en el que un paciente puede experimentar alucinaciones auditivas y visuales. Además, la percepción del dolor se disocia de la percepción de estímulos nocivos. La ketamina parece unirse preferentemente a los receptores NMDA en interneurones GABAergicos, que pueden explicar parcialmente sus efectos.
Activación de los canales de potasio de dos poros (K2Ps)
- Los canales de potasio de dos polos (K2Ps) modulan la conducta del potasio que contribuye al potencial de membrana de reposo en neuronas. Por lo tanto, la apertura de estos canales facilita una corriente hiperpolarizante, que reduce la excitabilidad neuronal. K2Ps have been found to be affected by general anesthetics (esp. halogenated inhalation anesthetics) and are currently under investigation as potential targets. El K2P canal familia consta de seis subfamilias, que incluye 15 miembros únicos. 13 de estos canales (excluidos los homómeros TWIK-1 y TWIK-2) se ven afectados por anestesia general. Aunque no se ha determinado que la anestesia general se une directamente a estos canales, tampoco está claro cómo estos fármacos afectan a K2P conductance, electrophysiological studies have shown that certain general anesthetics result in K2P activación del canal. Esta activación de canales propulsados por fármacos ha demostrado ser dependiente de aminoácidos específicos dentro de ciertos K2P canales (es decir, canales TREK-1 y TASK). En el caso de TREK-1, la activación se mostró a través de una perturbación anestésica a los racimos lipídicos de membrana y la activación de la fosfolipasa D2; la unión directa de anestesias para purificar TREK-1 reconstituido no tuvo efecto en la conducta. Los efectos de ciertas anestesias generales son menos pronunciados en K2P ratones nocivos, en comparación con sus contrapartes de tipo salvaje. En forma acumulativa, TASK-1, TASK-3 y TREK-1 están especialmente bien apoyados como un papel en la inducción de la anestesia general.
Otros
- Los agonistas de receptores opioides se utilizan principalmente para sus efectos analgésicos. Sin embargo, estos medicamentos también pueden provocar sedación. Este efecto está mediado por acciones opioides tanto en los receptores de opioide como en acetilcolina. Si bien estas drogas pueden conducir a una disminución de la excitación, no provocan una pérdida de conciencia. Por esta razón, a menudo se utilizan en paralelo con otras anestesias generales para ayudar a mantener un estado de anestesia general. Estos medicamentos incluyen morfina, fentanilo, hidromorfonía y remifentanil.
- Administración de la alfa2 adrenergia receptora agonista dexmedetomidina conduce a la sedación que se asemeja al sueño no-REM. Se utiliza en paralelo con otras anestesias generales para ayudar a mantener un estado de anestesia general, en una capacidad fuera de la etiqueta. Notablemente, los pacientes se despiertan fácilmente de este estado de sueño no-REM.
- Los antagonistas del receptor de Dopamina tienen propiedades sedantes y antieméticas. Anteriormente, se utilizaron en paralelo con los opioides para provocar anestesia neuroléptica (catalepsia, analgesia y falta de respuesta). Ya no se utilizan en el contexto, ya que los pacientes que experimentan anestesia neuroléptica eran con frecuencia conscientes de los procedimientos médicos que se estaban realizando, pero no podían moverse ni expresar emoción. Estas drogas incluyen haloperidol y droperidol.
Etapas de la anestesia
Durante la administración de un anestésico, el receptor pasa por diferentes etapas de comportamiento que finalmente conducen a la inconsciencia. Este proceso se acelera con los anestésicos intravenosos, tanto que es despreciable tenerlo en cuenta durante su uso. Las cuatro etapas de la anestesia se describen utilizando los signos de Guedel, que representan la profundidad de la anestesia. Estas etapas describen los efectos de la anestesia principalmente sobre la cognición, la actividad muscular y la respiración.
Etapa I - Analgesia
El receptor de la anestesia siente principalmente analgesia seguida de amnesia y una sensación de confusión al pasar a la siguiente etapa.
Etapa II - Emoción
La etapa II a menudo se caracteriza por el delirio y la confusión del receptor, con amnesia grave. Las irregularidades en los patrones de respiración son comunes en esta etapa de la anestesia. Las náuseas y los vómitos también son indicadores de la anestesia en etapa II. La lucha y el pánico a veces pueden ocurrir como resultado del delirio.
Etapa III - Anestesia quirúrgica
La respiración normal se reanuda al comienzo de la Etapa III. Cerca del final de la etapa, la respiración cesa por completo. Los indicadores de la anestesia en etapa III incluyen la pérdida del reflejo de las pestañas, así como la respiración regular. La profundidad de la anestesia de etapa III a menudo se puede medir por el movimiento de los ojos y el tamaño de la pupila.
Etapa IV - Depresión medular
No se produce respiración en la etapa IV. A esto le sigue poco después insuficiencia circulatoria y depresión de los centros vasomotores. La muerte es común en esta etapa de la anestesia si no se dispone de apoyo respiratorio y circulatorio.
Efectos secundarios fisiológicos
Además de los efectos clínicamente ventajosos de los anestésicos generales, existen otras consecuencias fisiológicas mediadas por esta clase de fármacos. En particular, una variedad de mecanismos puede facilitar una reducción de la presión arterial, incluida la reducción de la contractilidad cardíaca y la dilatación de la vasculatura. Esta caída de la presión arterial puede activar un aumento reflejo de la frecuencia cardíaca, debido a un mecanismo de retroalimentación mediado por barorreceptores. Sin embargo, algunos anestésicos interrumpen este reflejo.
Los pacientes bajo anestesia general tienen un mayor riesgo de desarrollar hipotermia, ya que la vasodilatación antes mencionada aumenta la pérdida de calor a través del flujo sanguíneo periférico. En general, estos fármacos reducen el umbral de temperatura corporal interna en el que se activan los mecanismos termorreguladores autónomos en respuesta al frío. (Por otro lado, el umbral en el que se activan los mecanismos termorreguladores en respuesta al calor suele aumentar).
Los anestésicos generalmente afectan la respiración. Los anestésicos inhalatorios provocan broncodilatación, aumento de la frecuencia respiratoria y reducción del volumen corriente. El efecto neto es una disminución de la respiración, que debe ser manejada por los proveedores de atención médica, mientras el paciente está bajo anestesia general. Los reflejos que funcionan para aliviar las obstrucciones de las vías respiratorias también se amortiguan (por ejemplo, arcadas y tos). Agravado con una reducción en el tono del esfínter esofágico inferior, lo que aumenta la frecuencia de la regurgitación, los pacientes son especialmente propensos a la asfixia mientras están bajo anestesia general. Los proveedores de atención médica controlan de cerca a las personas bajo anestesia general y utilizan una serie de dispositivos, como un tubo endotraqueal, para garantizar la seguridad del paciente.
Los anestésicos generales también afectan la zona desencadenante de quimiorreceptores y el centro de vómitos del tronco encefálico, lo que provoca náuseas y vómitos después del tratamiento.
Farmacocinética
Anestésicos generales intravenosos
Inducción
Los anestésicos generales administrados por vía intravenosa suelen ser moléculas pequeñas y altamente lipófilas. Estas características facilitan su rápida distribución preferencial en el cerebro y la médula espinal, que son altamente vascularizados y lipofílicos. Es aquí donde las acciones de estos fármacos conducen a la inducción de la anestesia general.
Eliminación
Después de la distribución en el sistema nervioso central (SNC), el fármaco anestésico se difunde fuera del SNC hacia los músculos y las vísceras, seguido de los tejidos adiposos. En pacientes que reciben una sola inyección de fármaco, esta redistribución da como resultado la finalización de la anestesia general. Por lo tanto, luego de la administración de un solo bolo anestésico, la duración del efecto del fármaco depende únicamente de la cinética de redistribución.
Sin embargo, la vida media de un fármaco anestésico después de una infusión prolongada depende de la cinética de redistribución del fármaco, el metabolismo del fármaco en el hígado y la concentración existente del fármaco en la grasa. Cuando ya se han disuelto grandes cantidades de un fármaco anestésico en las reservas de grasa del cuerpo, esto puede ralentizar su redistribución fuera del cerebro y la médula espinal, prolongando sus efectos sobre el SNC. Por esta razón, se dice que las vidas medias de estos fármacos infundidos dependen del contexto. En general, las infusiones prolongadas de fármacos anestésicos dan como resultado vidas medias más prolongadas, eliminación más lenta del cerebro y la médula espinal y terminación tardía de la anestesia general.
Anestésicos generales inhalatorios
La concentración alveolar mínima (MAC) es la concentración de un anestésico inhalatorio en los pulmones que evita que el 50 % de los pacientes respondan a la incisión quirúrgica. Este valor se usa para comparar las potencias de varios anestésicos generales inhalatorios y afecta la presión parcial del fármaco que utilizan los proveedores de atención médica durante la inducción y/o el mantenimiento de la anestesia general.
Inducción
La inducción de la anestesia se ve facilitada por la difusión de un fármaco anestésico inhalado en el cerebro y la médula espinal. La difusión por todo el cuerpo continúa hasta que la presión parcial del fármaco dentro de los distintos tejidos es equivalente a la presión parcial del fármaco dentro de los pulmones. Los proveedores de atención médica pueden controlar la tasa de inducción de la anestesia y las concentraciones finales del tejido del anestésico variando la presión parcial del anestésico inspirado. Una presión parcial más alta del fármaco en los pulmones impulsará la difusión más rápidamente por todo el cuerpo y producirá una concentración tisular máxima más alta. La frecuencia respiratoria y el volumen inspiratorio también afectarán la prontitud del inicio de la anestesia, al igual que la extensión del flujo sanguíneo pulmonar.
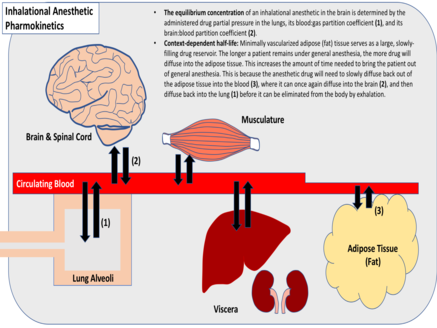
El coeficiente de partición de un fármaco gaseoso es indicativo de su solubilidad relativa en varios tejidos. Esta métrica es la concentración relativa de fármaco entre dos tejidos, cuando sus presiones parciales son iguales (gas:sangre, grasa:sangre, etc.). Los anestésicos inhalatorios varían ampliamente con respecto a sus solubilidades tisulares y coeficientes de reparto. Los anestésicos que son altamente solubles requieren muchas moléculas de fármaco para elevar la presión parcial dentro de un tejido dado, a diferencia de los anestésicos mínimamente solubles que requieren relativamente pocas. Generalmente, los anestésicos inhalatorios que son mínimamente solubles alcanzan el equilibrio más rápidamente. Sin embargo, los anestésicos inhalatorios que tienen un alto coeficiente de partición grasa:sangre alcanzan el equilibrio más lentamente, debido a la mínima vascularización del tejido adiposo, que sirve como un gran reservorio que se llena lentamente para el fármaco.
Eliminación
Los anestésicos inhalados se eliminan mediante la espiración, luego de su difusión a los pulmones. Este proceso depende en gran medida del coeficiente de partición sangre:gas del anestésico, la solubilidad del tejido, el flujo de sangre a los pulmones y la frecuencia respiratoria y el volumen inspiratorio del paciente. Para los gases que tienen una solubilidad tisular mínima, la terminación de la anestesia generalmente ocurre tan rápido como el inicio de la anestesia. Sin embargo, para los gases que tienen una alta solubilidad en los tejidos, la finalización de la anestesia generalmente depende del contexto. Al igual que con las infusiones de anestésicos intravenosos, la administración prolongada de gases anestésicos altamente solubles generalmente da como resultado vidas medias más prolongadas del fármaco, una eliminación más lenta del cerebro y la médula espinal y una finalización tardía de la anestesia.
El metabolismo de los anestésicos inhalados generalmente no es una vía importante de eliminación de fármacos.
Contenido relacionado
Lista de trastornos mentales
Operacion plastica
Ángela Vicente