Aminoácidos
Los aminoácidos son compuestos orgánicos que contienen amino ( −NH+3) y carboxilato −CO−2grupos funcionales, junto con una cadena lateral (grupo R) específica para cada aminoácido. Los elementos presentes en cada aminoácido son carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); además, el azufre (S) está presente en las cadenas laterales de cisteína y metionina, y el selenio (Se) en el aminoácido menos común selenocisteína. Se sabe que más de 500 aminoácidos naturales constituyen unidades monoméricas de péptidos, incluidas las proteínas, a partir de 2020 (aunque solo 20 aparecen en el código genético, además de la selenocisteína, que se codifica de una manera especial).
Los aminoácidos son nombrados formalmente por la Comisión Conjunta de Nomenclatura Bioquímica IUPAC-IUBMB en términos de la estructura "neutra" ficticia que se muestra en la ilustración. Por ejemplo, el nombre sistemático de la alanina es ácido 2-aminopropanoico, basado en la fórmula CH 3 −CH(NH 2 )−COOH. La Comisión justificó este enfoque de la siguiente manera:
Los nombres sistemáticos y las fórmulas dadas se refieren a formas hipotéticas en las que los grupos amino no están protonados y los grupos carboxilo no están disociados. Esta convención es útil para evitar varios problemas de nomenclatura, pero no debe interpretarse como que estas estructuras representan una fracción apreciable de las moléculas de aminoácidos.
Se pueden clasificar según las ubicaciones de los grupos funcionales estructurales centrales, como aminoácidos alfa- (α-), beta- (β-), gamma- (γ-) o delta- (δ-) ; otras categorías se relacionan con la polaridad, la ionización y el tipo de grupo de cadena lateral (alifático, acíclico, aromático, que contiene hidroxilo o azufre, etc.). En forma de proteínas, los residuos de aminoácidos forman el segundo componente más grande (siendo el agua el más grande) de los músculos y otros tejidos humanos. Más allá de su papel como residuos en las proteínas, los aminoácidos participan en varios procesos, como el transporte de neurotransmisores y la biosíntesis.
Historia
Los primeros aminoácidos se descubrieron a principios del siglo XIX. En 1806, los químicos franceses Louis-Nicolas Vauquelin y Pierre Jean Robiquet aislaron un compuesto de los espárragos que posteriormente se denominó asparagina, el primer aminoácido descubierto. La cistina se descubrió en 1810, aunque su monómero, la cisteína, no se descubrió hasta 1884. La glicina y la leucina se descubrieron en 1820. El último de los 20 aminoácidos comunes que se descubrió fue la treonina en 1935 por William Cumming Rose, quien también determinó los aminoácidos esenciales. aminoácidos y estableció los requerimientos mínimos diarios de todos los aminoácidos para un crecimiento óptimo.
La unidad de la categoría química fue reconocida por Wurtz en 1865, pero no le dio un nombre particular. El primer uso del término "aminoácido" en el idioma inglés data de 1898, mientras que el término alemán, Aminosäure, se usó antes. Se descubrió que las proteínas producen aminoácidos después de la digestión enzimática o la hidrólisis ácida. En 1902, Emil Fischer y Franz Hofmeister propusieron de forma independiente que las proteínas se forman a partir de muchos aminoácidos, por lo que se forman enlaces entre el grupo amino de un aminoácido con el grupo carboxilo de otro, lo que da como resultado una estructura lineal que Fischer denominó "péptido".
Estructura general
En la estructura que se muestra en la parte superior de la página, R representa una cadena lateral específica para cada aminoácido. El átomo de carbono próximo al grupo carboxilo se llama carbono α. Los aminoácidos que contienen un grupo amino unido directamente al carbono α se denominan α-aminoácidos. Estos incluyen prolina e hidroxiprolina, que son aminas secundarias. En el pasado, a menudo se les llamaba iminoácidos, un nombre inapropiado porque no contienen una agrupación imina HN=C. El término obsoleto sigue siendo frecuente.
Isomería
Las formas naturales comunes de aminoácidos tienen la estructura −NH+3( −NH+2− en el caso de la prolina) y −CO−2grupos funcionales unidos al mismo átomo de carbono y, por lo tanto, son α-aminoácidos. Con la excepción de la glicina aquiral, los aminoácidos naturales tienen la configuración L y son los únicos que se encuentran en las proteínas durante la traducción en el ribosoma.
La convención L y D para la configuración de aminoácidos no se refiere a la actividad óptica del aminoácido en sí, sino a la actividad óptica del isómero de gliceraldehído a partir del cual, en teoría, se puede sintetizar ese aminoácido ( el D -gliceraldehído es dextrógiro; L -gliceraldehído es levorrotatorio).
Una convención alternativa es usar los designadores ( S ) y ( R ) para especificar la configuración absoluta. Casi todos los aminoácidos en las proteínas están ( S ) en el carbono α, siendo la cisteína ( R ) y la glicina no quirales. La cisteína tiene su cadena lateral en la misma ubicación geométrica que los otros aminoácidos, pero la terminología R / S se invierte porque el azufre tiene un número atómico más alto en comparación con el oxígeno carboxilo, lo que le da a la cadena lateral una prioridad más alta según Cahn-Ingold-Prelog. reglas de secuencia, mientras que los átomos en la mayoría de las otras cadenas laterales les dan menor prioridad en comparación con el grupo carboxilo.
Los residuos de D -aminoácidos se encuentran en algunas proteínas, pero son raros.
Cadenas laterales
Los aminoácidos se designan como α- cuando el átomo de nitrógeno amino está unido al carbono α, el átomo de carbono adyacente al grupo carboxilato.
En todos los casos que se indican a continuación en esta sección, el 

Cadenas laterales alifáticas
Varias cadenas laterales contienen solo H y C, y no se ionizan. Estos son los siguientes (con símbolos de tres y una letra entre paréntesis):
- Glicina (Gly, G): H−
- Alanina (Ala, A): CH 3 −
- Valina (Val, V): (CH 3 ) 2 CH−
- Leucina (Leu, L): (CH 3 ) 2 CHCH 2 −
- Isoleucina (Ile, I): CH 3 CH 2 CH (CH 3 )
- Prolina (Pro, P): −CH 2 CH 2 CH 2 − ciclada sobre la amina
Cadenas laterales neutrales polares
Dos aminoácidos contienen cadenas laterales de alcohol. Estos no se ionizan en condiciones normales, aunque uno, la serina, se desprotona durante la catálisis por las serina proteasas: este es un ejemplo de perturbación severa y no es característico de los residuos de serina en general.
- Serina (Ser, S, no
cuando no está severamente perturbado): HOCH 2 −
- Treonina (Thr, T, no
): CH 3 CHOH−
La treonina tiene dos centros quirales, no solo el centro quiral L (2 S ) en el carbono α compartido por todos los aminoácidos excepto la glicina aquiral, sino también (3 R ) en el carbono β. La especificación estereoquímica completa es L -treonina (2 S,3 R ).
Cadenas laterales de amida
Dos aminoácidos tienen cadenas laterales de amida, de la siguiente manera:
- Asparagina (Asn, N): NH 2 COCH 2 −
- Glutamina (Gln, Q): NH 2 COCH 2 CH 2 −
Estas cadenas laterales no se ionizan en el rango normal de pH.
Cadenas laterales que contienen azufre
Dos cadenas laterales contienen átomos de azufre, de los cuales uno se ioniza en el rango normal (con 
- Cisteína (Cys, C,
) : HSCH2 −
- Metionina (Met, M, no
): CH 3 CH 2 CH 2 −
Cadenas laterales aromáticas
Tres aminoácidos tienen estructuras de anillos aromáticos como cadenas laterales, como se ilustra. De estos, la tirosina se ioniza en el rango normal; los otros dos no).
- Fenilalanina (Phe, F, no
): izquierda en la ilustración
- Tirosina (Tyr, Y,
): medio en la ilustración
- Triptófano (Trp, W, no
): justo en la ilustración
Cadenas laterales aniónicas
Dos aminoácidos tienen cadenas laterales que son aniones a pH normal. Aunque el nombre inapropiado está tan extendido que es imposible de erradicar, no deberían llamarse aminoácidos ácidos, porque actúan como bases de Brønsted en todas las circunstancias excepto en enzimas como la pepsina que actúan en ambientes de pH muy bajo como el estómago de los mamíferos.
- Aspartato ( no "ácido aspártico", Asp, D,
): O 2 CCH 2 −
- Glutamato ( no "ácido glutámico", Glu, E,
): O 2 CCH 2 CH 2 −
Cadenas laterales catiónicas
Hay tres aminoácidos con cadenas laterales que son cationes a pH neutro (aunque en uno existen formas de histidina, catiónica y neutra). Son comúnmente llamados aminoácidos básicos, pero este término es engañoso: la histidina puede actuar como un ácido de Brønsted y como una base de Brønsted a pH neutro, la lisina actúa como un ácido de Brønsted y la arginina tiene una carga positiva fija y no se ioniza en condiciones neutras. Los nombres histidinio, lisinio y argininio serían nombres más precisos para las estructuras, pero esencialmente no tienen vigencia.
- Histidina (His, H,
): Las formas protonadas y desprotonadas en equilibrio se muestran a la izquierda de la imagen
- Lisina (Lys, K,
): se muestra en el medio de la imagen
- Arginina (Arg, R,
12}">): se muestra a la derecha de la imagen
β- y γ-aminoácidos
Aminoácidos con la estructura NH+3−CXY−CXY−CO−2, como la β-alanina, un componente de la carnosina y algunos otros péptidos, son β-aminoácidos. Unos con la estructura NH+3−CXY−CXY−CXY−CO−2son γ-aminoácidos, y así sucesivamente, donde X e Y son dos sustituyentes (uno de los cuales normalmente es H).
Zwitteriones
En solución acuosa, los aminoácidos a pH moderado existen como zwitteriones, es decir, como iones dipolares con NH+3y CO−2en estados cargados, por lo que la estructura general es NH+3−CHR−CO−2. A pH fisiológico, las llamadas "formas neutras" −NH 2 −CHR−CO 2 H no están presentes en ningún grado mensurable. Aunque las dos cargas en la estructura real suman cero, es engañoso y erróneo llamar a una especie con una carga neta de cero "sin carga".
A pH muy bajo (por debajo de 3), el grupo caboxilato se protona y la estructura se convierte en un ácido carboxílico de amonio, NH+3−CHR−CO 2 H. Esto es relevante para enzimas como la pepsina que son activas en ambientes ácidos como el estómago y los lisosomas de los mamíferos, pero no se aplica significativamente a las enzimas intracelulares. A un pH muy alto (superior a 10, que normalmente no se ve en condiciones fisiológicas), el grupo amonio se desprotona para dar NH 2 −CHR−CO−2.
Aunque en química se utilizan varias definiciones de ácidos y bases, la única que es útil para la química en disolución acuosa es la de Brønsted: un ácido es una especie que puede donar un protón a otra especie, y una base es aquella que puede aceptar un protón Este criterio se utiliza para etiquetar los grupos en la ilustración anterior. Tenga en cuenta que el aspartato y el glutamato son los grupos principales que actúan como bases de Brønsted, y las referencias comunes a estos como aminoácidos ácidos (junto con el terminal C) son completamente erróneas y engañosas. Asimismo, los llamados aminoácidos básicosincluyen una (histidina) que actúa tanto como un ácido de Brønsted como una base, una (lisina) que actúa principalmente como un ácido de Brønsted y otra (arginina) que normalmente es irrelevante para el comportamiento ácido-base ya que tiene una carga positiva fija. Además, la tirosina y la cisteína, que actúan principalmente como ácidos a pH neutro, suelen quedar olvidadas en la clasificación habitual.
Punto isoeléctrico
Para los aminoácidos con cadenas laterales sin carga, el zwitterión predomina a valores de pH entre los dos valores de pKa, pero coexiste en equilibrio con pequeñas cantidades de iones netos negativos y netos positivos. En el punto medio entre los dos valores de p K a, la cantidad de trazas de iones negativos netos y trazas de iones positivos netos se equilibran, de modo que la carga neta promedio de todas las formas presentes es cero. Este pH se conoce como punto isoeléctrico p I, por lo que p I =1/2( pKa1 + pKa2 ). _
Para los aminoácidos con cadenas laterales cargadas, está involucrada la p K a de la cadena lateral. Por lo tanto, para el aspartato o el glutamato con cadenas laterales negativas, el grupo amino terminal está esencialmente en su totalidad en la forma cargada NH+3, pero esta carga positiva debe equilibrarse con el estado con solo un grupo carboxilato C-terminal con carga negativa. Esto ocurre a mitad de camino entre los dos valores de carboxilato p K a : p I =1/2(p K a1 + p K a (R) ), donde p K a (R) es la cadena lateral p K a.
Se aplican consideraciones similares a otros aminoácidos con cadenas laterales ionizables, incluidos no solo el glutamato (similar al aspartato), sino también la cisteína, la histidina, la lisina, la tirosina y la arginina con cadenas laterales positivas.
Los aminoácidos tienen movilidad cero en la electroforesis en su punto isoeléctrico, aunque este comportamiento suele explotarse más para péptidos y proteínas que para aminoácidos individuales. Los zwitteriones tienen una solubilidad mínima en su punto isoeléctrico y algunos aminoácidos (en particular, con cadenas laterales no polares) pueden aislarse por precipitación del agua ajustando el pH al punto isoeléctrico requerido.
Propiedades fisicoquímicas de los aminoácidos.
La CA. Se pueden clasificar 20 aminoácidos canónicos según sus propiedades. Los factores importantes son la carga, la hidrofilia o la hidrofobicidad, el tamaño y los grupos funcionales.Estas propiedades influyen en la estructura de la proteína y en las interacciones proteína-proteína. Las proteínas solubles en agua tienden a tener sus residuos hidrofóbicos (Leu, Ile, Val, Phe y Trp) enterrados en el medio de la proteína, mientras que las cadenas laterales hidrofílicas están expuestas al solvente acuoso. (Tenga en cuenta que en bioquímica, un residuo se refiere a un monómero específico dentro de la cadena polimérica de un polisacárido, proteína o ácido nucleico). Las proteínas integrales de la membrana tienden a tener anillos externos de aminoácidos hidrofóbicos expuestos que los anclan en la bicapa lipídica. Algunas proteínas de membrana periférica tienen un parche de aminoácidos hidrofóbicos en su superficie que se adhiere a la membrana. De manera similar, las proteínas que tienen que unirse a moléculas cargadas positivamente tienen superficies ricas en aminoácidos cargados negativamente como el glutamato y el aspartato. mientras que las proteínas que se unen a moléculas cargadas negativamente tienen superficies ricas en cadenas cargadas positivamente como la lisina y la arginina. Por ejemplo, la lisina y la arginina están muy enriquecidas en regiones de baja complejidad de proteínas de unión a ácidos nucleicos.Hay varias escalas de hidrofobicidad de residuos de aminoácidos.
Algunos aminoácidos tienen propiedades especiales, como la cisteína, que puede formar enlaces disulfuro covalentes con otros residuos de cisteína, la prolina, que forma un ciclo con el esqueleto del polipéptido, y la glicina, que es más flexible que otros aminoácidos.
Además, la glicina y la prolina están muy enriquecidas en las regiones de baja complejidad de las proteínas eucarióticas y procarióticas, mientras que se ha observado lo contrario (infrarrepresentado) para los aminoácidos altamente reactivos, complejos o hidrófobos, como la cisteína, la fenilalanina, el triptófano y la metionina., valina, leucina, isoleucina.
Muchas proteínas sufren una variedad de modificaciones postraduccionales, mediante las cuales se unen grupos químicos adicionales a las cadenas laterales de aminoácidos. Algunas modificaciones pueden producir lipoproteínas hidrofóbicas o glicoproteínas hidrofílicas. Este tipo de modificación permite el direccionamiento reversible de una proteína a una membrana. Por ejemplo, la adición y eliminación del ácido graso palmítico a los residuos de cisteína en algunas proteínas de señalización hace que las proteínas se adhieran y luego se separen de las membranas celulares.
Tabla de abreviaturas y propiedades de aminoácidos estándar
Aunque los símbolos de una letra se incluyen en la tabla, IUPAC-IUBMB recomiendan que "el uso de los símbolos de una letra se limite a la comparación de secuencias largas".
| Aminoácidos | Símbolos de 3 y 1 letra | Cadena lateral | Índice de hidropatía | Absortividad molar | Masa molecular | Abundancia en proteínas (%) | Codificación genética estándar, notación IUPAC | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 3 | 1 | Clase | Polaridad | Carga neta a pH 7,4 | Longitud de onda, λ máx. (nm) | Coeficiente ε (mM ·cm ) | |||||
| alanina | ala | UN | alifático | no polar | Neutral | 1.8 | 89.094 | 8.76 | GCN | ||
| Arginina | Argentina | R | catión fijo | polar basico | Positivo | −4,5 | 174.203 | 5.78 | Gerente General, CGY | ||
| asparagina | como | norte | Amida | Polar | Neutral | −3,5 | 132.119 | 3.93 | AAY | ||
| aspartato | Áspid | D | Anión | Base de Bronsted | Negativo | −3,5 | 133.104 | 5.49 | GAY | ||
| cisteína | Cis | C | tiol | Ácido de Bronsted | Neutral | 2.5 | 250 | 0.3 | 121.154 | 1.38 | UGY |
| glutamina | gln | q | Amida | Polar | Neutral | −3,5 | 146.146 | 3.9 | COCHE | ||
| Glutamato | Glú | mi | Anión | Base de Bronsted | Negativo | −3,5 | 147.131 | 6.32 | GAR | ||
| Glicina | gly | GRAMO | alifático | no polar | Neutral | −0,4 | 75.067 | 7.03 | GGN | ||
| histidina | Su | H | catión aromático | Ácido y base de Brønsted | Positivo, 10% Neutro, 90% | −3,2 | 211 | 5.9 | 155.156 | 2.26 | ISLA PEQUEÑA |
| isoleucina | isla | yo | alifático | no polar | Neutral | 4.5 | 131.175 | 5.49 | AUH | ||
| leucina | Leu | L | alifático | no polar | Neutral | 3.8 | 131.175 | 9.68 | TU, CUY | ||
| Lisina | Lys | k | Catión | Ácido de Bronsted | Positivo | −3,9 | 146.189 | 5.19 | AAR | ||
| metionina | Reunió | METRO | tioéter | no polar | Neutral | 1.9 | 149.208 | 2.32 | AGO | ||
| Fenilalanina | fe | F | Aromático | no polar | Neutral | 2.8 | 257, 206, 188 | 0,2, 9,3, 60,0 | 165.192 | 3.87 | UUY |
| prolina | Pro | PAG | Cíclico | no polar | Neutral | −1,6 | 115.132 | 5.02 | CCN | ||
| serina | Ser | S | hidroxilico | Polar | Neutral | −0,8 | 105.093 | 7.14 | UCN, AGY | ||
| treonina | Thr | T | hidroxilico | Polar | Neutral | −0,7 | 119.119 | 5.53 | ACN | ||
| triptófano | TRP | W | Aromático | no polar | Neutral | −0,9 | 280, 219 | 5,6, 47,0 | 204.228 | 1.25 | UGG |
| tirosina | Tyr | Y | Aromático | Ácido de Bronsted | Neutral | −1,3 | 274, 222, 193 | 1,4, 8,0, 48,0 | 181.191 | 2.91 | UAY |
| Valina | valle | V | alifático | no polar | Neutral | 4.2 | 117.148 | 6.73 | PISTOLA |
En algunas especies, dos aminoácidos adicionales están codificados por codones que generalmente se interpretan como codones de parada:
| 21 y 22 aminoácidos | 3 letras | 1 letra | Masa molecular |
|---|---|---|---|
| selenocisteína | Segundo | tu | 168.064 |
| pirrolisina | pil | O | 255.313 |
Además de los códigos de aminoácidos específicos, los marcadores de posición se utilizan en los casos en que el análisis químico o cristalográfico de un péptido o proteína no puede determinar de manera concluyente la identidad de un residuo. También se utilizan para resumir motivos de secuencias de proteínas conservadas. El uso de letras individuales para indicar conjuntos de residuos similares es similar al uso de códigos de abreviaturas para bases degeneradas.
| Aminoácidos ambiguos | 3 letras | 1 letra | Aminoácidos incluidos | Codones incluidos |
|---|---|---|---|---|
| Cualquiera / desconocido | Xaa | X | Todos | NNN |
| Asparagina o ácido aspártico | Asx | B | D, N | RAYO |
| Glutamina o ácido glutámico | Glx | Z | mi, q | RAE |
| Leucina o isoleucina | Xle | j | ILLINOIS | YTR, ATH, CTY |
| Hidrofóbico | Φ | V, I, L, F, W, Y, M | NTN, TAY, TGG | |
| Aromático | Ω | F, W, Y, H | YWY, TTY, TGG | |
| Alifático (no aromático) | Ψ | V, yo, L, M | VTN, TTR | |
| Pequeña | π | P, G, A, S | BCN, RGY, GGR | |
| hidrófilo | ζ | S, T, H, N, Q, E, D, K, R | FURGONETA, WCN, CGN, AGY | |
| Cargado positivamente | + | k, r, h | ARR, LLORAR, CGR | |
| Cargado negativamente | − | D, E | GAN |
Unk se usa a veces en lugar de Xaa, pero es menos estándar.
Ter o * (de la terminación) se usa en notación para mutaciones en proteínas cuando ocurre un codón de parada. No corresponde a ningún aminoácido en absoluto.
Además, muchos aminoácidos no estándar tienen un código específico. Por ejemplo, varios fármacos peptídicos, como Bortezomib y MG132, se sintetizan artificialmente y conservan sus grupos protectores, que tienen códigos específicos. Bortezomib es Pyz–Phe–boroLeu y MG132 es Z–Leu–Leu–Leu–al. Para ayudar en el análisis de la estructura de la proteína, hay disponibles análogos de aminoácidos fotorreactivos. Estos incluyen fotoleucina ( pLeu ) y fotometionina ( pMet ).
Ocurrencia y funciones en bioquímica.
Los aminoácidos que tienen el grupo amina unido al átomo de carbono (alfa) junto al grupo carboxilo tienen una importancia particular. Se conocen como 2-, alfa- o α-aminoácidos (fórmula genérica H 2 NCHRCOOH en la mayoría de los casos, donde R es un sustituyente orgánico conocido como "cadena lateral"); a menudo, el término "aminoácido" se usa para referirse específicamente a estos. Incluyen los 22 aminoácidos proteinogénicos ("constructores de proteínas"), que se combinan en cadenas peptídicas ("polipéptidos") para formar los componentes básicos de una amplia gama de proteínas. Todos estos son estereoisómeros L (enantiómeros "zurdos"), aunque algunos D-aminoácidos ("diestros") se encuentran en envolturas bacterianas, como neuromodulador ( D -serina), y en algunos antibióticos.
Muchos aminoácidos proteinogénicos y no proteinogénicos tienen funciones biológicas. Por ejemplo, en el cerebro humano, el glutamato (ácido glutámico estándar) y el ácido gamma-aminobutírico ("GABA", gamma-aminoácido no estándar) son, respectivamente, los principales neurotransmisores excitadores e inhibidores. La hidroxiprolina, un componente principal del colágeno del tejido conjuntivo, se sintetiza a partir de la prolina. La glicina es un precursor biosintético de las porfirinas utilizadas en los glóbulos rojos. La carnitina se utiliza en el transporte de lípidos. Nueve aminoácidos proteinogénicos se denominan "esenciales" para los humanos porque el cuerpo humano no puede producirlos a partir de otros compuestos y, por lo tanto, deben ingerirse como alimento. Otros pueden ser condicionalmente esenciales para ciertas edades o condiciones médicas. Los aminoácidos esenciales también pueden variar de una especie a otra.Debido a su importancia biológica, los aminoácidos son importantes en la nutrición y se usan comúnmente en suplementos nutricionales, fertilizantes, piensos y tecnología alimentaria. Los usos industriales incluyen la producción de medicamentos, plásticos biodegradables y catalizadores quirales.
Aminoácidos proteinogénicos
Los aminoácidos son los precursores de las proteínas. Se unen por reacciones de condensación para formar cadenas poliméricas cortas llamadas péptidos o cadenas más largas llamadas polipéptidos o proteínas. Estas cadenas son lineales y no ramificadas, con cada residuo de aminoácido dentro de la cadena unido a dos aminoácidos vecinos. En la naturaleza, el proceso de hacer proteínas codificadas por material genético de ADN/ARN se llama traducción e implica la adición paso a paso de aminoácidos a una cadena de proteína en crecimiento por medio de una ribozima llamada ribosoma. El orden en que se agregan los aminoácidos se lee a través del código genético de una plantilla de ARNm, que es una copia de ARN de uno de los genes del organismo.
Veintidós aminoácidos se incorporan de forma natural a los polipéptidos y se denominan aminoácidos proteinogénicos o naturales. De estos, 20 están codificados por el código genético universal. Los 2 restantes, la selenocisteína y la pirrolisina, se incorporan a las proteínas mediante mecanismos sintéticos únicos. La selenocisteína se incorpora cuando el ARNm que se traduce incluye un elemento SECIS, lo que hace que el codón UGA codifique selenocisteína en lugar de un codón de terminación. La pirrolisina es utilizada por algunas arqueas metanogénicas en enzimas que utilizan para producir metano. Se codifica con el codón UAG, que normalmente es un codón de parada en otros organismos. Este codón UAG va seguido de una secuencia descendente de PYLIS.
Varios estudios evolutivos independientes han sugerido que Gly, Ala, Asp, Val, Ser, Pro, Glu, Leu, Thr pueden pertenecer a un grupo de aminoácidos que constituyeron el código genético primitivo, mientras que Cys, Met, Tyr, Trp, His, Phe puede pertenecer a un grupo de aminoácidos que constituyeron adiciones posteriores del código genético.
Aminoácidos estándar vs no estándar
Los 20 aminoácidos que están codificados directamente por los codones del código genético universal se denominan aminoácidos estándar o canónicos. A menudo se incorpora una forma modificada de metionina ( N -formilmetionina) en lugar de metionina como el aminoácido inicial de proteínas en bacterias, mitocondrias y cloroplastos. Otros aminoácidos se denominan no estándar o no canónicos. La mayoría de los aminoácidos no estándar tampoco son proteinogénicos (es decir, no pueden incorporarse a las proteínas durante la traducción), pero dos de ellos son proteinogénicos, ya que pueden incorporarse traduccionalmente a las proteínas mediante la explotación de información no codificada en el código genético universal.
Los dos aminoácidos proteinogénicos no estándar son la selenocisteína (presente en muchos no eucariotas así como en la mayoría de los eucariotas, pero no codificados directamente por el ADN) y la pirrolisina (que se encuentra solo en algunas arqueas y al menos una bacteria). La incorporación de estos aminoácidos no estándar es rara. Por ejemplo, 25 proteínas humanas incluyen selenocisteína en su estructura primaria, y las enzimas caracterizadas estructuralmente (selenoenzimas) emplean selenocisteína como resto catalítico en sus sitios activos. La pirrolisina y la selenocisteína se codifican a través de codones variantes. Por ejemplo, la selenocisteína está codificada por el codón de parada y el elemento SECIS.
La N -formilmetionina (que a menudo es el aminoácido inicial de las proteínas en bacterias, mitocondrias y cloroplastos) generalmente se considera una forma de metionina en lugar de un aminoácido proteinogénico separado. Las combinaciones de codón-ARNt que no se encuentran en la naturaleza también se pueden usar para "expandir" el código genético y formar nuevas proteínas conocidas como aloproteínas que incorporan aminoácidos no proteinogénicos.
Aminoácidos no proteinogénicos
Además de los 22 aminoácidos proteinogénicos, se conocen muchos aminoácidos no proteinogénicos. Estos no se encuentran en las proteínas (por ejemplo, carnitina, GABA, levotiroxina) o no se producen directamente y de forma aislada por la maquinaria celular estándar (por ejemplo, hidroxiprolina y selenometionina).
Los aminoácidos no proteinogénicos que se encuentran en las proteínas se forman por modificación postraduccional, que es la modificación después de la traducción durante la síntesis de proteínas. Estas modificaciones suelen ser esenciales para la función o regulación de una proteína. Por ejemplo, la carboxilación del glutamato permite una mejor unión de los cationes de calcio y el colágeno contiene hidroxiprolina, generada por la hidroxilación de la prolina. Otro ejemplo es la formación de hipusina en el factor de iniciación de la traducción EIF5A, mediante la modificación de un residuo de lisina. Dichas modificaciones también pueden determinar la localización de la proteína, por ejemplo, la adición de grupos hidrofóbicos largos puede hacer que una proteína se una a una membrana de fosfolípidos.
Algunos aminoácidos no proteinogénicos no se encuentran en las proteínas. Los ejemplos incluyen ácido 2-aminoisobutírico y el neurotransmisor ácido gamma-aminobutírico. Los aminoácidos no proteinogénicos a menudo se presentan como intermediarios en las vías metabólicas de los aminoácidos estándar; por ejemplo, la ornitina y la citrulina se encuentran en el ciclo de la urea, parte del catabolismo de los aminoácidos (ver más abajo). Una rara excepción al predominio de los α-aminoácidos en biología es el β-aminoácido beta alanina (ácido 3-aminopropanoico), que se utiliza en plantas y microorganismos en la síntesis de ácido pantoténico (vitamina B 5 ), un componente de coenzima a
En nutrición humana
Cuando el cuerpo humano los incorpora a través de la dieta, los 20 aminoácidos estándar se utilizan para sintetizar proteínas, otras biomoléculas o se oxidan a urea y dióxido de carbono como fuente de energía. La vía de oxidación comienza con la eliminación del grupo amino por una transaminasa; el grupo amino luego se alimenta al ciclo de la urea. El otro producto de la transamidación es un cetoácido que entra en el ciclo del ácido cítrico. Los aminoácidos glucogénicos también se pueden convertir en glucosa a través de la gluconeogénesis. De los 20 aminoácidos estándar, nueve (His, Ile, Leu, Lys, Met, Phe, Thr, Trp y Val) se denominan aminoácidos esenciales porque el cuerpo humano no puede sintetizarlos a partir de otros compuestos en el nivel necesario para el crecimiento normal. por lo que deben obtenerse de los alimentos.Además, la cisteína, la tirosina y la arginina se consideran aminoácidos semiesenciales y la taurina un ácido aminosulfónico semiesencial en niños. Las rutas metabólicas que sintetizan estos monómeros no están completamente desarrolladas. Las cantidades requeridas también dependen de la edad y la salud del individuo, por lo que es difícil hacer afirmaciones generales sobre el requerimiento dietético de algunos aminoácidos. La exposición dietética al aminoácido no estándar BMAA se ha relacionado con enfermedades neurodegenerativas humanas, incluida la ELA.

Diagrama de las cascadas de señalización molecular que intervienen en la síntesis de proteínas musculares miofibrilares y la biogénesis mitocondrial en respuesta al ejercicio físico y aminoácidos específicos o sus derivados (principalmente
L - leucina y HMB). Muchos aminoácidos derivados de proteínas alimentarias promueven la activación de mTORC1 y aumentan la síntesis de proteínas mediante la señalización a través de Rag GTPasas.
showAbreviaturas y representaciones:

El entrenamiento de resistencia estimula la síntesis de proteínas musculares (MPS) durante un período de hasta 48 horas después del ejercicio (se muestra con una línea de puntos más clara). La ingestión de una comida rica en proteínas en cualquier momento durante este período aumentará el aumento inducido por el ejercicio en la síntesis de proteínas musculares (mostrado con líneas continuas).
Funciones no proteicas
En los seres humanos, los aminoácidos no proteicos también tienen funciones importantes como intermediarios metabólicos, como en la biosíntesis del neurotransmisor ácido gamma-aminobutírico (GABA). Muchos aminoácidos se utilizan para sintetizar otras moléculas, por ejemplo:
- El triptófano es un precursor del neurotransmisor serotonina.
- La tirosina (y su precursor, la fenilalanina) son precursores de los neurotransmisores de catecolaminas dopamina, epinefrina y norepinefrina y varias trazas de aminas.
- La fenilalanina es un precursor de la fenetilamina y la tirosina en humanos. En las plantas, es un precursor de varios fenilpropanoides, que son importantes en el metabolismo de las plantas.
- La glicina es un precursor de las porfirinas como el hemo.
- La arginina es un precursor del óxido nítrico.
- La ornitina y la S -adenosilmetionina son precursores de las poliaminas.
- El aspartato, la glicina y la glutamina son precursores de los nucleótidos. Sin embargo, no se conocen todas las funciones de otros aminoácidos no estándar abundantes.
Algunos aminoácidos no estándar se utilizan como defensas contra los herbívoros en las plantas. Por ejemplo, la canavanina es un análogo de la arginina que se encuentra en muchas legumbres, y en cantidades particularmente grandes en Canavalia gladiata (frijol espada). Este aminoácido protege a las plantas de depredadores como los insectos y puede causar enfermedades en las personas si se comen algunos tipos de legumbres sin procesar. El aminoácido no proteico mimosina se encuentra en otras especies de leguminosas, en particular Leucaena leucocephala. Este compuesto es un análogo de la tirosina y puede envenenar a los animales que pastan en estas plantas.
Usos en la industria
Los aminoácidos se utilizan para una variedad de aplicaciones en la industria, pero su uso principal es como aditivos para la alimentación animal. Esto es necesario, ya que muchos de los componentes a granel de estos alimentos, como la soja, tienen niveles bajos o carecen de algunos de los aminoácidos esenciales: lisina, metionina, treonina y triptófano son los más importantes en la producción de estos alimentos. En esta industria, los aminoácidos también se utilizan para quelar cationes metálicos con el fin de mejorar la absorción de minerales de los suplementos, que pueden ser necesarios para mejorar la salud o la productividad de estos animales.
La industria alimentaria también es un importante consumidor de aminoácidos, en particular, ácido glutámico, que se utiliza como potenciador del sabor, y aspartamo (aspartilfenilalanina 1-metil éster) como edulcorante artificial bajo en calorías. En la industria de la nutrición humana se emplea una tecnología similar a la utilizada para la nutrición animal para aliviar los síntomas de las deficiencias de minerales, como la anemia, al mejorar la absorción de minerales y reducir los efectos secundarios negativos de la suplementación con minerales inorgánicos.
La capacidad quelante de los aminoácidos se ha utilizado en fertilizantes para la agricultura para facilitar la entrega de minerales a las plantas con el fin de corregir las deficiencias de minerales, como la clorosis férrica. Estos fertilizantes también se utilizan para evitar que se produzcan carencias y para mejorar la salud general de las plantas. La producción restante de aminoácidos se utiliza en la síntesis de fármacos y cosméticos.
De manera similar, algunos derivados de aminoácidos se utilizan en la industria farmacéutica. Incluyen 5-HTP (5-hidroxitriptófano) que se usa para el tratamiento experimental de la depresión, L -DOPA ( L -dihidroxifenilalanina ) para el tratamiento del Parkinson y el fármaco eflornitina que inhibe la ornitina descarboxilasa y se usa en el tratamiento de la enfermedad del sueño.
Código genético expandido
Desde 2001, se han agregado 40 aminoácidos no naturales a la proteína mediante la creación de un codón único (recodificación) y un correspondiente par de ARN de transferencia: aminoacil – ARNt-sintetasa para codificarlo con diversas propiedades fisicoquímicas y biológicas para poder usarlo como una herramienta para explorar la estructura y la función de las proteínas o para crear proteínas nuevas o mejoradas.
Nullómeros
Los nullómeros son codones que, en teoría, codifican un aminoácido; sin embargo, en la naturaleza existe un sesgo selectivo contra el uso de este codón en favor de otro, por ejemplo, las bacterias prefieren usar CGA en lugar de AGA para codificar la arginina. Esto crea algunas secuencias que no aparecen en el genoma. Esta característica se puede aprovechar y utilizar para crear nuevos fármacos selectivos para combatir el cáncer y para evitar la contaminación cruzada de las muestras de ADN de las investigaciones en la escena del crimen.
Bloques de construcción químicos
Los aminoácidos son importantes como materias primas de bajo costo. Estos compuestos se utilizan en la síntesis de grupos quirales como bloques de construcción enantioméricamente puros.
Los aminoácidos se han investigado como precursores de catalizadores quirales, como para reacciones de hidrogenación asimétrica, aunque no existen aplicaciones comerciales.
Plásticos biodegradables
Los aminoácidos han sido considerados como componentes de polímeros biodegradables, que tienen aplicaciones como empaques amigables con el medio ambiente y en medicina en la administración de fármacos y la construcción de implantes protésicos. Un ejemplo interesante de tales materiales es el poliaspartato, un polímero biodegradable soluble en agua que puede tener aplicaciones en pañales desechables y agricultura. Debido a su solubilidad y capacidad para quelar iones metálicos, el poliaspartato también se utiliza como agente antiincrustante biodegradable e inhibidor de la corrosión. Además, el aminoácido aromático tirosina se ha considerado como un posible sustituto de fenoles como el bisfenol A en la fabricación de policarbonatos.
Síntesis
Síntesis química
La producción comercial de aminoácidos generalmente se basa en bacterias mutantes que producen en exceso aminoácidos individuales utilizando glucosa como fuente de carbono. Algunos aminoácidos se producen mediante conversiones enzimáticas de intermediarios sintéticos. El ácido 2-aminotiazolina-4-carboxílico es un intermedio en una síntesis industrial de L -cisteína, por ejemplo. El ácido aspártico se produce mediante la adición de amoníaco al fumarato utilizando una liasa.
Biosíntesis
En las plantas, el nitrógeno se asimila primero en compuestos orgánicos en forma de glutamato, formado a partir de alfa-cetoglutarato y amoníaco en la mitocondria. Para otros aminoácidos, las plantas usan transaminasas para mover el grupo amino del glutamato a otro alfa-cetoácido. Por ejemplo, la aspartato aminotransferasa convierte el glutamato y el oxaloacetato en alfa-cetoglutarato y aspartato. Otros organismos también usan transaminasas para la síntesis de aminoácidos.
Los aminoácidos no estándar generalmente se forman a través de modificaciones en los aminoácidos estándar. Por ejemplo, la homocisteína se forma a través de la vía de transsulfuración o por la desmetilación de la metionina a través del metabolito intermedio S -adenosilmetionina, mientras que la hidroxiprolina se produce mediante una modificación postraduccional de la prolina.
Los microorganismos y las plantas sintetizan muchos aminoácidos poco comunes. Por ejemplo, algunos microbios producen ácido 2-aminoisobutírico y lantionina, que es un derivado de la alanina con puente de sulfuro. Ambos aminoácidos se encuentran en lantibióticos peptídicos como la alameticina. Sin embargo, en las plantas, el ácido 1-aminociclopropano-1-carboxílico es un pequeño aminoácido cíclico disustituido que es un intermediario en la producción de la hormona vegetal etileno.
Reacciones
Los aminoácidos experimentan las reacciones esperadas de los grupos funcionales constituyentes.
Formación de enlaces peptídicos
Como tanto los grupos de amina como de ácido carboxílico de los aminoácidos pueden reaccionar para formar enlaces amida, una molécula de aminoácido puede reaccionar con otra y unirse a través de un enlace amida. Esta polimerización de aminoácidos es lo que crea las proteínas. Esta reacción de condensación produce el enlace peptídico recién formado y una molécula de agua. En las células, esta reacción no ocurre directamente; en cambio, el aminoácido se activa primero mediante la unión a una molécula de ARN de transferencia a través de un enlace éster. Este aminoacil-tRNA se produce en una reacción dependiente de ATP llevada a cabo por una aminoacil tRNA sintetasa. Este aminoacil-tRNA es entonces un sustrato para el ribosoma, que cataliza el ataque del grupo amino de la cadena de proteína que se alarga en el enlace éster.Como resultado de este mecanismo, todas las proteínas producidas por los ribosomas se sintetizan comenzando en su extremo N y avanzando hacia su extremo C.
Sin embargo, no todos los enlaces peptídicos se forman de esta manera. En unos pocos casos, los péptidos son sintetizados por enzimas específicas. Por ejemplo, el tripéptido glutatión es una parte esencial de las defensas de las células contra el estrés oxidativo. Este péptido se sintetiza en dos pasos a partir de aminoácidos libres. En el primer paso, la gamma-glutamilcisteína sintetasa condensa la cisteína y el ácido glutámico a través de un enlace peptídico formado entre el carboxilo de la cadena lateral del glutamato (el carbono gamma de esta cadena lateral) y el grupo amino de la cisteína. Este dipéptido luego se condensa con glicina por la glutatión sintetasa para formar glutatión.
En química, los péptidos se sintetizan mediante una variedad de reacciones. Uno de los más utilizados en la síntesis de péptidos en fase sólida utiliza los derivados de oxima aromática de los aminoácidos como unidades activadas. Estos se añaden en secuencia a la cadena peptídica en crecimiento, que se une a un soporte de resina sólida. Las bibliotecas de péptidos se utilizan en el descubrimiento de fármacos a través de la detección de alto rendimiento.
La combinación de grupos funcionales permite que los aminoácidos sean ligandos polidentados efectivos para quelatos de aminoácidos y metales. Las múltiples cadenas laterales de aminoácidos también pueden sufrir reacciones químicas.
Catabolismo
La degradación de un aminoácido a menudo implica desaminación al mover su grupo amino a alfa-cetoglutarato, formando glutamato. Este proceso involucra transaminasas, a menudo las mismas que se usan en la aminación durante la síntesis. En muchos vertebrados, el grupo amino se elimina a través del ciclo de la urea y se excreta en forma de urea. Sin embargo, la degradación de aminoácidos puede producir ácido úrico o amoníaco en su lugar. Por ejemplo, la serina deshidratasa convierte la serina en piruvato y amoníaco. Después de eliminar uno o más grupos amino, el resto de la molécula a veces se puede usar para sintetizar nuevos aminoácidos, o se puede usar para obtener energía al ingresar a la glucólisis o al ciclo del ácido cítrico, como se detalla en la imagen de la derecha.
Complejización
Los aminoácidos son ligandos bidentados que forman complejos de aminoácidos de metales de transición.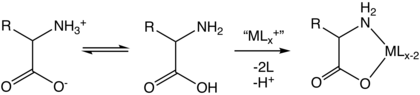
Análisis químico
El contenido total de nitrógeno de la materia orgánica está formado principalmente por los grupos amino de las proteínas. El nitrógeno total Kjeldahl (TKN) es una medida de nitrógeno ampliamente utilizada en el análisis de aguas (residuales), suelos, alimentos, piensos y materia orgánica en general. Como su nombre indica, se aplica el método Kjeldahl. Hay métodos más sensibles disponibles.
Contenido relacionado
Técnico de emergencias médicas
Campaña de salud
Salud sexual y reproductiva