Alfa-2-Macroglobulina
α2-Macroglobulina (α2M) o alfa-2-macroglobulina es una proteína plasmática de gran tamaño (720 KDa) que se encuentra en la sangre. Es producido principalmente por el hígado y también sintetizado localmente por macrófagos, fibroblastos y células suprarrenocorticales. En los humanos está codificado por el gen A2M.
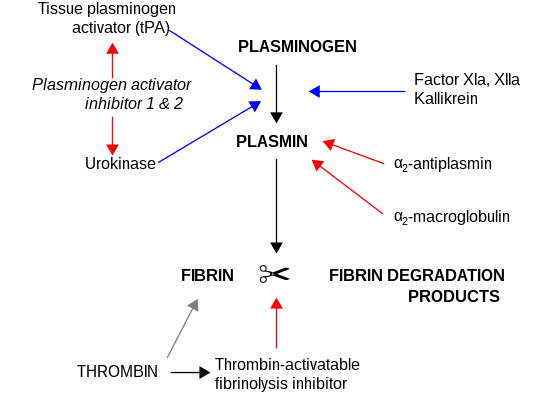
Laα2-Macroglobulina actúa como antiproteasa y es capaz de inactivar una enorme variedad de proteinasas. Funciona como inhibidor de la fibrinólisis al inhibir la plasmina y la calicreína. Funciona como inhibidor de la coagulación al inhibir la trombina. La α2-macroglobulina puede actuar como proteína transportadora porque también se une a numerosos factores de crecimiento y citocinas, como el factor de crecimiento derivado de plaquetas, el factor de crecimiento básico de fibroblastos, TGF-β, insulina e IL- 1β.
No se ha reconocido ninguna deficiencia específica con enfermedad asociada, y ningún estado patológico se atribuye a bajas concentraciones de α2-macroglobulina. La concentración de α2-macroglobulina aumenta 10 veces o más en el síndrome nefrótico cuando otras proteínas de menor peso molecular se pierden en la orina. Su gran tamaño evita la pérdida de α2-macroglobulina en la orina. El resultado neto es que la α2-macroglobulina alcanza niveles séricos iguales o superiores a los de la albúmina en el síndrome nefrótico, lo que tiene el efecto de mantener la presión oncótica.
Estructura
La α2-macroglobulina humana está compuesta por cuatro subunidades idénticas unidas por enlaces -S-S-. Además de las formas tetraméricas de α2-macroglobulina, se han identificado inhibidores de la proteasa αM diméricos y, más recientemente, monoméricos.
Cada monómero de la α2-macroglobulina humana está compuesto por varios dominios funcionales, incluidos dominios de macroglobulina, un dominio que contiene éster de tiol y un dominio de unión al receptor. En general, la α2-macroglobulina es la proteína no inmunoglobulina más grande del plasma humano.
Se ha demostrado que la secuencia de aminoácidos de la α2-macroglobulina es un 71% igual a la de la proteína de la zona del embarazo (PZP; también conocida como α2< asociada al embarazo). /sub>-glicoproteína).
Función
La familia de proteínas α-macroglobulina (αM) incluye inhibidores de proteasa, tipificados por la α2-macroglobulina tetramérica humana (α2M); pertenecen a la familia I39 de inhibidores de la proteinasa MEROPS, clan IL. Estos inhibidores de proteasas comparten varias propiedades definitorias, que incluyen (1) la capacidad de inhibir proteasas de todas las clases catalíticas, (2) la presencia de una 'región cebo' (también conocida como secuencia de aminoácidos en una molécula de α2-macroglobulina, o una proteína homóloga, que contiene enlaces peptídicos escindibles para aquellas proteinasas que inhibe) y un éster de tiol, (3) un mecanismo inhibidor de proteasa similar y (4) la inactivación de la capacidad inhibidora por reacción del tioéster con pequeñas aminas primarias. Los inhibidores de la proteasa αM inhiben por impedimento estérico. El mecanismo implica la escisión por proteasa de la región cebo, un segmento de αM que es particularmente susceptible a la escisión proteolítica, que inicia un cambio conformacional tal que la αM colapsa alrededor de la proteasa. En el complejo αM-proteasa resultante, el sitio activo de la proteasa está estéricamente protegido, disminuyendo así sustancialmente el acceso a los sustratos proteicos. Se producen dos eventos adicionales como consecuencia de la escisión de la región del cebo, a saber, (1) el éster de h-cisteinil-g-glutamil tiol se vuelve altamente reactivo y (2) un cambio conformacional importante expone un dominio de unión al receptor COOH-terminal (RBD) conservado. La exposición a RBD permite que el complejo de proteasa αM se una a los receptores de eliminación y se elimine de la circulación. Se han identificado inhibidores de la proteasa αM tetraméricos, diméricos y, más recientemente, monoméricos.
Laα2-macroglobulina es capaz de inactivar una enorme variedad de proteinasas (incluidas serina, cisteína, aspártico y metaloproteinasas). Funciona como inhibidor de la fibrinólisis al inhibir la plasmina y la calicreína. Funciona como inhibidor de la coagulación al inhibir la trombina. La α2-Macroglobulina tiene en su estructura un "cebo" región. Las proteinasas que se unen y escinden la región del cebo quedan unidas a α2M. El complejo proteinasa-α2M es reconocido por los receptores de macrófagos y eliminado del sistema.
α2-macroglobulina se une al zinc, así como al cobre en el plasma, incluso con más fuerza que la albúmina, por lo que también se la conoce como transcupreína. Del 10 al 15% del cobre en el plasma humano está quelado por α2-macroglobulina.
Enfermedad
Los niveles deα2-macroglobulina aumentan cuando los niveles de albúmina sérica son bajos, lo que se observa con mayor frecuencia en el síndrome nefrótico, una afección en la que los riñones comienzan a filtrar algunas de las proteínas sanguíneas más pequeñas. Debido a su tamaño, la α2-macroglobulina se retiene en el torrente sanguíneo. El aumento de la producción de todas las proteínas significa que aumenta la concentración de α2-macroglobulina. Este aumento tiene pocos efectos adversos sobre la salud pero se utiliza como pista de diagnóstico.
Un aumento de α2-macroglobulina con una cantidad normal de albúmina indica principalmente inflamación aguda y/o crónica.
Una variante común (29,5%) (polimorfismo) de la α2-macroglobulina aumenta el riesgo de padecer la enfermedad de Alzheimer.
Laα2-macroglobulina se une a las formas activas de la gelatinasa (MMP-2 y MMP-9) y las elimina de la circulación a través de receptores eliminadores de los fagocitos.