Aldehído
En química orgánica, un aldehído es un compuesto orgánico que contiene un grupo funcional con la estructura R−CH=O. El propio grupo funcional (es decir, sin la cadena lateral "R") se conoce como grupo aldehído o formilo. Los aldehídos son comunes y juegan un papel importante en la tecnología y las esferas biológicas.
Estructura y unión
Los aldehídos presentan un centro de carbono que está conectado por un enlace doble al oxígeno y un enlace simple al hidrógeno y un enlace simple a un tercer sustituyente, que es el carbono o, en el caso del formaldehído, el hidrógeno. El carbono central a menudo se describe como hibridado sp. El grupo aldehído es algo polar. La longitud del enlace C=O es de unos 120-122 picómetros.
Propiedades físicas y caracterización
Los aldehídos tienen propiedades diversas y que dependen del resto de la molécula. Los aldehídos más pequeños son más solubles en agua, formaldehído y acetaldehído completamente. Los aldehídos volátiles tienen olores acre.
Los aldehídos se pueden identificar por métodos espectroscópicos. Usando espectroscopía IR, muestran una fuerte banda de ν CO cerca de 1700 cm. En sus espectros de H NMR, el centro de hidrógeno de formilo absorbe cerca de δ H 9,5 a 10, que es una parte distintiva del espectro. Esta señal muestra el acoplamiento característico a cualquier protón en el carbono α con una pequeña constante de acoplamiento típicamente menor a 3,0 Hz. Los espectros C NMR de aldehídos y cetonas dan una señal suprimida (débil) pero distintiva en δ C 190 a 205.
Aplicaciones y ocurrencia
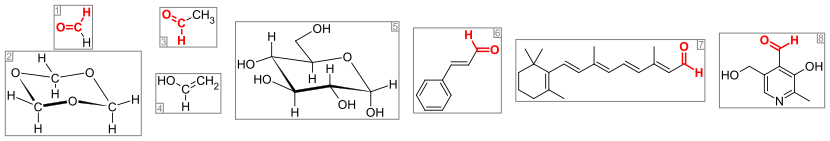
Aldehídos importantes y compuestos relacionados. El grupo aldehído (o grupo formilo) es de color rojo. Desde la izquierda: (1) formaldehído y (2) su trímero 1,3,5-trioxano, (3) acetaldehído y (4) su alcohol vinílico enol, (5) glucosa (forma de piranosa como α- d -glucopiranosa), (6) el saborizante cinamaldehído, (7) el pigmento visual retinal y (8) la vitamina piridoxal.
Aldehídos naturales
Se encuentran rastros de muchos aldehídos en los aceites esenciales y, a menudo, contribuyen a sus olores favorables, por ejemplo, cinamaldehído, cilantro y vainillina. Posiblemente debido a la alta reactividad del grupo formilo, los aldehídos no son comunes en varios de los componentes básicos naturales: aminoácidos, ácidos nucleicos, lípidos. Sin embargo, la mayoría de los azúcares son derivados de aldehídos. Estas aldosas existen como hemiacetales, una especie de forma enmascarada del aldehído original. Por ejemplo, en una solución acuosa solo existe una pequeña fracción de glucosa como aldehído.
Síntesis
Existen varios métodos para preparar aldehídos, pero la tecnología dominante es la hidroformilación. Es ilustrativa la generación de butiraldehído por hidroformilación de propeno:H 2 + CO + CH 3 CH=CH 2 → CH 3 CH 2 CH 2 CHO
Rutas oxidativas
Los aldehídos se generan comúnmente por oxidación del alcohol. En la industria, el formaldehído se produce a gran escala por oxidación del metanol. El oxígeno es el reactivo de elección, siendo "verde" y barato. En el laboratorio, se utilizan agentes oxidantes más especializados, pero los reactivos de cromo (VI) son populares. La oxidación se puede lograr calentando el alcohol con una solución acidificada de dicromato de potasio. En este caso, el exceso de dicromato oxidará aún más el aldehído a un ácido carboxílico, por lo que el aldehído se elimina por destilación a medida que se forma (si es volátil) o se utilizan reactivos más suaves como PCC.[O] + CH 3 (CH 2) 9 OH → CH 3 (CH 2) 8 CHO + H 2 O
La oxidación de alcoholes primarios para formar aldehídos se puede lograr en condiciones más suaves, sin cromo, empleando métodos o reactivos como el ácido IBX, el peryodinano de Dess-Martin, la oxidación de Swern, TEMPO o la oxidación de Oppenauer.
Otra ruta de oxidación importante en la industria es el proceso Wacker, mediante el cual el etileno se oxida a acetaldehído en presencia de catalizadores de cobre y paladio (el acetaldehído también se produce a gran escala por la hidratación del acetileno).
A escala de laboratorio, los α-hidroxiácidos se utilizan como precursores para preparar aldehídos mediante escisión oxidativa.
Métodos de especialidad
| Nombre de la reacción | Sustrato | Comentario |
|---|---|---|
| Ozonólisis | alquenos | La ozonólisis de alquenos no totalmente sustituidos produce aldehídos tras un tratamiento reductor. |
| reducción orgánica | ésteres | Reducción de un éster con hidruro de diisobutilaluminio (DIBAL-H) o hidruro de sodio y aluminio. |
| Reacción de Rosenmund | Cloruros de acilo | Cloruros de acilo reducidos selectivamente a aldehídos. El hidruro de tri - t -butoxialuminio de litio (LiAlH(O Bu) 3) es un reactivo eficaz. |
| Reacción de Wittig | cetonas | Una reacción de Wittig modificada usando metoximetilentrifenilfosfina como reactivo. |
| Reacciones de formilación | arenos nucleófilos | Varias reacciones, por ejemplo, la reacción de Vilsmeier-Haack. |
| Reacción de Nef | Compuestos nitro | La hidrólisis ácida de un compuesto nitro primario para formar un aldehído. |
| Oxidación de Kornblum | haloalcanos | La oxidación de un haluro primario con sulfóxido de dimetilo para formar un aldehído. |
| reacción de zincke | piridinas | Aldehídos de zincke formados en una variación de reacción. |
| Síntesis de aldehído de Stephen | Nitrilos | Hidrólisis de una sal de iminio generada por cloruro de estaño (II) y HCl para formar un aldehído. |
| hidrólisis de haluro geminal | dihaluros geminales | Hidrólisis de dihaluros geminales primarios para producir aldehídos. |
| Síntesis de Meyers | Oxazinas | Hidrólisis de oxazina hemiaminal con agua y ácido oxálico para producir un aldehído. |
| Variación del reordenamiento de Hofmann | amidas insaturadas o α-hidroxi | Aldehídos a través de la hidrólisis de un carbamato intermedio. |
| Reacción de McFadyen-Stevens | hidrazidas | Descomposición térmica catalizada por bases de acilsulfonilhidrazidas. |
| Biotransformación | alquenos | Cultivos celulares liofilizados de Trametes hirsuta en presencia de oxígeno. |
Reacciones comunes
Los aldehídos participan en muchas reacciones. Desde la perspectiva industrial, las reacciones importantes son (a) condensaciones, por ejemplo, para preparar plastificantes y polioles, y (b) reducción para producir alcoholes, especialmente "oxo-alcoholes". Desde la perspectiva biológica, las reacciones clave implican la adición de nucleófilos al carbono formilo en la formación de iminas (desaminación oxidativa) y hemiacetales (estructuras de azúcares de aldosa).
Reacciones ácido-base
Debido a la estabilización por resonancia de la base conjugada, un hidrógeno α en un aldehído es débilmente ácido, con un ap K a cercano a 17. Esta acidificación se atribuye a (i) la capacidad de extracción de electrones del centro de formilo y (ii) el hecho de que que la base conjugada, un anión enolato, deslocaliza su carga negativa. El propio protón formilo no se desprotona fácilmente.
Enolización
Los aldehídos (excepto aquellos sin un carbono alfa, o sin protones en el carbono alfa, como el formaldehído y el benzaldehído) pueden existir en el tautómero ceto o enol. El tautomerismo ceto-enol es catalizado por ácidos o bases. Por lo general, el enol es el tautómero minoritario, pero es más reactivo. La enolización normalmente se invierte varias veces por segundo.
Reducción
El grupo formilo se puede reducir fácilmente a un alcohol primario (-CH 2 OH). Normalmente, esta conversión se logra mediante hidrogenación catalítica, ya sea directamente o mediante hidrogenación por transferencia. Las reducciones estequiométricas también son populares, ya que pueden efectuarse con borohidruro de sodio.
Oxidación
El grupo formilo se oxida fácilmente al grupo carboxilo correspondiente (−COOH). El oxidante preferido en la industria es el oxígeno o el aire. En el laboratorio, los agentes oxidantes populares incluyen permanganato de potasio, ácido nítrico, óxido de cromo (VI) y ácido crómico. La combinación de dióxido de manganeso, cianuro, ácido acético y metanol convertirá el aldehído en un éster metílico.
Otra reacción de oxidación es la base de la prueba del espejo de plata. En esta prueba, un aldehído se trata con el reactivo de Tollens, que se prepara agregando una gota de solución de hidróxido de sodio a una solución de nitrato de plata para dar un precipitado de óxido de plata (I), y luego agregando suficiente solución de amoníaco diluido para volver a disolver el precipitar en amoníaco acuoso para producir el complejo [Ag(NH 3) 2 ]. Este reactivo convierte los aldehídos en ácidos carboxílicos sin atacar los dobles enlaces carbono-carbono. El nombre de prueba del espejo de plata surge porque esta reacción produce un precipitado de plata, cuya presencia puede usarse para probar la presencia de un aldehído.
Otra reacción de oxidación implica el reactivo de Fehling como prueba. Los iones complejos de Cu se reducen a un precipitado de Cu 2 O de color rojo ladrillo.
Si el aldehído no puede formar un enolato (p. ej., benzaldehído), la adición de una base fuerte induce la reacción de Cannizzaro. Esta reacción da como resultado una desproporción, produciendo una mezcla de alcohol y ácido carboxílico.
Reacciones de adición nucleófila
Los nucleófilos se agregan fácilmente al grupo carbonilo. En el producto, el carbono del carbonilo se hibridiza sp, se une al nucleófilo y el centro de oxígeno se protona:RCHO + Nu → RCH(Nu)ORCH(Nu)O + H → RCH(Nu)OH
En muchos casos, se elimina una molécula de agua después de la adición; en este caso, la reacción se clasifica como una reacción de adición-eliminación o adición-condensación. Hay muchas variaciones de las reacciones de adición nucleófila.
Nucleófilos de oxígeno
En la reacción de acetalización, en condiciones ácidas o básicas, se añade un alcohol al grupo carbonilo y se transfiere un protón para formar un hemiacetal. En condiciones ácidas, el hemiacetal y el alcohol pueden reaccionar para formar un acetal y agua. Los hemiacetales simples suelen ser inestables, aunque los cíclicos como la glucosa pueden ser estables. Los acetales son estables, pero vuelven al aldehído en presencia de ácido. Los aldehídos pueden reaccionar con el agua para formar hidratos, R−CH(OH) 2. Estos dioles son estables cuando están presentes fuertes grupos atractores de electrones, como en el hidrato de cloral. El mecanismo de formación es idéntico a la formación de hemiacetal.
Nucleófilos de nitrógeno
En la alquilimino-des-oxo-bisustitución, se agrega una amina primaria o secundaria al grupo carbonilo y se transfiere un protón del nitrógeno al átomo de oxígeno para crear una carbinolamina. En el caso de una amina primaria, se puede eliminar una molécula de agua del intermedio de carbinolamina para producir una imina o su trímero, una hexahidrotriazina. Esta reacción es catalizada por ácido. La hidroxilamina (NH 2 OH) también se puede agregar al grupo carbonilo. Después de la eliminación del agua, esto da como resultado una oxima. Un derivado de amoníaco de la forma H 2 NNR 2 como la hidracina (H 2 NNH 2) o 2,4-dinitrofenilhidrazina también pueden ser el nucleófilo y después de la eliminación del agua, dando lugar a la formación de una hidrazona, que suelen ser sólidos cristalinos de color naranja. Esta reacción forma la base de una prueba para aldehídos y cetonas.
Nucleófilos de carbono
El grupo ciano en HCN puede agregarse al grupo carbonilo para formar cianohidrinas, R−CH(OH)CN. En esta reacción el ion CN es el nucleófilo que ataca al átomo de carbono parcialmente positivo del grupo carbonilo. El mecanismo involucra un par de electrones del doble enlace del grupo carbonilo que se transfieren al átomo de oxígeno, dejándolo unido al carbono y dando al átomo de oxígeno una carga negativa. Este ion intermedio reacciona rápidamente con H, como el de la molécula HCN, para formar el grupo alcohol de la cianohidrina.
Los compuestos organometálicos, como los reactivos de organolitio, los reactivos de Grignard o los acetiluros, experimentan reacciones de adición nucleófila, lo que produce un grupo alcohólico sustituido. Las reacciones relacionadas incluyen adiciones de organoestananos, reacciones de Barbier y la reacción de Nozaki-Hiyama-Kishi.
En la reacción aldólica, los enolatos metálicos de cetonas, ésteres, amidas y ácidos carboxílicos se suman a los aldehídos para formar compuestos β-hidroxicarbonílicos (aldoles). La deshidratación catalizada por ácidos o bases conduce entonces a compuestos de carbonilo α,β-insaturados. La combinación de estos dos pasos se conoce como condensación aldólica.
La reacción de Prins ocurre cuando un alqueno o alquino nucleófilo reacciona con un aldehído como electrófilo. El producto de la reacción de Prins varía según las condiciones de reacción y los sustratos empleados.
Reacción de bisulfito
Los aldehídos forman característicamente "compuestos de adición" con bisulfito de sodio:RCHO + HSO3→ RCH(OH)SO3
Esta reacción se utiliza como prueba para aldehídos.
Reacciones más complejas
| Nombre de la reacción | Producto | Comentario |
|---|---|---|
| reducción de Wolff-Kishner | alcano | Si un aldehído se convierte en una hidrazona simple (RCH=NHNH 2) y se calienta con una base como KOH, el carbono terminal se reduce por completo a un grupo metilo. La reacción de Wolff-Kishner se puede realizar como una reacción de un solo recipiente, dando la conversión general RCH=O → RCH 3. |
| Reacción de acoplamiento de Pinacol | diol | Con agentes reductores como el magnesio |
| Reacción de Wittig | alqueno | Reactivo: un iluro |
| reacción de takai | alqueno | reactivo de diorganocromo |
| Reacciones de Corey-Fuchs | alquino | Reactivo de fosfina-dibromometileno |
| Reacción de Ohira-Bestmann | alquino | Reactivo: (diazometil)fosfonato de dimetilo |
| Reacción de Johnson-Corey-Chaykovsky | Epóxido | Reactivo: un iluro de sulfonio |
| Reacción Oxo-Diels-Alder | pirano | Los aldehídos pueden, típicamente en presencia de catalizadores adecuados, servir como socios en las reacciones de cicloadición. El aldehído sirve como componente dienófilo, dando un pirano o un compuesto relacionado. |
| hidroacilación | cetona | En la hidroacilación, se agrega un aldehído sobre un enlace insaturado para formar una cetona. |
| descarbonilación | alcano | Catalizada por metales de transición |
Dialdehídos
Un dialdehído es un compuesto químico orgánico con dos grupos aldehído. La nomenclatura de los dialdehídos tiene la terminación -dial o, a veces , -dialdehído. Los dialdehídos alifáticos cortos a veces reciben el nombre del diácido del que se derivan. Un ejemplo es el butanodial, que también se llama succinaldehído (del ácido succínico).
Bioquímica
Algunos aldehídos son sustratos de las enzimas aldehído deshidrogenasa que metabolizan los aldehídos en el cuerpo. Hay toxicidades asociadas con algunos aldehídos que están relacionados con enfermedades neurodegenerativas, enfermedades del corazón y algunos tipos de cáncer.
Contenido relacionado
Biodiésel
Grupo de la tabla periódica
Asparagina