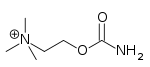
Agonista nicotínico
Un agonista nicotínico es un fármaco que imita la acción de la acetilcolina (ACh) en los receptores nicotínicos de acetilcolina (nAChR). El nAChR recibe su nombre por su afinidad por la nicotina.
Entre los ejemplos se incluyen la nicotina (por definición), la acetilcolina (el agonista endógeno de los nAChR), la colina, la epibatidina, la lobelina, la vareniclina y la citisina.
Historia

La nicotina es conocida desde hace siglos por su efecto intoxicante. Los químicos alemanes Posselt y Reimann la aislaron por primera vez en 1828 de la planta del tabaco.
El descubrimiento de los efectos positivos de la nicotina sobre la memoria animal fue realizado por investigaciones in vivo a mediados de los años 80. Esas investigaciones condujeron a una nueva era en los estudios del receptor nicotínico de acetilcolina (nAChR) y su estimulación, pero hasta entonces el enfoque se había centrado principalmente en la adicción a la nicotina. El desarrollo de agonistas de nAChR comenzó a principios de los años 90 después del descubrimiento de los efectos positivos de la nicotina. Algunas investigaciones mostraron una posible opción terapéutica en investigaciones preclínicas. ABT-418 fue uno de los primeros de una serie de agonistas de nAChR y fue diseñado por Abbott Labs. ABT-418 mostró un aumento significativo del rendimiento de coincidencia retardada con la muestra (DMTS) en monos macacos maduros de diferentes especies y sexos. ABT-418 también se ha examinado como un posible tratamiento para la enfermedad de Alzheimer, la enfermedad de Parkinson y el trastorno por déficit de atención con hiperactividad: esos experimentos mostraron resultados positivos.
Uno de los primeros compuestos activos del nAChR, además de la nicotina, que se comercializó como fármaco fue la galantamina, un alcaloide vegetal que funciona como un inhibidor débil de la colinesterasa (IC50 = 5 μM) así como un sensibilizador alostérico para los nAChR (EC50 = 50 nM).
Receptores acetilcolina nicotínicos y su sistema de señalización

Sistema de señalización
En el sistema nervioso humano, las señales colinérgicas nicotínicas se extienden por todo el sistema, donde el neurotransmisor acetilcolina (ACh) desempeña un papel clave en la activación de los canales iónicos controlados por ligando. El sistema colinérgico es una vía nerviosa vital, donde las neuronas colinérgicas sintetizan, almacenan y liberan el neurotransmisor ACh. Los principales receptores que convierten los mensajes de ACh son los receptores colinérgicos muscarínicos de acetilcolina, los nAChR neuronales y musculares. Si nos remontamos a la historia evolutiva, se considera que la ACh es la molécula transmisora más antigua y se hizo presente antes que la célula nerviosa. En el sistema nervioso, la estimulación colinérgica mediada por los nAChR controla vías como la liberación de transmisores y la sensibilidad celular, que pueden influir en la actividad fisiológica, incluido el sueño, la ansiedad, el procesamiento del dolor y las funciones cognitivas.
Receptores acetilcolina nicotínicos
Sitio de enlace
Existen dos sitios de unión en los nAChR heteroméricos; para estabilizar la forma abierta de los nAChR, ambos sitios de unión deben estar ocupados por un agonista, como la nicotina o la ACh.
El sitio de unión de la ACh del nAChR está formado por seis bucles, denominados A–F. Los bucles A, B y C del sitio de unión forman parte de la subunidad α y son los componentes principales del sitio de unión. La subunidad adyacente a la subunidad α (γ, δ, ε o β) contiene los bucles D, E y F.
Mecanismo de acción

Agonistas del receptor A4β2
Los α4β2 nAChR contienen dos subunidades α4 y tres subunidades β2, por lo que tienen dos sitios de unión para la ACh y otros agonistas. Los α4β2 nAChR representan aproximadamente el 90% de los nAChR en el cerebro humano y cuando se exponen crónicamente a la nicotina u otros agonistas de la nicotina conducen a un aumento en la densidad de los receptores α4β2, que es lo opuesto de lo que suele suceder cuando otros receptores están expuestos crónicamente a sus agonistas. El receptor α4β2 ha sido ampliamente estudiado en relación con la enfermedad de Alzheimer, así como para la dependencia de la nicotina y en 2009 hay varios medicamentos en el mercado que se dirigen específicamente al α4β2 nAChR.
Agonistas de receptores A7
Los receptores α7 son receptores neuronales homoméricos de acetilcolina que constan de cinco subunidades α7 y tienen cinco sitios de unión de ACh. Se ha informado que la expresión anormal de los receptores α7 influye en la progresión de enfermedades como la enfermedad de Alzheimer y la esquizofrenia. No se cree que los α7 tengan tanta afinidad por la nicotina como el receptor heteromérico, pero en cambio han mostrado más afinidad por la alfa bungarotoxina, que es un antagonista nicotínico que se encuentra en el veneno de algunas serpientes. Por lo tanto, se cree que la focalización de los receptores α7 es útil en el tratamiento de la enfermedad de Alzheimer y la esquizofrenia.
Agonistas del tipo muscular
Los nAChR se encuentran en la unión neuromuscular de los músculos esqueléticos. Se han encontrado dos receptores diferentes, uno de los cuales se ha encontrado principalmente en adultos y contiene dos subunidades α1, una β1, una ε y una δ, el otro se ha encontrado en fetos y contiene la subunidad γ en lugar de la subunidad ε. Los nAChR participan en la despolarización de la placa terminal muscular al aumentar la permeabilidad a los cationes, lo que conduce a la contracción de los músculos esqueléticos. Los nAChR que se encuentran en el sistema muscular esquelético tienen dos sitios de unión de ACh, uno de los cuales se encuentra en la interfaz entre las subunidades α1 y δ, mientras que el otro se encuentra en la interfaz entre las subunidades α1 y γ o ε. Entre los antagonistas de los nAChR diseñados específicamente para el sistema neuromuscular se encuentran los gases nerviosos y otros venenos diseñados para matar rápidamente a humanos u otros animales e insectos.
Binding
La ACh se une al nAChR debido a la diferencia de carga entre la molécula y la superficie del receptor. Cuando se une al nAChR, la ACh encaja en un bolsillo de unión formado por los bucles A, B y C que pertenecen a la subunidad α y la subunidad adyacente. Cuando la ACh se encaja en el bolsillo de unión, los bucles del nAChR experimentan un movimiento que conduce a una coordinación de la molécula de ACh en el bolsillo, mejorando los enlaces químicos entre la molécula y el receptor. Después del movimiento de los bucles que pertenecen a la subunidad α, a veces es posible que la molécula de ACh forme un enlace, por ejemplo, un puente salino, con la subunidad adyacente, mejorando aún más los enlaces entre el receptor y la ACh.
Diseño de drogas
Los fármacos que influyen en los nAChR son típicamente agonistas, agonistas parciales o antagonistas. Sin embargo, algunos agonistas de nAChR, como la nicotina, actúan como agentes despolarizantes de una manera dependiente del tiempo (segundos o minutos) en relación con la concentración y el subtipo de nAChR. La exposición crónica a algunos agonistas puede conducir a una desactivación funcional duradera resultante de una desensibilización rápida y persistente. Los agonistas parciales de nAChR se han investigado como posibles agentes para dejar de fumar; se cree que se unen a los nAChR y estimulan la liberación de dopamina en dosis más pequeñas que las alcanzadas por los agonistas completos, y en ausencia de nicotina.
La falta de especificidad entre algunos agonistas nicotínicos -o agonistas inespecíficos- está bien documentada como un factor de confusión para el tratamiento de enfermedades que requieren selectividad para subtipos específicos de nAChR. Se ha demostrado que muchos agonistas no específicos -como la ACh, la nicotina y la epibatidina- actúan sobre más de un subtipo.
Pharmacophore

El desarrollo del farmacóforo, un agonista del receptor nAChR, en 1970 sugirió que su actividad de unión al receptor dependía de la presencia de un átomo de nitrógeno con carga positiva y de la capacidad de formar puentes de hidrógeno conferida por un grupo carbonilo o nitro, es decir, el oxígeno del carbonilo en la acetilcolina o el nitrógeno en la (S)-nicotina. Investigaciones recientes han dilucidado los elementos estructurales y estereoquímicos responsables de la capacidad de unión y la potencia del farmacóforo; la presencia de un centro catiónico y átomos electronegativos capaces de formar puentes de hidrógeno con el centro del anillo de piridina en la (S)-nicotina confieren una mayor afinidad de unión, mientras que el enantiómero (S) es entre 10 y 100 veces más potente que su confórmero (R).
El anillo azabicíclico de la epibatidina también ofrece interacciones estéricas favorables con el receptor nAChR, debido a su distancia específica entre nitrógeno, N+-N, que se ha propuesto como un factor significativo para la afinidad del agonista, sin embargo, persiste cierto debate sobre su influencia. Las teorías contemporáneas sugieren que una diferencia de 7-8 Å entre los puntos que complementan el átomo de nitrógeno protonado y el aceptor de enlaces de hidrógeno podría mejorar la potencia. La baja densidad electrónica cerca del nitrógeno protonado y la mayor densidad electrónica hacia el anillo de piridina son favorables en los ligandos de nicotina protonados que contienen un anillo de piridina.
Las investigaciones recientes se han centrado en los subtipos de receptores α7 y α4β2 para el desarrollo de fármacos destinados a tratar la dependencia de la nicotina y el deterioro cognitivo, como la enfermedad de Alzheimer.
Relaciones estructura-actividad
Relaciones estructura-actividad: Muscle nAChR agonistas
Se han utilizado varios modelos para probar la afinidad de los agonistas del nAChR por los subtipos de receptores mediante la identificación de las moléculas y sus estructuras (es decir, grupos constituyentes y conformación estérica) que confieren mayor afinidad. Al utilizar un modelo para el subtipo de receptor muscular nAChR (α1)2β1δγ, se obtuvieron los siguientes resultados:
- anatoxin не epibatidine не acetylcholine не DMPP нели cytisine √≥ntel не nicotine не coniine tubocurare Lobeline,
donde la anatoxina tuvo la mayor eficacia de actividad y el tubocurare la menor. En contraste, la acetilcolina indujo un tiempo de apertura del receptor mucho más largo, sin embargo, la anatoxina resultó más potente. Estos resultados sugieren que los derivados de la anatoxina podrían mejorar la comprensión de las relaciones estructura-actividad (SAR) para los nAChR musculares.
El cloruro de succinilcolina, un fármaco que ya se encuentra en el mercado, es un éster de bischolina y un relajante muscular de acción corta. Los ésteres de bischolina son compuestos que pueden actuar como agonistas competitivos de los nAChR de tipo muscular y se han utilizado en estudios de SAR. En un modelo de nAChR Torpedo (α1)2β1δγ se demostró que la potencia de los agonistas de ésteres de bischolina depende de la longitud de la cadena, ya que la potencia aumenta con cadenas más largas. La eficacia parece ser independiente de la longitud de la cadena, ya que la eficacia más alta se observa en ésteres de bischolina con cuatro a siete unidades de CH2 y es menor tanto para menos unidades de CH
2 como para más.
Relación estructura-actividad: agonistas α4β2 nAChR

La combinación de los elementos estructurales de la acetilcolina y la nicotina, reduciendo así la flexibilidad conformacional con un anillo de ciclopropano, ha llevado al descubrimiento de ligandos de nAChR α4β2 potentes y selectivos. La modulación de tres elementos estructurales (el ligador y la sustitución del grupo amino o del anillo de piridina) se puede utilizar para determinar la influencia de los ligandos en la potencia y la selectividad.
Los factores que inhiben la unión incluyen el impedimento estérico dentro del grupo amino y/o los enlaces de cadena carbonada saturados/insaturados, de ahí la preferencia por los enlaces de éter de cadena corta. A menudo se logra una mayor afinidad de unión si el anillo de piridina está mono o disustituido con halógenos. La sustitución en el grupo amino con tres amidas diferentes aumentó la unión; donde la metilamida tuvo la mayor, otras amidas sustituidas mostraron una disminución en la afinidad de unión debido al impedimento estérico y/o la ausencia de un grupo metilo, lo que resultó en la pérdida de interactividad hidrofóbica. La estereoquímica del nitrógeno de piridina y/o el anillo de piridina, como efectos estereoelectrónicos, muestran efectos positivos, aunque sutiles, en la unión al α4β2 nAChR. Un ligando de éter de piridilo con una piridina sustituida con bromo y un grupo amino sustituido con amida metilada exhibió la mayor potencia.
Relaciones estructura-actividad: agonistas α7 nAChR


La búsqueda de agonistas selectivos y potentes del receptor α7-nAChR ha producido una serie de posibles fármacos candidatos; por ejemplo, SEN12333/WAY-317538 y otros compuestos con perfiles farmacocinéticos deseables, para los que se han propuesto relaciones estructura-actividad, muestran selectividad por los receptores α7-nAChR (en comparación con los receptores α1, α3 y α4β2-nAChR).
El farmacóforo óptimo del agonista del receptor α7 nAChR comprende una fracción básica unida a través de una cadena de carbono unida a través de un puente amida a una fracción aromática. El puente amida se puede invertir sin afectar la potencia del agonista. Los grupos biarilo muestran mayor potencia que los grupos monoarilo debido a la presencia de una fracción aromática y la sustitución del grupo biarilo arilo en la posición 2; la potencia es mayor para los agonistas con un donador/aceptor H+ en el grupo biarilo arilo. Una mayor cantidad de aceptores de enlaces de hidrógeno probablemente disminuya la permeabilidad a través de la barrera hematoencefálica (BHE) debido al área de superficie polar, y debe tenerse en cuenta al diseñar agonistas dirigidos a los receptores α7 nAChR.
Se pueden utilizar varios grupos de aminas cíclicas (por ejemplo, arilpiperazina, piperidina y morfolina) como fracción básica, aunque su efecto sobre la potencia agonista es limitado. Las aminas terciarias acíclicas son suficientes como fracciones básicas, pero los grupos más grandes afectan negativamente la tolerabilidad debido a su composición estérica.
Se sabe que muchos derivados de la quinuclidina (como la amida de quinuclidina) son agonistas del receptor α7 nAChR. Los estudios de SAR para la amida de quinuclidina han identificado factores que afectan la potencia y la afinidad de estos agonistas. Se favorece la sustitución para del anillo de quinuclidina y una configuración estereoquímica 3-(R). Se observa una mayor actividad cuando un anillo de 5 miembros se fusiona con una fracción aromática. Se puede lograr una mayor mejora si el anillo fusionado proporciona resonancia electrónica al carbonilo de la amida, mientras que la actividad disminuye si el anillo contiene donantes de enlaces de hidrógeno.
Se ha propuesto que la rigidez de la quinuclidina y la ortogonalidad del puente de nitrógeno en relación con el carbonilo de la amida son importantes para una unión óptima. La estabilidad de la amida de quinuclidina (un derivado más potente) en modelos in vitro de ratas fue baja; sin embargo, la adición de un grupo metilo en la posición 2 del anillo de quinuclidina aumentó significativamente su estabilidad.
Desarrollo de las drogas
El desarrollo de los agonistas del receptor nicotínico de acetilcolina comenzó a principios de los años 90, tras el descubrimiento de los efectos positivos de la nicotina en la memoria animal. El desarrollo de los agonistas del receptor nicotínico de acetilcolina ha avanzado mucho desde entonces. Los agonistas del receptor nicotínico de acetilcolina están ganando cada vez más atención como fármacos candidatos para múltiples trastornos del sistema nervioso central, como la enfermedad de Alzheimer, la esquizofrenia, el trastorno por déficit de atención e hiperactividad (TDAH) y la adicción a la nicotina. Los receptores nicotínicos de acetilcolina son receptores que se encuentran en el sistema nervioso central, el sistema nervioso periférico y los músculos esqueléticos. Son canales iónicos regulados por ligando con sitios de unión para la acetilcolina y otros agonistas. Cuando los agonistas se unen a un receptor, estabilizan el estado abierto del canal iónico, lo que permite la entrada de cationes.
En 2009 había en el mercado al menos cinco medicamentos que afectan a los receptores nicotínicos de acetilcolina.
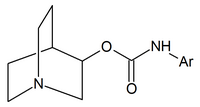 |  | 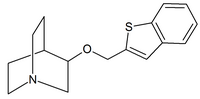 |
| Quinuclidine carbamates | Quinuclidine amides | Quinuclidine ethers |
Productos de agonista nicotínico
Otros agonistas nicotínicos, aunque generalmente con un uso clínico limitado, incluyen:
- lobelina, agonista en los receptores nicotinicos tipo Ganglion y también afecta a los terminales neuronales sensoriales
- epibatidina, agonista del tipo Ganglion, α4β2 y receptores α7
- decamethonio causa bloqueo de despolarización en los receptores del tipo muscular, de forma similar a suxamethonio
Actividad nicotínica versus muscarínica
| Comparación de agonistas cholinergicos | ||||
|---|---|---|---|---|
| Sustancia | Especificación del receptor | Hidrolisis por acetylcholinesterase | Comentarios | |
| Muscarinic | Nicotínico | |||
| Choline | ++ | ++ | ++ | Nutrición esencial |
| Acetylcholine | ++ | ++ | ++ | ligand endógeno |
| Carbachol | ++ | ++ | - | Usado en el tratamiento de glaucoma |
| Methacholine | ++ | + | ++ | |
| Bethanechol | ++ | - | - | Usado en la vejiga y hipotonia gastrointestinal. |
| Muscarine | ++ | - | - | Alcaloides naturales encontrados en ciertos hongos. Causa del envenenamiento por hongos |
| Nicotina | - | ++ | - | Alcaloides naturales encontrados en la planta de tabaco. |
| Pilocarpina | ++ | - | - | Usado en glaucoma |
| Oxotremorine | ++ | - | - | |
Situación actual
En la actualidad, la investigación y el diseño de fármacos agonistas del receptor de nicotina se orientan al tratamiento de múltiples enfermedades y trastornos del sistema nervioso central.
Targacept tiene tres fármacos candidatos que se encuentran en ensayos clínicos: AZD3480 (TC-1734) para el TDAH, que actualmente se encuentra en ensayos clínicos de fase II, AZD1446 (TC-6683) para la enfermedad de Alzheimer en colaboración con AstraZeneca y TC-5619 para disfunciones cognitivas en la esquizofrenia.
La farmacéutica Memory Pharmaceuticals, junto con su socio Roche, tiene un candidato a fármaco, MEM 3454 (RG3487), un agonista parcial del receptor nicotínico α7, para la enfermedad de Alzheimer.
Abbott Laboratories, en colaboración con NeuroSearch, tiene dos candidatos a fármacos en ensayos clínicos: ABT-894, un agonista selectivo del receptor de nicotina α4β2, para el TDAH y ABT-560, un modulador del receptor nicotínico neuronal, que fue seleccionado por Abbott en 2006 como un nuevo candidato en desarrollo para las disfunciones cognitivas.
EnVivo Pharmaceuticals tiene un candidato a fármaco en ensayos clínicos, EVP-6124, un agonista selectivo del receptor de nicotina α7 para la enfermedad de Alzheimer y la esquizofrenia, y un compuesto de seguimiento, EVP-4473, que ha completado con éxito el desarrollo preclínico.
Véase también
- Receptor de acetilcolina muscular
- Muscarinic agonist
- Muscarinic antagonist
- Receptor acetilcolina nicotínico
- Antagonista nicotínico
- Medicamentos parasimpáticos
Referencias
- ^ a b Matera, Carlo; Papotto, Claudio; Dallanoce, Clelia; De Amici, Marco (agosto 2023). "Advances in small molecule selective ligands for heteromeric nicotinic acetylcholine receives". Pharmacological Research. 194: 106813. doi:10.1016/j.phrs.2023.106813. Hdl:2434/978688. PMID 37302724.
- ^ Henningfield, Jack E; Zeller, Mitch (2006), "Nicotine psychopharmacology research contributions to United States and global tabaco regulation: a look back and a look forward", Psicofarmacología, 184 ()3-4): 286–291, doi:10.1007/s00213-006-0308-4, PMID 16463054, S2CID 38290573
- ^ a b Haroutunian, Vahram; Barnes, Edward; Davis, KL (1985), "Cholinergie modulación de la memoria en ratas", Psicofarmacología, 87 3): 266–271, doi:10.1007/BF00432705, PMID 3001803, S2CID 20040918
- ^ a b c d e Buccafusco, J. J. (2004), "subtipos de receptores nicotínicos neuronales: definición de objetivos terapéuticos" (PDF), Intervenciones moleculares, 4 5): 285–295, doi:10.1124/mi.4.5.8, PMID 15471911, archivado desde el original (PDF) on 2006-01-08, recuperado 2009-12-21
- ^ Buccafusco, J. J.; Jackson, W. J.; Terry Jr, AV; Marsh, KC; Decker, MW; Arneric, SP (1995), "Mejoramiento en el rendimiento de una tarea de emparejamiento retardado de monos después de ABT-418: un nuevo activador de canal cholinergic para el mejoramiento de la memoria", Psicofarmacología, 120 3): 256 –266, doi:10.1007/BF02311172, PMID 8524972, S2CID 23215696
- ^ Ludwig, J.; Höffle-Maas, A. (2010), "Localization by site-directed mutagenesis of a galantamine binding site on α7 dominio extracelular del receptor de acetilcolina nicotínica", Journal of Receptors and Signal Transduction, 30 (6): 469 –483, doi:10.3109/10799893.2010.505239, PMID 21062106, S2CID 9160835
- ^ Liu, Zhaoping; Zhang, J; Berg, Darwin K. (2007), "Role of endogenous nicotinic signaling in guide neuronal development", Biochemical Pharmacology, 74 (8): 1112–1119, doi:10.1016/j.bcp.2007.05.022, PMC 2116993, PMID 17603025
- ^ a b Gotti, C.; Clementi, F. (2004), "Receptores nicotínicos neuronales: de la estructura a la patología", Avances en Neurobiología, 74 (6): 363 –396, doi:10.1016/j.pneurobio.2004.09.006, PMID 15649582, S2CID 24093369
- ^ a b c Paterson, David; Nordberg, Agneta (2000), "Receptores nicotínicos neuronales en el cerebro humano", Avances en Neurobiología, 61 1): 75–111, doi:10.1016/s0301-0082(99)00045-3, PMID 10759066, S2CID 27207955
- ^ Sala, F.; Nistri, A.; Criado, M. (2008), "Nicotinic acetylcholine receives of adrenal chromaffin cells", Acta Physiologica, 192 2): 203 –212, doi:10.1111/j.1748-1716.2007.01804.x, PMID 18005395, S2CID 29310750
- ^ a b c Itier, Valérie; Bertrand, Daniel (2001), "Receptores nicotínicos neuronales: de la estructura proteica a la función", Cartas FEBS, 504 3): 118 –125, doi:10.1016/S0014-5793(01)02702-8, PMID 11532443
- ^ a b Lindstrom, JM (2003), "Nicotinic acetylcholine receptores de músculos y nervios", Annals of the New York Academy of Sciences, 998: 41 –52, doi:10.1196/annals.1254.007, PMID 14592862, S2CID 84583356
- ^ Mihailescu, Stefan; Drucker-Colín, René (2000), "Nicotine, Brain Nicotinic Receptors, and Neuropsychiatric Disorders", Archivos de Investigación Médica, 31 2): 131–144, doi:10.1016/S0188-4409(99)00087-9, PMID 10880717
- ^ Arias, Hugo R. (1997), "Topology of ligand binding sites on the nicotinic acetylcholine recipient", Brain Research Reviews, 25 2): 133 –191, doi:10.1016/S0165-0173(97)00020-9, PMID 9403137, S2CID 26453010
- ^ a b c d Haydar, Simon N.; Ghiron, Chiara; Bettinetti, Laura; Bothman, Hendrick; Comery, Thomas A.; Dunlop, John; La Rosa, Salvatore; Micco, Iolanda; Pollastrini, Martina; Quinn, Joanna; Roncarati, Renza; Scali, Carla; Valacchi, Michela; Varrone, Maurizio Novel alpha 7 nicotínico receptor agonista acetilcolina", Bioorgánico & Medicinal Química, 17 (14): 5247–5258, doi:10.1016/j.bmc.2009.05.040, PMID 19515567
- ^ Brunton, Laurence L.; Lazo, John S.; Parker, Keith L., eds. (2006), La base farmacológica de la terapéutica de Goodman & Gilman (11 ed.), McGRAW HILL, ISBN 978-0-07-142280-2
- ^ Unwin, Nigel (2004), "La estructura refinada del receptor de acetilcolina Nicotínico a 4 A° Resolución", Journal of Molecular Biology, 346 4): 967 –989, doi:10.1016/j.jmb.2004.12.031, PMID 15701510
- ^ Cassels, Bruce K.; Bermúdez, Isabel; Dajas, Federico; Abin-Carriquiry, J. Andrés; Wonnacott, Susan (2005), "De diseño ligando a la eficacia terapéutica: el desafío para la investigación del receptor nicotínico", Drug Discovery hoy, 10 ()23 –24): 1657–1665, doi:10.1016/S1359-6446(05)03665-2, hdl:10533/176659, PMID 16376826
- ^ Matera, Carlo; Papotto, Claudio; Dallanoce, Clelia; De Amici, Marco (agosto 2023). "Advances in small molecule selective ligands for heteromeric nicotinic acetylcholine receives". Pharmacological Research. 194: 106813. doi:10.1016/j.phrs.2023.106813. Hdl:2434/978688. PMID 37302724.
- ^ Gotti, C.; Fornasari, D.; Clementi, F. (1997), "Human Neuronal Nicotinc Receptors", Avances en Neurobiología, 53 2): 199 –237, doi:10.1016/S0301-0082(97)00034-8, PMID 9364611, S2CID 10421687
- ^ Tøndera, Janne E.; Olesena, Preben H.; Hansena, John Bondo; Begtrupb, Mikael; Petterssona, Ingrid (2001), "Un farmacéutico nicotínico mejorado y un modelo estereoelectivo de CoMFA para agonistas nicotínicos que actúan en los receptores de acetilcolina central, etiquetados por [3caril] Revista de diseño molecular asistido por computadora, 15 3): 247 –258, Bibcode:2001JCAMD..15..247T, doi:10.1023/A:1008140021426, PMID 11289078, S2CID 80361
- ^ Cooper, Julia C.; Gutbrod, Oliver; Witzemann, Veit; Methfessel, Christoph (1996), "Pharmacology of the nicotinic acetylcholine recipient from fetal rat muscular expressed in Xenopus oocytes", European Journal of Pharmacology, 309 3): 287 –298, doi:10.1016/0014-2999(96)00294-4, PMID 8874153
- ^ Carter, Chris R.J.; Cao, Liren; Kawai, Hideki; Smith, Peter A.; Dryden, William F.; Raftery, Michael A.; Dunn, Susan M.J. (2007), "La longitud de la dependencia de las interacciones de los ligantes bisquaternarios con el receptor de acetilcolina nicotinica Torpedo", Biochemical Pharmacology, 73 3): 417 –426, doi:10.1016/j.bcp.2006.10.011, PMID 17118342
- ^ Charton, Yves; Guillonneau, Claude.; Lockhart, Brian; Lestageb, Pierre; Goldsteina, Solo (2008), "Preparation and affinity profile of novel nicotinic ligands", Bioorgánico & Medicinal Cartas de química, 18 (6): 2188–2193, doi:10.1016/j.bmcl.2007.12.075, PMID 18262785
- ^ Walker, Daniel P.; Wishka, Donn G.; Piotrowski, David W.; Jia, Shaojuan; Reitz, Steven C.; Yates, Karen M.; Myers, Jason K.; Vetman, Tatiana N.; Margolis, Brandon J.; Jacobsen, E. Jon; Acker, Brad A; Groppi, síntesis E.; Wolfe, Bruce in vivo actividad de aryl azabicíclico en medio de agonistas de receptores acetilcolina nicotínicos a7", Bioorgánico & Medicinal Química, 14 (24): 8219 –8248, doi:10.1016/j.bmc.2006.09.019, PMID 17011782
- ^ http://www.envivopharma.com - Nicotinic Alpha7 Acetylcholine Receptor Agonist Program Archivado 2010-01-07 en la máquina Wayback
- ^ a b Rollema, H.; Chambers, L.K; Coe, J.W.; Glowa, J.; Hurst, R.S.; Lebel, L.A; Lu, Y.; Mansbach, R.S.; Mather, R.J.; Rovetti, C.C.; Sands, S.B.; Schaffer, E.mac; Schulz, D.W.4β2 acetilcolina del receptor agonista parcial vareniclina, una ayuda efectiva para dejar de fumar", Neurofarmacología, 52 3): 985 –994, doi:10.1016/j.neuropharm.2006.10.016, PMID 17157884, S2CID 53267460
- ^ a b "CHAMPIX comprimidos de color filmado de 0,5 mg; tabletas de CHAMPIX 1 mg de filmación - Resumen de las características del producto (SmPC) - (eMC)". emc.medicines.org.uk. Archivado desde el original el 2012-12-24.
- ^ Greenblatt, H.M.; Kryger, G.; Lewis, T.; Silman, I.; Sussman, J.L (1999), "Structure of acetylcholinesterase complexed with (-)-galanthamine at 2.3 angstrom resolution", Cartas FEBS, 463 3): 321 –326, doi:10.1016/S0014-5793(99)01637-3, PMID 10606746
- ^ "Reminyl XL 8mg, 16mg y 24mg cápsulas de liberación prolongada - Resumen de Características del Producto (SmPC) - (eMC)". emc.medicines.org.uk. Archivado desde el original el 2012-12-24.
- ^ Dani, John A.; Biasi, Mariella De (2001), "Mecanismos celulares de adicción a la nicotina", Farmacología Bioquímica y Comportamiento, 70 4): 439 –446, doi:10.1016/S0091-3057(01)00652-9, PMID 11796143, S2CID 12960054
- ^ a b c d Rang, H. P. (2003), Farmacología, Edimburgo: Churchill Livingstone, ISBN 978-0-443-07145-4 Página 149
- ^ XI, Zheng-xiong; Spiller, Krista; Gardner, Eliot L. (2009), "Desarrollo de medicamentos basados en el mecanismo para el tratamiento de la dependencia de la nicotina", Acta Pharmacol Sin, 30 (6): 723 –739, doi:10.1038/aps.2009.46, PMC 3713229, PMID 19434058, ProQuest 213027402
- ^ "Miostat FDA label" (PDF). fda.gov. Diciembre de 2003.
- ^ Tuba, Zoltan; Maho, Sandor; Vizi, E. Sylvester (2002), "Synthesis and Structure-Activity Relationships of Neuromuscular Blocking Agents", Química Medicinal actual, 9 (16): 1507 –1536, doi:10.2174/0929867023369466, PMID 12171561, ProQuest 215095660
- ^ "Anectine Injection - Summary of Product Characteristics (SmPC) - (eMC)". emc.medicines.org.uk. Archivado desde el original el 2012-12-24.
- ^ Carroll, F. Ivy (2004), "Epibatidine structure-actividad relationships", Bioorgánico & Medicinal Cartas de química, 14 (8): 1889 –1896, doi:10.1016/j.bmcl.2004.02.007, PMID 15050621
- ^ A menos que se especifique en cajas, la referencia es: Tabla 10-3 en: Rod Flower; Humphrey P. Rang; Maureen M. Dale; Ritter, James M. (2007), Farmacia de Rang & Dale, Edimburgo: Churchill Livingstone, ISBN 978-0-443-06911-6
- ^ Matera, Carlo; Papotto, Claudio; Dallanoce, Clelia; De Amici, Marco (agosto 2023). "Advances in small molecule selective ligands for heteromeric nicotinic acetylcholine receives". Pharmacological Research. 194: 106813. doi:10.1016/j.phrs.2023.106813. Hdl:2434/978688. PMID 37302724.
- ^ "Roche - Farmacéutica Pipeline". Archivado desde el original el 21 de julio de 2009. Retrieved 2009-12-21.
- ^ "Memory Pharmaceuticals Achieves Enrollment Goal For Phase 2 Study Of MEM 3454 In Cognitive Impairment Associated With Schizophrenia". Archivado desde el original en 2009-01-09. Retrieved 2009-12-21.
- ^ "Drug Development". Archivado desde el original el 30 de junio de 2006. Retrieved 2009-12-21.
- ^ "Programas - EnVivo". Archivado desde el original el 2009-08-06. Retrieved 2009-12-21.
Enlaces externos
![]() Medios relacionados con agonistas nicotínicos en Wikimedia Commons
Medios relacionados con agonistas nicotínicos en Wikimedia Commons
- nicotinic+agonistas de la Biblioteca Nacional de Medicina de EE.UU.
- MeSH lista de agentes 82018722