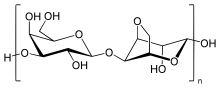
Agarosa
La agarosa es un heteropolisacárido, generalmente extraído de ciertas algas rojas. Es un polímero lineal formado por la unidad repetitiva de agarobiosa, que es un disacárido formado por D-galactosa y 3,6-anhidro-L-galactopiranosa. La agarosa es uno de los dos componentes principales del agar y se purifica del agar eliminando el otro componente del agar, la agaropectina.
La agarosa se utiliza con frecuencia en biología molecular para la separación de moléculas grandes, especialmente ADN, mediante electroforesis. Las losas de geles de agarosa (generalmente 0,7 - 2%) para electroforesis se preparan fácilmente vertiendo la solución líquida tibia en un molde. Una amplia gama de diferentes agarosas de diferentes pesos moleculares y propiedades están disponibles comercialmente para este propósito. La agarosa también se puede formar en perlas y usarse en varios métodos cromatográficos para la purificación de proteínas.
Estructura
La agarosa es un polímero lineal con un peso molecular de aproximadamente 120 000, que consta de alternancia de D-galactosa y 3,6-anhidro-L-galactopiranosa unidas por α- (1→3) y enlaces glucosídicos β-(1→4). La 3,6-anhidro-L-galactopiranosa es una L-galactosa con un puente anhidro entre las posiciones 3 y 6, aunque algo de L -Las unidades de galactosa en el polímero pueden no contener el puente. Algunas unidades de D-galactosa y L-galactosa pueden metilarse, y también se encuentran piruvato y sulfato en pequeñas cantidades.
Cada cadena de agarosa contiene ~800 moléculas de galactosa, y las cadenas de polímero de agarosa forman fibras helicoidales que se agregan en una estructura superenrollada con un radio de 20-30 nm. Las fibras son casi rígidas y tienen un amplio rango de longitud dependiendo de la concentración de agarosa. Cuando se solidifican, las fibras forman una malla tridimensional de canales de diámetro que oscila entre 50 nm y >200 nm dependiendo de la concentración de agarosa utilizada; las concentraciones más altas producen diámetros de poro promedio más bajos. La estructura tridimensional se mantiene unida con enlaces de hidrógeno y, por lo tanto, puede romperse calentándola de nuevo a un estado líquido.
Propiedades
La agarosa está disponible como un polvo blanco que se disuelve en agua casi hirviendo y forma un gel cuando se enfría. La agarosa exhibe el fenómeno de la histéresis térmica en su transición de líquido a gel, es decir, se gelifica y se funde a diferentes temperaturas. Las temperaturas de gelificación y fusión varían según el tipo de agarosa. Las agarosas estándar derivadas de Gelidium tienen una temperatura de gelificación de 34–38 °C (93–100 °F) y una temperatura de fusión de 90–95 °C (194–203 °F), mientras que las derivadas de Gracilaria, debido a sus sustituyentes metoxi más altos, tiene una temperatura de gelificación de 40–52 °C (104–126 °F) y una temperatura de fusión de 85–90 °C (185–194 °F). Las temperaturas de fusión y gelificación pueden depender de la concentración del gel, particularmente a una concentración de gel baja de menos del 1%. Por lo tanto, las temperaturas de gelificación y fusión se dan a una concentración de agarosa específica.
La agarosa natural contiene grupos metilo sin carga y el grado de metilación es directamente proporcional a la temperatura de gelificación. Sin embargo, la metilación sintética tiene el efecto inverso, por lo que una mayor metilación reduce la temperatura de gelificación. Una variedad de agarosas modificadas químicamente con diferentes temperaturas de fusión y gelificación están disponibles a través de modificaciones químicas.
La agarosa en el gel forma una malla que contiene poros, y el tamaño de los poros depende de la concentración de agarosa agregada. En reposo, los geles de agarosa son propensos a la sinéresis (extrusión de agua a través de la superficie del gel), pero el proceso es lo suficientemente lento como para no interferir con el uso del gel.
El gel de agarosa puede tener una alta fuerza de gel a baja concentración, lo que lo hace adecuado como medio anticonvección para la electroforesis en gel. Los geles de agarosa tan diluidos como al 0,15 % pueden formar placas para la electroforesis en gel. El polímero de agarosa contiene grupos cargados, en particular piruvato y sulfato. Estos grupos cargados negativamente pueden ralentizar el movimiento de las moléculas de ADN en un proceso llamado electroendosmosis (EEO) y, por lo tanto, generalmente se prefiere la agarosa con bajo contenido de EEO para su uso en la electroforesis de ácidos nucleicos en gel de agarosa. Las agarosas con cero EEO también están disponibles, pero pueden no ser deseables para algunas aplicaciones, ya que pueden fabricarse agregando grupos cargados positivamente que pueden afectar las reacciones enzimáticas posteriores. La electroendosmosis es una de las razones por las que la agarosa se usa preferentemente sobre el agar, ya que la agaropectina en el agar contiene una cantidad significativa de grupos sulfato y carboxilo cargados negativamente. La eliminación de agaropectina en agarosa reduce sustancialmente la EEO, así como también reduce la adsorción no específica de biomoléculas a la matriz del gel. Sin embargo, para algunas aplicaciones, como la electroforesis de proteínas séricas, puede ser deseable un EEO alto y se puede agregar agaropectina en el gel utilizado.
Agarosas de baja temperatura de fusión y gelificación
Las temperaturas de fusión y gelificación de la agarosa se pueden modificar mediante modificaciones químicas, más comúnmente por hidroxietilación, que reduce la cantidad de enlaces de hidrógeno intracatenarios, lo que resulta en temperaturas de fusión y fraguado más bajas que las agarosas estándar. La temperatura exacta está determinada por el grado de sustitución, y muchas agarosas de bajo punto de fusión (LMP) disponibles pueden permanecer fluidas en un rango de 30 a 35 °C (86 a 95 °F). Esta propiedad permite que las manipulaciones enzimáticas se lleven a cabo directamente después de la electroforesis en gel de ADN mediante la adición de cortes de gel fundido que contienen fragmentos de ADN de interés a una mezcla de reacción. La agarosa LMP contiene menos sulfatos que pueden afectar algunas reacciones enzimáticas y, por lo tanto, se usa preferentemente para algunas aplicaciones. La hidroxietilación puede reducir el tamaño de los poros al reducir la densidad de empaquetamiento de los paquetes de agarosa, por lo que el gel LMP también puede afectar el tiempo y la separación durante la electroforesis. Las agarosas con temperatura de gelificación o de fusión ultrabaja pueden gelificar solo a 8-15 °C (46-59 °F).
Aplicaciones
La agarosa es una matriz preferida para trabajar con proteínas y ácidos nucleicos, ya que tiene una amplia gama de estabilidad física, química y térmica, y su menor grado de complejidad química también hace que sea menos probable que interactúe con biomoléculas. La agarosa se usa más comúnmente como medio para la separación electroforética a escala analítica en la electroforesis en gel de agarosa. Los geles elaborados con agarosa purificada tienen un tamaño de poro relativamente grande, lo que los hace útiles para la separación de moléculas grandes, como proteínas y complejos de proteínas >200 kilodaltons, así como fragmentos de ADN >100 pares de bases. La agarosa también se usa ampliamente para una serie de otras aplicaciones, por ejemplo, inmunodifusión e inmunoelectroforesis, ya que las fibras de agarosa funcionan como un ancla para los inmunocomplejos.
Electroforesis en gel de agarosa
La electroforesis en gel de agarosa es el método de rutina para resolver el ADN en el laboratorio. Los geles de agarosa tienen un poder de resolución más bajo para el ADN que los geles de acrilamida, pero tienen un mayor rango de separación y, por lo tanto, generalmente se usan para fragmentos de ADN con longitudes de 50 a 20 000 pb (pares de bases), aunque es posible una resolución de más de 6 Mb con pulsos. electroforesis en gel de campo (PFGE). También se puede utilizar para separar moléculas de proteínas grandes y es la matriz preferida para la electroforesis en gel de partículas con radios efectivos superiores a 5-10 nm.
El tamaño de los poros del gel afecta el tamaño del ADN que se puede tamizar. Cuanto menor sea la concentración del gel, mayor será el tamaño de los poros y mayor será el ADN que se puede tamizar. Sin embargo, los geles de baja concentración (0,1 - 0,2 %) son frágiles y, por lo tanto, difíciles de manejar, y la electroforesis de moléculas de ADN grandes puede tardar varios días. El límite de resolución para la electroforesis en gel de agarosa estándar es de alrededor de 750 kb. Este límite se puede superar con PFGE, donde se aplican al gel campos eléctricos ortogonales alternos. Los fragmentos de ADN se reorientan cuando el campo aplicado cambia de dirección, pero las moléculas de ADN más grandes tardan más en realinearse cuando se altera el campo eléctrico, mientras que para las más pequeñas es más rápido y, por lo tanto, el ADN se puede fraccionar según el tamaño.
Los geles de agarosa se vierten en un molde y, una vez fraguados, normalmente se sumergen horizontalmente en una solución tampón. Los tampones de tris-acetato-EDTA y tris-borato-EDTA se usan comúnmente, pero otros tampones como tris-fosfato, ácido barbitúrico-barbitúrico de sodio o tampones de tris-barbitúrico se pueden usar en otras aplicaciones. El ADN normalmente se visualiza tiñéndolo con bromuro de etidio y luego se observa bajo una luz ultravioleta, pero hay otros métodos de tinción disponibles, como SYBR Green, GelRed, azul de metileno y cristal violeta. Si se necesitan los fragmentos de ADN separados para un experimento posterior posterior, se pueden cortar del gel en rodajas para su posterior manipulación.
Purificación de proteínas
La matriz de gel de agarosa se usa a menudo para la purificación de proteínas, por ejemplo, en la separación a escala preparativa basada en columnas como en la cromatografía de filtración en gel, la cromatografía de afinidad y la cromatografía de intercambio iónico. Sin embargo, no se usa como un gel continuo, sino que se forma en perlas o resinas porosas de finura variable. Las perlas son altamente porosas para que la proteína pueda fluir libremente a través de las perlas. Estas perlas a base de agarosa son generalmente blandas y fáciles de triturar, por lo que deben usarse en procedimientos de flujo por gravedad, centrifugación a baja velocidad o baja presión. La resistencia de las resinas se puede mejorar aumentando la reticulación y el endurecimiento químico de las resinas de agarosa; sin embargo, estos cambios también pueden dar lugar a una menor capacidad de unión de proteínas en algunos procedimientos de separación, como la cromatografía de afinidad.
La agarosa es un material útil para la cromatografía porque no absorbe biomoléculas de manera significativa, tiene buenas propiedades de fluidez y puede tolerar extremos de pH y fuerza iónica, así como una alta concentración de desnaturalizantes como urea 8M o guanidina HCl 6M.. Ejemplos de matriz basada en agarosa para la cromatografía de filtración en gel son Sepharose y WorkBeads 40 SEC (agarosa en perlas reticuladas), Praesto y Superose (agarosas en perlas altamente reticuladas) y Superdex (dextrano unido covalentemente a agarosa).
Para la cromatografía de afinidad, la agarosa en perlas es la resina de matriz más utilizada para la unión de los ligandos que se unen a la proteína. Los ligandos se unen covalentemente a través de un espaciador a los grupos hidroxilo activados del polímero de perlas de agarosa. A continuación, las proteínas de interés se pueden unir selectivamente a los ligandos para separarlas de otras proteínas, después de lo cual se pueden eluir. Las perlas de agarosa utilizadas suelen tener densidades del 4 % y el 6 % con una alta capacidad de unión a proteínas.
Medios de cultivo sólidos
En ocasiones, se puede usar una placa de agarosa en lugar de agar para cultivar organismos, ya que el agar puede contener impurezas que pueden afectar el crecimiento del organismo o algunos procedimientos posteriores, como la reacción en cadena de la polimerasa (PCR). La agarosa también es más dura que el agar y, por lo tanto, puede ser preferible cuando se necesita una mayor fuerza de gel, y su temperatura de gelificación más baja puede evitar que se produzca un choque térmico en el organismo cuando las células se suspenden en líquido antes de la gelificación. Puede utilizarse para el cultivo de bacterias autótrofas estrictas, protoplastos vegetales, Caenorhabditis elegans, otros organismos y diversas líneas celulares.
Ensayos de motilidad
A veces se usa agarosa en lugar de agar para medir la motilidad y la movilidad de los microorganismos. Las especies móviles podrán migrar, aunque lentamente, a través del gel poroso y luego se podrán visualizar las tasas de infiltración. La porosidad del gel está directamente relacionada con la concentración de agar o agarosa en el medio, por lo que se pueden usar geles de diferentes concentraciones para evaluar la motilidad de natación, enjambre, deslizamiento y espasmos de una célula. El ensayo de migración de células bajo agarosa se puede utilizar para medir la quimiotaxis y la quimiocinesis. Se coloca una capa de gel de agarosa entre una población celular y un quimioatrayente. A medida que se desarrolla un gradiente de concentración a partir de la difusión del quimioatrayente en el gel, varias poblaciones de células que requieren diferentes niveles de estimulación para migrar pueden visualizarse con el tiempo usando microfotografía a medida que avanzan hacia arriba a través del gel contra la gravedad a lo largo del gradiente.
Contenido relacionado
Quimotripsina
Thomas Midgley Jr.
Pera