ADN polimerasa II
ADN polimerasa II (también conocida como ADN Pol II o Pol II) es una ADN polimerasa procariótica dependiente de ADN codificada por el sistema PolB. gene.
La ADN polimerasa II es una proteína de 89,9 kDa y es miembro de la familia B de ADN polimerasas. Fue aislado originalmente por Thomas Kornberg en 1970 y caracterizado durante los años siguientes. La funcionalidad in vivo de Pol II está en debate, pero el consenso muestra que Pol II participa principalmente como enzima de respaldo en la replicación del ADN procariótico. La enzima tiene capacidad de síntesis de ADN 5′→3′, así como actividad correctora de exonucleasa 3′→5′. DNA Pol II interactúa con múltiples socios de unión comunes con DNA Pol III para mejorar su fidelidad y procesividad.
Descubrimiento
La ADN polimerasa I fue la primera ADN polimerasa dirigida por ADN que se aisló de E. coli. Varios estudios que involucraron esta enzima aislada indicaron que la ADN pol I probablemente estaba involucrada en la replicación reparadora y no era la principal polimerasa replicativa. Para comprender mejor el papel in vivo de DNA pol I, E. coli deficientes en esta enzima (denominados Pol A1-) fueron generados en 1969 por De Lucia y Cairns. Tal como se caracterizó, esta nueva cepa mutante era más sensible a la luz ultravioleta, lo que corrobora la hipótesis de que el ADN pol I estaba involucrado en la replicación reparadora. El mutante creció al mismo ritmo que el tipo salvaje, lo que indica la presencia de otra enzima responsable de la replicación del ADN. Siguieron el aislamiento y la caracterización de esta nueva polimerasa implicada en la replicación semiconservadora del ADN, en estudios paralelos realizados por varios laboratorios. La nueva polimerasa se denominó ADN polimerasa II y se creía que era la principal enzima replicativa de E. coli por un tiempo. El ADN pol II fue cristalizado por primera vez por Anderson et al. en 1994.
En 2023, se informó que la transcripción acelerada relacionada con el envejecimiento hace que Pol II cometa más errores, lo que genera copias defectuosas que pueden causar numerosas enfermedades.
Estructura
DNA Pol II es una proteína de 89,9 kD, compuesta por 783 aminoácidos, que está codificada por el gen polB (dinA). Una proteína globular, DNA Pol II, funciona como un monómero, mientras que muchas otras polimerasas formarán complejos. Hay tres secciones principales de este monómero a las que coloquialmente se hace referencia como palma, dedos y pulgar. Esta “mano” se cierra alrededor de una hebra de ADN. La palma del complejo contiene tres residuos catalíticos que se coordinarán con dos iones metálicos divalentes para funcionar. DNA Pol II tiene una gran cantidad de copias en la célula, alrededor de 30-50, mientras que el nivel de DNA Pol III en una célula es cinco veces menor.
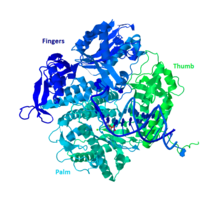
Similitud con otras polimerasas del grupo B
La mayoría de las polimerasas se han agrupado en familias basadas en estructuras y funciones similares. DNA Pol II pertenece al Grupo B junto con DNA Pol α, δ, ϵ y ζ humanos. Todos estos son homólogos de RB69, 9°N-7 y Tgo. Los otros miembros del grupo B tienen al menos otra subunidad que hace que el ADN Pol II sea único.
Función
Confirmado
Todas las polimeras están involucradas con la replicación del ADN en alguna capacidad, sintetizando cadenas de ácidos nucleicos. La replicación del ADN es un aspecto vital de la proliferación de una célula. Sin reproducir su ADN, una célula no puede dividir y compartir su información genética a la progenie. En prokaryotes, como E. coli, ADN Pol III es la mayor polimerasa involucrada en la replicación del ADN. Aunque el ADN Pol II no es un factor importante en la replicación del cromosoma, tiene otros roles que llenar.
DNA Pol II participa en la replicación del ADN. Si bien puede que no sea tan rápido como DNA Pol III, tiene algunas capacidades que la convierten en una enzima eficaz. Esta enzima tiene una actividad exonucleasa 3′→5′ asociada junto con actividad primasa. DNA Pol II es una enzima de alta fidelidad con una tasa de error de sustitución de ≤ 2×10−6 y una tasa de error de cambio de marco −1 de ≤ 1×10−6. DNA Pol II puede corregir y procesar discrepancias causadas por Pol III. Banach-Orlowska et al. demostró que DNA Pol II está involucrado en la replicación, pero depende de la cadena y replica preferentemente la cadena retrasada. Un mecanismo propuesto sugiere que cuando DNA Pol III se detiene o deja de funcionar, entonces DNA Pol II puede reclutarse específicamente hasta el punto de replicación y continuar con la replicación.
Hay muchas formas diferentes en que se puede dañar el ADN, desde el daño de los rayos UV hasta la oxidación, por lo que es lógico que existan diferentes tipos de polimerasas para reparar estos daños. Una función importante que desempeña DNA Pol II es la principal polimerasa para la reparación de enlaces cruzados entre cadenas. Los enlaces cruzados entre hebras son causados por sustancias químicas como la mostaza nitrogenada y el psoraleno que crean lesiones citotóxicas. Reparar estas lesiones es difícil porque ambas cadenas de ADN han sido dañadas por el agente químico y, por lo tanto, la información genética en ambas cadenas es incorrecta. El mecanismo exacto de cómo se fijan estos enlaces cruzados entre cadenas aún se está investigando, pero se sabe que Pol II está muy involucrado.
Actividad
DNA Pol II no es la polimerasa más estudiada, por lo que hay muchas funciones propuestas para esta enzima, todas ellas funciones probables, pero que en última instancia no están confirmadas:
- reparación de ADN dañado por radiación UV
- réplica reinicio en UV-irradiated E. coli
- mutagenesis adaptativa
- supervivencia a largo plazo
Mecanismo

Durante la replicación del ADN, los pares de bases están sujetos a daños en la secuencia. Una secuencia de ADN dañada puede provocar que se detenga la replicación. Para corregir un error en la secuencia, DNA Pol II cataliza la reparación de pares de bases de nucleótidos. Los estudios in vitro han demostrado que Pol II interactúa ocasionalmente con proteínas accesorias de Pol III (complejo de carga de abrazadera β y abrazadera) dando a Pol II acceso a la hebra naciente en crecimiento. Con respecto a la función de DNA Pol II durante la replicación del ADN, esto tiene sentido ya que cualquier error que produzca Pol III se producirá en la cadena en crecimiento y no en la cadena conservadora. El dominio N-terminal de DNA Pol II es responsable de la asociación y disociación de la cadena de ADN a la subunidad catalítica. Lo más probable es que haya dos sitios en el dominio N-terminal de DNA Pol II que reconocen el ADN monocatenario. Uno de los sitios es responsable de reclutar ADN monocatenario para DNA Pol II y otro sitio es responsable de la disociación del ADN monocatenario de DNA Pol II.

Al unirse al sustrato, DNA Pol II se une a los nucleósidos trifosfato para mantener la estructura de enlaces de hidrógeno del ADN. Luego se une el dNTP correcto y el complejo enzimático sufre cambios conformacionales de subdominios y residuos de aminoácidos. Estos cambios conformacionales permiten que la tasa de síntesis de reparación sea rápida. El sitio activo contiene dos iones Mg2+ que están estabilizados mediante ácidos aspárticos catalíticos D419 y D547. Los iones de magnesio se unen al ADN junto con el dNTP en el estado abierto y coordinan los cambios conformacionales de los residuos de aminoácidos del sitio activo para que se produzca la catálisis (estado cerrado). Después de que se liberan los iones de magnesio, la enzima vuelve a su estado abierto.
Distribución de especies
Procariota
La ADN polimerasa II es un miembro de la familia de la polimerasa B y apoya a la polimerasa III en la replicación del ADN moviéndose desde el extremo 3' al extremo 5'. En el caso de que la Polimerasa III se detenga durante un error de replicación, la Polimerasa II puede interrumpir y escindir las bases no coincidentes. La polimerasa II tiene un factor de fidelidad mucho mayor que la polimerasa III, lo que significa que es mucho menos probable que cree errores de emparejamiento. Sin el paso de corrección de la Polimerasa II, la Polimerasa III extendería los desemparejamientos y, por lo tanto, crearía una mutación.
Además de proteger contra mutaciones que podrían ser causadas por la polimerasa III, la polimerasa II funciona para proteger contra mutaciones causadas por la polimerasa IV. La polimerasa IV es mucho más propensa a errores que la polimerasa II, pero también funciona para reparar pares de bases no coincidentes a partir del extremo 3'. La polimerasa II protege el extremo 3 ′ de la polimerasa IV y le impide actuar. Esta protección evitará la formación de mutaciones mientras la Polimerasa II esté funcionando normalmente. Si la polimerasa II queda inactiva por una mutación o inhabilitada por otros factores, la polimerasa IV ocupará su lugar para reparar las bases desapareadas.
Eucariótico
Si bien la polimerasa II no funcionará de forma natural junto con los miembros eucariotas de la familia B, comparte motivos estructurales y funcionales similares. Los miembros de la familia B incluyen la polimerasa α, ε, ζ y δ. Todas estas polimerasas funcionan para corregir el ADN recién sintetizado en la dirección 3′→5′. Estas polimerasas son capaces de sintetizar ADN tanto en la cadena principal como en la rezagada. Esta clase de polimerasa tiende a ser muy precisa, lo que les permite corregir cualquier error de emparejamiento que se produzca durante la síntesis de ADN.
Reglamento
La ADN Polimerasa II es naturalmente abundante en la célula, y suele ser cinco veces mayor que la cantidad de Polimerasa III. Esta mayor abundancia permite que la polimerasa II supere a la polimerasa III en caso de errores de emparejamiento. Esta cantidad se puede aumentar al inducir la respuesta SOS, que regula positivamente el gen polB, de modo que la cantidad de polimerasa II aumenta aproximadamente siete veces más. Aunque la polimerasa II puede funcionar en ambas hebras, se ha demostrado que prefiere la hebra retrasada frente a la hebra principal.
Contenido relacionado
Ley de Fick
Miosina
Hexoquinasa
Microfluidos
Katal