Activación del enlace carbono-hidrógeno
En química orgánica y química organometálica, la activación del enlace carbono-hidrógeno (activación C−H) es un tipo de reacción orgánica en la que un enlace carbono-hidrógeno se escinde y se reemplaza por un enlace C−X (X ≠ H es típicamente un elemento del grupo principal, como carbono, oxígeno o nitrógeno). Algunos autores restringen aún más el término activación C–H a las reacciones en las que un enlace C–H, que típicamente se considera "no reactivo", interactúa con un centro de metal de transición M, lo que resulta en su escisión y la generación de una especie organometálica con un enlace M–C. El intermedio de este paso (a veces conocido como el paso de activación de C−H) podría luego sufrir reacciones posteriores con otros reactivos, ya sea in situ (lo que a menudo permite que el metal de transición se use en una cantidad catalítica) o en un paso separado, para producir el producto funcionalizado.

El término alternativo funcionalización C−H se utiliza para describir cualquier reacción que convierta un enlace C−H relativamente inerte en un enlace C−X, independientemente del mecanismo de reacción (o con una actitud agnóstica hacia él). En particular, esta definición no requiere que el enlace C–H escindido interactúe inicialmente con el metal de transición en el mecanismo de reacción. A diferencia de la variedad organometálica, este tipo ampliado de activación C-H se emplea ampliamente en la industria y en la naturaleza. Esta definición más amplia abarca todas las reacciones que caerían bajo la definición restringida de activación C–H dada anteriormente. Sin embargo, también incluye reacciones de hidroxilación de C–H de alcanos catalizadas por hierro que se realizan a través del mecanismo de rebote de oxígeno (por ejemplo, enzimas del citocromo P450 y sus análogos sintéticos), en las que no se cree que una especie organometálica esté involucrada en el mecanismo. En otros casos, las especies organometálicas están involucradas indirectamente. Esto ocurre, por ejemplo, con los procesos de inserción de C–H catalizados por Rh(II) en los que se genera una especie de carbeno metálico electrófilo y el enlace C–H del hidrocarburo se inserta en el carbono del carbeno sin interacción directa del hidrocarburo con el metal. Otras posibilidades mecanicistas que no implican la escisión directa del enlace C–H por el metal incluyen (i) generación de especies de arilmetal por mecanismo de sustitución aromática electrofílica (común para especies electrofílicas de Pd, Pt, Au, Hg), (ii) escisión del enlace C–H mediante abstracción de átomos de hidrógeno por un radical centrado en O o N, que luego puede continuar reaccionando y sufrir funcionalización con o sin formación de un intermedio organometálico (por ejemplo, reacción de Kharasch–Sosnovsky), y (iii) desprotonación de C–H en la posición α de un sistema π asistida por la formación inicial de un complejo π con un metal electrofílico para generar una especie organometálica nucleófila (por ejemplo, por complejos de ciclopentadieniliron).
A menudo, cuando los autores hacen la distinción entre la funcionalización de C–H y la activación de C−H, limitan esta última al sentido estricto. Sin embargo, puede resultar difícil demostrar definitivamente la participación o no de una interacción entre el enlace C–H y el metal antes de la ruptura del enlace. Este artículo analiza las reacciones de funcionalización de C–H en general, pero con un enfoque en la activación de C–H sensu stricto.
Clasificación
Los mecanismos de activación de C-H por los centros metálicos se pueden clasificar en tres categorías generales:
- i) Adiciones oxidativas, en las que un centro metálico de bajo contenido se inserta en un enlace de carbono-hidrógeno, que oculta el vínculo y oxida el metal:
- LnM + RH → LnM(R)(H)
- ii) Activación electrofílica en la que un metal electrofílico ataca al hidrocarburo, desplazando un protón:
- LnM+ + RH → LnMR + H+
- Una variante particularmente común de esta categoría, conocida como metalación concertada-deprotonación, implica una base interna ligada (a menudo un carboxilato, por ejemplo, acetato o pivalato) aceptando simultáneamente el protón desplazado intramolecularmente.
- iii) metatesis sigma-bond, que procede a través de un estado de transición "cuatro-centrado" en el que los lazos rompen y forman en un solo paso:
- LnMX + RH → LnMR + XH
Panorama histórico
La primera reacción de activación de C–H se atribuye a menudo a Otto Dimroth, quien en 1902 informó que el benceno reaccionaba con acetato de mercurio(II) (véase: organomercurio). Muchos centros metálicos electrofílicos experimentan esta reacción similar a la de Friedel-Crafts. Joseph Chatt observó la adición de enlaces C-H del naftaleno por complejos de Ru(0).
Las activaciones C-H asistidas por quelación son frecuentes. Shunsuke Murahashi informó de una funcionalización C-H asistida por quelación catalizada por cobalto de la 2-fenilisoindolin-1-ona a partir de (E)-N,1-difenilmetanamina.

En 1969, A.E. Shilov informó que el tetracloroplatinato de potasio inducía una mezcla de isótopos entre el metano y el agua pesada. Se propuso que la vía implicaba la unión del metano al Pt(II). En 1972, el grupo de Shilov pudo producir metanol y cloruro de metilo en una reacción similar que implicaba una cantidad estequiométrica de tetracloroplatinato de potasio, hexacloroplatinato de potasio catalítico, metano y agua. Debido al hecho de que Shilov trabajó y publicó en la Unión Soviética durante la era de la Guerra Fría, su trabajo fue en gran medida ignorado por los científicos occidentales. Este llamado sistema de Shilov es hoy uno de los pocos sistemas catalíticos verdaderos para funcionalizaciones de alcanos.
En algunos casos, los descubrimientos en la activación de C-H se hicieron en conjunción con los del acoplamiento cruzado. En 1969, Yuzo Fujiwara informó sobre la síntesis de (E)-1,2-difenileteno a partir de benceno y estireno con Pd(OAc)2 y Cu(OAc)2, un procedimiento muy similar al del acoplamiento cruzado. En la categoría de adición oxidativa, M. L. H. Green informó en 1970 sobre la inserción fotoquímica de tungsteno (como un complejo Cp2WH2) en un enlace C–H de benceno y George M. Whitesides en 1979 fue el primero en llevar a cabo una activación C–H alifática intramolecular.

El siguiente avance fue informado independientemente por dos grupos de investigación en 1982. R. G. Bergman informó la primera activación intermolecular C–H mediada por metales de transición de hidrocarburos inactivados y completamente saturados por adición oxidativa. Usando un enfoque fotoquímico, la fotólisis de Cp*Ir(PMe3)H2, donde Cp* es un ligando pentametilciclopentadienilo, condujo a la especie insaturada coordinativamente Cp*Ir(PMe3) que reaccionó por adición oxidativa con ciclohexano y neopentano para formar los complejos hidridoalquilo correspondientes, Cp*Ir(PMe3)HR, donde R = ciclohexilo y neopentilo, respectivamente. W.A.G. Graham descubrió que los mismos hidrocarburos reaccionan con Cp*Ir(CO)2 tras la irradiación para producir los complejos de alquilhidruro relacionados Cp*Ir(CO)HR, donde R = ciclohexilo y neopentilo, respectivamente. En el último ejemplo, se presume que la reacción se produce mediante la adición oxidativa de alcano a un intermediario de iridio(I) de 16 electrones, Cp*Ir(CO), formado por irradiación de Cp*Ir(CO)2.
Se informó sobre la activación selectiva y funcionalización de enlaces C–H de alcanos utilizando un complejo de tungsteno equipado con ligandos de pentametilciclopentadienilo, nitrosilo, alilo y neopentilo, Cp*W(NO)(η3-alilo)(CH2CMe3).
En un ejemplo que involucra este sistema, el alcano pentano se convierte selectivamente en el halocarbono 1-yodopentano. Esta transformación se logró mediante la termólisis de Cp*W(NO)(η3-alil)(CH2CMe3) en pentano a temperatura ambiente, lo que dio como resultado la eliminación de neopentano mediante un proceso de pseudo-primer orden, generando un intermediario de 16 electrones indetectable, electrónicamente y estéricamente insaturado, que está coordinado por un ligando η2-butadieno. La activación intermolecular posterior de una molécula de solvente de pentano produce un complejo de 18 electrones que posee un ligando n-pentilo. En un paso separado, la reacción con yodo a −60 °C libera 1-yodopentano del complejo.
Comprensión mecánica
Un método para mejorar las reacciones químicas es comprender el mecanismo de reacción subyacente. Se pueden utilizar técnicas espectroscópicas de resolución temporal para seguir la dinámica de la reacción química. Esta técnica requiere un desencadenante para iniciar el proceso, que en la mayoría de los casos es la iluminación del compuesto. Las reacciones fotoiniciadas de complejos de metales de transición con alcanos sirven como un potente sistema modelo para comprender la ruptura del fuerte enlace C-H.

En estos sistemas, la muestra se ilumina con luz ultravioleta, que excita el centro metálico, lo que provoca la disociación del ligando. Esta disociación crea un intermediario de 16 electrones, altamente reactivo y deficiente en electrones, con un sitio de coordinación vacante. Esta especie se une a una molécula de alcano, formando un complejo σ (coordinación de un enlace C-H). En un tercer paso, el átomo de metal se inserta en el enlace C-H, lo escinde y produce el hidruro metálico de alquilo (o arilo).
Los intermediarios y su cinética pueden observarse utilizando técnicas espectroscópicas de resolución temporal (p. ej., TR-IR, TR-XAS, TR-RIXS). La espectroscopia infrarroja de resolución temporal (TR-IR) es un método bastante conveniente para observar estos intermediarios. Sin embargo, solo se limita a complejos que tienen ligandos activos en IR y es propensa a asignaciones correctas en la escala de tiempo de femtosegundos debido al enfriamiento vibracional subyacente. Para responder a la pregunta de la diferencia en reactividad para complejos distintos, es necesario investigar la estructura electrónica de estos. Esto se puede lograr mediante espectroscopia de absorción de rayos X (XAS) o dispersión inelástica resonante de rayos X (RIXS). Estos métodos se han utilizado para seguir los pasos de la activación C-H con resolución orbital y proporcionar información detallada sobre las interacciones responsables de la ruptura del enlace C-H.
En 2023, Girolami informó sobre la caracterización completa de la estructura del metano unido a un centro metálico: los estudios de perturbación isotópica del equilibrio (IPE) que involucran isotopólogos deuterados mostraron que el metano se une al centro metálico a través de un único puente M···H-C; los cambios en las constantes de acoplamiento 1JCH indican claramente que la estructura del ligando de metano está significativamente perturbada en relación con la molécula libre.
Activación C-H dirigida
La activación C-H dirigida, asistida por quelación o "guiada" implica grupos directores que influyen en la regioquímica y la estereoquímica. Este es el estilo más útil de activación C-H en la síntesis orgánica. La N,N-dimetilbencilamina sufre ciclometalación fácilmente por muchos metales de transición. Una implementación semipráctica implica grupos directores de coordinación débil, como lo ilustra la reacción de Murai.

El mecanismo de las reacciones de activación C-H catalizadas por Pd de la 2-fenilpiridina implica un intermediario de metalaciclo. El intermediario se oxida para formar una especie PdIV, seguida de una eliminación reductora para formar el enlace C-O y liberar el producto.

Borylation
La transformación de enlaces C-H en enlaces C-B a través de la borilación ha sido investigada exhaustivamente debido a su utilidad en la síntesis (es decir, para reacciones de acoplamiento cruzado). John F. Hartwig informó sobre una borilación de arenos y alcanos altamente regioselectiva catalizada por un complejo de rodio. En el caso de los alcanos, se observó una funcionalización terminal exclusiva.

Más tarde, se descubrió que los catalizadores de rutenio tenían una mayor actividad y compatibilidad de grupos funcionales.
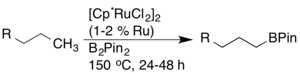
También se han desarrollado otros catalizadores de borilación, incluidos los catalizadores basados en iridio, que activan enlaces C-H con alta compatibilidad.
Para más información, consultar la borilación.
Gas natural
Aunque los químicos no han logrado desarrollar un proceso comercial para la activación selectiva de C-H del metano, dicha reacción es la base de la metanogénesis inversa. En este proceso catalizado por níquel, el metano se convierte en el sustituyente metilo de la coenzima M, CH3SCH2CH2SO−3.
El metano natural no se utiliza como materia prima química, a pesar de su abundancia y bajo coste. La tecnología actual hace un uso prodigioso del metano mediante reformado con vapor para producir gas de síntesis, una mezcla de monóxido de carbono e hidrógeno. Este gas de síntesis se utiliza luego en reacciones de Fischer-Tropsch para fabricar productos con cadenas de carbono más largas o metanol, una de las materias primas químicas industriales más importantes. Un método interesante para convertir estos hidrocarburos implica la activación C-H. Roy A. Periana, por ejemplo, informó que los complejos que contienen metales de transición tardía, como Pt, Pd, Au y Hg, reaccionan con metano (CH4) en H2SO4 para producir bisulfato de metilo. Sin embargo, el proceso no se ha implementado comercialmente.
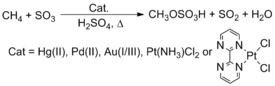
Activaciones asimétricas C-H

La síntesis total del ácido litospérmico emplea una funcionalización C-H guiada en la última etapa hasta formar un sistema altamente funcionalizado. El grupo director, una imina quiral no racémica, es capaz de realizar una alquilación intramolecular, que permite la conversión catalizada por rodio de la imina en dihidrobenzofurano.

La síntesis total de calotrixina A y B se caracteriza por una reacción de acoplamiento cruzado catalizada por Pd intramolecular mediante activación C-H, un ejemplo de una activación C-H guiada. El acoplamiento cruzado se produce entre los enlaces C-I y C-H del arilo para formar un enlace C-C. La síntesis de un análogo de la mescalina emplea la anulación enantioselectiva catalizada por rodio de una aril imina mediante una activación C-H.

Alkene isomerization
No existen ejemplos de activaciones de enlaces C-H de metales de transición comercialmente útiles, salvo para un tipo de conversión: la isomerización de alquenos. Se reconocen al menos dos mecanismos. En el caso de los hidruros de alquenos y metales, la isomerización puede realizarse mediante inserción migratoria, seguida de eliminación de beta-hidruro. Este proceso es la base del recorrido en cadena. Otro mecanismo para la isomerización de alquenos es la conversión de un complejo de alquenos en un complejo de alil-hidruro.
Véase también
- Activación de bonos de carbono
- Acoplamiento oxidativo del metano
- Acoplamiento cruzado deshidrogenativo [Reacción CDC]
- Sistema Shilov
- Funcionalización C-H Meta-selectiva
Comentarios más antiguos
- Pre-2004
- Arndtsen, B. A.; Bergman, R. G.; Mobley, T. A.; Peterson, T. H. (1995). "Selective Intermolecular Carbon–Hydrogen Bond Activation by Synthetic Metal Complexes in Homogeneous Solution". Accounts of Chemical Research. 28 (3): 154–162. doi:10.1021/ar00051a009.
- Crabtree, R. H. (2001). "Alkane C-H activación y funcionalidad con catalizadores homogéneos de metal de transición: un siglo de progreso – un nuevo milenio en perspectiva". J. Chem. Soc., Dalton Trans. 17 (17): 2437–2450. doi:10.1039/B103147N.
- 2004-7
- Crabtree, R. H. (2004). "Activación de CH alcalina organometallica". J. Organomet. Chem. 689 (24): 4083–4091. doi:10.1016/j.jorganchem.2004.07.034. S2CID 95482372.
- Activación de bonificación orgánica C-H: Introducción Alan S. Goldman y Karen I. Goldberg ACS Symposium Series 885, Activation and Functionalization of C-H Bonds, 2004, 1 a 43
- Periana, R. A.; Bhalla, G.; Tenn, W. J.; III; Young, K. J. H.; Liu, X. Y.; Mironov, O.; Jones, C.; Ziatdinov, V. R. (2004). "Perspectives on some challenges and approaches for developing the next generation of selective, low temperature, oxidation catalysts for alkane hydroxylation based on the C–H activación reaction". Journal of Molecular Catalysis A: Chemical. 220 (1): 7–25. doi:10.1016/j.molcata.2004.05.036.
- Lersch, M.Tilset (2005). "Aspectos mecánicos de la activación C-H por Complejos de Pt". Chem. Rev. 105 (6): 2471–2526. doi:10.1021/cr030710y. PMID 15941220., Vedernikov, A. N. (2007). "Recent Advances in the Platinum-mediated CH Bond Functionalization". Curr. Org. Chem. 11 (16): 1401–1416. doi:10.2174/138527207782418708.
- 2008-2011
- Davies, H. M. L.; Manning, J. R. (2008). "Catalytic C–H funcionalización por inserción metalcarbenoide y nitrenoide". Naturaleza. 451 (7177): 417-424. Código:2008Natur.451..417D. doi:10.1038/nature06485. PMC 3033428. PMID 18216847.
- Boutadla, Y.; Davies, D. L.; Macgregor, S. A.; Poblador-Bahamonde, A. I. (2009). "Mecanismos de activación de bonos C-H: sinergia rica entre computación y experimento". Dalton Trans. 2009 (30): 5820–5831. doi:10.1039/B904967C. PMID 19623381.
- Wencel-Delord, J.; Dröge, T.; Liu, F.; Glorius, F. (2011). "Towards Mild Metal-Catalyzed C-H Bond Activation". Chem. Soc. Rev. 40 (9): 4740–4761. doi:10.1039/C1CS15083A. PMID 21666903.
- Shulpin, G. B. (2010). "Mejoramiento de la selectividad en la funcionalidad de los bonos C-H: Una revisión". Org. Biomol. Chem. 8 (19): 4217–4228. doi:10.1039/c004223d. PMID 20593075.
- Lyons, T. W.; Sanford, M. S. (2010). "Palladium-Catalyzed Ligand-Directed C-H Funalization Reactions". Chem. Rev. 110 (2): 1147–1169. doi:10.1021/cr900184e. PMC 2836499. PMID 20078038.*Balcells, D.; Clot, E.; Eisenstein, O. (2010). "C-H Bond Activation in Transition Metal Species from a Computational Perspective". Chem. Rev. 110 (2): 749–823. doi:10.1021/cr900315k. PMID 20067255.
- 2012-2015
- Hashiguchi, B. G.; Bischof, S. M.; Konnick, M. M.; Periana, R. A. (2012). "Designing Catalysts for Functionalization of Unactivated C-H Bonds Based on the CH Activation Reaction". Acc. Chem. Res. 45 (6): 885-898. doi:10.1021/ar200250r. PMID 22482496.
- Kuhl, N.; Hopkinson, M. N.; Wencel-Delord, J.; Glorius, F. (2012). "Más allá de los grupos de dirección: Transition Metal-Catalyzed C H Activation of Simple Arenes". Angew. Chem. Int.. 51 (41): 10236-10254. doi:10.1002/anie.201203269. PMID 22996679.
- Wencel-Delord, J.; Glorius, F. (2013). "La activación de los bonos C-H permite la rápida construcción y diversificación de las moléculas funcionales en el último estadio". Química Naturaleza. 5 (5): 369-375. Código:2013NatCh...5..369W. doi:10.1038/nchem.1607. PMID 23609086.
Fuentes adicionales
- Bergman FAQ en Nature on C-H activation (2007)
- Literatura Presentación de Ramtohul en grupo Stoltz sobre aplicaciones de activación C-H
- Powerpoint en el trabajo de John Bercaw
- Center for Selective C-H Functionalization
Referencias
- ^ a b Gandeepan, Parthasarathy; Müller, Thomas; Zell, Daniel; Cera, Gianpiero; Warratz, Svenja; Ackermann, Lutz (2019). "3d Metales de Transición para la Activación C-H". Reseñas químicas. 119 (4): 2192–2452. doi:10.1021/acs.chemrev.8b00507. PMID 30480438. S2CID 53726772.
- ^ Altus, Kristof M.; Love, Jennifer A. (2021-12-10). "El continuo de mecanismos de activación y terminología del carbono-hidrógeno (C-H). Comunicaciones Química. 4 (1): 1–11. doi:10.1038/s42004-021-00611-1. ISSN 2399-3669. PMC 9814233.
- ^ Chatt, J.; Davidson, J. M. (1965). "El tautomerismo de los complejos de la arene y la fosfina ditertiaria de rutenio(0), y la preparación de nuevos tipos de hidrado-complejos de rutenio(II)". J. Chem. Soc. 1965: 843. doi:10.1039/JR9650000843.
- ^ Murahashi, Shunsuke (1955-12-01). "Sintesis de Phthalimidines de Schiff Bases y Monóxido de carbono". Journal of the American Chemical Society. 77 (23): 6403-6404. doi:10.1021/ja01628a120. ISSN 0002-7863.
- ^ Fekl, U.; Goldberg, K. I. (2003). Hidrocarburo homogéneo C-H Activación y Funcionalización con platino. Avances en Química Inorgánica. Vol. 54. pp. 259–320. doi:10.1016/S0898-8838(03)54005-3. ISBN 9780120236541.
- ^ Fujiwara, Yuzo; Noritani, Ichiro; Danno, Sadao; Asano, Ryuzo; Teranishi, Shiichiro (1969-12-01). "Sustitución aromática de olefinas. VI. Arylation of olefins with palladium(II) acetate". Journal of the American Chemical Society. 91 (25): 7166–7169. doi:10.1021/ja01053a047. ISSN 0002-7863.
- ^ Green, M. L.; Knowles, P. J. (1970). "Formación de un derivado de hidrato de fenil de tungsteno de benceno". J. Chem. Soc.. 24 (24): 1677. doi:10.1039/C29700001677.
- ^ Foley, Paul; Whitesides, George M. (1979). "La generación térmica de bis (triethylphosphine)-3,3-dimetilplatinaciclobutano de dineopentylbis(triethylphosphine)platinum(II)". J. Am. Chem. Soc. 101 (10): 2732–2733. doi:10.1021/ja00504a041.
- ^ a b Janowicz, Andrew H.; Bergman, Robert G. (1982). "Carbon-hidrogen activation in saturated hydrocarbons: direct observation of M + R−H → M(R)(H)". J. Am. Chem. Soc. 104 (1): 352–354. doi:10.1021/ja00365a091.
- ^ a b Hoyano, James K.; Graham, William A. G. (1982). "Adicionamiento oxidativo de los bonos de carbono-hidrógeno de neopentano y cicloohexano a un complejo de iridio(I) generado fotoquímicamente". J. Am. Chem. Soc. 104 (13): 3723–3725. doi:10.1021/ja00377a032.
- ^ Baillie, Rhett A.; Legzdins, Peter (2013). "Activación Distintiva y Funcionalización de Bonos Hidrocarburos C-H Iniciado por Cp*W(NO)(Cp*W(NO)3-allyl)2CMe3) Complejos". Acc. Chem. Res. 47 (2): 330–340. doi:10.1021/ar400108p. PMID 24047442.
- ^ Jay, Raphael M.; Banerjee, Ambar; Leitner, Torsten; Wang, Ru-Pan; Harich, Jessica; Stefanuik, Robert; Wikmark, Hampus; Coates, Michael R.; Beale, Emma V.; Kabanova, Victoria; Kahraman, Abdullah; Wach, Anna; Ozerov, Dmitry; Arrell, Christopher; Johnson, Philip J-0223. M. "Tracking C-H activación con resolución orbital". Ciencia. 380 (6648): 955-960. doi:10.1126/science.adf8042. ISSN 0036-8075. S2CID 259002884.
- ^ Banerjee, Ambar; Jay, Raphael M.; Leitner, Torsten; Wang, Ru-Pan; Harich, Jessica; Stefanuik, Robert; Coates, Michael R.; Beale, Emma V.; Kabanova, Victoria (2023-07-26). Acceso a Interacciones Orbitales Metal-Specíficas en Activación C-H mediante Scattering Resonant Inelastic X-ray (Informe). Química. doi:10.26434/chemrxiv-2023-fm49h.
- ^ Sempsrott, Peter J.; Trinh, Brian B.; Flener Lovitt, Charity; Capra, Nicolas E.; Girolami, Gregory S. (2023-06-09). "Un complejo de metano de Osmium(II): Elucidación del modo de coordinación de metano". Avances científicos. 9 (23): eadg8130. doi:10.1126/sciadv.adg8130. PMC 10256148. PMID 37294762.
- ^ Brückl, T.; Baxter, R. D.; Ishihara, Y.; Baran, P. S. (2012). "Innata y guía C-H Funalization Logic". Accounts of Chemical Research. 45 (6): 826-839. doi:10.1021/ar200194b. 3288638. PMID 22017496.
- ^ Chetcuti, Michael J.; Ritleng, Vincent (2007). "Formación de un Complejo Ruthenium-Arene, Ciclometallación con una Benzylamina Sustituida, e Inserción de un Alquino". J. Chem.. 84 (6): 1014. Código:2007JChEd..84.1014C. doi:10.1021/ed084p1014.
- ^ Murai, Shinji; Kakiuchi, Fumitoshi; Sekine, Shinya; Tanaka, Yasuo; Kamatani, Asayuki; Sonoda, Motohiro; Chatani, Naoto (1993). "Adiciones catalíticas eficientes de bonos aromáticos de carbono-hidrógeno a las olefinas". Naturaleza. 366 (6455): 529–531. código:1993Natur.366..529M. doi:10.1038/366529a0. S2CID 5627826.
- ^ Lyons, T. W.; Sanford, M. S. (2010). "Palladium-Catalyzed Ligand-Directed C-H Funalization Reactions". Chem. Rev. 110 (2): 1147–1169. doi:10.1021/cr900184e. PMC 2836499. PMID 20078038.
- ^ Chen, Huiyuan; Schlecht, Sabine; Semple, Thomas C.; Hartwig, John F. (2000). "Thermal, Catalytic, Regiospecific Functionalization of Alkanes". Ciencia. 287 (5460): 1995–1997. Código:2000Sci...287.1995C. doi:10.1126/ciencia.287.5460.1995. PMID 10720320.
- ^ Murphy, J. M.; Lawrence, J. D.; Kawamura, K.; Incarvito, C.; Hartwig, J. F. (2006). "Ruthenium-Catalyzed Regiospecific Borylation of Methyl C-H bonds". J. Am. Chem. Soc. 128 (42): 13684–13685. doi:10.1021/ja064092p. PMID 17044685.
- ^ Ishiyama, T.; Takagi, J.; Ishida, K.; Miyaura, N.; Anastasi, N. R.; Hartwig, J. F. (2002). "Mild Iridium-Catalyzed Borylation of Arenes. Números de alta rotación, reacciones de temperatura ambiente y aislamiento de un intermediario potencial". J. Am. Chem. Soc. 124 (3): 390-391. doi:10.1021/ja0173019. PMID 11792205.
- ^ Ishiyama, T.; Takagi, J.; Hartwig, J. F.; Miyaura, N. (2002). "A Stoichiometric Aromatic C-H Borylation Catalyzed by Iridium(I)/2,2′-Bipyridine Complexes at Room Temperature". Angewandte Chemie International Edition. 41 (16): 3056–3058. doi:10.1002/1521-3773(20020816)41:16 obtenidos3056::aid-anie3056 confianza3.0.co;2-#. PMID 12203457.
- ^ Press, L. P.; Kosanovich, A. J.; McCulloch, B. J.; Ozerov, O. V. (2016). "High-Turnover Aromatic C-H Borylation Catalyzed by POCOP-Type Pincer Complexes of Iridium". J. Am. Chem. Soc. 138 (30): 9487–9497. doi:10.1021/jacs.6b03656. PMID 27327895.
- ^ Timmers, Peer H. A.; Welte, Cornelia U.; Koehorst, Jasper J.; Plugge, Caroline M.; Jetten, Mike S. M.; Stams, Alfons J. M. (2017). "Metanogénesis reversa y respiración en la arquea metanotrófica". Archaea: 1–22. doi:10.1155/2017/1654237. PMC 5244752. PMID 28154498.
- ^ Sen, A. (1999). "Catalytic Activation of Methane and Ethane by Metal Compounds". En Murai, S. (ed.). Activación de bonos no reactivos y síntesis orgánica. Vol. 3. Springer Berlin Heidelberg. pp. 81–95. ISBN 978-3-540-64862-8.
- ^ "Metanol". www.essentialchemicalindustry.org. Retrieved 2016-02-01.
- ^ Periana, R. A.; Taube, D. J.; Evitt, E. R.; Loffler, D. G.; Wentrcek, P. R.; Voss, G.; Masuda, T. (1993). "Un sistema de alto rendimiento para la oxidación del metano al metanol". Ciencia. 259 (5093): 340–343. Código:1993Sci...259..340P. doi:10.1126/ciencia.259.5093.340. PMID 17832346. S2CID 21140403.
- ^ Periana, R. A.; Taube, D. J.; Gamble, S.; Taube, H.; Satoh, T.; Fujii, H. (1998). "Catálisis de platino para la oxidación de alto rendimiento del metano a un metanol Derivativo". Ciencia. 280 (5363): 560-564. Código:1998Sci...280..560P. doi:10.1126/ciencia.280.5363.560. PMID 9554841.
- ^ Davies, H. M. L.; Morton, D. (2011). "Principios Rectores para Carbenes Ródicos Selectivos y Estereoselectivos C–H Funcionalización por Donor/Aceptor". Chemical Society Reviews. 40 (4): 1857–69. doi:10.1039/C0CS00217H. PMID 21359404.
- ^ O'Malley, S. J.; Tan, K. L.; Watzke, A.; Bergman, R. G.; Ellman, J. A. (2005). "Total Synthesis of (+)-Lithospermic Acid by Asymmetric Intramolecular Alkylation via Catalytic C-H Bond Activation". J. Am. Chem. Soc. 127 (39): 13496–13497. doi:10.1021/ja052680h. PMID 16190703.
- ^ Ramkumar, N.; Nagarajan, R. (2013). "b. Sintesis total de Calothrixin A y B vía C-H Activación". J. Org. Chem. 78 (6): 2802–2807. doi:10.1021/jo302821v. PMID 23421392.
- ^ Ahrendt, Kateri A.; Bergman, Robert G.; Ellman, Jonathan A. (2003-04-01). "Synthesis of a Tricyclic Mescaline Analogue by Catalytic C−H Bond Activation". Cartas orgánicas. 5 (8): 1301–1303. doi:10.1021/ol034228d. ISSN 1523-7060. PMID 12688744.
- ^ Molloy, John J.; Morack, Tobias; Gilmour, Ryan (2019). "Positional and Geometrical Isomerisation of Alkenes: The Pinnacle of Atom Economy". Angewandte Chemie International Edition. 58 (39): 13654–13664. doi:10.1002/anie.201906124. PMID 31233259.

