Actínida
La serie actínida () o actinoide () engloba los 15 elementos químicos metálicos con números atómicos del 89 al 103, del actinio al laurencio. La serie de actínidos deriva su nombre del primer elemento de la serie, el actinio. El símbolo químico informal An se utiliza en debates generales sobre la química de los actínidos para referirse a cualquier actínido.
El Libro Rojo de la IUPAC de 1985 recomienda que se use actinoide en lugar de actínido, ya que el sufijo -uro normalmente indica un ion negativo. Sin embargo, debido al uso actual generalizado, la actínida todavía está permitida. Dado que actinoide significa literalmente similar al actinio (cf. humanoide o androide), se ha argumentado por razones semánticas que el actinio no puede ser lógicamente un actinoide, pero la IUPAC reconoce su inclusión en función del uso común.
Todos los actínidos son elementos del bloque f, excepto el último (lawrencio) que es un elemento del bloque d. El actinio a veces se ha considerado bloque d en lugar de lawrencio, pero la clasificación con lawrencio en el bloque d es adoptada con mayor frecuencia por quienes estudian el tema. La serie corresponde en su mayoría al llenado de la capa de electrones 5f, aunque en el estado fundamental muchos tienen configuraciones anómalas que involucran el llenado de la capa 6d debido a la repulsión interelectrónica. En comparación con los lantánidos, también en su mayoría elementos del bloque f, los actínidos muestran una valencia mucho más variable. Todos ellos tienen radios atómicos e iónicos muy grandes y exhiben una gama inusualmente grande de propiedades físicas. Mientras que el actinio y los actínidos tardíos (desde el americio en adelante) se comportan de manera similar a los lantánidos, los elementos torio, protactinio y uranio son mucho más similares a los metales de transición en su química, con el neptunio y el plutonio ocupando una posición intermedia.
Todos los actínidos son radiactivos y liberan energía tras la desintegración radiactiva; El uranio y el torio naturales y el plutonio producido sintéticamente son los actínidos más abundantes en la Tierra. Estos se utilizan en reactores nucleares y armas nucleares. El uranio y el torio también tienen diversos usos actuales o históricos, y el americio se usa en las cámaras de ionización de la mayoría de los detectores de humo modernos.
De los actínidos, el torio y el uranio primordiales se encuentran naturalmente en cantidades sustanciales. La desintegración radiactiva del uranio produce cantidades transitorias de actinio y protactinio, y ocasionalmente se producen átomos de neptunio y plutonio a partir de reacciones de transmutación en minerales de uranio. Los otros actínidos son elementos puramente sintéticos. Las pruebas de armas nucleares han liberado al medio ambiente al menos seis actínidos más pesados que el plutonio; El análisis de los escombros de la explosión de una bomba de hidrógeno en 1952 mostró la presencia de americio, curio, berkelio, californio, einstenio y fermio.
En las presentaciones de la tabla periódica, los elementos del bloque f suelen mostrarse como dos filas adicionales debajo del cuerpo principal de la tabla. Esta convención es enteramente una cuestión de estética y practicidad de formato; una tabla periódica de formato ancho que rara vez se usa inserta las series 4f y 5f en sus lugares apropiados, como partes de las filas sexta y séptima de la tabla (períodos).
| Actin-ium89Ac [227] | Thorio90Th 232.04 | Protactinium91Pa 231.04 | Uranium92U 238.03 | Neptu-nium93Np [237] | Plutón-94Pu [244] | Americium95Am [243] | Curium96Cm [247] | Berkel-ium97Bk [247] | Californio98Cf [251] | Einsteinium99Es [252] | Fermium100Fm [257] | Mende-levium101Md [258] | Nobel102No [259] | Lawren-cium103Lr [266] |
Primordial De la decadencia SintéticoFrontera muestra la ocurrencia natural del elemento
Descubrimiento, aislamiento y síntesis
| Elemento | Año | Método |
|---|---|---|
| Neptunium | 1940 | Bombarding 238U por neutrones |
| Plutonium | 1941 | Bombarding 238U by deuterons |
| Americium | 1944 | Bombarding 239Pu por neutrones |
| Curium | 1944 | Bombarding 239Pu por partículas α |
| Berkelium | 1949 | Bombarding 241Am por partículas α |
| Californio | 1950 | Bombarding 242Cm por partículas α |
| Einsteinium | 1952 | Como producto de la explosión nuclear |
| Fermium | 1952 | Como producto de la explosión nuclear |
| Mendelevium | 1955 | Bombarding 253Es por partículas α |
| Nobelium | 1965 | Bombarding 243Am por 15N o 238U con 22Ne |
| Lawrencium | 1961 –1971 | Bombarding 252Cf por 10B o 11B y de 243Am con 18O |
Al igual que los lantánidos, los actínidos forman una familia de elementos con propiedades similares. Dentro de los actínidos, existen dos grupos superpuestos: elementos transuránicos, que siguen al uranio en la tabla periódica; y elementos transplutonio, que siguen al plutonio. En comparación con los lantánidos, que (excepto el prometio) se encuentran en la naturaleza en cantidades apreciables, la mayoría de los actínidos son raros. La mayoría no se encuentran en la naturaleza, y de los que sí, solo el torio y el uranio lo hacen en cantidades más que mínimas. Los actínidos más abundantes o más fáciles de sintetizar son el uranio y el torio, seguidos por el plutonio, el americio, el actinio, el protactinio, el neptunio y el curio.
La existencia de elementos transuránicos fue sugerida en 1934 por Enrico Fermi, basándose en sus experimentos. Sin embargo, aunque en ese momento se conocían cuatro actínidos, aún no se entendía que formaban una familia similar a los lantánidos. La opinión predominante que dominó las primeras investigaciones sobre los transuránicos fue que eran elementos regulares en el séptimo período, con torio, protactinio y uranio correspondientes al hafnio, tantalio y tungsteno del sexto período, respectivamente. La síntesis de transuránicos socavó gradualmente este punto de vista. En 1944, una observación de que el curio no mostraba estados de oxidación superiores a 4 (mientras que su supuesto homólogo del sexto período, el platino, puede alcanzar un estado de oxidación de 6) llevó a Glenn Seaborg a formular una "hipótesis de actínidos". Los estudios de actínidos conocidos y los descubrimientos de otros elementos transuránicos proporcionaron más datos en apoyo de esta posición, pero la frase "hipótesis de los actínidos" (lo que implica que una "hipótesis" es algo que no ha sido probado de manera decisiva) permaneció en uso activo por parte de los científicos hasta fines de la década de 1950.
En la actualidad, existen dos métodos principales para producir isótopos de elementos transplutonio: (1) irradiación de los elementos más ligeros con neutrones; (2) irradiación con partículas cargadas aceleradas. El primer método es más importante para las aplicaciones, ya que solo la irradiación de neutrones utilizando reactores nucleares permite la producción de cantidades considerables de actínidos sintéticos; sin embargo, se limita a elementos relativamente ligeros. La ventaja del segundo método es que se pueden obtener elementos más pesados que el plutonio, así como isótopos deficientes en neutrones, que no se forman durante la irradiación de neutrones.
Entre 1962 y 1966, hubo intentos en los Estados Unidos de producir isótopos de transplutonio mediante una serie de seis explosiones nucleares subterráneas. Se extrajeron pequeñas muestras de roca del área de la explosión inmediatamente después de la prueba para estudiar los productos de la explosión, pero no se pudieron detectar isótopos con un número de masa superior a 257, a pesar de las predicciones de que dichos isótopos tendrían vidas medias relativamente largas de descomposición alfa. Esta falta de observación se atribuyó a la fisión espontánea debido a la gran velocidad de los productos ya otros canales de desintegración, como la emisión de neutrones y la fisión nuclear.
De actinio a uranio
El uranio y el torio fueron los primeros actínidos descubiertos. El uranio fue identificado en 1789 por el químico alemán Martin Heinrich Klaproth en el mineral de pechblenda. Lo nombró por el planeta Urano, que había sido descubierto ocho años antes. Klaproth pudo precipitar un compuesto amarillo (probablemente diuranato de sodio) al disolver pechblenda en ácido nítrico y neutralizar la solución con hidróxido de sodio. Luego redujo el polvo amarillo obtenido con carbón y extrajo una sustancia negra que confundió con metal. Sesenta años después, el científico francés Eugène-Melchior Péligot lo identificó como óxido de uranio. También aisló la primera muestra de uranio metálico calentando tetracloruro de uranio con potasio metálico. La masa atómica del uranio se calculó entonces como 120, pero Dmitri Mendeleev en 1872 la corrigió a 240 usando sus leyes de periodicidad. Este valor fue confirmado experimentalmente en 1882 por K. Zimmerman.
El óxido de torio fue descubierto por Friedrich Wöhler en el mineral torianita, que se encontró en Noruega (1827). Jöns Jacob Berzelius caracterizó este material con más detalle en 1828. Mediante la reducción de tetracloruro de torio con potasio, aisló el metal y lo llamó torio en honor al dios nórdico del trueno y el relámpago Thor. Péligot utilizó más tarde el mismo método de aislamiento para el uranio.
El actinio fue descubierto en 1899 por André-Louis Debierne, asistente de Marie Curie, en los desechos de pechblenda que quedaron después de la eliminación del radio y el polonio. Describió la sustancia (en 1899) como similar al titanio y (en 1900) como similar al torio. Sin embargo, el descubrimiento del actinio por Debierne fue cuestionado en 1971 y 2000, argumentando que las publicaciones de Debierne en 1904 contradecían su trabajo anterior de 1899-1900. En cambio, esta opinión acredita el trabajo de 1902 de Friedrich Oskar Giesel, quien descubrió un elemento radiactivo llamado emanio que se comportaba de manera similar al lantano. El nombre actinio proviene del griego antiguo: ακτίς, ακτίνος (aktis, aktinos), que significa haz o rayo. Este metal no fue descubierto por su propia radiación sino por la radiación de los productos hijos. Debido a la estrecha similitud del actinio y el lantano y la baja abundancia, el actinio puro solo se pudo producir en 1950. El término actínido probablemente fue introducido por Victor Goldschmidt en 1937.
El protactinio posiblemente fue aislado en 1900 por William Crookes. Se identificó por primera vez en 1913, cuando Kasimir Fajans y Oswald Helmuth Göhring encontraron el isótopo de corta duración 234mPa (vida media 1,17 minutos) durante sus estudios del 238U decadencia. Llamaron al nuevo elemento brevium (del latín brevis que significa breve); el nombre se cambió a protoactinium (del griego πρῶτος + ἀκτίς que significa "primer elemento de haz") en 1918 cuando dos grupos de científicos, encabezados por la austriaca Lise Meitner y Otto Hahn de Alemania y Frederick Soddy y John Cranston de Gran Bretaña, descubrieron de forma independiente el 231Pa. El nombre se acortó a protactinio en 1949. Este elemento se caracterizó poco hasta 1960, cuando A. G. Maddock y sus compañeros de trabajo en el Reino Unido aislaron 130 gramos de protactinio de 60 toneladas de desechos que quedaron después de la extracción de uranio. de su mineral.
Neptunio y superior
Edwin McMillan y Philip H. Abelson descubrieron el neptunio (llamado así por el planeta Neptuno, el siguiente planeta a partir de Urano, que dio nombre al uranio) en 1940 en Berkeley, California. Produjeron el isótopo 239Np (vida media = 2,4 días) bombardeando uranio con neutrones lentos. Fue el primer elemento transuránico producido sintéticamente.
Los elementos transuránicos no se encuentran en cantidades considerables en la naturaleza y normalmente se sintetizan a través de reacciones nucleares realizadas con reactores nucleares. Por ejemplo, bajo la irradiación con neutrones del reactor, el uranio-238 se convierte parcialmente en plutonio-239:
Esta reacción de síntesis fue utilizada por Fermi y sus colaboradores en el diseño de los reactores ubicados en el sitio de Hanford, que produjeron cantidades significativas de plutonio-239 para las armas nucleares del Proyecto Manhattan y los EE. UU. arsenal nuclear de posguerra.
Los actínidos con los números de masa más altos se sintetizan bombardeando uranio, plutonio, curio y californio con iones de nitrógeno, oxígeno, carbono, neón o boro en un acelerador de partículas. Así, el nobelio se produjo bombardeando uranio-238 con neón-22 como
- .
Los primeros isótopos de elementos transplutonio, americio-241 y curio-242, fueron sintetizados en 1944 por Glenn T. Seaborg, Ralph A. James y Albert Ghiorso. El curio-242 se obtuvo bombardeando plutonio-239 con partículas α de 32 MeV
- .
Los isótopos americio-241 y curio-242 también se produjeron mediante la irradiación de plutonio en un reactor nuclear. Este último elemento lleva el nombre de Marie Curie y su esposo Pierre, quienes se destacan por descubrir el radio y por su trabajo en radioactividad.
El bombardeo de curio-242 con partículas α dio como resultado un isótopo de californio 245Cf (1950), y un procedimiento similar produjo en 1949 berkelio-243 a partir de americio-241. Los nuevos elementos recibieron el nombre de Berkeley, California, por analogía con su homólogo lantánido, el terbio, que recibió su nombre del pueblo de Ytterby en Suecia.
En 1945, B. B. Cunningham obtuvo el primer compuesto químico a granel de un elemento transplutonio, a saber, hidróxido de americio. A lo largo de los años, se acumularon cantidades de miligramos de americio y microgramos de curio que permitieron la producción de isótopos de berkelio (Thomson, 1949) y californio (Thomson, 1950). Cantidades considerables de estos elementos se produjeron en 1958 (Burris B. Cunningham y Stanley G. Thomson), y el primer compuesto de californio (0,3 µg de CfOCl) se obtuvo en 1960 por B. B. Cunningham y J. C. Wallmann.
El einstenio y el fermio se identificaron entre 1952 y 1953 en las consecuencias del "Ivy Mike" prueba nuclear (1 de noviembre de 1952), la primera prueba exitosa de una bomba de hidrógeno. La exposición instantánea de uranio-238 a un gran flujo de neutrones resultante de la explosión produjo isótopos pesados de uranio, incluidos el uranio-253 y el uranio-255, y su desintegración β produjo einstenio-253 y fermio-255. El descubrimiento de los nuevos elementos y los nuevos datos sobre la captura de neutrones se mantuvieron inicialmente en secreto por orden del ejército estadounidense hasta 1955 debido a las tensiones de la Guerra Fría. Sin embargo, el equipo de Berkeley pudo preparar einstenio y fermio por medios civiles, mediante el bombardeo de plutonio-239 con neutrones, y publicó este trabajo en 1954 con la advertencia de que no eran los primeros estudios que se habían realizado sobre esos elementos. El 'Ivy Mike' los estudios fueron desclasificados y publicados en 1955. Las primeras cantidades significativas (submicrogramos) de einstenio fueron producidas en 1961 por Cunningham y sus colegas, pero esto aún no se ha hecho para el fermio.
El primer isótopo de mendelevio, 256Md (vida media 87 min), fue sintetizado por Albert Ghiorso, Glenn T. Seaborg, Gregory R. Choppin, Bernard G. Harvey y Stanley G. Thompson cuando bombardearon un blanco de 253 Es con partículas alfa en el ciclotrón de 60 pulgadas del Laboratorio de Radiación de Berkeley; este fue el primer isótopo de cualquier elemento que se sintetizó un átomo a la vez.
Hubo varios intentos de obtener isótopos de nobelio por parte de grupos suecos (1957) y estadounidenses (1958), pero el primer resultado fiable fue la síntesis de 256No por parte del grupo ruso (Georgy Flyorov et al.) en 1965, como lo reconoció la IUPAC en 1992. En sus experimentos, Flyorov et al. bombardearon uranio-238 con neón-22.
En 1961, Ghiorso et al. obtuvo el primer isótopo de laurencio al irradiar californio (principalmente californio-252) con iones de boro-10 y boro-11. El número de masa de este isótopo no estaba claramente establecido (posiblemente 258 o 259) en ese momento. En 1965, Flyorov et al. sintetizó 256Lr a partir de 243Am y 18O. Así, la IUPAC reconoció a los equipos de física nuclear de Dubna y Berkeley como los co-descubridores del laurencio.
Isótopos
| Propiedades nucleares de isótopos de los isótopos transplutonio más importantes | ||||||
|---|---|---|---|---|---|---|
| Isotope | Media vida | Probability of espontáneafis en % | Emission energy (MeV) (yield in %) | Actividad específica (Bq/kg) de | ||
| α | γ | α, partículas β | fisión | |||
| 241Am | 432.2(7) y | 4.3(18)×10−10 | 5.485 (84.8) 5.442 (13.1) 5.388 (1.66) | 0,059 (35,9) 0,026 (2,27) | 1.27×1014 | 546.1 |
| 243Am | 7.37(4)×103 Sí. | 3.7 2)×10−9 | 5.275 (87.1) 5.233 (11.2) 5.181 (1.36) | 0,074 (67.2) 0,043 (5,9) | 7.39×1012 | 273.3 |
| 242Cm | 162.8 2) d | 6.2(3)×10−6 | 6.069 (25.92) 6.112 (74.08) | 0,044 (0.04) 0.102 (4×10−3) | 1.23×1017 | 7.6×109 |
| 244Cm | 18.10(2) y | 1.37(3)×10−4 | 5.762 (23.6) 5.804 (76.4) | 0,043 (0.02) 0.100 (1.5×10−3) | 2.96×1015 | 4.1×109 |
| 245Cm | 8.5(1)×103 Sí. | 6.1(9)×10−7 | 5.529 (0,58) 5.488 (0,83) 5.361 (93.2) | 0,175 (9,88) 0.133 (2.83) | 6.35×1012 | 3.9×104 |
| 246Cm | 4.76(4)×103 Sí. | 0,02615(7) | 5.343 (17.8) 5.386 (82.2) | 0,045 (19) | 1.13×1013 | 2.95×109 |
| 247Cm | 1.56(5)×107 Sí. | — | 5.267 (13.8) 5.212 (5.7) 5.147 (1.2) | 0.402 (72) 0,278 (3.4) | 3.43×109 | — |
| 248Cm | 3.48(6)×105 Sí. | 8.39(16) | 5.034 (16.52) 5.078 (75) | — | 1.40×1011 | 1.29×1010 |
| 249Bk | 330(4) d | 4.7 2)×10−8 | 5.406 (1 5.406)×10−3) 5.378 (2.6×10−4) | 0,32 (5,8)×10; 5 -) | 5.88×1016 | 2.76×107 |
| 249Cf | 351(2) y | 5.0(4)×10−7 | 6.193 (2.46) 6.139 (1.33) 5.946 (3.33) | 0,388 (66) 0.333 (14.6) | 1.51×1014 | 7.57×105 |
| 250Cf | 13.08(9) y | 0,077(3) | 5.988 (14.99) 6.030 (84.6) | 0,043 | 4.04×1015 | 3.11×1012 |
| 251Cf | 900(40) y | ? | 6.078 (2.6) 5.567 (0,9) 5.569 (0,9) | 0.177 (17.3) 0,27 (6,8) | 5.86×1013 | — |
| 252Cf | 2.645(8) y | 3.092(8) | 6.075 (15.2) 6.118 (81.6) | 0,042 (1,4×10−2) 0.100 (1.3×10−2) | 1.92×1016 | 6.14×1014 |
| 254Cf | 60.5 2) d | ■100 | 5.834 (0,26) 5.792 (5.3×10−2) | — | 9.75×1014 | 3.13×1017 |
| 253Es | 20.47(3) d | 8.7(3)×10−6 | 6.540 (0,85) 6.552 (0,71) 6.590 (6.6) | 0,387 (0,05) 0.429 (8)×10−3) | 9.33×1017 | 8.12×1010 |
| 254Es | 275.7(5) d | 3×10−6 | 6.347 (0,75) 6.358 (2.6) 6.415 (1.8) | 0,042 (100) 0,034 (30) | 6.9×1016 | — |
| 255Es | 39.8(12) d | 0,0041(2) | 6.267 (0,78) 6.401 (7) | — | 4.38×1017(β) 3.81×1016(α) | 1.95×1013 |
| 255F m | 20.07(7) h | 2.4(10)×10; 5 - | 7.022 (93.4) 6.963 (5.04) 6.892 (0,62) | 0,00057 (19.1) 0,081 (1) | 2.27×1019 | 5.44×1012 |
| 256F m | 157.6(13) min | 91.9 3) | 6.872 (1.2) 6.917 (6.9) | — | 1.58×1020 | 1.4×1019 |
| 257F m | 100.5 2) d | 0.210(4) | 6.752 (0,58) 6.695 (3.39) 6.622 (0,6) | 0.241 (11) 0.179 (8.7) | 1.87×1017 | 3.93×1014 |
| 256Md | 77 2) min | — | 7.142 (1.84) 7.206 (5.9) | — | 3.53×1020 | — |
| 257Md | 5.52(5) h | — | 7.074 (14) | 0.371 (11,7) 0,325 (2,5) | 8.17×1019 | — |
| 258Md | 51.5(3) d | — | 6.73 | — | 3.64×1017 | — |
| 255No | 3.1 2) min | — | 8.312 (1.16) 8.266 (2.6) 8.121 (27.8) | 0.187 (3.4) | 8.78×1021 | — |
| 259No | 58(5) min | — | 7.455 (9.8) 7.500 (29.3) 7.533 (17.3) | — | 4.63×1020 | — |
| 256Lr | 27(3) s | ▪ 0,03 | 8.319 (5.4) 8.390 (16) 8.430 (33) | — | 5.96×1022 | — |
| 257Lr | 646(25) ms | — | 8.796 (18) 8.861 (82) | — | 1.54×1024 | — |
En 2016 se identificaron 32 isótopos de actinio y ocho estados isoméricos excitados de algunos de sus nucleidos. Tres isótopos, 225Ac, 227Ac y 228Ac, se encontraron en la naturaleza y los demás se produjeron en el laboratorio; solo los tres isótopos naturales se utilizan en las aplicaciones. El actinio-225 es un miembro de la serie del neptunio radiactivo; fue descubierto por primera vez en 1947 como un producto de descomposición del uranio-233, es un emisor α con una vida media de 10 días. El actinio-225 está menos disponible que el actinio-228, pero es más prometedor en aplicaciones de radiotrazadores. El actinio-227 (vida media de 21,77 años) se encuentra en todos los minerales de uranio, pero en pequeñas cantidades. Un gramo de uranio (en equilibrio radiactivo) contiene solo 2×10−10 gramo de 227Ac. El actinio-228 es un miembro de la serie del torio radiactivo formado por la desintegración del 228Ra; es un emisor β− con una vida media de 6,15 horas. En una tonelada de torio hay 5×10−8 gramo de 228Ac. Fue descubierto por Otto Hahn en 1906.
Hay 31 isótopos conocidos de torio que varían en número de masa de 208 a 238. De estos, el más longevo es 232Th, cuya vida media de 1.4×1010< /sup> años significa que todavía existe en la naturaleza como un nucleido primordial. El siguiente más longevo es 230Th, un producto de desintegración intermedia de 238U con una vida media de 75 400 años. Varios otros isótopos de torio tienen vidas medias de más de un día; todos estos también son transitorios en las cadenas de decaimiento de 232Th, 235U y 238U.
Se conocen 28 isótopos de protactinio con números de masa 212-239, así como tres estados isoméricos excitados. En la naturaleza solo se han encontrado 231Pa y 234Pa. Todos los isótopos tienen vidas cortas, excepto el protactinio-231 (vida media de 32 760 años). Los isótopos más importantes son 231Pa y 233Pa, que es un producto intermedio en la obtención de uranio-233 y es el más asequible entre los isótopos artificiales de protactinio. 233Pa tiene una vida media conveniente y energía de radiación γ y, por lo tanto, se usó en la mayoría de los estudios de química de protactinio. El protactinio-233 es un emisor β con una vida media de 26,97 días.
Hay 26 isótopos conocidos de uranio, con números de masa 215–242 (excepto 220 y 241). Tres de ellos, 234U, 235U y 238U, están presentes en cantidades apreciables en la naturaleza. Entre otros, el más importante es el 233U, que es un producto final de transformación del 232Th irradiado por neutrones lentos. El 233U tiene una eficiencia de fisión mucho mayor con neutrones (térmicos) de baja energía, en comparación, p. con 235U. La mayoría de los estudios de química del uranio se realizaron con uranio-238 debido a su larga vida media de 4,4×10 9 años.
Hay 24 isótopos de neptunio con números de masa de 219, 220 y 223–244; todos ellos son altamente radiactivos. Los más populares entre los científicos son 237Np de larga duración (t1/2 = 2,20× 106 años) y de corta duración 239Np, 238Np (t1/2 ~ 2 días).
Se conocen dieciocho isótopos de americio con números de masa de 229 a 247 (con la excepción de 231). Los más importantes son 241Am y 243Am, que son emisores alfa y también emiten rayos γ suaves pero intensos; ambos se pueden obtener en forma isotópicamente pura. Las propiedades químicas del americio se estudiaron primero con 241Am, pero luego cambiaron a 243Am, que es casi 20 veces menos radiactivo. La desventaja de 243Am es la producción del isótopo hijo de vida corta 239Np, que debe tenerse en cuenta en el análisis de datos.
Entre 19 isótopos de curio, que varían en número de masa de 233 a 251, los más accesibles son 242Cm y 244Cm; son emisores α, pero con una vida útil mucho más corta que los isótopos de americio. Estos isótopos casi no emiten radiación γ, pero experimentan una fisión espontánea con la emisión asociada de neutrones. Los isótopos de curio de vida más prolongada (245–248Cm, todos emisores α) se forman como una mezcla durante la irradiación con neutrones de plutonio o americio. Tras una breve irradiación, esta mezcla está dominada por 246Cm, y luego 248Cm comienzan a acumularse. Ambos isótopos, especialmente 248Cm, tienen una vida media más prolongada (3,48×105 años) y son mucho más convenientes para realizar investigaciones químicas que 242Cm y 244Cm, pero también tienen una tasa de fisión espontánea bastante alta. 247Cm tiene la vida útil más larga entre los isótopos de curio (1,56×10< span data-sort-value="7000700000000000000♠">7 años), pero no se forma en grandes cantidades debido a la fuerte fisión inducida por los neutrones térmicos.
Se identificaron diecisiete isótopos de berkelio con los números de masa 233–234, 236, 238 y 240–252. Solo 249Bk está disponible en grandes cantidades; tiene una vida media relativamente corta de 330 días y emite principalmente partículas β blandas, que son inconvenientes para la detección. Su radiación alfa es bastante débil (1.45×10−3% con respecto a la radiación β), pero a veces se usa para detectar este isótopo. 247Bk es un emisor alfa con una larga vida media de 1380 años, pero es difícil de obtener en cantidades apreciables; no se forma con la irradiación de plutonio con neutrones debido a la estabilidad β de los isótopos de curio con un número de masa inferior a 248.
Los 20 isótopos de californio con números de masa 237–256 se forman en reactores nucleares; californium-253 es un emisor β y el resto son emisores α. Los isótopos con números de masa par (250Cf, 252Cf y 254Cf) tienen una alta tasa de fisión espontánea, especialmente 254 Cf de los cuales el 99,7% se descompone por fisión espontánea. Californium-249 tiene una vida media relativamente larga (352 años), fisión espontánea débil y fuerte emisión γ que facilita su identificación. 249Cf no se forma en grandes cantidades en un reactor nuclear debido a la lenta desintegración β del isótopo original 249Bk y una gran sección transversal de interacción con los neutrones, pero se puede acumular en la forma isotópicamente pura como el producto de desintegración β de (preseleccionado) 249Bk. El californio producido por la irradiación de plutonio en el reactor consiste principalmente en 250Cf y 252Cf, siendo este último predominante para grandes fluencias de neutrones, y su estudio se ve obstaculizado por la fuerte radiación de neutrones..
| Parent isótopo | t1/2 | Hija isótopo | t1/2 | Hora de establecer equilibrio radiactivo |
|---|---|---|---|---|
| 243Am | 7370 años | 239Np | 2.35 días | 47.3 días |
| 245Cm | 8265 años | 241Pu | 14 años | 129 años |
| 247Cm | 1.64×107 años | 243Pu | 4.95 horas | 7.2 días |
| 254Es | 270 días | 250Bk | 3.2 horas | 35,2 horas |
| 255Es | 39,8 días | 255F m | 22 horas | 5 días |
| 257F m | 79 días | 253Cf | 17,6 días | 49 días |
Entre los 18 isótopos conocidos de einstenio con números de masa de 240 a 257, el más asequible es 253Es. Es un emisor α con una vida media de 20,47 días, una emisión γ relativamente débil y una pequeña tasa de fisión espontánea en comparación con los isótopos de californio. La irradiación prolongada de neutrones también produce un isótopo de vida prolongada 254Es (t1/2 = 275,5 días).
Se conocen veinte isótopos de fermio con números de masa de 241–260. 254Fm, 255Fm y 256Fm son emisores α con una vida media corta (horas), que pueden aislarse en cantidades significativas. 257Fm (t1/2 = 100 días) puede acumularse tras una irradiación intensa y prolongada. Todos estos isótopos se caracterizan por altas tasas de fisión espontánea.
Entre los 17 isótopos conocidos de mendelevio (números de masa de 244 a 260), el más estudiado es 256Md, que se desintegra principalmente a través de la captura de electrones (la radiación α es ≈10 %) con la vida media de 77 minutos. Otro emisor alfa, 258Md, tiene una vida media de 53 días. Ambos isótopos se producen a partir de einstenio raro (253Es y 255Es respectivamente), lo que limita su disponibilidad.
Los isótopos de nobelio de vida larga y los isótopos de laurencio (y de elementos más pesados) tienen vidas medias relativamente cortas. Para el nobelio, se conocen 11 isótopos con números de masa 250-260 y 262. Las propiedades químicas del nobelio y el laurencio se estudiaron con 255No (t1/2 = 3 min) y 256Lr (t1/2 = 35 s). El isótopo de nobelio de vida más larga, 259No, tiene una vida media de aproximadamente 1 hora. El laurencio tiene 13 isótopos conocidos con números de masa 251–262 y 266. El más estable de todos es 266Lr con una vida media de 11 horas.
Entre todos estos, los únicos isótopos que ocurren en cantidades suficientes en la naturaleza para ser detectados en algo más que trazas y tienen una contribución medible a los pesos atómicos de los actínidos son los primordiales 232Th, 235U y 238U, y tres productos de desintegración de larga duración del uranio natural, 230Th, 231Pa, y 234U. El torio natural consta de 0,02(2)% 230Th y 99,98(2)% 232Th; el protactinio natural consiste en 100% 231Pa; y el uranio natural consta de 0,0054(5) % 234U, 0,7204(6) % 235U y 99,2742(10) % 238U.
Formación en reactores nucleares
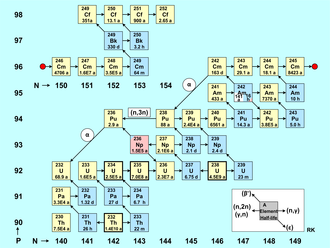
La figura acumulación de actínidos es una tabla de nucleidos con el número de neutrones en el eje horizontal (isótopos) y el número de protones en el eje vertical (elementos). El punto rojo divide los nucleidos en dos grupos, por lo que la figura es más compacta. Cada nucleido está representado por un cuadrado con el número de masa del elemento y su tiempo medio. Los isótopos de actínidos existentes naturalmente (Th, U) están marcados con un borde en negrita, los emisores alfa tienen un color amarillo y los emisores beta tienen un color azul. El rosa indica captura de electrones (236Np), mientras que el blanco representa un estado metaestable de larga duración (242Am).
La formación de nucleidos de actínidos se caracteriza principalmente por:
- Neutron captura reacciones (n,γ), que están representadas en la figura por una flecha corta derecha.
- También se tienen en cuenta las reacciones (n,2n) y las reacciones menos frecuentes (γ,n), ambas marcadas por una flecha izquierda corta.
- Aún más raramente y sólo provocada por neutrones rápidos, se produce la reacción (n,3n), que está representada en la figura con un ejemplo, marcado por una flecha izquierda larga.
Además de estas reacciones nucleares inducidas por neutrones o gamma, la conversión radiactiva de los nucleidos de actínidos también afecta el inventario de nucleidos en un reactor. Estos tipos de descomposición están marcados en la figura con flechas diagonales. La desintegración beta-menos, marcada con una flecha que apunta hacia arriba a la izquierda, juega un papel importante en el equilibrio de las densidades de partículas de los nucleidos. Los nucleidos que se desintegran por emisión de positrones (decaimiento beta-plus) o captura de electrones (ϵ) no ocurren en un reactor nuclear excepto como productos de reacciones de desactivación; sus desintegraciones están marcadas con flechas que apuntan hacia abajo a la derecha. Debido a las largas vidas medias de los nucleidos dados, la desintegración alfa casi no juega ningún papel en la formación y desintegración de los actínidos en un reactor de potencia, ya que el tiempo de residencia del combustible nuclear en el núcleo del reactor es bastante corto (unos pocos años).). Las excepciones son los dos nucleidos de vida relativamente corta 242Cm (T1/2 = 163 d) y 236Pu (T1 /2 = 2,9 año). Solo para estos dos casos, el decaimiento α está marcado en el mapa de nucleidos por una flecha larga que apunta hacia abajo a la izquierda.
Distribución en la naturaleza
El torio y el uranio son los actínidos más abundantes en la naturaleza con concentraciones de masa respectivas de 16 ppm y 4 ppm. El uranio se encuentra principalmente en la corteza terrestre como una mezcla de sus óxidos en el mineral uraninita, también llamado pechblenda por su color negro. Hay varias docenas de otros minerales de uranio como la carnotita (KUO2VO4·3H2O) y autunita (Ca(UO2)2(PO4)2·nH2O). La composición isotópica del uranio natural es 238U (abundancia relativa 99,2742%), 235U (0,7204%) y 234U (0,0054%); de estos 238U tiene la mayor vida media de 4,51×10< span data-sort-value="7000900000000000000♠">9 años. La producción mundial de uranio en 2009 ascendió a 50.572 toneladas, de las cuales el 27,3% se extrajo en Kazajstán. Otros importantes países mineros de uranio son Canadá (20,1 %), Australia (15,7 %), Namibia (9,1 %), Rusia (7,0 %) y Níger (6,4 %).
| Ore | Ubicación | Uranio contenido, % | Relación de masas 239Pu/ore | Ratio 239Pu/U ()×1012) |
|---|---|---|---|---|
| Urano | Canadá | 13.5 | 9.1×10−12 | 7.1 |
| Urano | Congo | 38 | 4.8×10−12 | 12 |
| Urano | Colorado, EE.UU. | 50 | 3.8×10−12 | 7.7 |
| Monazite | Brasil | 0,244 | 2.1×10−14 | 8.3 |
| Monazite | North Carolina, US | 1.64 | 5.9×10−14 | 3.6 |
| Fergusonite | - | 0,25 | c)×10−14 | c) |
| Carnotite | - | 10 | c)×10−14 | ■0.4 |
Los minerales de torio más abundantes son la torianita (ThO2), la torita (ThSiO4) y monacita, ((Th,Ca,Ce)PO< subclase="template-chem2-sub">4). La mayoría de los minerales de torio contienen uranio y viceversa; y todos tienen una fracción significativa de lantánidos. Los ricos yacimientos de minerales de torio se encuentran en los Estados Unidos (440 000 toneladas), Australia e India (~300 000 toneladas cada uno) y Canadá (~100 000 toneladas).
La abundancia de actinio en la corteza terrestre es de solo 5×10< span data-sort-value="2998850000000000000♠">−15%. El actinio está presente principalmente en los que contienen uranio, pero también en otros minerales, aunque en cantidades mucho menores. El contenido de actinio en la mayoría de los objetos naturales corresponde al equilibrio isotópico del isótopo padre 235U, y no se ve afectado por la débil migración de Ac. El protactinio es más abundante (10−12%) en la corteza terrestre que el actinio. Fue descubierto en el mineral de uranio en 1913 por Fajans y Göhring. Como actinio, la distribución del protactinio sigue la de 235U.
La vida media del isótopo de neptunio de vida más larga, 237Np, es insignificante en comparación con la edad de la Tierra. Así, el neptunio está presente en la naturaleza en cantidades insignificantes producidas como productos intermedios de descomposición de otros isótopos. Las trazas de plutonio en minerales de uranio se encontraron por primera vez en 1942, y los resultados más sistemáticos sobre 239Pu se resumen en la tabla (no se pudieron detectar otros isótopos de plutonio en esas muestras). El límite superior de abundancia del isótopo más longevo del plutonio, 244Pu, es 3×10−20%. No se pudo detectar plutonio en muestras de suelo lunar. Debido a su escasez en la naturaleza, la mayor parte del plutonio se produce sintéticamente.
Extracción
Debido a la baja abundancia de actínidos, su extracción es un proceso complejo de varios pasos. Los fluoruros de actínidos se usan generalmente porque son insolubles en agua y se pueden separar fácilmente con reacciones redox. Los fluoruros se reducen con calcio, magnesio o bario:
Entre los actínidos, el torio y el uranio son los más fáciles de aislar. El torio se extrae principalmente de la monacita: el pirofosfato de torio (ThP2O7) se hace reaccionar con ácido nítrico y el nitrato de torio producido se trata con fosfato de tributilo. Las impurezas de tierras raras se separan aumentando el pH en solución de sulfato.
En otro método de extracción, la monacita se descompone con una solución acuosa de hidróxido de sodio al 45 % a 140 °C. Los hidróxidos metálicos mixtos se extraen primero, se filtran a 80 °C, se lavan con agua y se disuelven con ácido clorhídrico concentrado. A continuación, la solución ácida se neutraliza con hidróxidos a pH = 5,8 que da como resultado la precipitación de hidróxido de torio (Th(OH)4) contaminado con ~3 % de hidróxidos de tierras raras; el resto de hidróxidos de tierras raras permanece en solución. El hidróxido de torio se disuelve en un ácido inorgánico y luego se purifica de los elementos de tierras raras. Un método eficaz es la disolución de hidróxido de torio en ácido nítrico, ya que la solución resultante puede purificarse mediante extracción con disolventes orgánicos:
- Th(OH)4 + 4 HNO3 → Th(NO3)4 + 4 H2O
El torio metálico se separa del óxido, cloruro o fluoruro anhidro haciéndolo reaccionar con calcio en una atmósfera inerte:
- ThO2 + 2 Ca → 2 CaO + Th
A veces, el torio se extrae por electrólisis de un fluoruro en una mezcla de cloruro de sodio y potasio a 700–800 °C en un crisol de grafito. El torio de alta pureza se puede extraer de su yoduro con el proceso de barra de cristal.
El uranio se extrae de sus minerales de varias formas. En un método, el mineral se quema y luego se hace reaccionar con ácido nítrico para convertir el uranio en un estado disuelto. El tratamiento de la solución con una solución de fosfato de tributilo (TBP) en queroseno transforma el uranio en una forma orgánica UO2(NO3)2(TBP)2. Las impurezas insolubles se filtran y el uranio se extrae por reacción con hidróxidos como (NH4)2U2O7 o con peróxido de hidrógeno como UO4·2H2O.
Cuando el mineral de uranio es rico en minerales como dolomita, magnesita, etc., esos minerales consumen mucho ácido. En este caso, se utiliza el método del carbonato para la extracción de uranio. Su componente principal es una solución acuosa de carbonato de sodio, que convierte el uranio en un complejo [UO2(CO3)3] 4−, que es estable en soluciones acuosas a bajas concentraciones de iones de hidróxido. Las ventajas del método del carbonato de sodio son que los productos químicos tienen una baja corrosividad (en comparación con los nitratos) y que la mayoría de los metales distintos del uranio se precipitan de la solución. La desventaja es que los compuestos de uranio tetravalente también precipitan. Por lo tanto, el mineral de uranio se trata con carbonato de sodio a temperatura elevada y bajo presión de oxígeno:
- 2 UO2 + O2 + 6 CO2 - 2
3 → 2 [UO2(CO3)3]4-
Esta ecuación sugiere que el mejor solvente para el procesamiento de carbonato de uranio es una mezcla de carbonato con bicarbonato. A un pH alto, esto da como resultado la precipitación de diuranato, que se trata con hidrógeno en presencia de níquel, lo que produce un tetracarbonato de uranio insoluble.
Otro método de separación utiliza resinas poliméricas como polielectrolito. Los procesos de intercambio de iones en las resinas dan como resultado la separación del uranio. El uranio de las resinas se lava con una solución de nitrato de amonio o ácido nítrico que produce nitrato de uranilo, UO2(NO3)2·6H< sub>2O. Cuando se calienta, se convierte en UO3, que se convierte en UO2 con hidrógeno:
- UO3 + H2 → UO2 + H2O
La reacción del dióxido de uranio con ácido fluorhídrico lo convierte en tetrafluoruro de uranio, que produce uranio metálico al reaccionar con magnesio metálico:
- 4 HF + UO2 → UF4 + 2 H2O
Para extraer plutonio, el uranio irradiado con neutrones se disuelve en ácido nítrico y se agrega un agente reductor (FeSO4 o H2O2) a la solución resultante. Esta adición cambia el estado de oxidación del plutonio de +6 a +4, mientras que el uranio permanece en forma de nitrato de uranilo (UO2(NO3)2< /sub>). La solución se trata con un agente reductor y se neutraliza con carbonato de amonio a pH = 8 que da como resultado la precipitación de compuestos Pu4+.
En otro método, Pu4+ y UO2 +
2 se extraen primero con fosfato de tributilo, luego se hizo reaccionar con hidracina lavando el plutonio recuperado.
La mayor dificultad en la separación del actinio es la similitud de sus propiedades con las del lantano. Por lo tanto, el actinio se sintetiza en reacciones nucleares a partir de isótopos de radio o se separa mediante procedimientos de intercambio iónico.
Propiedades
Los actínidos tienen propiedades similares a los lantánidos. Las capas electrónicas 6d y 7s se rellenan con actinio y torio, y la capa 5f se llena con un aumento adicional del número atómico; la capa 4f está llena de lantánidos. McMillan y Abelson obtuvieron la primera evidencia experimental del llenado de la capa 5f en los actínidos en 1940. Al igual que en los lantánidos (ver contracción de los lantánidos), el radio iónico de los actínidos disminuye monótonamente con el número atómico (véase también el principio de Aufbau).
| Elemento | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | F m | Md | No | Lr |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Cargo básico ()Z) | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 |
| masa atómica | [227] | 232.0377(4) | 231.03588 2) | 238.02891(3) | [237] | [244] | [243] | [247] | [247] | [251] | [252] | [257] | [258] | [259] | [266] |
| Número de isótopos naturales | 3 | 7 | 3 | 8 | 3 | 4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| isótopos naturales | 225, 227-228 | 227–232, 234 | 231, 233–234 | 233–240 | 237, 239–240 | 238–240, 244 | — | — | — | — | — | — | — | — | — |
| Cantidad natural isótopos | — | 230, 232 | 231 | 234, 235, 238 | — | — | — | — | — | — | — | — | — | — | — |
| isótopo de más larga vida | 227 | 232 | 231 | 238 | 237 | 244 | 243 | 247 | 247 | 251 | 252 | 257 | 258 | 259 | 266 |
| La mitad de la vida del isótopo más largo | 21.8 años | 14 mil millones de años | 32,500 años | 4.47 mil millones de años | 2.14 millones de años | 80,8 millones de años | 7.370 años | 15,6 millones de años | 1.380 años | 900 años | 1.29 años | 100,5 días | 52 días | 58 min | 11 horas |
| El isótopo más común | 227 | 232 | 231 | 238 | 237 | 239 | 241 | 244 | 249 | 252 | 253 | 255 | 256 | 255 | 260 |
| Media vida del isótopo más común | 21.8 años | 14 mil millones de años | 32,500 años | 4.47 mil millones de años | 2.14 millones de años | 24,100 años | 433 años | 18,1 años | 320 días | 2.64 años | 20.47 días | 20.07 horas | 78 min | 3.1 min | 2.7 min |
| Configuración electrónica en estado del suelo (fase del gas) | 6d17s2 | 6d27s2 | 5f26d17s2 | 5f36d17s2 | 5f46d17s2 | 5f67s2 | 5f77s2 | 5f76d17s2 | 5f97s2 | 5f107s2 | 5f117s2 | 5f127s2 | 5f137s2 | 5f147s2 | 5f147s27p1 |
| estados de oxidación | 2, 3 | 2, 3, 4 | 2, 3, 4, 5 | 2, 3, 4, 5, 6 | 3, 4, 5, 6, 7 | 3, 4, 5, 6, 7 | 2, 3, 4, 5, 6, 7 | 2, 3, 4, 6 | 2, 3, 4 | 2, 3, 4 | 2, 3, 4 | 2, 3 | 2, 3 | 2, 3 | 3 |
| Radio metálica (nm) | 0.203 | 0.180 | 0.162 | 0,153 | 0.150 | 0.162 | 0.173 | 0.174 | 0.170 | 0.186 | 0.186 | ? 0.198 | ? 0.194 | ? 0.197 | ? 0.171 |
| Radius iónico (nm): An4+ An3+ | — 0.126 | 0.114 — | 0.104 0.118 | 0.103 0.118 | 0.101 0.116 | 0.100 0.115 | 0,099 0.114 | 0,099 0.112 | 0,097 0.110 | 0,096 0.109 | 0,085 0,098 | 0,084 0,091 | 0,084 0,090 | 0,084 0,095 | 0,083 0,088 |
| Temperatura (°C): fusión hirviendo | 1050 3198 | 1842 4788 | 1568 ? 4027 | 1132.2 4131 | 639 ? 4174 | 639,4 3228 | 1176 ? 2607 | 1340 3110 | 986 2627 | 900 ? 1470 | 860 ? 996 | 1530 — | 830 — | 830 — | 1630 — |
| Densidad, g/cm3 | 10.07 | 11.78 | 15.37 | 19.06 | 20.45 | 19.84 | 11.7 | 13.51 | 14.78 | 15.1 | 8.84 | ? 9.7 | ? 10.3 | ? 9.9 | ? 14.4 |
| Potencial de electrodo estándar (V): E° (An4+/An0) E° (An3+/An0) | — −2.13 | −1.83 — | −1.47 — | −1.38 −1.66 | −1.30 −1.79 | −1.25 2.00 a | −0,90 −2.07 | −0,75 −2.06 | −0.55 −1.96 | −0,59 −1.97 | −0.36 −1.98 | −0,29 −1.96 | — −1.74 | — −1.20 | — −2.10 |
| Color: [M(H)2O)n]4+ [M(H)2O)n]3+ | — Incoloro | Incoloro Azul | Amarillo Azul oscuro | Verde Púrpura | Amarillo verde Púrpura | Brown Violet | Rojo Rose | Amarillo Incoloro | Beige Amarillo verde | Verde Verde | — Rosa | — — | — — | — — | — — |
| Colores aproximados de iones actinidos en solución acuosa Los colores para las actinides 100–103 son desconocidos ya que cantidades suficientes aún no se han sintetizado | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Actinide (actinuro)Z) | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 |
| Estado de oxidación | |||||||||||||||
| +2 | F m2+ | Md2+ | No2+ | ||||||||||||
| +3 | Ac3+ | Th3+ | Pa3+ | U3+ | Np3+ | Pu3+ | Am3+ | Cm3+ | Bk3+ | Cf3+ | Es3+ | F m3+ | Md3+ | No3+ | Lr3+ |
| +4 | Th4+ | Pa4+ | U4+ | Np4+ | Pu4+ | Am4+ | Cm4+ | Bk4+ | Cf4+ | ||||||
| +5 | PaO+ 2 | UO+ 2 | NpO+ 2 | PuO+ 2 | AmO+ 2 | ||||||||||
| +6 | UO2+ 2 | NpO2+ 2 | PuO2+ 2 | AmO2+ 2 | CmO2+ | ||||||||||
| +7 | NpO3+ 2 | PuO3+ 2 | AmO3 - 3 5 | ||||||||||||
Propiedades físicas
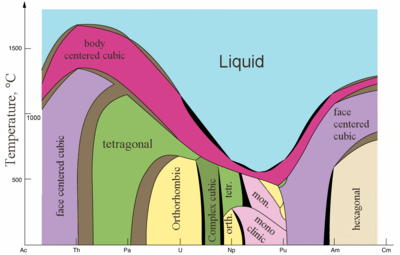 | 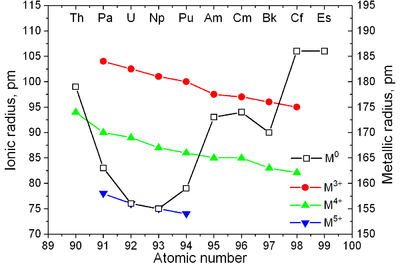 |
| Principales estructuras de cristal de algunos actinides vs. temperatura | Radii metálico e iónico de actinides |

Los actínidos son metales típicos. Todos ellos son blandos y tienen un color plateado (pero se deslustran con el aire), densidad y plasticidad relativamente altas. Algunos de ellos se pueden cortar con un cuchillo. Su resistividad eléctrica varía entre 15 y 150 µΩ·cm. La dureza del torio es similar a la del acero blando, por lo que el torio puro calentado se puede enrollar en láminas y estirar en alambre. El torio es casi la mitad de denso que el uranio y el plutonio, pero es más duro que cualquiera de ellos. Todos los actínidos son radiactivos, paramagnéticos y, a excepción del actinio, tienen varias fases cristalinas: el plutonio tiene siete y el uranio, el neptunio y el californio tres. Las estructuras cristalinas de protactinio, uranio, neptunio y plutonio no tienen análogos claros entre los lantánidos y son más similares a las de los metales de transición 3d.
Todos los actínidos son pirofóricos, especialmente cuando están finamente divididos, es decir, se encienden espontáneamente al reaccionar con el aire a temperatura ambiente. El punto de fusión de los actínidos no tiene una dependencia clara del número de electrones f. El punto de fusión inusualmente bajo del neptunio y el plutonio (~640 °C) se explica por la hibridación de los orbitales 5f y 6d y la formación de enlaces direccionales en estos metales.
| Lanthanides | Ln3+Å | Actinides | An3+Å | An4+Å |
|---|---|---|---|---|
| Lanthanum | 1.061 | Actinium | 1.11 | – |
| Cerium | 1.034 | Thorium | 1.08 | 0.99 |
| Praseodymium | 1.013 | Protactinio | 1.05 | 0.93 |
| Neodymium | 0.995 | Uranio | 1.03 | 0.93 |
| Prometio | 0.979 | Neptunium | 1.01 | 0.92 |
| Samarium | 0.964 | Plutonium | 1.00 | 0.90 |
| Europium | 0.950 | Americium | 0.99 | 0.89 |
| Gadolinium | 0.938 | Curium | 0.98 | 0.88 |
| Terbium | 0.923 | Berkelium | – | – |
| Dysprosium | 0.908 | Californio | – | – |
| Holmium | 0.894 | Einsteinium | – | – |
| Erbium | 0.881 | Fermium | – | – |
| Thulium | 0.869 | Mendelevium | – | – |
| Ytterbium | 0.858 | Nobelium | – | – |
| Lutetium | 0.848 | Lawrencium | – | – |
Propiedades químicas
Al igual que los lantánidos, todos los actínidos son altamente reactivos con halógenos y calcógenos; sin embargo, los actínidos reaccionan más fácilmente. Los actínidos, especialmente aquellos con una pequeña cantidad de electrones 5f, son propensos a la hibridación. Esto se explica por la similitud de las energías de los electrones en las capas 5f, 7s y 6d. La mayoría de los actínidos exhiben una mayor variedad de estados de valencia, y los más estables son +6 para uranio, +5 para protactinio y neptunio, +4 para torio y plutonio y +3 para actinio y otros actínidos.
El actinio es químicamente similar al lantano, lo que se explica por sus radios iónicos y estructuras electrónicas similares. Como el lantano, el actinio casi siempre tiene un estado de oxidación de +3 en los compuestos, pero es menos reactivo y tiene propiedades básicas más pronunciadas. Entre otros actínidos trivalentes, el Ac3+ es el menos ácido, es decir, tiene la tendencia más débil a hidrolizarse en soluciones acuosas.
El torio es bastante activo químicamente. Debido a la falta de electrones en los orbitales 6d y 5f, los compuestos tetravalentes de torio son incoloros. A pH < 3, las soluciones de sales de torio están dominadas por los cationes [Th(H2O)8]4+. El ion Th4+ es relativamente grande y, dependiendo del número de coordinación, puede tener un radio entre 0,95 y 1,14 Å. Como resultado, las sales de torio tienen una débil tendencia a hidrolizarse. La capacidad distintiva de las sales de torio es su alta solubilidad tanto en agua como en disolventes orgánicos polares.
El protactinio exhibe dos estados de valencia; el +5 es estable y el estado +4 se oxida fácilmente a protactinio (V). Así, el protactinio tetravalente en solución se obtiene por la acción de agentes reductores fuertes en atmósfera de hidrógeno. El protactinio tetravalente es químicamente similar al uranio (IV) y al torio (IV). Los fluoruros, fosfatos, hipofosfato, yodato y fenilarsonatos de protactinio(IV) son insolubles en agua y ácidos diluidos. El protactinio forma carbonatos solubles. Las propiedades hidrolíticas del protactinio pentavalente son similares a las del tantalio (V) y el niobio (V). El complejo comportamiento químico del protactinio es consecuencia del inicio del llenado de la capa 5f en este elemento.
El uranio tiene una valencia de 3 a 6, siendo la última la más estable. En estado hexavalente, el uranio es muy similar a los elementos del grupo 6. Muchos compuestos de uranio (IV) y uranio (VI) no son estequiométricos, es decir, tienen una composición variable. Por ejemplo, la fórmula química real del dióxido de uranio es UO2+x, donde x varía entre −0,4 y 0,32. Los compuestos de uranio (VI) son oxidantes débiles. La mayoría de ellos contienen el "uranilo" grupo, UO2+
2. Se pueden acomodar entre 4 y 6 ligandos en un plano ecuatorial perpendicular al grupo uranilo. El grupo uranilo actúa como un ácido duro y forma complejos más fuertes con ligandos donantes de oxígeno que con ligandos donantes de nitrógeno. NpO2+
2 y PuO2+
2< /span> son también la forma común de Np y Pu en el estado de oxidación +6. Los compuestos de uranio (IV) exhiben propiedades reductoras, por ejemplo, son fácilmente oxidados por el oxígeno atmosférico. El uranio (III) es un agente reductor muy fuerte. Debido a la presencia de la capa d, el uranio (así como muchos otros actínidos) forma compuestos organometálicos, como UIII(C5H5)3 y UIV(C5H5)4.
El neptunio tiene estados de valencia del 3 al 7, que pueden observarse simultáneamente en soluciones. El estado más estable en solución es +5, pero se prefiere la valencia +4 en compuestos sólidos de neptunio. El neptunio metálico es muy reactivo. Los iones de neptunio son propensos a la hidrólisis y a la formación de compuestos de coordinación.
El plutonio también exhibe estados de valencia entre 3 y 7 inclusive y, por lo tanto, es químicamente similar al neptunio y al uranio. Es altamente reactivo y forma rápidamente una película de óxido en el aire. El plutonio reacciona con el hidrógeno incluso a temperaturas tan bajas como 25-50 °C; también forma fácilmente haluros y compuestos intermetálicos. Las reacciones de hidrólisis de iones de plutonio de diferentes estados de oxidación son bastante diversas. El plutonio (V) puede entrar en reacciones de polimerización.
La mayor diversidad química entre los actínidos se observa en el americio, que puede tener una valencia entre 2 y 6. El americio divalente se obtiene únicamente en compuestos secos y soluciones no acuosas (acetonitrilo). Los estados de oxidación +3, +5 y +6 son típicos para soluciones acuosas, pero también en estado sólido. El americio tetravalente forma compuestos sólidos estables (dióxido, fluoruro e hidróxido) así como complejos en soluciones acuosas. Se informó que en solución alcalina el americio se puede oxidar al estado heptavalente, pero estos datos resultaron ser erróneos. La valencia más estable del americio es 3 en las soluciones acuosas y 3 o 4 en los compuestos sólidos.
La valencia 3 es dominante en todos los elementos subsiguientes hasta el laurencio (con la excepción del nobelio). El curio puede ser tetravalente en sólidos (fluoruro, dióxido). Berkelium, junto con una valencia de +3, también muestra la valencia de +4, más estable que la del curio; la valencia 4 se observa en fluoruro y dióxido sólidos. La estabilidad de Bk4+ en solución acuosa es similar a la de Ce4+. Solo se observó valencia 3 para californio, einstenio y fermio. El estado divalente está probado para mendelevio y nobelio, y en nobelio es más estable que el estado trivalente. Lawrencium muestra valencia 3 tanto en soluciones como en sólidos.
El potencial de redox aumentos de −0.32 V en uranio, a través de 0.34 V (Np) y 1.04 V (Pu) a 1.34 V en americium revelando la creciente capacidad de reducción de la An4+ iones de americium a uranio. Todos los actinides forman AnH3 hidratos de color negro con propiedades tipo sal. Actinides también producen carburos con la fórmula general de AnC o AnC2 (U2C3 para uranio) y sulfuros An2S3 y AnS2.
Compuestos
Óxidos e hidróxidos
| Compuesto | Color | Simetría de cristal, tipo | Constantes de celo, Å | Densidad, g/cm3 | Temperatura, °C | ||
|---|---|---|---|---|---|---|---|
| a | b | c | |||||
| Ac2O3 | Blanco | Hexagonal, La2O3 | 4.07 | - | 6.29 | 9.19 | – |
| PaO2 | - | Cubic, CaF2 | 5.505 | - | - | - | - |
| Pa2O5 | Blanco | cúbico, CaF2 Cubic Tetragonal Hexagonal Rhombohedral Orthorhombic | 5.446 10.891 5.429 3.817 5.425 6.92 | - - - - - 4.02 | - 10.992 5.503 13.22 - 4. 18 | - | 700 700–1100 1000 1000–1200 1240-1400 – |
| ThO2 | Incoloro | Cubic | 5.59 | - | - | 9.87 | – |
| UO2 | Black-brown | Cubic | 5.47 | - | - | 10.9 | – |
| NpO2 | Greenish-brown | Cubic, CaF2 | 5.424 | - | - | 11.1 | – |
| PuO | Negro | Cubic, NaCl | 4.96 | - | - | 13.9 | – |
| PuO2 | Verde de oliva | Cubic | 5.39 | - | - | 11.44 | – |
| Am2O3 | Red-brown Red-brown | Cubic, Mn2O3 Hexagonal, La2O3 | 11.03 3.817 | - | - 5.971 | 10.57 11.7 | – |
| AmO2 | Negro | Cubic, CaF2 | 5.376 | - | - | - | - |
| Cm2O3 | Blanco - - | Cubic, Mn2O2 Hexagonal, LaCl3 Monoclinic, Sm2O3 | 11.01 3.80 14.28 | - - 3.65 | - 6 8.9 | 11.7 | – |
| CmO2 | Negro | Cubic, CaF2 | 5.37 | - | - | - | - |
| Bk2O3 | Marrón ligero | Cubic, Mn2O3 | 10.886 | - | - | - | - |
| BkO2 | Red-brown | Cubic, CaF2 | 5.33 | - | - | - | - |
| Cf2O3 | Incoloro Amarillo - | Cubic, Mn2O3 Monoclinic, Sm2O3 Hexagonal, La2O3 | 10.79 14.12 3.72 | - 3.59 - | - 8.80 5.96 | - | - |
| CfO2 | Negro | Cubic | 5.31 | - | - | - | - |
| Es2O3 | - | Cubic, Mn2O3 Monoclinic Hexagonal, La2O3 | 10.07 14.1 3.7 | - 3.59 - | - 8.80 6 | - | - |
| Estado de oxidación | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| +3 | Pu2O3 | Am2O3 | Cm2O3 | Bk2O3 | Cf2O3 | Es2O3 | |||||
| +4 | ThO2 | PaO2 | UO2 | NpO2 | PuO2 | AmO2 | CmO2 | BkO2 | CfO2 | ||
| +5 | Pa2O5 | U2O5 | Np2O5 | ||||||||
| +5,+6 | U3O8 | ||||||||||
| +6 | UO3 |
- An - actinide
**Dependiendo de los isótopos
Algunos actínidos pueden existir en varias formas de óxido, como An2O3, AnO2, An2O5 y AnO3. Para todos los actínidos, los óxidos AnO3 son anfóteros y An2O3, AnO2 y An 2O5 son básicos, reaccionan fácilmente con el agua, formando bases:
- An2O3 + 3 H2O → 2 An(OH)3.
Estas bases son poco solubles en agua y por su actividad están cerca de los hidróxidos de metales de tierras raras. Np(OH)3 aún no se ha sintetizado, Pu(OH)3 tiene un color azul mientras que Am(OH)3 es rosa y hidróxido de curio Cm(OH)3 es incoloro. También se conocen Bk(OH)3 y Cf(OH)3, así como hidróxidos tetravalentes para Np, Pu y Am y pentavalentes para Np y Am.
La base más fuerte es el actinio. Todos los compuestos de actinio son incoloros, excepto el sulfuro de actinio negro (Ac2S3). Los dióxidos de actínidos tetravalentes cristalizan en el sistema cúbico, al igual que en el fluoruro de calcio.
El torio al reaccionar con el oxígeno forma exclusivamente el dióxido:
El dióxido de torio es un material refractario con el punto de fusión más alto entre todos los óxidos conocidos (3390 °C). Agregar 0.8–1% ThO2 al tungsteno estabiliza su estructura, por lo que los filamentos dopados tienen una mejor estabilidad mecánica a las vibraciones. Para disolver ThO2 en ácidos, se calienta a 500–600 °C; el calentamiento por encima de 600 °C produce una forma muy resistente a los ácidos y otros reactivos de ThO2. Una pequeña adición de iones de fluoruro cataliza la disolución de dióxido de torio en ácidos.
Se han obtenido dos óxidos de protactinio: PaO2 (negro) y Pa2O5 (blanco); el primero es isomorfo con ThO2 y el segundo es más fácil de obtener. Ambos óxidos son básicos y Pa(OH)5 es una base débil y poco soluble.
Descomposición de determinadas sales de uranio, por ejemplo UO2(NO3)·6H2O en aire a 400 °C, produce UO3 naranja o amarillo. Este óxido es anfótero y forma varios hidróxidos, siendo el más estable el hidróxido de uranilo UO2(OH)2. La reacción del óxido de uranio (VI) con hidrógeno da como resultado dióxido de uranio, que es similar en sus propiedades al ThO2. Este óxido también es básico y corresponde al hidróxido de uranio (U(OH)4).
El plutonio, el neptunio y el americio forman dos óxidos básicos: An2O3 y AnO2. El trióxido de neptunio es inestable; por lo tanto, hasta ahora solo se pudo obtener Np3O8. Sin embargo, los óxidos de plutonio y neptunio con la fórmula química AnO2 y An2O3 están bien caracterizados.
Sales
- *An - actinide
**Dependiendo de los isótopos
| Compuesto | Color | Simetría de cristal, tipo | Constantes de celo, Å | Densidad, g/cm3 | ||
|---|---|---|---|---|---|---|
| a | b | c | ||||
| AcF3 | Blanco | Hexagonal, LaF3 | 4.27 | - | 7.53 | 7.88 |
| PaF4 | Marrón oscuro | Monoclinic | 12.7 | 10.7 | 8.42 | – |
| PaF5 | Negro | Tetragonal, β-UF5 | 11.53 | - | 5.19 | – |
| ThF4 | Incoloro | Monoclinic | 13 | 10.99 | 8.58 | 5.71 |
| UF3 | Reddish-purple | Hexagonal | 7.18 | - | 7.34 | 8.54 |
| UF4 | Verde | Monoclinic | 11.27 | 10.75 | 8.40 | 6.72 |
| α-UF5 | Deslumbrante | Tetragonal | 6.52 | - | 4.47 | 5.81 |
| β-UF5 | Deslumbrante | Tetragonal | 11.47 | - | 5.20 | 6.45 |
| UF6 | Amarillo | Orthorhombic | 9.92 | 8.95 | 5.19 | 5.06 |
| NpF3 | Negro o púrpura | Hexagonal | 7.129 | - | 7.288 | 9.12 |
| NpF4 | Verde luz | Monoclinic | 12.67 | 10.62 | 8.41 | 6.8 |
| NpF6 | Naranja | Orthorhombic | 9.91 | 8.97 | 5.21 | 5 |
| PuF3 | Violet-blue | Trigonal | 7.09 | - | 7.25 | 9.32 |
| PuF4 | Pale marrón | Monoclinic | 12.59 | 10.57 | 8.28 | 6.96 |
| PuF6 | Red-brown | Orthorhombic | 9.95 | 9.02 | 3.26 | 4.86 |
| AmF3 | Rosa o beige ligero | hexagonal, LaF3 | 7.04 | - | 7.255 | 9.53 |
| AmF4 | Naranja roja | Monoclinic | 12.53 | 10.51 | 8.20 | – |
| CmF3 | De marrón a blanco | Hexagonal | 4.041 | - | 7.179 | 9.7 |
| CmF4 | Amarillo | Monoclinic, UF4 | 12.51 | 10.51 | 8.20 | – |
| BkF3 | Amarillo verde | Trigonal, LaF3 Orthorhombic, YF3 | 6.97 6.7 | - 7.09 | 7.14 4.41 | 10.15 9.7 |
| BkF4 | - | Monoclinic, UF4 | 12.47 | 10.58 | 8.17 | – |
| CfF3 | - - | Trigonal, LaF3 Orthorhombic, YF3 | 6. 94 6.65 | - 7.04 | 7.10 4.39 | – |
| CfF4 | - - | Monoclinic, UF4 Monoclinic, UF4 | 1.242 1.233 | 1.047 1.040 | 8.126 8.113 | – |
Los actínidos reaccionan fácilmente con los halógenos formando sales con las fórmulas MX3 y MX4 (X = halógeno). Entonces, el primer compuesto de berkelio, BkCl3, se sintetizó en 1962 con una cantidad de 3 nanogramos. Al igual que los halógenos de los elementos de tierras raras, los cloruros, bromuros y yoduros de actínidos son solubles en agua y los fluoruros son insolubles. El uranio produce fácilmente un hexafluoruro incoloro, que se sublima a una temperatura de 56,5 °C; debido a su volatilidad, se utiliza en la separación de isótopos de uranio con centrifugación de gases o difusión gaseosa. Los hexafluoruros de actínidos tienen propiedades cercanas a los anhídridos. Son muy sensibles a la humedad y se hidrolizan formando AnO2F2. Se sintetizaron el pentacloruro y el hexacloruro negro de uranio, pero ambos son inestables.
La acción de los ácidos sobre los actínidos produce sales, y si los ácidos no son oxidantes, entonces el actínido de la sal se encuentra en un estado de baja valencia:
- U + 2 H2SO4 → U(SO4)2 + 2 H2
- 2 Pu + 6 HCl → 2 PuCl3 + 3 H2
Sin embargo, en estas reacciones el hidrógeno regenerado puede reaccionar con el metal, formando el hidruro correspondiente. El uranio reacciona con los ácidos y el agua mucho más fácilmente que el torio.
Las sales de actínidos también se pueden obtener disolviendo los hidróxidos correspondientes en ácidos. Los nitratos, cloruros, sulfatos y percloratos de actínidos son solubles en agua. Al cristalizar en soluciones acuosas, estas sales forman hidratos, como Th(NO3)4·6H2O, Th(SO< sub>4)2·9H2O y Pu2(SO4)3·7H2O. Las sales de actínidos de alta valencia se hidrolizan fácilmente. Así, el sulfato incoloro, el cloruro, el perclorato y el nitrato de torio se transforman en sales básicas de fórmulas Th(OH)2SO4 y Th(OH)3NO3. La solubilidad e insolubilidad de los actínidos trivalentes y tetravalentes es como la de las sales de lantánidos. Así, los fosfatos, fluoruros, oxalatos, yodatos y carbonatos de actínidos son poco solubles en agua; precipitan como hidratos, como ThF4·3H2O y Th(CrO4)2·3H 2O.
Actínidos con estado de oxidación +6, excepto los cationes de tipo AnO22+, forman [AnO4] 2−, [An2O7]2− y otros aniones complejos. Por ejemplo, el uranio, el neptunio y el plutonio forman sales de Na2UO4 (uranato) y (NH4)2< /sub>U2O7 (diuranato). En comparación con los lantánidos, los actínidos forman más fácilmente compuestos de coordinación y esta capacidad aumenta con la valencia de los actínidos. Los actínidos trivalentes no forman compuestos de coordinación de fluoruro, mientras que el torio tetravalente forma K2ThF6, KThF5 e incluso K5< /sub>ThF9 complejos. El torio también forma los correspondientes sulfatos (por ejemplo, Na2SO4·Th(SO4)2·5H 2O), nitratos y tiocianatos. Sales de fórmula general An2Th(NO3)6·nH2O son de naturaleza de coordinación, con el número de coordinación de torio igual a 12. Aún más fácil es producir sales complejas de actínidos pentavalentes y hexavalentes. Los compuestos de coordinación más estables de los actínidos (torio tetravalente y uranio) se obtienen en reacciones con dicetonas, p. acetilacetona.
Aplicaciones
Si bien los actínidos tienen algunas aplicaciones establecidas en la vida diaria, como en detectores de humo (americio) y mantos de gas (torio), se utilizan principalmente en armas nucleares y como combustible en reactores nucleares. Las dos últimas áreas explotan la propiedad de los actínidos de liberar una enorme energía en las reacciones nucleares, que bajo ciertas condiciones pueden convertirse en reacciones en cadena autosostenidas.
El isótopo más importante para aplicaciones de energía nuclear es el uranio-235. Se utiliza en el reactor térmico, y su concentración en uranio natural no supera el 0,72%. Este isótopo absorbe fuertemente los neutrones térmicos liberando mucha energía. Un acto de fisión de 1 gramo de 235U se convierte en aproximadamente 1 MW·día. De importancia es que 235
< sub style="font-size:inherit;line-height:inherit;vertical-align:baseline">92U
emite más neutrones de los que absorbe; al alcanzar la masa crítica, 235
92U
ingresa en una reacción en cadena autosostenida. Por lo general, el núcleo de uranio se divide en dos fragmentos con la liberación de 2 a 3 neutrones, por ejemplo:
- 23592U + 10n restablecimiento 115
45Rh
+ 118
47Ag
+ 310n
Otros isótopos de actínidos prometedores para la energía nuclear son el torio-232 y su producto del ciclo de combustible del torio, el uranio-233.
| reactor nuclear |
| El núcleo de la mayoría de los reactores nucleares de la Generación II contiene un conjunto de varillas metálicas huecas, generalmente hechas de aleaciones de zirconio, llenas de pellets de combustible nuclear sólido, principalmente óxido, carburo, nitruro o monosulfido de uranio, plutonio o torio, o su mezcla (el denominado combustible MOX). El combustible más común es el óxido de uranio-235. Los neutrones rápidos son ralentizados por los moderadores, que contienen agua, carbono, deuterio o berilio, como neutrones térmicos para aumentar la eficiencia de su interacción con uranio-235. La tasa de reacción nuclear se controla mediante la introducción de varillas adicionales hechas de borón o cadmio o un absorbente líquido, generalmente ácido bórico. Los reactores para la producción de plutonio se llaman reactor de cría o reproductores; tienen un diseño diferente y usan neutrones rápidos. |
La emisión de neutrones durante la fisión del uranio es importante no solo para mantener la reacción en cadena nuclear, sino también para la síntesis de los actínidos más pesados. El uranio-239 se convierte a través de la desintegración β en plutonio-239, que, como el uranio-235, es capaz de fisionarse espontáneamente. Los primeros reactores nucleares del mundo no se construyeron para generar energía, sino para producir plutonio-239 para armas nucleares.
Alrededor de la mitad del torio producido se utiliza como material emisor de luz de los mantos de gas. El torio también se agrega a las aleaciones de varios componentes de magnesio y zinc. Por lo tanto, las aleaciones Mg-Th son ligeras y fuertes, pero también tienen un alto punto de fusión y ductilidad y, por lo tanto, se utilizan ampliamente en la industria de la aviación y en la producción de misiles. El torio también tiene buenas propiedades de emisión de electrones, con una larga vida útil y una barrera de bajo potencial para la emisión. El contenido relativo de isótopos de torio y uranio se usa ampliamente para estimar la edad de varios objetos, incluidas las estrellas (ver datación radiométrica).
La principal aplicación del plutonio ha sido en armas nucleares, donde el isótopo plutonio-239 fue un componente clave debido a su facilidad de fisión y disponibilidad. Los diseños basados en plutonio permiten reducir la masa crítica a aproximadamente un tercio de la del uranio-235. Las bombas de plutonio tipo 'Fat Man' producidas durante el Proyecto Manhattan utilizaron una compresión explosiva de plutonio para obtener densidades significativamente más altas de lo normal, combinadas con una fuente central de neutrones para comenzar la reacción y aumentar la eficiencia. Por lo tanto, solo se necesitaron 6,2 kg de plutonio para un rendimiento explosivo equivalente a 20 kilotones de TNT. (Consulte también Diseño de armas nucleares). Hipotéticamente, se podrían usar tan solo 4 kg de plutonio, y tal vez incluso menos, para fabricar una sola bomba atómica utilizando diseños de ensamblaje muy sofisticados.
El plutonio-238 es un isótopo potencialmente más eficiente para los reactores nucleares, ya que tiene una masa crítica más pequeña que el uranio-235, pero continúa liberando mucha energía térmica (0,56 W/g) por descomposición incluso cuando se detiene la reacción en cadena de fisión. por barras de control. Su aplicación está limitada por su alto precio (alrededor de US$1000/g). Este isótopo se ha utilizado en termopilas y sistemas de destilación de agua de algunos satélites y estaciones espaciales. Entonces, las naves espaciales Galileo y Apolo (por ejemplo, Apolo 14) tenían calentadores alimentados por cantidades de kilogramos de óxido de plutonio-238; este calor también se transforma en electricidad con termopilas. La desintegración del plutonio-238 produce partículas alfa relativamente inofensivas y no va acompañada de radiación gamma. Por lo tanto, este isótopo (~160 mg) se utiliza como fuente de energía en los marcapasos cardíacos, donde dura unas 5 veces más que las baterías convencionales.
El actinio-227 se utiliza como fuente de neutrones. Su alta energía específica (14,5 W/g) y la posibilidad de obtener cantidades significativas de compuestos térmicamente estables son atractivos para su uso en generadores termoeléctricos de larga duración para uso remoto. 228Ac se utiliza como indicador de radiactividad en la investigación química, ya que emite electrones de alta energía (2,18 MeV) que se pueden detectar fácilmente. Las mezclas de 228Ac-228Ra se utilizan ampliamente como fuente gamma intensa en la industria y la medicina.
El desarrollo de materiales autoincandescentes dopados con actínidos con matrices cristalinas duraderas es una nueva área de utilización de actínidos, ya que la adición de radionucleidos emisores alfa a algunos vidrios y cristales puede conferir luminiscencia.
Toxicidad
Las sustancias radiactivas pueden dañar la salud humana a través de (i) contaminación local de la piel, (ii) exposición interna debido a la ingestión de isótopos radiactivos y (iii) sobreexposición externa por actividad β y radiación γ. Junto con los elementos de radio y transuranio, el actinio es uno de los venenos radiactivos más peligrosos con una alta actividad α específica. La característica más importante del actinio es su capacidad para acumularse y permanecer en la capa superficial de los esqueletos. En la etapa inicial del envenenamiento, el actinio se acumula en el hígado. Otro peligro del actinio es que sufre una descomposición radiactiva más rápido de lo que se excreta. La adsorción del tracto digestivo es mucho menor (~0,05%) para el actinio que para el radio.
El protactinio en el cuerpo tiende a acumularse en los riñones y los huesos. La dosis máxima segura de protactinio en el cuerpo humano es de 0,03 µCi que corresponde a 0,5 microgramos de 231Pa. Este isótopo, que podría estar presente en el aire en forma de aerosol, mide 2,5×108 veces más tóxico que el ácido cianhídrico.
El plutonio, cuando ingresa al cuerpo a través del aire, los alimentos o la sangre (p. ej., una herida), se asienta principalmente en los pulmones, el hígado y los huesos y solo alrededor del 10 % va a otros órganos, y permanece allí durante décadas. El largo tiempo de residencia del plutonio en el cuerpo se explica en parte por su escasa solubilidad en agua. Algunos isótopos de plutonio emiten radiación alfa ionizante, que daña las células circundantes. La dosis letal media (LD50) durante 30 días en perros después de la inyección intravenosa de plutonio es de 0,32 miligramos por kg de masa corporal y, por lo tanto, la dosis letal para humanos es de aproximadamente 22 mg para una persona que pesa 70 kg; la cantidad para la exposición respiratoria debe ser aproximadamente cuatro veces mayor. Otra estimación supone que el plutonio es 50 veces menos tóxico que el radio y, por lo tanto, el contenido permisible de plutonio en el cuerpo debe ser de 5 µg o 0,3 µCi. Tal cantidad es casi invisible bajo el microscopio. Después de los ensayos en animales, esta dosis máxima permitida se redujo a 0,65 µg o 0,04 µCi. Los estudios en animales también revelaron que la vía de exposición al plutonio más peligrosa es la inhalación, después de lo cual el cuerpo retiene entre el 5% y el 25% de las sustancias inhaladas. Según el tamaño de las partículas y la solubilidad de los compuestos de plutonio, el plutonio se localiza en los pulmones o en el sistema linfático, o se absorbe en la sangre y luego se transporta al hígado y los huesos. La contaminación a través de los alimentos es la forma menos probable. En este caso, solo alrededor del 0,05 % de los compuestos solubles y el 0,01 % insolubles del plutonio se absorben en la sangre y el resto se excreta. La exposición de la piel dañada al plutonio retendría casi el 100% del mismo.
El uso de actínidos en combustible nuclear, fuentes radiactivas selladas o materiales avanzados como cristales autoincandescentes tiene muchos beneficios potenciales. Sin embargo, una preocupación seria es la radiotoxicidad extremadamente alta de los actínidos y su migración en el medio ambiente. El uso de formas químicamente inestables de actínidos en MOX y fuentes radiactivas selladas no es apropiado según los estándares de seguridad modernos. Existe el desafío de desarrollar materiales estables y duraderos que contengan actínidos, que proporcionen un almacenamiento, uso y disposición final seguros. Una necesidad clave es la aplicación de soluciones sólidas de actínidos en fases huésped cristalinas duraderas.
Propiedades nucleares
| Nuclide | Media vida | Modo de declive | Fracción de rama | Fuente |
|---|---|---|---|---|
| 206 81Tl | 4.202 ± 0,011 m | β− | 1.0 | LNHB |
| 208 81Tl | 3.060 ± 0,008 m | β− | 1.0 | BIPM-5 |
| 210 82Pb | 22.20 ± 0.22 y | β− | 1.0 | ENSDF |
| α | (1,9 ± 0,4) x 10−8 | |||
| 211 82Pb | 36,1 ± 0,2 m | β− | 1.0 | ENSDF |
| 212 82Pb | 10.64 ± 0,01 h | β− | 1.0 | BIPM-5 |
| 214 82Pb | 26,8 ± 0,9 m | β− | 1.0 | ENSDF |
| 211 83Bi | 2.14 ± 0,02 m | β− | 0,00276 ± 0,00004 | ENSDF |
| α | 0,9724 ± 0,00004 | |||
| 212 83Bi | 60,54 ± 0,06 m | α | 0,593 ± 0,0007 | BIPM-5 |
| β− | 0,607 ± 0,0007 | |||
| 214 83Bi | 19,9 ± 0,4 m | α | 0,00021 ± 0,00001 | ENSDF |
| β− | 0,9979 ± 0,00001 | |||
| 210 84Po | 138.376 ± 0,002 d | α | 1.0 | ENSDF |
| 219 86Rn | 3.96 ± 0,01 s | α | 1.0 | ENSDF |
| 220 86Rn | 55,8 ± 0,3 s | α | 1.0 | BIPM-5 |
| 221 87Fr. | 4,9 ± 0,2 m | β− | 0,00005 ± 0,00003 | ENSDF |
| α | 0,9995 ± 0,00003 | |||
| 223 88Ra | 11.43 ± 0,05 d | α | 1.0 | ENSDF |
| 14C | (8,9 ± 0,4) x 10−10 | |||
| 224 88Ra | 3.627 ± 0,007 d | α | 1.0 | BIPM-5 |
| 225 88Ra | 14.9 ± 0,2 d | β− | 1.0 | ENSDF |
| 226 88Ra | (1.600 ± 0,007) x 103 Sí. | α | 1.0 | BIPM-5 |
| 228 88Ra | 5.75 ± 0,03 y | β− | 1.0 | ENSDF |
| 224 89Ac | 2.78 ± 0,17 h | α | 0,091 +0.020 –0.014 | ENSDF |
| CE | 0.909 +0.014 -0.020 | |||
| 225 89Ac | 10.0 ± 0.1 d | α | 1.0 | ENSDF |
| 227 89Ac | 21.772 ± 0,003 y | α | 0,01380 ± 0,00004 | ENSDF |
| β− | 0,9620 ± 0,00004 | |||
| 228 89Ac | 6.15 ± 0,02 h | β− | 1.0 | ENSDF |
| 227 90Th | 18,718 ± 0,005 d | α | 1.0 | BIPM-5 |
| 228 90Th | 698.60 ± 0,23 d | α | 1.0 | BIPM-5 |
| 229 90Th | (7.34 ± 0,16) x 103 Sí. | α | 1.0 | ENSDF |
| 230 90Th | (7.538 ± 0,030) x 104 Sí. | α | 1.0 | ENSDF |
| SF | ≤ 4 x 10−13 | |||
| 231 90Th | 25.52 ± 0,01 h | β− | 1.0 | ENSDF |
| α | ~ 4 x 10−13 | |||
| 232 90Th | (1.405 ± 0,006) x 1010 Sí. | α | 1.0 | ENSDF |
| SF | (1,1 ± 0,4) x 10−11 - | |||
| 233 90Th | 22.15 ± 0,15 m | β− | 1.0 | LNHB |
| 234 90Th | 24.10 ± 0,03 d | β− | 1.0 | ENSDF |
| 231 91Pa | (3.276 ± 0,011) x 104 Sí. | α | 1.0 | ENSDF |
| SF | ≤ 3 x 10−12 | |||
| 232 91Pa | 1.32 ± 0,02 d | CE | 0,00003 ± 0,00001 | ENSDF |
| β− | 0,9997 ± 0,00001 | |||
| 233 91Pa | 26.98 ± 0,02 d | β− | 1.0 | LNHB |
| 234 91Pa | 6.70 ± 0,05 h | β− | 1.0 | ENSDF |
| 234m 91Pa | 1.159 ± 0,016 m | IT | 0,0016 ± 0,0002 | IAEA-CRP-XG |
| β− | 0,984 ± 0,0002 | |||
| 232 92U | 68,9 ± 0,4 y | α | 1.0 | ENSDF |
| SF | ||||
| 233 92U | (1.592 ± 0,002) x 105 Sí. | α | 1.0 | ENSDF |
| SF | ||||
| 234 92U | (2.455 ± 0,006) x 105 Sí. | α | 1.0 | LNHB |
| SF | (1,6 ± 0,2) x 10−11 - | |||
| 235m 92U | 26 ± 1 m | IT | 1.0 | ENSDF |
| 235 92U | (7.038 ± 0,005) x 108 Sí. | α | 1.0 | ENSDF |
| SF | (7 ± 2) x 10−11 - | |||
| 236 92U | (2.342 ± 0,004) x 107 Sí. | α | 1.0 | ENSDF |
| SF | (9,4 ± 0,4) x 10−10 | |||
| 237 92U | 6.749 ± 0,016 d | β− | 1.0 | LNHB |
| 238 92U | (4.468 ± 0,005) x 109 Sí. | α | 1.0 | LNHB |
| SF | (5,45 ± 0,04) x 10−7 | |||
| 239 92U | 23.45 ± 0,02 m | β− | 1.0 | ENSDF |
| 236 93Np | (1,55 ± 0,08) x 105 Sí. | α | 0,0016 ± 0,0006 | LNHB |
| β− | 0,120 ± 0,006 | |||
| CE | 0.878 ± 0,006 | |||
| 236m 93Np | 22,5 ± 0,4 h | β− | 0,47 ± 0,01 | LNHB |
| CE | 0,53 ± 0,01 | |||
| 237 93Np | (2.144 ± 0,007) x 106 Sí. | α | 1.0 | ENSDF |
| SF | ||||
| 238 93Np | 2.117 ± 0,002 d | β− | 1.0 | ENSDF |
| 239 93Np | 2.356 ± 0,003 d | β− | 1.0 | ENSDF |
| 236 94Pu | 2.858 ± 0,008 y | α | 1.0 | ENSDF |
| LNHB | Laboratoire National Henri Becquerel, Datos recomendados
http://www.nucleide.org/DDEP_WG/DDEPdata.htm, 3 de octubre de 2006. |
| BIPM-5 | M.-M. Bé, V. Chisté, C. Dulieu, E. Browne, V. Chechev, N. Kuzmenko, R. Helmer,
A. Nichols, E. Schönfeld, R. Dersch, Monographie BIPM-5, Table of Radionuclides, Vol. 2 – A = 151 a 242, 2004. |
| ENSDF | "Evaluated Nuclear Structure Data File". Brookhaven National Laboratory. Retrieved 15 de noviembre 2006. |
| IAEA-CRP-XG | M.-M. Bé, V. P. Chechev, R. Dersch, O. A. M. Helene, R. G. Helmer, M. Herman,
S. Hlavác, A. Marcinkowski, G. L. Molnár, A. L. Nichols, E. Schönfeld, V. R. Vanin, M. J. Woods, IAEA CRP "Actdate of X Ray and Gamma Ray Decay Data Standards for Detector Calibration and Other Applications", IAEA Scientific and Technical Information report STI/PUB/1287, May 2007, International Atomic Energy Agency, Vienna, Austria, ISBN 92-0-113606-4. |
Contenido relacionado
Ácido benzoico
Coca-Cola (combustible)
Lista de pegamentos


![{displaystyle {ce {{^{238}_{92}U}+{}_{0}^{1}n->{}_{92}^{239}U->[beta ^{-}][23.5 {ce {min}}]{}_{93}^{239}Np->[beta ^{-}][2.3 {ce {days}}]{}_{94}^{239}Pu}}left({ce {->[alpha ][2.4cdot 10^{4} {ce {years}}]}}right){ce {^{235}_{92}U}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e7a95dee843f1cf5e9156013e8ca01c30870d896)





![{displaystyle {begin{array}{l}{}\{ce {2AmF3{}+3Ba->[{ce {1150-1350^{circ }C}}]3BaF2{}+2Am}}\{ce {PuF4{}+2Ba->[{ce {1200^{circ }C}}]2BaF2{}+Pu}}\{ce {UF4{}+2Mg->[{ce {>500^{circ }C}}]U{}+2MgF2}}\{}end{array}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/057c8209f7427fca3331e574fa79f36c0e2a81db)











![{displaystyle {ce {Th{}+O2->[{ce {1000^{circ }C}}]overbrace {ThO2} ^{Thorium~dioxide}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/13e4a27b9ed3d03fc5420ed4a04020bf77562406)