Ácido carbónico
En química, el ácido carbónico es un compuesto inorgánico con la fórmula química H2 CO3. Como solución diluida en agua, es omnipresente, pero el compuesto puro, un gas incoloro, solo se puede obtener a temperaturas de alrededor de -80 °C. La molécula se convierte rápidamente en agua y dióxido de carbono en presencia de agua, sin embargo, en ausencia de agua, contrariamente a la creencia popular, es bastante estable a temperatura ambiente. La interconversión de dióxido de carbono y ácido carbónico está relacionada con el ciclo respiratorio de los animales y la acidez de las aguas naturales.
En bioquímica y fisiología, el nombre "ácido carbónico" se aplica a menudo a soluciones acuosas de dióxido de carbono, que desempeñan un papel importante en el sistema amortiguador de bicarbonato, que se utiliza para mantener la homeostasis ácido-base.
Equilibrios químicos
Valores constantes de equilibrio
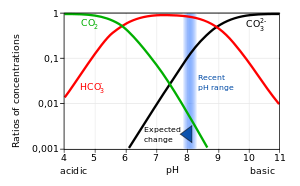
En solución acuosa, el ácido carbónico se comporta como un ácido dibásico. El diagrama de Bjerrum muestra concentraciones de equilibrio típicas, en solución, en agua de mar, de dióxido de carbono y las diversas especies derivadas de él, en función del pH. La acidificación de las aguas naturales es causada por la creciente concentración de dióxido de carbono en la atmósfera, lo que es causado por la quema de cantidades crecientes de carbón e hidrocarburos.
El cambio esperado se refiere al efecto previsto de la acidificación continua del océano. Se ha estimado que el aumento en el dióxido de carbono disuelto ha provocado que el pH promedio de la superficie del océano disminuya en aproximadamente 0,1 con respecto a los niveles preindustriales.
La base de datos de constantes de estabilidad contiene 136 entradas con valores para las constantes de protonación generales, β1 y β2, del ion carbonato. En las siguientes expresiones [H+] representa la concentración, en equilibrio, de la especie química H+, etc.
El valor de log β1 disminuciones con creciente fuerza iónica, . A 25 °C:
- :
- (datos seleccionados de la base de datos SC)
El valor de log β2 también disminuye al aumentar la fuerza iónica.
- :
At =0 y 25 °C los valores pK de las constantes de disociación escalonada son
- pK1 = logβ2 - logβ1 = 6.77.
- pK2 = logβ1 = 9.93.
Cuando pH = pK las dos especies químicas en equilibrio entre sí tienen la misma concentración.
Nota 1: aparentemente hay valores contradictorios en la literatura para pKa. Pines et al. citan un valor para "pKapp" de 6,35, consistente con el valor de 6,77, mencionado anteriormente. También dan un valor para "pKa" de 3.49 y afirmar que
- pKa = pKapp log− KD (eqn. 5)
donde KD=[CO2]/[H2CO3]. (ecuación 3) La situación surge de la forma en que se nombran y definen las constantes de disociación, que se establece claramente en el texto del artículo de Pines, pero no en el resumen.
Nota 2: La numeración de las constantes de disociación es inversa a la numeración de las constantes de asociación, por lo que pK 2 (disociación)= log β1 (asociación). El valor de la constante escalonada para el equilibrio
está dado por
- pK1(disociación)1 = tronco β2 β1 (asociación)
En soluciones no biológicas
La constante de equilibrio de hidratación a 25 °C se denomina Kh, que en el caso del ácido carbónico es [H2CO3 ]/[CO2] ≈ 1,7×10−3 en agua pura y ≈ 1,2×10−3 en agua de mar. Por lo tanto, la mayoría del dióxido de carbono no se convierte en ácido carbónico, quedando como moléculas de CO2. En ausencia de un catalizador, el equilibrio se alcanza muy lentamente. Las constantes de velocidad son 0,039 s−1 para la reacción directa y 23 s−1 para la reacción inversa.
En la industria de las bebidas, el agua con gas o "gasificada" suele denominarse agua carbonatada. Se hace disolviendo dióxido de carbono bajo una pequeña presión positiva en agua. Muchos refrescos tratados de la misma forma los vuelven efervescentes.
Existen cantidades significativas de H2CO3 molecular en soluciones acuosas sujetas a presiones de múltiples gigapascales (decenas de miles de atmósferas), como puede ocurrir en el interior de los planetas.. Se alcanzan presiones de 0,6 a 1,6 GPa a 100 K y de 0,75 a 1,75 GPa a 300 K en los núcleos de grandes satélites helados como Ganímedes, Calisto y Titán, donde hay agua y dióxido de carbono. El ácido carbónico puro, al ser más denso, se hundiría bajo las capas de hielo y las separaría de los núcleos rocosos de estas lunas.
En soluciones biológicas
Cuando la enzima anhidrasa carbónica también está presente en la solución, tiene prioridad la siguiente reacción.
Cuando la cantidad de dióxido de carbono creado por la reacción directa excede su solubilidad, se desprende gas y se produce un tercer equilibrio
también debe tenerse en cuenta. La constante de equilibrio de esta reacción está definida por la ley de Henry. Las dos reacciones se pueden combinar para el equilibrio en solución.
- :
Cuando se usa la ley de Henry para calcular el valor del término en el denominador se necesita cuidado con respecto a la dimensionalidad.
En fisiología, el dióxido de carbono excretado por los pulmones puede denominarse ácido volátil o ácido respiratorio.
Uso del término ácido carbónico
Strictly speaking the term "carbonic acid" refers to the chemical compound with the formula , sin embargo, por razones históricas, el dióxido de carbono disuelto en líquido extracelular se conoce a menudo como "ácido carbónico" en la literatura bioquímica.
Dado que pKa1 tiene un valor de ca. 6.8, en el equilibrio, el ácido carbónico estará casi 50% disociado en el fluido extracelular (citosol) que tiene un pH de aprox. 7.2.
La reacción en la que se produce
- HCO3− + H+ ⇌ CO2 + H2O
es rápido en los sistemas biológicos. El dióxido de carbono se puede describir como el anhídrido del ácido carbónico.
Ácido carbónico puro
El ácido carbónico, H2CO3, es bastante estable a temperatura ambiente como gas. En presencia de agua, se descompone para formar dióxido de carbono y agua, lo que acelera aún más la descomposición.
El ácido carbónico puro se produce principalmente de dos formas, la irradiación de protones de dióxido de carbono sólido puro o mediante la reacción de cloruro de hidrógeno y bicarbonato de potasio a 100 K en metanol.
Se ha producido una versión deuterada a alta presión de ácido carbónico, es decir, D2CO3, en una celda híbrida con abrazadera (aleación rusa/cobre-berilio) a 1,85 GPa y caracterizado por difracción de neutrones. Las moléculas, que son planas, forman dímeros unidos por pares de puentes de hidrógeno. Los tres enlaces C-O son casi equidistantes a 1,34 Å. Las distancias C-O y C=O más típicas son 1,43 y 1,23 Å, respectivamente. Las longitudes inusuales de los enlaces C-O se atribuyen a enlaces π deslocalizados en el centro de la molécula, además de enlaces de hidrógeno extraordinariamente fuertes, indicados por la separación O---O de 2.13 Å. La brevedad de la separación O---O es en parte una consecuencia de los 136° O-H-O, impuestos por los anillos de 8 miembros con doble enlace de hidrógeno. Se observan distancias O---O más largas en enlaces de hidrógeno intramoleculares fuertes, p. en ácido dicarboxílico, que están por encima de 2,4 Å. El ácido carbónico preparado a presión ambiente no muestra picos de Bragg en la difracción de rayos X y, por lo tanto, debe considerarse amorfo.
Contenido relacionado
Hemiacetal
Cementación
Citrato de litio


![{displaystyle beta _{1}={frac {[{text{HCO}}_{3}^{-}]}{[{text{H}}^{+}][{text{CO}}_{3}^{2-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/170497229ff9169a1bf46ef141b7f8f0e4156143)


![{displaystyle beta _{2}={frac {[{text{H}}_{2}{text{CO}}_{3}]}{[{text{H}}^{+}]^{2}[{text{CO}}_{3}^{2-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b8c36da403b35d01cd677b5d8be799b358f2736a)





![{displaystyle {ce {K_3 = {frac {[H^+][HCO_3^{-}]}{[CO_2(soln)]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/728be989d8b5ded1f0cf378c3ebe5f6532b00c8f)

